近年来,由于大气层中臭氧层的破坏加剧,导致到达地球表面的太阳紫外辐射UV-B增强。有研究表明,臭氧浓度每减少1%,到达地表的UV-B辐射量会增加2%。研究日渐增强的UV-B对营光合作用生长的生物影响一直以来备受关注(李梅, 2013; 郭秀林等, 2001)。
UV-B辐射对海洋藻类的生理生化影响首先体现在对其光合作用的影响上:一是破坏反应系统,光合作用的原初光化学反应在反应中心进行,光能被捕光天线色素吸收后,经过色素间的能量传递最后到达反应中心。类囊体膜上存在2种光系统:光系统Ⅰ (PSⅠ)和光系统Ⅱ(PSⅡ)。虽然UV-B辐射对PS有影响,但UV-B辐射对植物的主要作用部位是PSⅡ,已有很多实验证据支持这一结论(师生波等, 2011)。UV-B辐射会引起电子传递效率下降,导致光合作用被抑制,使叶绿体的放氧活性下降。其原因是:(1)增强的UV-B辐射导致叶绿素(包括叶绿素a和叶绿素b)和类胡萝卜素含量下降。(2) PSⅡ的蛋白被破坏,电子传递受阻,叶绿素吸收光而激发的高能电子传不出去,积累的能量导致叶绿素的卟啉环发生氧化—开环,光系统反应中心失活,Hill反应活力下降,PSⅡ的电子传递效率降低。二是使光合作用的关键酶含量和酶活性下降,导致CO2羧化效率降低。三是引起参与卡尔文循环的酶的活性发生变化。在种子植物中,UV-B能够引发2个独立的效应:一种是针对损伤的应答反应; 另一种是通过磷酸化的UV-B感光受体,来引发光形态建成(高淑清等, 2004; Frohnmeyer et al, 2003; Ulm et al, 2005)。引发的反应与受到UV-B的波长、通量和持续时间有关。本研究中应用的叶绿素荧光检测技术是一种简便、快捷、可靠、无损伤的光合作用研究方法,在植物的光合作用、胁迫生理学、水生生物学等方面都得到了广泛的应用(简敏菲等, 2016)。
另一方面,在紫外辐射诱导下,生物体内会有相应的生化代谢产物响应。在植物中,响应紫外诱导的方式主要体现为次生代谢物的变化(陈梦, 2018); 在动物中,UV-B辐射可影响其鞘脂类代谢、核酸代谢、亚油酸代谢、氨基酸代谢等通路(王恩鹏等, 2016); 在微生物中,紫外诱变改变了菌株次级代谢产物的种类(韦云, 2016)。不同种植物的叶绿素对UV-B紫外线辐射的敏感度不同,同种植物的叶绿素含量对不同UV-B辐射强度的敏感度也不同(蒋鹤鸣等, 2012; 王龙飞, 2013; 耿予欢等, 2006)。本研究使用的多光谱荧光成像技术不仅可以作为植物生物和非生物胁迫的诊断指标,其荧光参数F440/F690和F440/F740还可以表示植物次级代谢产物酚醛类化合物的变化; F690/F740与叶绿素浓度负相关,可以表示叶绿素浓度的变化,在植物和藻类中得到了广泛应用(Granum et al, 2015)。
酪氨酸酶能够结合铜离子来催化初始的单酚类物质(如酪氨酸)羟基化反应,并进一步氧化二元酚物质(如DOPA与DHI)来产生醌类物质,是植物黑色素合成过程中的关键酶(Zhang et al, 2006)。正常的黑色素合成和沉着具有保护表层细胞、防御紫外线辐射和防止内部组织过热等作用。已有研究表明,UV-B辐射条件下的酪氨酸酶活性与黑色素含量有明显提高(吴姗姗等, 2016),酪氨酸酶的活性高低将直接影响黑色素的合成(宋康康, 2007)。
藻类受UV-B辐射的影响,除以上在光合作用及次级代谢物的影响外,还包括植物酶系统、蛋白含量的变化、金属元素含量的变化等方面(蔡恒江等, 2006; 缪锦来等, 2004)。在对红藻抗紫外辐射的研究中,多聚焦在类菌孢素氨基酸(MAA)物质合成和抗辐射机制上(Brawley et al, 2017)。本实验室在条斑紫菜(Pyropia yezoensis)的基因组研究中,除了发现MAA合成机制外,还发现酪氨酸酶基因在紫菜中呈显著扩张,预示着紫菜可能通过该家族基因扩张在应对紫外辐射产生了适应性(毕桂萁, 2018)。
条斑紫菜作为一种生长在浅海潮间带的大型海藻,在退潮期间,藻体完全暴露在空气中接受太阳照射,因此,随着全球范围紫外辐射的逐渐增强,条斑紫菜藻体会比被海水覆盖的海藻受到更强烈、更直接的UV-B辐射(姜红霞, 2007); 而其作为我国主要的养殖海藻,具有极高的经济价值(高淑清等, 2004),研究UV-B辐射对条斑紫菜影响极为必要。
本研究拟应用叶绿素荧光成像及多光谱荧光成像技术,检测条斑紫菜在不同强度UV-B辐照下的光合作用及生理生化特征的变化,并同时检测酪氨酸酶活性的变化,以深入解析条斑紫菜对紫外辐射的响应及防御机制。
1 材料与方法 1.1 实验材料采用本实验室条斑紫菜纯系RZ品系叶状体为实验材料,于光照为35~45 μmol/m2·s、光周期为12 L : 12 D、10℃通气条件下培养。挑选生长一致、长度约为5 cm且状态良好的藻体进行辐照实验。
1.2 实验内容及方法 1.2.1 UV-B系统设置如图 1所示,UV-B辐射系统空间分为左右2个部分,左侧为对照组系统,右侧为实验组系统,各组中间使用不透光黑布隔开,防止紫外线穿过。辐射体系采用德国飞利浦生产的UV-B紫外灯,紫外灯外用上海生化试剂公司生产的0.12 mm乙酸纤维素薄膜包裹,目的是除去280 nm短波长紫外线。同时,为了防止乙酸纤维素薄膜的老化,所用薄膜每周更新一次。整个UV-B辐射系统在正式实验前连续照射72 h以上,以减少光源的不稳定性。实验组和对照组上方分别悬挂可见光源,使用光照计测量可见光光强,调整光源距离,确保实验组系统的可见光强始终为35~45 μmol/m2·s。在UV-B系统实验组的上方加挂UV-B光源,并使用山东师范大学生产的UV-B型紫外辐射强度仪测定辐照强度,调整UV-B光源距离,确保实验A组的UV-B光强恒定为0.5 W/m2,实验B组的UV-B光强始终为2 W/m2。每个实验组光源下放置5个直径为15 cm的玻璃平皿,每个平皿中加入适量海水,海水中均匀分散放置10片完整条斑紫菜叶片(即5个平行),使每片藻体互不遮挡。设置时间梯度为0、1、2、3、4、5和6 h,每隔1 h从对照组、实验A组和实验B组的培养皿中各采集一次藻体样本。
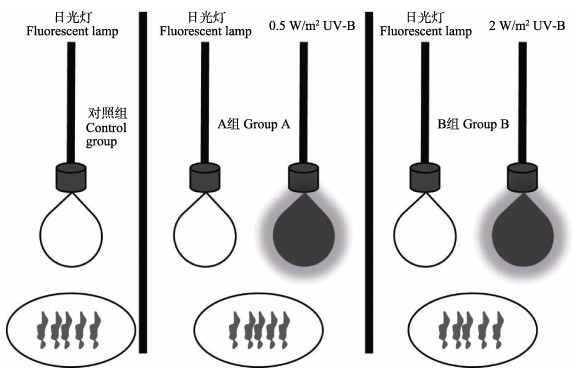
|
图 1 实验装置示意 Fig.1 Schematic diagram of the experimental device |
叶绿素荧光参数和多光谱参数测定:每次随机收取5片叶状体,按照对照组、实验A组、实验B组的顺序分别放入提前准备好的无菌小平皿中,用无菌镊子使其排列整齐,并展平。同时,为使藻体表面能够保持湿润状态,在展平过程中要时刻注意藻体的状态,并用无菌刷子补充水分。放入叶绿素荧光成像仪Fluor Cam系统(Fluor Cam 800MF,北京易科泰生态技术有限公司)、多光谱荧光成像仪(Multi-color Fluor Cam,北京易科泰生态技术有限公司)。15 min暗适应后,进行多种荧光参数的测定。叶绿素荧光成像仪Fluor Cam系统设定快门shutter=1,敏感度Sensitivity=45,光化光光强Act1=21,饱和光光强Super=45,测定参数包括最大光量子效率(QY_max,评估PSⅡ最大光合效率)、非光化学淬灭(NPQ_Lss,评估藻体光保护能力)、光化学淬灭(qP_Lss,PSⅡ中处于开放状态的反应中心的比例)和稳态荧光衰减率(Rfd_Lss,评估藻体活力)。多光谱荧光成像系统设定快门shutter=5,敏感度Sensitivity=6.2,紫外光UV=100。测定参数包括极早期胁迫参数F440/F690、F440/F740和叶绿素负相关参数F690/F740。
酪氨酸酶活性测定:使用北京索莱宝科技有限公司的酪氨酸酶活性检测试剂盒(微量法)进行测定。
1.2.3 数据处理图片绘制使用R语言的ggplot2包和ggpubr包,组间差异显著性比较使用R语言的Wilcoxon秩和检验,使用默认双侧检验。
2 结果 2.1 叶绿素荧光光合参数对照组、0.5 W/m2实验A组、2 W/m2实验B组中的叶绿素荧光动力学数据分析结果见图 2。与对照组相比(图 2a),在0.5 W/m2和2 W/m2辐射条件下,QY_max在1~6 h逐渐下降,0.5 W/m2条件下,QY_max从0.59下降至0.218 (P < 0.05);2 W/m2条件下QY_max从0.59下降至0.072 (P < 0.05)。与各时间段的对照组相比(图 2b),0.5 W/m2和2 W/m2 UV-B辐射条件下的NPQ_Lss值均呈下降趋势,0.5 W/m2辐射条件下,NPQ_Lss值从0 h的0.15下降到了6 h的0.05 (P < 0.05),但在2 h数值有小幅度回升(P > 0.1),3~6 h持续下降。2 W/m2辐射条件下,NPQ_Lss值从0 h的0.15下降到了6 h的0.03 (P < 0.05),但在3 h数值有小幅度回升(P > 0.1),从2 h开始趋于平稳; 0.5 W/m2条件下,qP_Lss值在0~1 h的均值图(图 2c)中无显著变化(P > 0.1),与此时对照组的数值大体一致; 在1 h后qP_Lss值开始下降(P < 0.01),但幅度相较于2 W/m2辐射条件下缓和; qP_Lss在2 W/m2辐射条件下1 h处的值与0.5 W/m2条件下的6 h处的值相似(P > 0.05);不同强度紫外线都会降低条斑紫菜叶状体的Rfd_Lss值(图 2d),0.5 W/m2 Rfd_Lss缓慢匀速下降; 2 W/m2照射条件下在0~1 h中,Rfd_Lss值受到的影响显著(P < 0.01),1~6 h时间段内Rfd_Lss值缓慢降低。
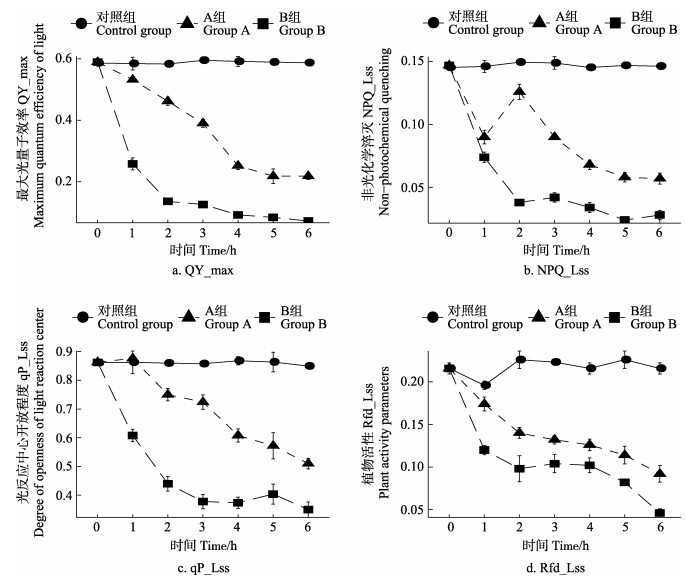
|
图 2 不同处理条件下条斑紫菜叶绿素荧光参数变化 Fig.2 Changes of chlorophyll fluorescence parameters of P. yezoensis under different treatment conditions |
在F440/F690(图 3a)和F440/F740(图 3b)图中,0.5 W/m2辐射条件下0~2 h均略高于对照组,在3 h的时间点上,均值下降但并不显著(P > 0.05),3~6 h不再下降,趋于稳定。2 W/m2紫外辐射条件下,F440/F690和F440/F740的均值在2 h处便与对照组有显著差异(P < 0.05),开始有明显的下降趋势。这相比于0.5 W/m2条件下提前1 h左右。在图 3c中,0.5 W/m2紫外辐射条件下的6 h内,F690/F740值在总体水平上降低,但并不显著(P > 0.05),而在2 W/m2的辐射条件下,F690/F740值在0~3 h下降,于4 h后迅速上升,于5 h开始高于对照组(P < 0.05)。
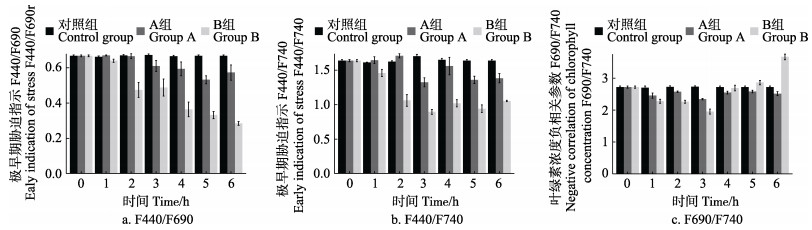
|
图 3 不同处理条件下条斑紫菜多光谱参数变化 Fig.3 Multi-spectral parameters of P. yezoensis under different treatment conditions |
未照射UV-B的对照组显示,条斑紫菜在0~6 h时间内的酶活力较为稳定,数值在35 U/g上下波动; 与对照组相比,经UV-B处理的2个实验组在1 h后酪氨酸酶的活性明显升高(P < 0.01),0.5 W/m2实验组的酪氨酸酶活性上升至67.38 U/g,2 W/m2实验组的酪氨酸酶活性上升至77.55 U/g,2个实验组的酪氨酸酶活在随后的时间内分别在64.90~70.78和65.54~77.55 U/g范围内波动(图 4a)。

|
图 4 UV-B照射条件下0~6 h酪氨酸酶活力的变化 Fig.4 Changes in tyrosinase activity in UV-B irradiation for 1~6 h |
对照组的酪氨酸酶活在0~6 h时间段中一直处于较低水平(中位数 < 40),而实验组酪氨酸酶活均处于较高水平(中位数 > 60),并且0.5 W/m2条件下的酶活性相较与2 W/m2条件下稳定,但酶活性中位数略低于后者(P < 0.05)(图 4b)。
3 讨论随着臭氧空洞的不断扩大,能够到达地表的UV-B辐射也逐渐增强。条斑紫菜作为一种生长在潮间带的大型经济海藻,紫外辐射的变化直接影响到其生长和发育。
已有研究表明,UV(主要是UV-B)会对藻类光合系统造成巨大损伤,这在Herrmann等(1996)与Prasad等(2004)分析UV对杜氏盐藻(Dunaliella salina)、棕鞭藻(Ochromonas danica)与蓝藻(Plectonema boryanum)的影响时即有发现。
本研究发现,UV-B会直接影响条斑紫菜的最大光量子效率(QY_max),且在强度高的紫外辐射下,最大光量子效率比低强度紫外辐射提前下降至平稳期,说明藻体PSⅡ最大光合效率降低; 不同强度的紫外线都会对条斑紫菜叶状体的非光化学淬灭(NPQ_Lss)造成负面影响,且紫外强度越高,NPQ_Lss值整体越低,说明藻体以热能的形式散失多余能量的能力越弱,光保护能力降低; 藻体的光化学淬灭(qP_Lss)变化结果说明,PSⅡ中处于开放状态的反应中心同样受UV-B的影响趋于关闭状态; 藻体光合活性(Rfd_Lss)受UV-B辐射影响会明显降低,光合器官受到损伤,但藻体自身会通过自保机制维持自身在一段时间内的活性,随着照射时间的增长,自保机制不足以抵御UV-B辐射的伤害,藻体的活性会继续下降。
Frohnmeyer等(2003)、Ulm等(2005)和Jenkins (2009)研究发现,自然条件下,由于它们拥有有效的修复和保护机制,植物在UV-B辐射下都可以很好地避免损伤。利用多光谱荧光技术对条斑紫菜叶状体在受胁迫初期进行检测,采用极早期胁迫参数F440/F690、F440/F740和叶绿素浓度负相关参数F690/F740,分析条斑紫菜的生理生化响应。研究发现,极早期胁迫参数值在低辐照强度下的0~2 h变化并不显著,而在高辐照强度下的1 h便开始变化,并在2 h处有显著性差异,说明紫外线强度不同会影响藻体进入受胁迫阶段的时间,且强度越大,进入受胁迫阶段的时间越早; 同时,在UV-B辐照下,随辐照时间增加,F440/F690和F440/F740值在高、低辐射强度下均呈下降趋势,说明酚醛类物质随辐照时间延长浓度会降低; 藻体中的叶绿素浓度(F690/F740)受紫外线强度和照射时间长短的影响,叶绿素浓度在UV-B胁迫初期略微上升,但当2 W/m2 UV-B辐射强度超过4 h后,叶绿素浓度会迅速下降。0.5 W/m2 UV-B辐射强度在6 h内对叶绿素浓度影响不大,甚至可以提高叶绿素浓度。这与UV-B在绿藻中的研究一致(王明辉, 2008)。
在紫菜抵抗紫外辐射机制的研究中,认为紫菜能够合成一类特殊的氨基酸—类菌胞素氨基酸(Mycosporine-like amino acid, MAA)(张英莲, 2007)。MAA能够有效吸收紫外光线,根据同源基因预测,也发现了紫菜能够合成MAA的基因(Brawley et al, 2017)。基于本实验室对条斑紫菜与坛紫菜高质量基因组的分析,发现除MAA合成机制外,紫菜中还含有酪氨酸酶基因家族(毕桂萁, 2018)。酪氨酸酶是黑色素合成的关键酶(宋康康, 2007),在抵抗紫外辐射中起着重要作用(朱静等, 2013; 宋缘, 2017)。本研究通过检测不同UV-B照射条件下的酪氨酸酶活性,发现条斑紫菜的酪氨酸酶活性水平在1 h内即显著提高,并且在随后的紫外辐射期间,始终维持高活性水平,推测条斑紫菜可能会通过酪氨酸酶途径以酚类物质为前体合成黑色素,以抵御紫外辐射。
综上所述,当辐射强度较低时,条斑紫菜叶绿素对UV-B辐射的敏感度较低,当辐射强度较高时,条斑紫菜叶绿素对UV-B辐射的敏感度较高; 随着UV-B辐射时间和强度的增加,光合反应中心的开放程度以及光合效率会降低,酚醛类等物质会减少,酪氨酸酶活性升高。本研究可为后续分析条斑紫菜抗紫外线辐射机制提供研究基础,保障我国紫菜产业的可持续健康发展。
Bi GQ. Genome of Pyropia yezoensis and Pyropia haitanensis reveals key functional and evolutionary innovations at environmental adaptation at environmental adaptation. Doctoral Dissertation of Ocean University of China, 2018 [毕桂萁.紫菜基因组及其环境适应性研究.中国海洋大学博士研究生学位论文, 2018]
|
Brawley SH, Blouin NA, Ficko-Blean E, et al. Insights into the red algae and eukaryotic evolution from the genome of Porphyra umbilicalis (Bangiophyceae, Rhodophyta). Proceedings of the National Academy of Sciences, 2017, 114(31): 6361-6370 DOI:10.1073/pnas.1703088114 |
Cai HJ, Tang XX, Zhang PY, et al. Response of activity of antioxidant enzymes to UV-B radiation enhancement in three species of red-tide microalgae. Periodical of Ocean University of China (Natural Science), 2006, 36(1): 81-84 [蔡恒江, 唐学玺, 张培玉, 等. 3种海洋赤潮微藻抗氧化酶活性对UV-B辐射增强的响应. 中国海洋大学学报(自然科学版), 2006, 36(1): 81-84] |
Chen M. Study of regulation mechanism for secondary metabolites disturbance in Clematis terniflora DC. under UVB irradiation & cloning and expression analysis of CtPPQ in coumarin biosynthesis. Master's Thesis of Zhejiang University, 2018, 1-115 [陈梦.紫外诱导圆锥铁线莲次生代谢扰动的调控机制研究及香豆素合成酶PPO的克隆与表达.浙江大学硕士研究生学位论文, 2018, 1-115] http://cdmd.cnki.com.cn/Article/CDMD-10335-1018172723.htm
|
Granum E, Pérez-Bueno ML, Calderón CE, et al. Metabolic responses of avocado plants to stress induced by Rosellinia necatrix analysed by fluorescence and thermal imaging. European Journal of Plant Pathology, 2015, 142(3): 625-632 DOI:10.1007/s10658-015-0640-9 |
Frohnmeyer H, Staiger D. Ultraviolet-B radiation-mediated responses in plants: Balancing damage and protection. Plant Physiology, 2003, 133(4): 1420-1428 DOI:10.1104/pp.103.030049 |
Gao SQ, Shan BN. Advances in biological functions of Pyropia yezoensis. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2004, 13(12): 1661-1662 [高淑清, 单保恩. 条斑紫菜生物学作用的研究进展. 现代中西医结合杂志, 2004, 13(12): 1661-1662 DOI:10.3969/j.issn.1008-8849.2004.12.127] |
Geng YH, Li L, Wei D, et al. Physiological adaptability of Chlamydomonas nivalis under ultraviolet radiation. Food Science, 2006, 27(3): 40-43 [耿予欢, 李琳, 魏东, 等. 极地雪藻对紫外辐射的生理适应性研究. 食品科学, 2006, 27(3): 40-43] |
Guo XL, Wang RW. Influence of enhanced ultraviolet radiation on growth and physiological metabolism in plants. Journal of Biology, 2001, 18(1): 12-14 [郭秀林, 王睿文. 紫外辐射增加对植物生长及某些生理代谢的影响. 生物学杂志, 2001, 18(1): 12-14 DOI:10.3969/j.issn.2095-1736.2001.01.005] |
Herrmann H, Häder DP, Köfferlein M, et al. Effects of UV radiation on photosynthesis of phytoplankton exposed to solar simulator light. Journal of Photochemistry and Photobiology B: Biology, 1996, 34(1): 21-28 DOI:10.1016/1011-1344(95)07245-4 |
Jenkins GI. Signal transduction in responses to UV-B radiation. Annual Review of Plant Biology, 2009, 60(1): 407-431 DOI:10.1146/annurev.arplant.59.032607.092953 |
Jian MF, Wang SC, YU HP, et al. Influence of Cd2+ or Cu2+ stress on the growth and photosynthetic fluorescence characteristics of Hydrilla verticillata. Acta Ecologica Sinica, 2016, 36(6): 1719-1727 [简敏菲, 汪斯琛, 余厚平, 等. Cd2+、Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响. 生态学报, 2016, 36(6): 1719-1727] |
Jiang HM, Jiang H, Zhou GM, et al. Spectral reflectance response of plant leaf to simulated UVB stress. Spectroscopy and Spectral Analysis, 2012, 32(2): 453-458 [蒋鹤鸣, 江洪, 周国模, 等. 利用高光谱遥感监测紫外辐射对亚热带树木的影响. 光谱学与光谱分析, 2012, 32(2): 453-458 DOI:10.3964/j.issn.1000-0593(2012)02-0453-06] |
Jiang HX. Ecophysiological responses of Pyropia haitanensis (Rhodophyta) to solar ultraviolet radiation. Doctoral Dissertation of Shantou University, 2007, 1-166 [姜红霞.坛紫菜对阳光紫外辐射的生理生态学响应.汕头大学博士研究生学位论文, 2007, 1-166] http://cdmd.cnki.com.cn/Article/CDMD-10560-2007134795.htm
|
Li M. Effects of excess UV-B irradiation on physiological and biochemical responses in three species of Saussurea on eastern of Qinghai-Tibetan Plateau. Master's Thesis of Northwest Normal University, 2013, 1-66 [李梅.青藏高原东缘三种风毛菊属植物对增补UV-B辐射的生理响应.西北师范大学硕士研究生学位论文, 2013, 1-66] http://cdmd.cnki.com.cn/Article/CDMD-10736-1014018793.htm
|
Miao JL, Kan GF, Jiang YH, et al. Responses of bio-chemical compositions of four Antarctic ice microalgae to UV-B irradiation enhancement. Marine Sciences, 2004(9): 26-31 [缪锦来, 阚光锋, 姜英辉, 等. 4种南极冰藻的生化组成对UV-B辐射增强的响应. 海洋科学, 2004(9): 26-31 DOI:10.3969/j.issn.1000-3096.2004.09.006] |
Prasad SM, Zeeshan M. Effect of UV-B and monocrotophos, singly and in combination, on photosynthetic activity and growth of non-heterocystous cyanobacterium Plectonema boryanum. Environmental and Experimental Botany, 2004, 52(2): 175-184 DOI:10.1016/j.envexpbot.2004.01.013 |
Shi SB, Shang YX, Zhu PJ, et al. Effects of solar UV-B radiation on the efficiency of PSⅡ photochemistry in the alpine plant Saussurea superba under different weather conditions in the Qinghai-Tibet Plateau of China. Chinese Journal of Plant Ecology, 2011, 35(7): 741-750 [师生波, 尚艳霞, 朱鹏锦, 等. 不同天气类型下UV-B辐射对高山植物美丽风毛菊叶片PSⅡ光化学效率的影响分析. 植物生态学报, 2011, 35(7): 741-750] |
Song KK. Effects of inhibitors on tyrosinase and their regulation on melanogenesis. Doctoral Dissertation of Xiamen University, 2007, 1-166 [宋康康.抑制剂对酪氨酸酶的效应及其对黑色素生成调控的研究.厦门大学博士研究生学位论文, 2007, 1-166] http://cdmd.cnki.com.cn/Article/CDMD-10384-2008058360.htm
|
Song Y. Studies on the radioprotection effect of melanin from spores of Aspergillus niger. Master's Thesis of Lanzhou University, 2017, 1-62 [宋缘.黑曲霉黑色素辐射防护作用的研究.兰州大学硕士研究生学位论文, 2017, 1-62]
|
Ulm R, Nagy F. Signalling and gene regulation in response to ultraviolet light. Current Opinion in Plant Biology, 2005, 8(5): 477-482 DOI:10.1016/j.pbi.2005.07.004 |
Wang LF. The interactive effects of drought and enhanced UV-B radiation on photosynthesis and anthocyanin in three species in Lespedeza michx. Master's Thesis of Northwest A & F University, 2003, 1-78
|
王龙飞. UV-B辐射及干旱胁迫对三种胡枝子叶片光合特性及花青素含量的影响.西北农林科技大学硕士研究生学位论文, 2013, 1-78
|
Wang MH. Influence of ultraviolet radiation on growth, reproduction and chlorophyll content of green algae Scenedesmus dimorphus. Journal of Anhui Agricultural Sciences, 2008, 36(23): 9863-9864 [王明辉. 紫外线照射对绿藻Scenedesmus dimorphus生长繁殖和叶绿素含量的影响. 安徽农业科学, 2008, 36(23): 9863-9864 DOI:10.3969/j.issn.0517-6611.2008.23.025] |
Wang NP, Sun Y, Yue H, et al. Urinary metabonomic investigation into acute photo damage of rats induced by ultraviolet B irradiation using rapid resolution liquid chromatography-mass spectrometry. Chinese Journal of Analytical Chemistry, 2016, 44(9): 1410-1418 [王恩鹏, 孙岩, 越皓, 等. 基于快速高分辨液相色谱-质谱的中波紫外线辐射诱导大鼠急性光损伤的代谢组学研究. 分析化学, 2016, 44(9): 1410-1418] |
Wei Y. Study on the biological characteristics of two Metarhizium anisopliae UV-induced mutants. Master's Thesis of South China Agricultural University, 2016, 1-48 [韦云.两株绿僵菌紫外线诱变株的生物学特性研究.华南农业大学硕士研究生学位论文, 2016, 1-48]
|
Wu SS, Xu HH, Zhu DD, et al. Effect of UVB radiation on melanocytes and melanin synthesis-related gene expression. Journal of Xinjiang Medical University, 2016, 39(4): 422-425, 429 [吴姗姗, 许欢欢, 朱丹丹, 等. UVB辐射对黑色素细胞黑素合成及其相关基因表达的影响. 新疆医科大学学报, 2016, 39(4): 422-425, 429 DOI:10.3969/j.issn.1009-5551.2016.04.009] |
Zhang C, Xie LP, Huang J, et al. A novel putative tyrosinase involved in periostracum formation from the pearl oyster (Pinctada fucata). Biochemical and Biophysical Research Communications, 2006, 342(2): 632-639 DOI:10.1016/j.bbrc.2006.01.182 |
Zhang YL. UV-B induced changes of growth and MAAs in HAB causative algae from South China Sea. Master's Thesis of South China Normal University, 2007, 1-53 [张英莲. UV-B辐射对华南沿海常见赤潮藻类生长和类菌孢素氨基酸(MAAs)含量的影响.华南师范大学硕士研究生学位论文, 2007, 1-53]
|
Zhu J, Gu MY, Wang W, et al. Study on identification of a radiation-resistant black yeast-like fungus and isolation of melanin. Xinjiang Agricultural Sciences, 2013, 50(10): 1858-1864 [朱静, 顾美英, 王玮, 等. 一株耐辐射真菌的鉴定及黑色素分离提取. 新疆农业科学, 2013, 50(10): 1858-1864] |



