大口黑鲈(Micropterus salmoides)俗称加州鲈,原产于美国加利福尼亚州密西西比河水系,肉质鲜美、在市场上很受欢迎,加之具有生长迅速、易起捕、适温范围广、耐低氧能力强等特点,一直深受养殖户的欢迎(樊佳佳等, 2019)。我国年产量超过30万t,是全球产量最高的国家(邓国成等, 2011)。近年来,大口黑鲈已逐渐成为跑道式循环水养殖的主要养殖品种。但无论是传统的高密度养殖,还是跑道式集中圈养模式,都存在着疫病快速传播的潜在危险。其中,病毒性病害的爆发,常造成严重的经济损失。弹状病毒(Rhabdovirus)为一种单股不分节段的负链RNA病毒,种类较多,包括175种以上的成员,可感染脊椎动物、无脊椎动物和植物。鱼类弹状病毒因宿主广、毒株种类多、毒力强等特点,对各种淡水和海水鱼造成了严重危害(Zhang et al, 2018)。近几年,在大口黑鲈苗种培育及养殖早期流行一种可引起大口黑鲈鱼苗大量死亡的疾病,给鲈鱼养殖业带来巨大的经济损失。雷燕等(2015)结合流行病学调查及分子生物学鉴定,确认引起广东省佛山市一大口黑鲈养殖池塘鱼种暴发性死亡的疾病为弹状病毒病,其病原为弹状病毒。寻找敏感细胞是病毒体外培养的关键,而病毒的体外培养又是后续研究的基础。目前,已报道的用于大口黑鲈弹状病毒体外培养的细胞仅有大口黑鲈皮肤(LBS)细胞一种(Gao et al, 2018)。
卵黄抗体(IgY)是指从免疫禽蛋中提取出的针对特定抗原的抗体,具有化学性质稳定、产量高、成本低、特异性强且无任何毒副作用的优势; 由于与鱼类种系发生距离远,不会发生交叉血清学反应。卵黄抗体对某些动物疫病具有明显治疗和紧急预防作用; 纯化后的卵黄抗体还可用于病毒的检测(陈斌等, 2005)。卵黄抗体应用于水生动物疾病的预防和治疗屡见报道。特异性卵黄抗体可较好地保护感染白斑综合症病毒的斑节对虾,显著提高斑节对虾的存活率(Kumaran et al, 2010),用抗溶藻弧菌卵黄抗体拌喂感染溶藻弧菌的鲍鱼,可显著降低鲍鱼的死亡率(Wu et al, 2011)。Sunwoo等(2010)发现,特异性卵黄抗体能抑制大肠杆菌(Escherichia coli 987P)的生长。程娜(2014)研究发现,抗鳗利斯顿氏菌(Listonella anguillarum)卵黄抗体可明显提高感染鳗利斯顿氏菌香鱼(Plecoglossus altivelis)的存活率。由于大口黑鲈弹状病毒主要危害5 cm以下的鲈鱼苗种,而这一阶段的鱼苗免疫系统发育不完善,主动免疫预防难以实现,加之发病急,病程短,以抗体作为被动免疫的预防措施更具有生产实践意义。本研究在成功分离培养大口黑鲈弹状病毒的基础上,针对大口黑鲈病毒制备卵黄抗体,研究其对大口黑鲈弹状病毒的中和作用,为大口黑鲈弹状病毒病的防治与诊断试剂的开发提供理论基础。
1 材料与方法 1.1 病毒、细胞及实验动物弹状病毒感染的大口黑鲈鱼苗病样采自浙江省湖州市某苗种场,草鱼(Ctenopharyngodon idellus)卵巢细胞株(CO)由实验室保存。180日龄的健康蛋鸡由浙江湖州杨家埠鸡场提供,10只进行免疫,5只用作阴性对照。
1.2 主要试剂弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司(美国); 细胞培养基M199、胎牛血清及双抗均购自GIBCO公司; TRIZOL总RNA提取试剂、Ex Taq DNA聚合酶和pGEM-T连接试剂盒购自TaKaRa公司(日本); 反转录和定量PCR试剂购自TOYOBO公司(日本); 2×Taq PCR Master Mix购自天根生化科技(北京)有限公司; 辣根过氧化物酶HRP标记的羊抗鸡抗体、TMB显色试剂盒、MTT细胞增殖和细胞毒性检测试剂盒均购自碧云天生物技术公司(上海); 引物由苏州金唯智生物科技有限公司合成; 其他试剂均为国产分析纯级试剂。
1.3 大口黑鲈感染弹状病毒检测及分离培养取10尾患病大口黑鲈鱼苗置于冰上研磨,采用TRIZOL试剂提取组织总RNA,参考雷燕等(2015)的方法,进行RT-PCR检测,扩增产物送苏州金唯智生物科技有限公司测序。经PCR检测后,取感染MSRV的大口黑鲈鱼苗,匀浆后离心,取上清液,过滤除菌,滤液即为粗提的病毒原液。采用草鱼卵巢细胞株CO细胞作为大口黑鲈弹状病毒的敏感细胞,以含10%胎牛血清的M199完全培养基培养CO细胞至汇片60%~80%时,上述病毒粗提液用M199基础培养基1:5倍稀释后感染细胞,吸附1.5~2 h后,吸出未吸附病毒液,添加M199维持液继续培养48~72 h,出现细胞病变50%以上,收获病毒的细胞培养物,置于-80℃保存备用。此外,根据已公布的MSRV核酸序列(GenBank No: MK397811)设计引物,扩增特异性产物构建质粒,用于制备定量检测病毒核酸的标准品。同时,设计用于荧光定量PCR检测病毒核酸、内凝集素(intelectin)和内参的引物。所用引物具体信息见表 1。
|
|
表 1 本研究所用引物 Tab.1 Primers used in this study |
病毒的细胞培养物冻融、离心,取上清液,加入甲醛使终浓度为0.5%,密封后置于65℃灭活2 h,每30 min摇匀1次。冷却至室温,加入青霉素和链霉素(双抗浓度为100 μg/ml),分装封口,4℃保存。将灭活的大口黑鲈弹状病毒分别与弗氏完全佐剂和弗氏不完全佐剂按1:1体积比混合,完全乳化后得弗氏完全佐剂乳化疫苗和弗氏不完全佐剂乳化疫苗,4℃保存备用。
用上述制备的佐剂乳化疫苗采用胸肌多点注射的方式,免疫180~190日龄的产蛋鸡。分别于1、7、14和28 d免疫,共免疫4次,每次免疫1 ml/只。第1次采用弗氏完全佐剂乳化疫苗免疫,其他时间点用弗氏不完全佐剂乳化疫苗免疫。免疫5周后,从第35天开始收集鸡蛋,每天收集免疫鸡所产的鸡蛋,总共收集20 d。同时,以注射PBS作为对照组,免疫程序与实验组相同。
1.5 卵黄抗体的制备及效价测定收集的鸡蛋经表面消毒,在无菌条件下取蛋黄倒入烧杯中,加入8倍体积的乙酸-乙酸钠缓冲液(pH 5.2),搅拌10 min,4℃沉淀过夜,吸取上清液,10000 r/min离心15 min,收集上清液,加入饱和硫酸铵沉淀抗体蛋白,12000 r/min离心,收集沉淀,超纯水重悬,透析去除卵黄抗体中残留的盐离子。采用SDS-PAGE检测卵黄抗体纯度,BCA蛋白定量试剂盒测定浓度。
采用ELISA测定卵黄抗体效价。首先,制备MSRV蛋白,在MSRV病毒液中加入适量RIPA(含1 mmon/L PMSF),混匀后,置于冰上30 min,12000 r/min离心10 min,上清液即为病毒蛋白。病毒蛋白用PBS稀释后铺板,每孔100 μl,4℃包被过夜; 之后,PBST洗涤3次后,加入倍比稀释的卵黄抗体,每孔100 μl,37℃孵育1 h,洗涤3次后,再加入羊抗鸡二抗,于37℃孵育1 h,洗涤3次后,加TMB底物显色,最后,加入10%硫酸溶液终止反应。
1.6 卵黄抗体的抗病毒效果及其对内凝集素基因(intelectin)表达的影响 1.6.1 卵黄抗体对病毒的中和作用首先,测定病毒半数细胞感染量(TCID50),即MSRV病毒原液进行10倍稀释,分别接种CO细胞,每个稀释度设8个重复。24℃培养96 h,记录病变细胞数和未病变细胞数,按Reed-Muech法计算TCID50。
以每孔100个TCID50病毒量与倍比稀释的卵黄抗体混匀,24℃作用2 h后接种细胞,同时,设正常细胞孔对照及100 TCID50/孔、0.1 TCID50/孔的病毒对照,当100 TCID50/孔全部病变,而0.1 TCID50/孔中无病变时,用MTT法检测细胞存活量,按公式计算中和作用率:
作用率(%)=[(给药组平均值-病毒对照平均值)/ (正常细胞对照组平均值-病毒对照平均值)]×100%
1.6.2 卵黄抗体对弹状病毒复制的影响参考刘珍等(2016)的方法制备标准品,使用引物MSRV-F1/ MSRV-R1扩增病毒核酸特异性片段,PCR产物经纯化后与载体pGEM-T连接,将连接产物转化至大肠杆菌DH5α,筛选阳性克隆,提取质粒,并测序验证。测定重组质粒DNA浓度,换算成拷贝数作为标准品原液。以10倍梯度稀释的标准质粒为模板,MSRV-F2和MSRV-R2为引物,进行Real-time PCR扩增。反应参数:95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸1 min 19 s,共40个循环。得出计算病毒核酸拷贝数的标准曲线。
卵黄抗体与等体积的病毒液混合,24℃作用2 h后接种细胞,同时,设置病毒对照和正常细胞对照。于接种后第6、12、24、48和72小时收集细胞病毒液,TRIZOL提取总RNA,反转录参照TOYOBO公司的“ReverTra Ace qPCR RT Master Mix”试剂盒合成cDNA。使用引物MSRV-F2/MSRV-R2对样品cDNA进行Real-time PCR扩增,通过标准曲线换算得到样品中病毒RNA的拷贝数。
1.6.3 卵黄抗体对CO细胞中intelectin表达的影响按照1.6.2所述步骤处理样品,得到的样品cDNA分别用引物intelectin-F/intelectin-R和β-actin-F/β- actin-R进行Real-time PCR扩增,反应程序同1.6.2。得到的数据利用2-ΔΔCt方法计算实验组intelectin的相对表达量。
1.7 统计分析采用软件SPSS 16.0的单因素方差分析(One-way ANOVA)对各组数据进行差异分析,P < 0.05为显著性差异,P < 0.01为极显著性差异。
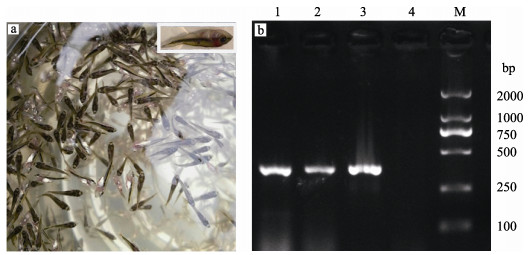
2 结果 2.1 弹状病毒核酸检测及分离培养患病大口黑鲈鱼苗的主要症状表现为停止摄食,水面漫游,打转,体色发黑,鳃和腹部充血(图 1a)。采用特异性引物对患病鱼组织核酸进行PCR检测,扩增片段大小与预期372 bp相符(图 1b)。
|
图 1 大口黑鲈弹状病毒的临床症状(a)与PCR检测结果(b) Fig.1 Clinical symptoms (a) and MSRV PCR products (b) of diseased M. salmoides 1~3:病鱼样品Diseased M. salmoide samples; 4:阴性对照Negative control; M:DNA Marker DL2000 |
利用患病鱼组织制备的病毒粗提液接种CO细胞后,24 h开始出现细胞病变,表现为细胞收缩变圆,聚集成团,出现明显的空斑(图 2)。细胞培养物经RT-PCR检测,同样可扩增出大口黑鲈弹状病毒的特异性片段。

|
图 2 大口黑鲈弹状病毒在草鱼卵巢细胞株(CO)上的病变情况 Fig.2 Cytopathic effect of CO cell monolayer inoculated with diseased fish tissue homogenate filtrate a:接种病毒2 d的CO细胞; b:正常的CO细胞 a: Cytopathic effect of CO cells 2 days post-infection; b: Normal CO cell monolayer |
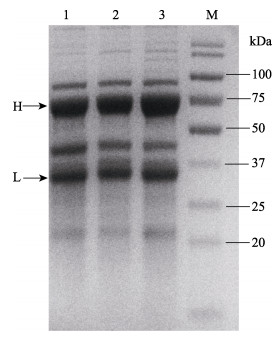
收集免疫后的鸡蛋蛋黄,纯化后得到的卵黄抗体浓度为1.8 mg/ml,经SDS-PAGE检测,从图 3可以看出,在50~75 kDa和25~37 kDa之间有明显的条带,与卵黄抗体轻链和重链大小预期相符(He et al, 2011)。ELISA测得卵黄抗体的效价为1:256。
|
图 3 卵黄抗体的SDS-PAGE分析 Fig.3 SDS-PAGE analysis of IgY 1~3: IgY; M:蛋白分子量标准Protein maker |
病毒TCID50经测定为104.12。卵黄抗体倍比稀释后,与病毒作用后接种CO细胞,用MTT法检测卵黄抗体中和作用率,结果显示,1/64倍稀释的卵黄抗体对病毒的中和作用最为明显,中和作用率为38.29%以上。
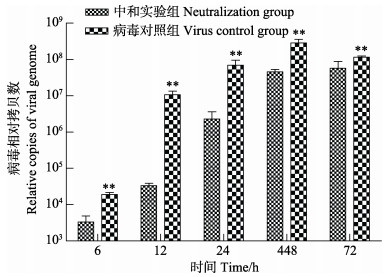
为定量测定病毒复制的核酸拷贝数,制备了荧光定量PCR的标准曲线,其R2为0.9983,引物的扩增效率为103%。在此基础上,应用Real-time PCR方法检测中和实验组及对照组的病毒复制情况,结果显示,病毒与卵黄抗体中和作用后接种CO细胞,于6、12、24、48和72 h 5个时间点收集的细胞培养物,测得的病毒RNA拷贝数均显著低于病毒对照组(图 4),其中,第12小时中和实验组病毒拷贝数仅为病毒对照组的0.003倍。
|
图 4 卵黄抗体对弹状病毒复制的影响 Fig.4 Neutralization of relative virus copies of MSRV using egg-yolk antibody **表示差异极显著(P < 0.01),下同 ** indicate highly significant differences, the same as below |
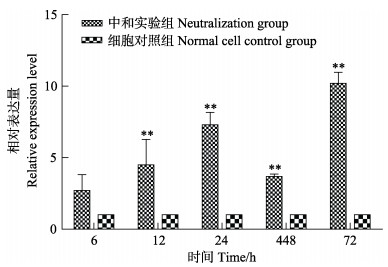
采用Real-time PCR方法检测中和实验组及细胞对照组不同时间点的CO细胞中intelectin基因的表达水平。结果显示,中和实验组intelectin基因的表达量在5个时间点均高于细胞对照组,其中,72 h时,中和实验组intelectin的表达量达到细胞对照组的10倍(图 5)。
|
图 5 卵黄抗体对CO细胞intelectin表达的影响 Fig.5 Relative expression of intelectin mRNA of MSRV challenged CO neutralized with egg-yolk antibody |
近年来,大口黑鲈弹状病毒在大口黑鲈苗种培育及养殖早期流行,严重时,80%池塘发病,死亡率高,短时间内可高达90%,经济损失巨大。研究利用CO细胞分离培养大口黑鲈弹状病毒,得到了较好的效果,病毒能在CO细胞上稳定传代,利用荧光定量PCR测定CO细胞培养的病毒RNA拷贝数,可达109 copies/ml以上,收获的细胞病毒液经浸泡感染大口黑鲈鱼苗,能复制出与自然发病鱼相似的症状。目前,用于大口黑鲈弹状病毒体外培养的细胞鲜有报道。Gao等(2018)利用大口黑鲈皮肤(LBS)细胞培养MSRV,可产生明显的细胞病变效应,应用Real-time PCR方法检测,感染细胞24 h时病毒RNA相对表达量为感染6 h时的70多倍。在应用CO细胞感染MSRV病毒时,检测到感染24 h时病毒RNA相对表达量为6 h时的800倍以上,说明,CO细胞较LBS细胞更适合MSRV的复制增殖。
卵黄抗体因具备无毒副作用和特异性高等特点,被广泛用于人和动物的疾病控制和治疗(Zhen et al, 2008)。本研究发现,大口黑鲈弹状病毒与特异性卵黄抗体作用后,在CO细胞中的复制水平明显降低,说明,特异性卵黄抗体对大口黑鲈弹状病毒具有中和作用,但其抗体效价低于已报道的抗病毒卵黄抗体水平。王建梅等(2012)用盐析法粗提制备的抗犬瘟热卵黄抗体,其效价最高可达1:819。张述斌等(2013)建立了一种用水稀释反复冻溶法、氯仿萃取法与冷乙醇沉淀法相互结合提取鸡新城疫卵黄抗体的方法,效价可达到1:2048。雷丹等(2018)应用水稀释法提取抗猪流行性腹泻病毒(PEDV)变异株卵黄抗体,其效价为1:12800。分析本研究中卵黄抗体效价低的原因,可能是免疫程序和抗体提取纯化方法不够理想,还需进一步优化。此外,本研究还发现,5个时间点中和实验组病毒RNA拷贝数较病毒对照组下降水平不一,其中,12 h时下降1000倍,表明卵黄抗体除了可以直接中和病毒,还可能在病毒复制增殖过程中发挥作用,其机制有待进一步研究。
内凝集素作为凝集素家族的一员,是一种新发现的分泌型凝集素。本研究中和实验组细胞的intelectin表达水平较正常细胞组有所升高,提示,卵黄抗体在免疫防御或应答方面发挥作用。李媛(2016)研究发现,迟缓爱德华氏菌(Edwardsiella tarda)特异性IgY能够增强大菱鲆(Scophthalmus maximus)头肾巨噬细胞的吞噬活性,刺激大菱鲆非特异性免疫相关酶(溶菌酶、超氧化物歧化酶、碱性磷酸酶)的产生,还能增强这些酶的活性,也说明,卵黄抗体具有刺激和调节机体免疫功能的作用。目前,水生动物有关intelectin的报道很少,Chang等(2007)报道,在草鱼体内经脂多糖诱导后intelectin表达水平显著上调。Lin等(2009)报道,在感染杀鲑气单胞菌(Aeromonas salmonicida)的肝脏中intelectin表达水平上调。本实验室前期研究发现,草鱼在接种草鱼出血病灭活苗早期,肾脏中intelectin基因表达显著上调(奕志娟等, 2015)。Chen等(2018)报道,斑马鱼(Danio rerio) intelectin基因zITLN1、zITLN2和zITLN3可以识别细菌细胞壁的主要成分,从而能结合细菌并引发细菌的凝集。目前,尚未见卵黄抗体刺激intelectin基因上调的相关报道,其上调与病毒复制的相关性及其机理有待进一步研究。
本研究成功建立了大口黑鲈弹状病毒的体外培养和卵黄抗体制备方法,明确了卵黄抗体的抗病毒中和作用,为进一步开发用于弹状病毒免疫防治的免疫制剂奠定了良好的基础。
Chang MX, Nie P. Intelectin gene from the grass carp Ctenopharyngodon idella: cDNA cloning, tissue expression, and immunohistochemical localization. Fish and Shellfish Immunology, 2007, 23(1): 128-140 |
Chen B, Yang ZH. Mechanism and prospects of egg yolk immunoglobulin (IgY). Zhejiang Journal Animal Science and Veterinary Medicine, 2005, 30(1): 9-10 [陈斌, 杨志华. 鸡卵黄免疫球蛋白(IgY)的作用机理及应用前景. 浙江畜牧兽医, 2005, 30(1): 9-10] |
Chen L, Yan J, Shi J, et al. Zebrafish intelectin 1 (zITLN1) plays a role in the innate immune response. Fish and Shellfish Immunology, 2018, 83: 96-103 |
Cheng N. Passive protective effect of chicken egg yolk immunoglobulins against experimental Listonella anguillarum infection in sweetfish (Plecoglossus altivelis). Masterxs Thesis of Ningbo University, 2014 [程娜.抗鳗利斯顿氏菌鸡卵黄抗体对致病香鱼保护作用的研究.宁波大学硕士研究生学位论文, 2014]
|
Deng GC, Bai JJ, Li SJ, et al. Diseases and prevention of largemouth bass cultured in ponds. Guangdong Agricultural Sciences, 2011, 38(18): 102-103, 137 [邓国成, 白俊杰, 李胜杰, 等. 大口黑鲈池塘养殖常见病害及其防治. 广东农业科学, 2011, 38(18): 102-103, 137] |
Fan JJ, Bai JJ, Li SJ, et al. Analysis on genetic diversity of three breeding populations of largemouth bass using formulated feeds. Progress in Fishery Sciences, 2019, 40(4): 57-64 [樊佳佳, 白俊杰, 李胜杰, 等. 驯食配合饲料的大口黑鲈3个选育世代的遗传多样性分析. 渔业科学进展, 2019, 40(4): 57-64] |
Gao EB, Chen GF. Micropterus salmoides rhabdovirus (MSRV) infection induced apoptosis and activated interferon signaling pathway in largemouth bass skin cells. Fish and Shellfish Immunology, 2018, 76: 161-166 |
He YN, Bjorkman PJ. Structure of FcRY, an avian immunoglobulin receptor related to mammalian mannose receptors, and its complex with IgY. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(30): 12431-12436 |
Kumaran T, Michaelbabu M, Selvaraj T, et al. Production of anti WSSV IgY edible antibody using herbal immunoadjuvant Asparagus racemosus and its immunological influence against WSSV infection in Penaeus monodon. Journal of Aquaculture Feed Science and Nutrition, 2010, 2(1): 1-5 |
Lei D, Li AQ, Luo SX, et al. Preparation, purification and activity factors analysis of IgY against variant of porcine epidemic diarrhea virus. China Animal Husbandry and Veterinary Medicine, 2018, 45(8): 2293-2302 [雷丹, 李安琪, 罗素贤, 等. 抗猪流行性腹泻病毒变异株卵黄抗体的制备、纯化及其活性影响因素的研究. 中国畜牧兽医, 2018, 45(8): 2293-2302] |
Lei Y, Qi RR, Cui LB, et al. Diagnosis of rhabdovirus disease in juvenile largemouth bass Micropterus salmonides. Journal of Dalian Ocean University, 2015, 30(3): 305-308 [雷燕, 戚瑞荣, 崔龙波, 等. 大口黑鲈鱼种弹状病毒病的诊断. 大连海洋大学学报, 2015, 30(3): 305-308] |
Li Y. Passive protective effect of specific egg yolk antibodies against Edwardsiella tarda in turbot (Scophthalmus maximus). Masterxs Thesis of Dalian University of Technology, 2016 [李媛.迟缓爱德华氏菌特异性卵黄抗体对大菱鲆的被动保护研究.大连理工大学硕士研究生学位论文, 2016]
|
Lin B, Cao Z, Su P, et al. Characterization and comparative analyses of zebrafish intelectins: Highly conserved sequences, diversified structures and functions. Fish and Shellfish Immunology, 2009, 26(3): 396-405 |
Liu Z, Zhang QL, Wan XY, et al. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates. Progress in Fishery Sciences, 2016, 37(2): 119-126 [刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测. 渔业科学进展, 2016, 37(2): 119-126] |
Sunwoo HH, Lee EN, Gujral N, et al. Growth inhibition of Escherichia coli 987P by neutralizing IgY antibodies. Open Immunology Journal, 2010, 3: 1-8 |
Wang JM, Yang J, Luo JF, et al. Preparation and titer detection of immunoglobulin of yolk against canine distemper. Journal of Shihezi University (Natural Science), 2012, 30(3): 327-332 [王建梅, 杨娇, 罗继芬, 等. 抗犬瘟热高免卵黄抗体的制备及效价的检测. 石河子大学学报(自然科学版), 2012, 30(3): 327-332] |
Wu CJ, Wang H, Chan YL, et al. Passive immune-protection of small abalone against Vibrio alginolyticus infection by anti- Vibrio IgY-encapsulated feed. Fish and Shellfish Immunology, 2011, 30(4-5): 1042-1048 |
Yi ZJ, Hao GJ, Yuan XM, et al. Inactivated vaccine for hemorrhage of grass carp up-regulates the expressions of major immune- related genes in spleen of grass carp. Chinese Journal of Cellular and Molecular Immunology, 2015, 31(5): 177-181 [奕志娟, 郝贵杰, 袁雪梅, 等. 草鱼出血病灭活疫苗上调草鱼脾细胞主要免疫分子的表达. 细胞与分子免疫学杂志, 2015, 31(5): 177-181] |
Zhang LJ, Li NQ, Lin Q, et al. An avirulent Micropterus salmoides rhabdovirus vaccine candidate protects Chinese perch against rhabdovirus infection. Fish and Shellfish Immunology, 2018, 77: 474-480 |
Zhang SB, Xue ZL, Zhang HB, et al. Study on extraction of chicken ND-IgY combining with water dilution repeated freezing and dissolving method, chloroform extraction and cold ethanol precipitation. Journal of Animal Science and Veterinary Medicine, 2013, 32(1): 11-12, 14 [张述斌, 薛掌林, 张洪波, 等. 利用水稀释反复冻溶法、氯仿萃取法与冷乙醇沉淀法相结合进行鸡新城疫卵黄抗体提取的试验研究. 畜牧兽医杂志, 2013, 32(1): 11-12, 14] |
Zhen Y, Jin L, Guo J, et al. Characterization of specific egg yolk immunoglobulin (IgY) against mastitis-causing Escherichia coli. Veterinary Microbiology, 2008, 130(1-2): 126-133 |



