鱼类是最古老的脊椎动物,在生物进化史中具有十分重要的地位。与哺乳类动物类似,鱼类也具有完善的免疫器官、组织和多种免疫细胞,这些是鱼类进行免疫预防各种疾病的免疫基础(Litman et al, 2005)。先天免疫系统是最早以非特异性的方式保护宿主免受其他有机体感染的免疫机制,是无脊椎动物和低等脊椎动物免疫防御的基础。发挥先天免疫作用的细胞以一种通用的方式识别病原体并做出免疫应答(Marchalonis et al, 1998)。
c-Jun N-末端激酶(c-Jun N-terminal kinase, JNK)是丝裂原活化蛋白激酶(MAPK)超家族的重要亚基(Sluss, 1996)。最早发现并鉴定出的哺乳动物JNK基因包括3种,它们分别被认定为JNK1、JNK2和JNK3 (也分别称为应激激活蛋白激酶SAPK-γ、SAPK-α和SAPK-β) (Dérijard et al, 1994)。JNK1和JNK2基因广泛表达。相比之下,JNK3基因的表达模式相对有限,主要局限于大脑、心脏和睾丸(Gupta et al, 1996)。JNK蛋白激酶在TNF信号通路中由肿瘤坏死因子受体相关蛋白(TRAF2)激活,在IL-1激活后由TRAF6进一步激活(Lomaga et al, 1999)。之后,JNK又通过丝列原活化蛋白激酶激酶4 (MKK4)(也称为SEK1)和MKK7在Thr和Tyr上的磷酸化而激活。MAPKK正是通过对Thr和Tyr上的T环发生磷酸化反应来激活JNK,丝氨酸磷酸酶、酪氨酸磷酸酶和双重特异性磷酸酶在介导JNK发生去磷酸化失活时必不可少(Keyse, 2000)。JNK通路在先天免疫反应中具有进化保守性。在果蝇细胞中,JNK通路在脂多糖(LPS)作用下被激活(Sluss, 1996)。在哺乳动物中,LPS或肿瘤坏死因子(TNF)、白细胞介素(IL)-1等炎性细胞因子可强烈诱导激活多种细胞类型的JNK(Chang et al, 2001)。在成纤维细胞中,JNK2的缺乏导致多种细胞因子严重减少,包括Ⅰ型干扰素(IFN)和IL-6(Chu et al, 1999)。
硬骨鱼是一种研究早期脊椎动物天然免疫应答功能的良好模型(Whyte, 2007)。牙鲆(Paralichthys olivaceus)是一种名贵的海产鱼类,其肉质鲜美,营养丰富,经济价值高,是重要的海水增养殖鱼类之一,市场十分广阔(李泽宇等, 2018)。了解牙鲆的先天防御机制,可以帮助我们控制鱼类疾病,保持鱼类养殖业的长期可持续性。迟缓爱德华氏菌(Edwardsiella tarda)是一种常见的胞内致病菌,会引起宿主感染爱德华氏菌病并导致死亡(Abayneh et al, 2013)。迟缓爱德华氏菌通过侵染吸附在细胞表面,向宿主细胞内注入毒力因子从而使宿主感染病菌(Rao et al, 2001)。它会引起鱼类的败血症,并伴有广泛的皮肤损害,影响肝脏、肾脏、脾脏和肌肉等内脏。这种细菌能够避免宿主的防御机制,从而在宿主体内迅速繁殖并导致死亡(Rao et al, 2001)。大部分鱼类都会受到迟缓爱德华氏菌的影响,包括鲤鱼、罗非鱼、鲶鱼和牙鲆(Psetta maxima)等(Castro et al, 2010; Ling et al, 2000)。本研究从牙鲆中克隆获得了免疫相关基因JNK2,并对其进行了鉴定。采用体内和体外2种方法对PoJNK2基因的表达模式以及对下游炎症细胞因子和转录因子AP-1的调节作用进行了探究。本研究可为鱼类抗病育种的研究提供理论参考,同时揭示了PoJNK2的促炎作用,可为鱼类疾病的治疗和预防提供理论支持。
1 材料与方法 1.1 材料 1.1.1 牙鲆在本实验中,所用牙鲆来自山东海阳黄海水产有限公司。随机选取3条雄鱼和3条雌鱼(1.5年龄,体长320~420 mm,体重500~700 g),经尾静脉抽血处死后进行解剖,每条鱼取心脏、肝脏、脾脏、头肾、脑、鳃、肌肉和肠8个组织,经液氮冷冻后保存于-80℃冰箱。
1.1.2 牙鲆鳃细胞系(FG9307)来自中国海洋大学细胞工程技术实验室馈赠。该细胞用DMEM/F12培养基[向其中加入10% (v/v) FBS(胎牛血清)、1% (v/v) NEAA和100 U/ml青霉素),24℃培养。
1.1.3 迟缓爱德华氏菌实验所用迟缓爱德华氏菌菌株为本实验室保存菌株。待使用时将该菌株划线接种于LB固体培养基中,28℃活化培养12 h。活化后,将单克隆菌落接种于LB液体培养基中,28℃摇晃培养12 h。用PBS缓冲液稀释使其终浓度为107 CFU/ml。
1.1.4 牙鲆迟缓爱德华氏菌攻毒实验及免疫相关器官的RNA提取来自本实验室学生制作,具体实验操作步骤详见本实验室已发表论文(曹丹丹等, 2018),提取RNA后,使用反转录试剂盒反转录成浓度为100 ng/μl cDNA模板,保存于-80℃,待使用时稀释至10 ng/μl。
1.2 方法 1.2.1 PoJNK2基因序列分析本研究分别通过分析比对氨基酸与核酸序列、脊椎动物JNK基因所编码氨基酸序列和系统进化对PoJNK2基因进行序列分析。DNAman程序用于分析氨基酸与核酸序列比对,MEGALIGN和DNAstar程序用于分析脊椎动物JNK基因结构域保守性,ClustalW和MEGA 6程序用于分析系统进化。该分析过程中所用到的脊椎动物JNK基因序列号详见表 1。
|
|
表 1 实验所用JNK2基因编号 Tab.1 JNK2 sequences used in this study |
在NCBI数据库中搜索到斑马鱼和半滑舌鳎JNK2序列,并在实验室已建立的牙鲆基因组和转录组数据库中进行比对,得到PoJNK2基因的cDNA序列,根据比对结果设计扩增PoJNK2基因核心序列的特异性引物PoJNK2-FW1/ RV1,详见表 2,利用PCR技术克隆验证。
|
|
表 2 实验所用引物 Tab.2 The primers used in this study |
根据定量引物设计原则,设计PoJNK2的qRT-PCR引物PoJNK2- qFw/qRv。选定牙鲆β-actin基因作为内参基因,通过qRT-PCR (SYBR qPCR SuperMix, Novoprotein, 上海)分析在牙鲆成鱼的不同组织中PoJNK2基因的表达情况。qRT-PCR所用模板为材料1.1.1中cDNA模板。
1.2.4 迟缓爱德华氏菌、poly Ⅰ:C、TNF-α刺激牙鲆鳃细胞系将生长状态良好的牙鲆鳃细胞系传代接板至12孔板,生长至细胞覆盖度达80%以上。向每孔中加入Polyinosinic: polycytidylic acid (Poly Ⅰ:C, Sigma)、TNF-α(科昕生物公司)和迟缓爱德华氏菌,使终浓度分别为50 μg/ml、20 ng/ml和5×106 CFU/ml。对照组分别加入相同浓度的PBS。
分别在刺激0、3、6、9和12 h时收集细胞样品(迟缓爱德华氏菌刺激组,取刺激后0、3、9、12 h的细胞样品),存于Trizol中待用。
1.2.5 PoJNK2过表达载体构建为更深入地探究牙鲆JNK2的基因功能,构建了PoJNK2的2种不同表达载体,分别以p-EGFP-N1和p-cDNA3.1-A为载体,其中,以p-EGFP-N1为载体所构建的表达载体带绿色荧光。在PoJNK2基因的ORF两端,即ATG处和TAG处利用引物PoJNK2-Fw2/Rv2设计XhoⅠ和BamHⅠ酶切位点。通过双酶切得到PoJNK2的ORF克隆片段,连接到p-EGFP-N1质粒中,得到p-JNK2- EGFP重组质粒。使用同样的方法,在PoJNK2基因的ORF两端利用引物PoJNK2-Fw3/Rv3设计HindⅢ和BamHⅠ酶切位点,与p-cDNA3.1质粒连接,得到p-cDNA3.1-JNK2重组质粒。
1.2.6 PoJNK2基因在牙鲆鳃细胞系中的过表达将生长状态良好的牙鲆鳃细胞系接板到12孔板,培养至细胞单层均匀覆盖密度达80%以上。使用LipofectamineTM 2000 (US Everbright, Inc., 苏州)进行p-JNK2-EGFP质粒转染,同时转染p-EGFP-N1质粒作为对照;转染p-cDNA3.1-JNK2质粒,对照组使用p-cDNA3.1-A质粒,具体步骤详见说明书。转染48 h以后,将p-JNK2-EGFP组细胞用DAPI染色后在激光共聚焦显微镜下观察拍照。p-cDNA3.1-JNK2组细胞在转染24 h后,使用20 ng/ml TNF-α进行刺激,24 h后提取细胞总RNA待用。
1.2.7 免疫调节检测实验将转染p-cDNA3.1- JNK2质粒48 h后的牙鲆鳃细胞,用20 ng/ml的TNF-α进行刺激,对照组用PBS处理。在刺激24 h以后,收集细胞样品,提取RNA,用qRT-PCR检测下游IL-6、IL-8和TNF-α的表达变化情况。
1.2.8 双荧光报告实验为了探究PoJNK2基因的表达变化对MAPK信号通路下游AP-1的转录调控作用,设计了双荧光素酶报告实验,检测JNK2基因在HEK-293T细胞中过表达后对AP-1转录因子的表达影响。使用LipofectamineTM 2000将p-cDNA3.1-JNK2质粒转染至HEK-293T细胞中,同时转染p-AP-1-luc荧光素酶报告质粒(碧云天生物公司),设置阴性对照组和空载质粒组,阴性对照组即在HEK-293T细胞中只转染p-AP-1-luc荧光素酶报告质粒,空载质粒组即转染空载质粒p-cDNA3.1和p-AP-1-luc荧光素酶报告质粒。根据双荧光素酶报告系统实验要求,按照p-AP-1-luc荧光素酶报告质粒:海肾荧光素酶报告质粒(pRL-TK)=50:1的比例,再在每个孔中共转染pRL-TK,转染24 h后进行双荧光素酶活性检测。
1.2.9 数据分析本实验所涉及数据差异性分析,均利用SPSS 20.0软件,使用单因素方差(One-way ANOVA) T检验进行比较。所有数据以平均值±标准误(Mean±SE)(n=3)表示,各个组之间的差异性用*表示(*P < 0.05; **P < 0.01)。
2 结果 2.1 PoJNK2基因的序列分析首先通过搜索本实验室的牙鲆转录组库,与NCBI数据库中的序列进行比对,获得了PoJNK2基因序列,PoJNK2 ORF序列长1263 bp,编码420个氨基酸。
为探究JNK2在脊椎动物中的进化关系,本研究利用MEGA 6构建了由不同脊椎动物的JNK2基因组成的系统进化树(图 2),牙鲆与大菱鲆(Scophthalmus maximus)在亲缘关系上最为接近。通过在线蛋白结构预测软件SMART对JNK2基因的结构域进行预测,结果显示,JNK2基因具有典型的丝氨酸-苏氨酸蛋白激酶催化结构域S_TKc。利用GENEDOC服务器对牙鲆JNK2的氨基酸序列与其他硬骨鱼氨基酸序列进行比对分析(图 3),结果显示,PoJNK2的S_TKc结构域与其他硬骨鱼的S_TKc结构域高度保守。

|
图 1 PoJNK2基因的核苷酸序列与氨基酸序列对应图 Fig.1 The nucleotide and deduced amino acid sequences of PoJNK2 |

|
图 2 JNK2的系统进化分析 Fig.2 The phylogenetic analysis diagram of JNK2 |

|
图 3 PoJNK2与其他已知JNK蛋白的MUSCLE的多重序列比对 Fig.3 Multiple sequence alignment of PoJNK2 with MUSCLE of other known JNK proteins 黑色区域表示每个氨基酸位点的同源性至少为70%。S_TKc结构域标注在上方的灰色条中 The black region indicates that the homology of each amino acid locus is at least the 70%. S_TKc domain is indicated as gray bars above the alignment |
通过qRT-PCR分析牙鲆PoJNK2基因在不同组织中的表达模式(图 4),在牙鲆心脏、肝脏、脾脏、头肾、脑、鳃、肌肉、肠8个组织中均有表达。其中,PoJNK2在鳃中表达最高,在脑和肠中表达也较高。
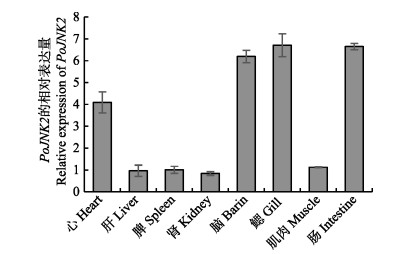
|
图 4 PoJNK2基因在牙鲆各个组织中的表达模式 Fig.4 Expression of PoJNK2 genes in different tissues of Japanese flounder β-actin基因是定量分析的内参对照,误差线代表平均值±标准误(n=3) β-actin gene expression was used as internal control, vertical bars represent the Mean±SE (n=3) |
在迟缓爱德华氏菌侵染牙鲆成鱼后,分别取了不同时间点的注菌组和对照组的脾脏、头肾、鳃3个组织,探究PoJNK2在迟缓爱德华氏菌刺激下的表达模式,qRT-PCR结果显示,在脾脏、头肾、鳃3个组织中,迟缓爱德华氏菌的刺激引起了PoJNK2的不同程度的变化(图 5)。
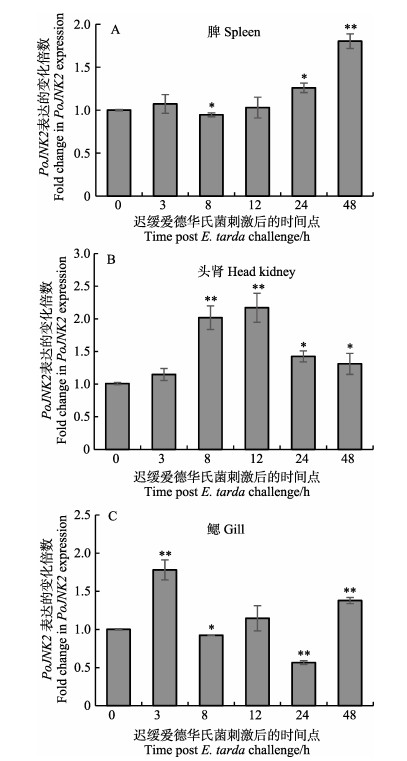
|
图 5 PoJNK2在迟缓爱德华菌刺激牙鲆组织中的表达模式 Fig.5 The expression pattern of PoJNK2 in Japanese flounder stimulated by E.tarda β-actin基因是定量分析的内参对照,时间点0 h表达量用作参照样品。误差线代表平均值±标准误(n=3)。实验组与空白对照(0 h)之间的显著差异由星号表示(*P < 0.05; **P < 0.01)。下同 β-actin gene was used as reference sample. The error line represents Mean±SE (n=3). The significant difference between the experimental group and the blank control (0 hours) was indicated by the asterisk (* P < 0.05; ** P < 0.01). The same as below |
分析PoJNK2的表达变化:在脾脏中(图 5A),迟缓爱德华氏菌刺激后,PoJNK2的表达没有太大的变化,直到刺激48 h时,实验组PoJNK2的表达量上升至对照组的1.8倍。在头肾中(图 5B),随着迟缓爱德华氏菌刺激作用的延长,PoJNK2的表达呈现出先升高后降低的趋势,在12 h时实验组表达量上升至对照组的2.2倍,随后开始下降,到48 h时降至对照组的1.3倍。在鳃中(图 5C),PoJNK2的表达趋势是先升高再降低又升高,在3 h时实验组表达量是对照组的1.7倍,在24 h时下降至0.6倍,而后又在48 h时上升至1.4倍。
2.4 免疫刺激牙鲆鳃细胞系后PoJNK2基因的差异表达分析为研究PoJNK2在抗病原菌感染方面发挥的重要作用,分别使用1.2.4中处理得到的cDNA模板,通过qRT-PCR分析PoJNK2的表达变化。结果如图 6所示,迟缓爱德华氏菌、poly Ⅰ:C、TNF-α刺激均能使PoJNK2的表达上调。观察PoJNK2在不同情况刺激下表达量的变化:在使用PBS刺激的对照组中(图 6A),PoJNK2的表达基本没有变化。在Poly Ⅰ:C刺激时(图 6B),PoJNK2在刺激前12 h里表达量没有明显变化,到24 h时,表达量突然升高至0 h的2.2倍。在TNF-α刺激时(图 6C),PoJNK2的表达是在12 h时开始增加,到24 h时,升高至0 h的2.6倍。迟缓爱德华氏菌刺激时(图 4D),PoJNK2的表达逐渐升高,到24 h时表达量达到0 h的3.4倍。

|
图 6 PoJNK2在免疫刺激牙鲆鳃细胞中的表达模式 Fig.6 Expression pattern of JNK2 in gill cells of immune stimulated Japanese flounder A~D:PoJNK2的mRNA水平在不同刺激下的FG细胞的定量表达模式,包括PBS、Poly Ⅰ:C、TNF-α和E.tarda。 A~D: Quantitative expression patterns of JNK2 mRNA in FG cells stimulated by different stimuli, including PBS, Poly Ⅰ: C, TNF- α and Edwardiella tarda |
通过激光共聚焦显微镜观察细胞转染P-JNK2- EGFP重组质粒后的状态,结果显示(图 7),与其他脊椎动物蛋白相似,PoJNK2在细胞质和细胞核中都有表达。
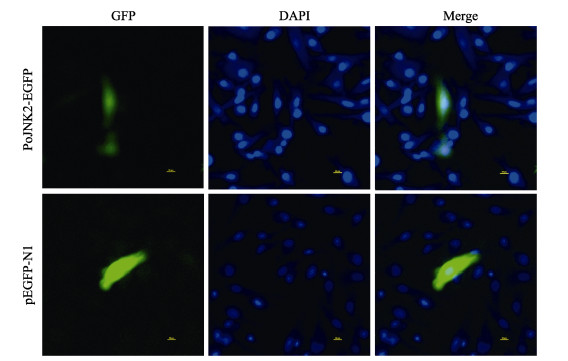
|
图 7 PoJNK2蛋白的亚细胞定位 Fig.7 Subcellular localization of JNK2 proteins in Japanese flounder 激光共聚焦扫描显微镜下,PoJNK2(绿色荧光)在细胞中的分布。核DNA用DAPI染色,为蓝色荧光,pEGFP-N1用作阴性对照。Bar = 10 μm Under laser confocal scanning microscope (LSCM), PoJNK2 in the whole cell, mainly in the cytoplasm. Nuclear DNA was stained with DAPI, blue fluorescence, pEGFP-N1 was used as negative control. Bar = 10 μm |
本实验深入研究了PoJNK2在抵抗病原菌侵害方面发挥的作用,通过qRT-PCR分析显示,相比空白对照组和转染空载质粒p-cDNA3.1组,过表达PoJNK2以后(图 8),牙鲆鳃细胞内的JNK2的表达量明显升高至空白对照组的6.4倍。
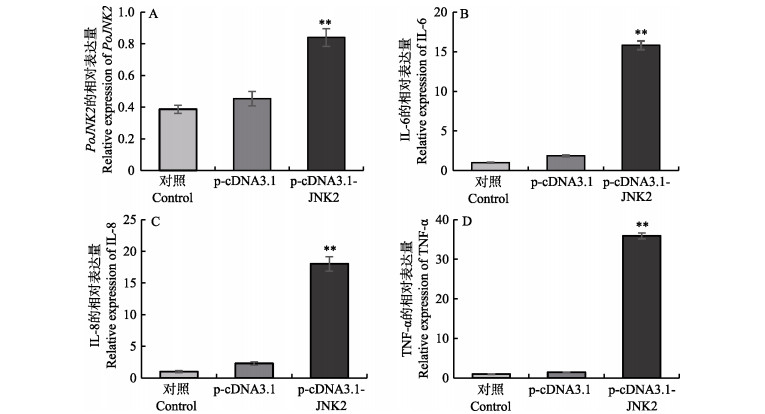
|
图 8 PoJNK2过表达对TNF-α刺激的FG细胞中通路下游细胞因子的表达的影响 Fig.8 Effect of PoJNK2 overexpression on the expression of cytokines downstream of pathway in FG cells stimulated by TNF-α A: qRT-PCR显示PoJNK2过表达后,mRNA表达量升高; B、C、D:转染24 h后,细胞用TNF-α刺激(20 ng/ml)刺激24 h,通过qRT-PCR分析IL-6和IL-8、TNF-α的表达水平 A: The expression of mRNA increased after overexpression of JNK2 by qRT-PCR. B, C, and D: The expression levels of IL-6, IL-8 and TNF- α were analyzed by qRT-PCR. The cells were stimulated with TNF- α (20 ng/ml) for 24 hours after transfection |
同时,还发现PoJNK2的过表达会使得通路下游的各个细胞因子均有不同程度的表达上调。PoJNK2过表达后,IL-6的表达量与p-cDNA3.1组和空白对照组相比分别升高了8.5和15.8倍;IL-8的表达量与p-cDNA3.1组和空白对照组相比分别升高了7.8和17.9倍;TNF-α的表达量与p-cDNA3.1组和空白对照组相比分别升高了24.7倍和35.9倍。
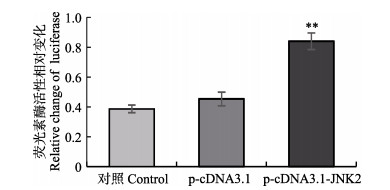
2.7 PoJNK2基因过表达对下游AP-1的转录调控作用为确定PoJNK2基因过表达后是否会对MAPK信号通路下游的转录因子AP-1有激活作用,设计双荧光素酶报告实验,结果如图 9所示,与空白对照组和转染p-cDNA3.1组相比,JNK2的过表达显著增强MAPK信号通路下游转录因子AP-1的转录活性。
|
图 9 PoJNK2过表达对AP-1报告基因活性的影响 Fig.9 The effect of overexpression of PoJNK2 on the activity of AP-1 reporter gene in Japanese flounder 转染24 h后检测荧光素酶活性。未转染质粒和转染p-cDNA3.1作为对照,显著差异由星号表示(*P < 0.05; **P < 0.01) The results showed that AP-1 luciferase reported the change of fluorescence intensity of plasmids. Luciferase activity was detected 24 hours after transfection. The difference between untransfected plasmid and transfected p-cDNA3.1 was indicated by asterisk (* P < 0.05; * P < 0.01) |
在以往研究中,从节肢动物到哺乳动物,JNK作为保守的应激激活蛋白激酶,可被多种免疫刺激物激活,并在宿主防御和免疫反应方面发挥重要作用(Delaney et al, 2006)。然而,对于硬骨鱼类,特别是牙鲆JNK功能的了解还十分有限。本研究对牙鲆JNK基因进行了序列鉴定和功能探究。
本研究发现,牙鲆JNK2具有典型的丝氨酸-苏氨酸蛋白激酶催化结构域S_TKc,且通过氨基酸序列分析显示,牙鲆JNK2的S_TKc结构域与其他硬骨鱼的S_TKc结构域高度保守,说明牙鲆JNK2与大部分硬骨鱼的JNK的同源性较高。
根据Zapata等(2006)研究发现,鱼类的免疫器官主要包括肾脏、脾脏、胸腺和肠道相关淋巴组织。同时,也有报道证实鱼类的鳃在抗病毒免疫方面发挥着重要作用(Li et al, 2014)。本研究发现,PoJNK2在脑、鳃和肠中表达较高,因此,推测PoJNK2在牙鲆对抗外来病原体的免疫防御中可能起着重要作用。为了探究这种免疫防御机制,使用迟缓爱德华氏菌侵染牙鲆的脾脏、头肾和鳃,定量检测PoJNK2的表达变化。结果发现,经迟缓爱德华氏菌刺激后,这3个组织中的PoJNK2的表达水平显著增加,基本呈现先升高后降低或者先升高后降低又升高的趋势。该结果进一步阐明了PoJNK2在牙鲆免疫防御中发挥的保护作用。然而,还需要进一步的研究来揭示这种免疫防御机制。
PolyI:C是一种病毒dsRNA类似物,在体内可以作为干扰素抑制剂(Liu et al, 2017)。TNF-α是一种由巨噬细胞衍生的具有抗肿瘤活性的细胞因子,与炎症、免疫调节、抗病毒防御、内毒素休克和有丝分裂等多种生物学过程有关(Hattori et al, 1996)。PolyI:C和TNF-α经常在实验中被用来模拟病毒对细胞进行刺激。Nishitoh等(1998)向293T细胞中转染含HA标记的JNK (HA-JNK)后,再使用TNF-α刺激,用免疫复合物激酶法检测JNK活性发现,TNF-α可诱导JNK活化,并推测TNF-α对JNK的激活可能是依赖于硫醇/二硫键的交换反应。本研究免疫刺激实验结果表明,PolyI:C、TNF-α和迟缓爱德华氏菌均能使PoJNK2的表达上调,但上调幅度有所不同。这说明PoJNK2在面对不同的免疫刺激其产生的免疫应答效果是不同的,其原因可能是细胞对于特定的免疫刺激物和活细菌的反应机制不一样。通过本研究结果可以确认细菌和病毒类似物均可刺激PoJNK2表达增加,说明PoJNK2在牙鲆抗菌抗病毒反应中可能发挥一定的作用。
炎症细胞因子是一类控制炎症细胞反应的免疫调节分子,主要包括IL-1β、IL-4、IL-6、IL-8、IL-10、IL-18和TNF-α等。细胞因子可与特定的细胞因子抑制剂和可溶性细胞因子受体协同作用,调节人体的免疫应答(Giorgos et al, 2014)。已有研究证实,哺乳动物中一些胞内类型的细菌感染可强烈激活JNK通路,而且在免疫刺激下,JNK激活是产生多种炎症细胞因子所必需的(Chu et al, 1999)。本研究证实了以上结论,PoJNK2过表达后能显著上调IL-6、IL-8和TNF-α的表达。这些结果表明,PoJNK2在牙鲆体内发挥免疫作用的机制可能是通过调节细胞因子从而产生促炎反应。
据研究,MAPK信号通路能够介导从细胞外到细胞质或细胞核的信号转导,从而调节多种细胞过程(Yang et al, 2012)。与其他MAPK成员相似,JNK蛋白主要分布在胞浆中,没有外部信号。在适当的环境刺激下,特异性上游MKK4或MKK7激酶通过双重磷酸化激活JNK。然后,磷酸化的JNK转移到细胞核,激活转录因子以改变靶基因的表达(Davis, 2000)。在Dunn等(2002)的研究中,证实JNK可以激活下游转录因子AP-1,然后调控着对病原体的反应起重要作用的各种炎症细胞因子的产生。Qu等(2015)研究表明,JNK通路可以调节AP-1在软体动物中对藻溶弧菌感染的反应。同样,在本研究中,PoJNK2的过表达显著激活了AP-1荧光素酶报告质粒的活性。这些发现表明,在牙鲆的感染过程中,PoJNK2可能是通过激活转录因子AP-1改变靶基因的表达,进而参与免疫反应。
综上所述,本研究首次在牙鲆中克隆验证了PoJNK2基因,核酸、氨基酸序列比对及系统进化分析都显示出JNK2基因与大多数硬骨鱼具有较高的保守性。组织表达表明,PoJNK2主要在牙鲆的免疫组织中表达。体内注射迟缓爱德华氏菌和体外免疫刺激(包括PolyI:C、TNF-α和迟缓爱德华氏菌)均能够增强PoJNK2的表达;作为胞内蛋白,PoJNK2在细胞内过表达会激活MAPK通路下游AP-1的转录,并显著上调炎症细胞因子IL-6、IL-8和TNF-α的表达。本研究为海水鱼类抗病育种和疾病防治提供了理论参考。
Abayneh T, Colquhoun DJ, Sørum H. Edwardsiella piscicida sp. nov., a novel species pathogenic to fish. Journal of Applied Microbiology, 2013, 114: 644-654 |
Cao DD, Liu JX, Wang ZG, et al. Expression analysis and functional characterization of NOD2 in the resistance of Japanese flounder (Paralichthys olivaceus) to Edwardsiella tarda infection. Progress in Fishery Sciences, 2018, 39(3): 53-64 [曹丹丹, 刘金相, 王志刚, 等. 牙鲆NOD2基因的表达分析及在抗迟缓爱德华氏菌感染过程中的功能. 渔业科学进展, 2018, 39(3): 53-64] |
Castro N, Toranzo AE, Barja JL, et al. Characterization of Edwardsiella tarda strains isolated from turbot, Psetta maxima (L.). Journal of Fish Diseases, 2010, 29(9): 541-547 |
Chang L, Karin M. Mammalian MAP kinase signalling cascades. Nature, 2001, 410: 37-40 |
Chu WM, Ostertag D, Li ZW, et al. JNK2 and IKKβ are required for activating the innate response to viral infection. Immunity, 1999, 11(6): 721-731 DOI:10.1016/S1074-7613(00)80146-6 |
Davis RJ. Signal transduction by the JNK group of MAP kinases. Cell, 2000, 103: 239-252 DOI:10.1016/S0092-8674(00)00116-1 |
Delaney JR, Stoven S, Uvell H, et al. Cooperative control of Drosophila immune responses by the JNK and NF-κB signaling pathways. EMBO Journal, 2006, 25: 3068-3077 DOI:10.1038/sj.emboj.7601182 |
Dérijard B, Hibi M, Wu IH, et al. JNK1: A protein kinase stimulated by UV light and Ha-Ras that binds and phosphorylates the c-Jun activation domain. Cell, 1994, 76: 1025-1037 DOI:10.1016/0092-8674(94)90380-8 |
Dunn C, Wiltshire C, Maclaren A, et al. Molecular mechanism and biological functions of c-Jun N-terminal kinase signalling via the c-Jun transcription factor. Cellular Signalling, 2002, 14: 585-593 DOI:10.1016/S0898-6568(01)00275-3 |
Giorgos B, Arseneau KO, Fabio C. Cytokines and mucosal immunity. Current Opinion in Gastroenterology, 2014, 30: 547-552 DOI:10.1097/MOG.0000000000000118 |
Gupta S, Barrett T, Whitmarsh AJ, et al. Selective interaction of JNK protein kinase isoforms with transcription factors. EMBO Journal, 1996, 15: 2760-2770 |
Hattori A, Hayashi K, Kohno M. Tumor necrosis factor (TNF) stimulates the production of nerve growth factor in fibroblasts via the 55-kDa type 1 TNF receptor. FEBS Letters, 1996, 379: 157 DOI:10.1016/0014-5793(95)01502-7 |
Keyse SM. Protein phosphatases and the regulation of mitogen-activated protein kinase signalling. Current Opinion in Cell Biology, 2000, 12: 186-192 DOI:10.1016/S0955-0674(99)00075-7 |
Li QM, Chen LJ, Rao YL, et al. Gill mediates immune responses after grass carp reovirus challenge in grass carp (Ctenopharyngodon idella). Acta Hydrobiologica Sinica, 2014, 38: 834-840 |
Li ZY, Chen SL, Guo H, et al. Screening of disease-resistant and fast growing families and subculture breeding for resistance against Edwardsiella tarda in Japanese flounder (Paralichthys olivaceus). Progress in Fishery Sciences, 2018, 39(3): 36-43 [李泽宇, 陈松林, 郭华, 等. 牙鲆抗迟缓爱德华氏菌病家系的继代选育与早期速生家系筛选. 渔业科学进展, 2018, 39(3): 36-43] |
Ling SHM, Wang XH, Xie L, et al. Use of green fluorescent protein (GFP) to study the invasion pathways of Edwardsiella tarda in in vivo and in vitro fish models. Microbiology, 2000, 146: 7 DOI:10.1099/00221287-146-1-7 |
Litman GW, Cannon JP, Dishaw LJ. Reconstructing immune phylogeny: New perspectives. Nature Reviews Immunology, 2005, 5: 866-879 DOI:10.1038/nri1712 |
Liu Y, Du Y, Wang H, et al. Porcine reproductive and respiratory syndrome virus (PRRSV) up-regulates IL-8 expression through TAK-1/JNK/AP-1 pathways. Virology, 2017, 506: 64-72 |
Lomaga MA, Yeh WC, Sarosi I, et al. TRAF6 deficiency results in osteopetrosis and defective interleukin-1, CD40, and LPS signaling. Genes & Development, 1999, 13: 1015 |
Marchalonis JJ, Schluter SF. A stochastic model for the rapid emergence of specific vertebrate immunity incorporating horizontal transfer of systems enabling duplication and combinatorial diversification. Journal of Theoretical Biology, 1998, 193: 429 DOI:10.1006/jtbi.1998.0711 |
Nishitoh H, Saitoh M, Mochida Y, et al. ASK1 is essential for JNK/SAPK activation by TRAF2. Molecular Cell, 1998, 2: 389-395 DOI:10.1016/S1097-2765(00)80283-X |
Qu F, Xiang Z, Wang F, et al. A novel molluscan Fos gene with immune defense function identified in the Hong Kong oyster, Crassostrea hongkongensis. Developmental & Comparative Immunology, 2015, 51: 194-201 |
Rao PS, Srinivasa Lim TM, Leung KY. Opsonized virulent Edwardsiella tarda strains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates. Infection & Immunity, 2001, 69: 5689 |
Sluss HKS. A JNK signal transduction pathway that mediates morphogenesis and an immune response in Drosophila. Genes & Development, 1996, 21
|
Whyte SK. The innate immune response of finfish--A review of current knowledge. Fish and Shellfish Immunology, 2007, 23: 1127-1151 DOI:10.1016/j.fsi.2007.06.005 |
Yang SH, Sharrocks AD, Whitmarsh AJ. MAP kinase signalling cascades and transcriptional regulation. Gene, 2012, 513: 1-13 |
Zapata A, Diez B, Cejalvo T, et al. Ontogeny of the immune system of fish. Fish and Shellfish Immunology, 2006, 20: 126-136 DOI:10.1016/j.fsi.2004.09.005 |



