2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 广西壮族自治区海洋研究所 广西海洋生物技术重点实验室 北海 536000
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Key Laboratory of Marine Biotechnology of Guangxi, Guangxi Institute of Oceanology, Beihai 536000
对虾养殖业是我国渔业经济的重要支柱产业,目前,国内对虾养殖年产量已突破100万t,产值超过600亿元(农业农村部科技教育司等, 2018),但经过10余年的快速发展,现已进入疾病高发期,因各类疾病导致的养殖对虾年损失已超过百亿元(农业农村部渔业渔政管理局等, 2018)。对虾疾病的暴发与养殖环境关系极为密切,良好的养殖环境能减少疾病发生。然而,近年来由于养殖用地缩减,市场需求增大,对虾养殖密度普遍提高,养殖中后期水体残饵、粪便积累增多,导致水体氨氮、亚硝基氮浓度过高,给养殖对虾带来了潜在的危害。研究发现,过高浓度的氨氮不仅对对虾具有直接的生物毒性(Barbieri et al, 2010),而且会降低对虾的免疫力(Liu et al, 2004),影响其正常的生理代谢(Racotta et al, 2000)。
采用益生菌改善养殖环境、提高养殖动物抗病力,是近年来水产养殖领域中的研究热点之一。自然环境中存在大量的功能性微生物,具有杀菌(Luis-Villaseñor et al, 2011; Liu et al, 2015)、提高对虾免疫力(Ochoa-Solano et al, 2006)、降解氨氮、亚硝基氮(Song et al, 2011; 胡修贵等, 2013; 王越等, 2019)等功能。其中,具有脱氮功能的微生物种类较多,广泛分布于土壤、海水和淡水水域及水产养殖系统中(沈李东等, 2011; 王磊等, 2016),在促进生态系统氮循环中发挥重要作用。
本研究从山东省潍坊市一家对虾养殖场分离到1株具有较高脱氮能力的细菌,研究了该菌在不同盐度、pH、碳源及C/N条件下对氨氮及亚硝基氮的去除能力,采用16S rRNA序列比对方法对该菌进行了初步的分类鉴定,同时,对该细菌进行了生物安全性评价,以期为该菌的开发利用提供技术支持。
1 材料与方法 1.1 实验用对虾及饲养管理菌株安全性评价所用凡纳滨对虾(Litopenaeus vannamei)购于山东省潍坊市一家对虾养殖场,其平均体长为(4.0±0.4) cm,实验前,于养殖池中暂养2周,水温为27.0℃,盐度为28.0,pH为7.4,溶解氧(DO) > 5.0 mg/L。
1.2 脱氮培养基硝化培养基的配方参照孙振(2013),经预实验筛选确定碳源为蔗糖,硝化培养基配方(g/L):蔗糖6.21,NH4Cl l0.5,MgSO4·7H2O 0.2,CaCl2 0.01,KH2PO4 0.5,EDTA (0.5 mol/L) 0.5 ml,Na2HPO4 0.5,FeSO4 0.01,NaCl l20,微量元素溶液为5 ml,pH为7.0~7.5。
微量元素溶液配制(g/L):EDTA 50,ZnSO4 2.2,MnCl2·4H2O 5.06,FeSO4·7H2O 5.0,CuSO4·5H2O 1.57,CaCl2 5.5,(NH4)6 Mo7O24·4H2O 1.1,CoCl2·6H2O 1.61,pH 7.0,培养基中的C/N接近20。115℃高压蒸汽灭菌20 min (在其他成分灭菌完成后,NH4Cl经0.22 μm微孔滤膜过滤除菌后再加入),固体培养基在未灭菌之前加入20%的琼脂粉。
1.3 菌株的采集与分离从山东省潍坊市的室外凡纳滨对虾养殖池中采集水样,装入无菌采样管中低温保存,带回实验室后采用Zobell 2216E(蛋白胨5 g/L、酵母膏1 g/L、FePO4 0.01 g/L、琼脂20 g/L、陈海水1 L,pH 7.8)平板划线法分离纯化,对所有菌株进行编号,–70℃保存备用。
1.4 脱氮菌株的筛选将分离纯化后的菌株采用划线方法接种到硝化固体培养基上,28℃培养箱培养48 h,根据菌株的生长情况进行筛选。将筛选出的菌株接种至硝化液体培养基中,置于28℃ 150 r/min的摇床,培养48 h后测定培养基中氨氮浓度,计算各菌株脱氮效率,筛选脱氮效率最高者用于后续研究。
氨氮的测定采用次溴酸盐氧化法,亚硝基氮测定采用萘乙二胺分光光度法(海洋监测规范第4部分) (GB 17378.4-2007)。氨氮去除率的计算按照公式:
| $氨氮去除率(\%)=(初始氨氮浓度-剩余氨氮浓度)/ 初始氨氮浓度\times100\% $ |
以蔗糖为碳源,配制C/N为20、盐度为15,pH为7.0~7.5,氨氮浓度分别为10、20、30、40和50 mg/L的硝化培养基。平板计数法测定细菌浓度,制定菌液OD值与细菌浓度的工作曲线,根据工作曲线配制浓度为107 CFU/ml的菌液,以3%的接种量接入硝化液体培养基中,在28℃,150 r/min的恒温摇床中振荡培养,每隔4 h取样1次,部分样品用于测定OD600 nm值,剩余样品经3000×g离心10 min后,测定培养基上清液中的氨氮含量和各组菌液中氨氮浓度,每组设置3个平行。
菌株OD600 nm与脱氮效率相关性分析:依据5个氨氮浓度组在每个取样时间点的平均OD值及平均脱氮效率,进行相关性分析,确定相关系数。
1.6 不同碳源对实验菌脱氮效果的影响为优化脱氮菌碳源,分别以葡萄糖、蔗糖、麦芽糖、丁二酸钠、柠檬酸钠、α-乳糖和可溶性淀粉为碳源,配制氨氮浓度为20 mg/L,C/N为20的硝化液体培养基。将浓度为1.0×107 CFU/ml菌液以3%的接种量接种于含不同碳源的液体硝化培养基中,28℃ 150 r/min的恒温摇床培养,每隔4 h取样1次,每组设3个平行。
1.7 不同盐度对实验菌株脱氮效果的影响以蔗糖为碳源,配制氨氮浓度为20 mg/L、C/N为20的硝化液体培养基,用NaCl调节培养基的盐度分别为5、15、25、35和45。参照1.5的培养及分析方法,测量各盐度组菌株的脱氮效果,每组设3个平行。
1.8 不同pH对实验菌株脱氮效果的影响以蔗糖为碳源,配制氨氮浓度为20 mg/L、C/N为20、盐度为15的液体硝化培养基,分别用0.1 mol/L的HCl和NaOH溶液调节液体培养基的初始pH,使其初始值分别为5、6、7、8和9。参照1.5的培养及分析方法,测量各pH组菌株的脱氮效果,每组设3个平行。
1.9 不同C/N对实验菌株脱氮效果的影响以蔗糖为碳源,配制氨氮浓度为20 mg/L、盐度为15的液体硝化培养基5组,通过调节蔗糖浓度,使各组的C/N分别为5、10、15、20和25。参照1.5的培养及分析方法,测量各组菌株的脱氮效果,每组设3个平行。
1.10 菌株生物安全性评价待测菌株用Zobell2216E液体培养基发酵24 h后,3000×g 4℃离心10 min,弃上清液,用PBS重悬稀释成菌悬液,然后在5个10 L的塑料桶内,用过滤海水将菌液分别稀释成浓度分别为1×104、1×105、1×106、1×107和1×108 CFU/ml感染用菌液各5 L。在每桶中放入10尾凡纳滨对虾浸泡感染,12 h后换水50%,之后每24 h换水30%,正常投喂养殖管理,全程充气,记录对虾的摄食、脱皮、活力及存活情况,至对虾稳定1周后,停止记录。
1.11 菌株初步鉴定采用16S rRNA序列分析比对和系统发育分析确定菌株的分类:菌株16S rRNA PCR序列扩增所用引物及程序参照Wan等(2013),PCR扩增产物测序委托上海桑尼生物科技有限公司,所得序列经NCBI Blast比对分析,选取同源性较高的序列,利用MEGA 6.0构建系统发育树,确定筛选菌株的分类地位。
1.12 数据分析采用Excel 2013软件对实验数据进行统计及相关性分析。采用SPSS16.0软件计算细菌感染半致死浓度。
2 结果 2.1 脱氮菌株的筛选从对虾养殖池中共分离出32株菌株,经脱氮效果检测,菌株2906脱氨氮效率达(92.1±2.4)%,为所选菌株中最高者。该菌株在2216E培养基上培养24 h,菌落直径为1~2 mm,边缘整齐、表面扁平,菌株淡绿色、半透明,选该菌为目标菌株用于后续研究。
2.2 菌株脱氨氮能力测定、菌株生长与脱氨氮率的相关性接种菌株2906于不同氨氮浓度的硝化培养基中,其脱氮效率见图 1。从图 1可以看出,在测试的氨氮浓度范围内,该菌株均表现出一定的脱氮能力,32 h时对浓度为10 mg/L的氨氮去除率达(98.9±0.8)%,对浓度为50 mg/L的氨氮去除率达(52.4±0.6)%。
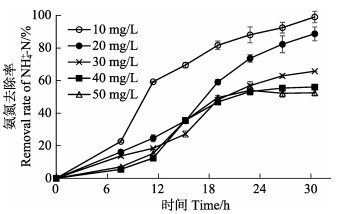
|
图 1 菌株2906对不同浓度氨氮的去除率 Fig.1 Nitrogen removal rate of strain 2906 in medium with different concentration of NH4+-N |
菌株氨氮去除率与OD值的关系见表 1,相关性分析显示,其二者的相关系数为0.94,具有强相关性,表明菌株增殖的过程也是代谢氨氮的过程。
|
|
表 1 不同氨氮组中各采样时间点菌液OD600 nm和脱氮效率 Tab.1 OD600 nm and removal rate of NH4+-N of fermentation broth at different sampling time |
菌株2906在7种不同碳源硝化培养基中的脱氮效率见图 2。从图 2可以看出,以柠檬酸钠为碳源的培养基在20 h时脱氮效率达100%;以蔗糖和葡萄糖为碳源的培养基在32 h时其脱氮效率接近100%;可溶性淀粉为碳源时,菌株2906的脱氮效果最差,32 h时仅为(8.3±1.2)%,其他3种碳源组的32 h脱氮效率均低于(61.1±2.3)%。检测各实验组不同发酵时间段培养基中亚硝酸盐浓度,结果显示,测试的发酵液中均未有亚硝酸盐检出,即氨氧化不产生亚硝酸盐。

|
图 2 碳源对菌株2906脱氮率的影响 Fig.2 Effects of carbon sources on nitrogen removal rate of strain 2906 |
菌株2906在不同盐度的硝化培养基中脱氮效率见图 3。从图 3可以看出,该菌株在盐度为5的培养基中脱氮效率最高,在28 h到达最高脱氮效率,为(94.1±2.0)%;在盐度为15的培养基中,32 h脱氮效率达(91.3±4.3)%;在盐度为25的培养基中,32 h时的脱氮效率仅为(45.4±3.3)%;而在盐度为35和45的培养基中,32 h时的脱氮效率分别为(2.06±1.8)%和(1.9±0.4)%,基本不具备脱氮能力。
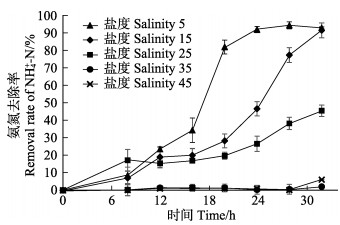
|
图 3 盐度对实验菌株脱氮率的影响 Fig.3 Effects of salinity on nitrogen removal rate of strain 2906 |
菌株2906在不同初始pH硝化培养基中的脱氮效率见图 4。从图 4可以看出,实验菌株在初始pH为8和7的培养基中32 h时具有最高的脱氮效率,分别为(88.9±6.0)%和(76.8±3.2)%;在初始pH为5和6的培养基中脱氮效率较低,在32 h时分别为(12.7±0.7)%和(24.6±2.8)%;在初始pH为9的培养基中脱氮效率仅为(25.1±2.4)%。
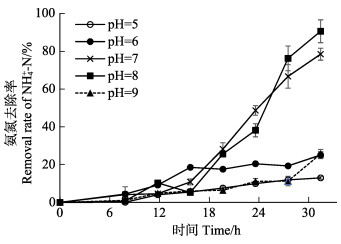
|
图 4 初始pH对实验菌株脱氮效率的影响 Fig.4 Effects of pH on nitrogen removal rate of strain 2906 |
菌株2906在不同C/N硝化培养基中的脱氮效率如图 5所示,在C/N为20的硝化培养基中,菌株的脱氮效率最高,发酵28 h脱氮效率即可达100%;C/N为15时,菌株脱氮效率次之,在32 h时脱氮效率均达100%;C/N为5时最差,发酵32 h脱氮效率仅为(53.6±3.5)%。

|
图 5 C/N对实验菌株脱氮效率的影响 Fig.5 Effects of C/N on nitrogen removal rate of strain 2906 |
使用菌株2906浸泡感染对虾,结果显示,高浓度菌液(108 CFU/ml)组的对虾在第3天全部死亡,其他4个浓度组到实验第10天均存活,且在实验期间摄食、脱皮正常,反应灵敏。根据死亡率计算可知,该菌株的LC50为2.8×107 CFU/ml。
2.8 菌株鉴定对菌株2906进行PCR扩增测序,得到长为1440 bp序列,将扩增产物序列进行BLAST序列比对(1https://blast.ncbi.nlm.nih.gov/Blast.cgi),结果显示,该菌与多株假交替单胞菌属细菌(Pseudoalteromonas spp.)亲缘关系最近,且与菌株P. tetraodonis在一个分支上,同源性达99.5%以上,选取与该菌株相近的11株菌的核酸序列构建系统发育树,判定该菌为1株假交替单胞菌(图 6)。

|
图 6 根据菌株2906 16S rRNA序列与相近的菌株构建系统发育树 Fig.6 Phylogenetic tree constructed based on the16S rRNA gene sequence of strain 2906 and similar strains 节点数为bootstrap支持率,1000次重复 The number of nodes is bootstrap support rate of 1000 repetitions |
假交替单胞菌属为1995年确立的1个新的细菌属(Gauthier et al, 1995),该属的细菌因具有分泌生物活性物质及多共生于海洋动植物体上的特性,引起了研究者的广泛关注。目前,已发现的该属细菌中有20余种能产生活性物质,其功效包括降解琼胶、抗细菌、抗真菌、杀菌、促进水生动物幼体附着等(Holmström et al, 1999, 张欢欢等, 2016)。王磊等(2016)从对虾肠道中分离出的1株假交替单胞菌,具有抗弧菌及脱氮功能,应用于对虾养殖中,能够显著降低水体中的氨氮浓度。本研究从对虾养殖水体中分离出的菌株2906为适应低盐度(5~15)的菌株,在pH为7~8时,具有较强的脱氨氮能力,而该环境条件为对虾养殖的适宜条件,且该菌对对虾表现出良好的生物安全性,因此,可将该菌株应用于对虾养殖系统中,发挥其脱氮功能。
氨氧化细菌多为自养细菌,广泛存在于土壤、湖泊及其底泥、海洋等环境中,但该类细菌极难培养(董莲华等, 2008)。近年来,关于厌氧氨氧化细菌的报道较多,厌氧氨氧化细菌能够在厌氧环境中,同时以NH4+作为电子供体,NO2–作为电子受体,将氨氮和亚硝酸氮转化为N2 (Mulder et al, 1995)。目前,在海洋中发现的该类细菌均属于浮霉菌纲,各种之间分类学距离较远,发现海洋中主要种类为Candidatus scalindua (魏海峰等, 2014)。本研究筛选的菌株2906为异养硝化细菌,能够利用柠檬酸钠、蔗糖、葡萄糖等有机碳源。迄今为止,已报道的异养硝化细菌主要在假单胞菌属(Pseudoalteromonas) (Koschorreck et al, 1996)、盐单胞菌属(Halomonas) (张欢欢, 2015)、不动杆菌属(Acinetobacter) (Yang et al, 2015)、产碱杆菌属(Alcaligenes) (van Neil et al, 1992)、副球菌属(Paracoccus) (Shi et al, 2013)及克雷伯氏菌属(Klebsiella) (Padhi et al, 2013)等属中,假交替单胞菌属细菌具有脱氮功能的相关报道较少,该属细菌的脱氮机理仍需后续研究。
异养硝化细菌脱氮过程与其所处的环境理化因子及营养物质有密切的关系,不同的菌株在不同的环境和营养条件下生长存在差异,适宜的碳源与盐度(Reddy et al, 2014)、pH (Fajardo et al, 2014)、C/N (Karanasios et al, 2016)、溶解氧(Meng et al, 2008)和温度(Capua et al, 2017)等能显著提高脱氮效果。本研究对所筛选的菌株进行脱氨氮条件比较显示,菌株2906能够有效利用柠檬酸钠、蔗糖及葡萄糖等有机碳,高效去除氨氮,且在氨氧化过程中,不产生亚硝酸盐,表明该菌为异养硝化菌。异养硝化菌在氨代谢过程中,由氨单氧酶(Ammonia monooxygenase)催化氨形成羟胺后,经非血红素铁羟胺氧化酶(Non-haem iron hydroxylamine oxidase)的催化,直接形成N2O和N2 (Richardson et al, 1998)。与自养细菌的代谢机制存在差别。
Barbieri E. Acute toxicity of ammonia in white shrimp (Litopenaeus schmitti) (Burkenroad, 1936, Crustacea) at different salinity levels. Aquaculture, 2010, 306(1-4): 329-333 DOI:10.1016/j.aquaculture.2010.06.009 |
Capua FD, Milone I, Lakaniemi AM, et al. High-rate autotrophic denitrification in a fluidized-bed reactor at psychrophilic temperatures. Chemical Engineering Journal, 2017, 313: 591-598 DOI:10.1016/j.cej.2016.12.106 |
Department of Science and Technology Education of Ministry of Agriculture and Rural Affairs, Department of Science and Technology Education of Ministry of Finance, Science and Technology Development Center of Ministry of Agriculture and Rural Affairs. China agricultural industry technology development report. Beijing: China Agricultural Science and Technology Press, 2018, 11(1): 238-243 [农业农村部科技教育司, 财政部科技教育司, 农业农村部科技发展中心. 中国农业产业技术发展报告. 北京:中国农业科学技术出版社, 2018, 11(1): 238-243] |
Dong LH, Yang JS, Yuan HL. Research advances in molecular ecology of ammonia oxidizing bacteria. Chinese Journal of Applied Ecology, 2008, 19(6): 1381-1388 [董莲华, 杨金水, 袁红莉. 氨氧化细菌的分子生态学研究进展. 应用生态学报, 2008, 19(6): 1381-1388] |
Fajardo C, Mora M, Fernández I, et al. Cross effect of temperature, pH and free ammonia on autotrophic denitrification process with sulphide as electron donor. Chemosphere, 2014, 97: 10-15 DOI:10.1016/j.chemosphere.2013.10.028 |
Fisheries and Fishery Administration Bureau of Ministry of Agriculture and Rural Affairs, National Aquatic Technology Promotion Station. China aquatic animal health status report in 2017. Beijing: China Agriculture Press, 2018 [农业农村部渔业渔政管理局, 全国水产技术推广总站. 2017中国水生动物卫生状况报告. 北京: 中国农业出版社, 2018]
|
Gauthier G, Gauthier M, Christen R. Phylogenetic analysis of the genera Alteromonas, Shewanella and Moritella using genes coding for small-subunit rRNA sequences and division of the genus Alteromonas into two genera, Alteromonas (Emended) and Pseudoalteromonas gen. nov., and proposal of twelve new species combinations. International Journal of Systematic Bacteriology, 1995, 45(4): 755-761 |
Holmström C, Kjelleberg S. Marine Pseudoalteromonas species are associated with higher organisms and produce biologically active extracellular agents. FEMS Microbiology Ecology, 1999, 30(4): 285-293 DOI:10.1111/j.1574-6941.1999.tb00656.x |
Hu XG, Zhao P, Li YH, et al. Isolation and identification of heterotrophic nitrosobacteria from bio-flocs and analysis of their characteristics. Progress in Fishery Sciences, 2013, 34(5): 97-103 [胡修贵, 赵培, 李玉宏, 等. 生物絮团中异养亚硝化菌的分离鉴定及其特性. 渔业科学进展, 2013, 34(5): 97-103 DOI:10.3969/j.issn.1000-7075.2013.05.015] |
Karanasios KA, Vasiliadou IA, Tekerlekopoulou AG, et al. Effect of C/N ratio and support material on heterotrophic denitrification of potable water in bio-filters using sugar as carbon source. International Biodeterioration and Biodegradation, 2016, 111: 62-73 DOI:10.1016/j.ibiod.2016.04.020 |
Liu CH, Chen JC. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus. Fish and Shellfish Immunology, 2004, 16(3): 321-334 DOI:10.1016/S1050-4648(03)00113-X |
Liu XF, Li Y, Li JR, et al. Isolation and characterisation of Bacillus spp. antagonistic to Vibrio parahaemolyticus for use as probiotics in aquaculture. World Journal of Microbiology and Biotechnology, 2015, 31(5): 795-803 |
Luis-Villaseñor IE, Macías-Rodríguez ME, Gómez-Gil B. Beneficial effects of four Bacillus strains on the larval cultivation of Litopenaeus vannamei. Aquaculture, 2011, 321: 136-144 DOI:10.1016/j.aquaculture.2011.08.036 |
Koschorreck M, Moore E, Conrad R. Oxidation of nitric oxide by a new heterotrophic Pseudononas sp. Archives of Microbiology, 1996, 166(1): 23-31 DOI:10.1007/s002030050351 |
Meng QJ, Yang FL, Liu LF, et al. Effects of COD/N ratio and DO concentration on simultaneous nitrifcation and denitrifcation in an airlift internal circulation membrane bioreactor. Journal of Environmental Sciences, 2008, 20(8): 933-939 DOI:10.1016/S1001-0742(08)62189-0 |
Mulder A, van de Graaf AA, Robertson LA, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiology Ecology, 1995, 16(3): 177-183 DOI:10.1111/j.1574-6941.1995.tb00281.x |
Ochoa-Solano JL, Olmos-Soto J. The functional property of Bacillus for shrimp feeds. Food Microbiology, 2006, 23(6): 519-525 DOI:10.1016/j.fm.2005.10.004 |
Padhi SK, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater. International Biodeterioration and Biodegradation, 2013, 78(3): 67-73 |
Racotta IS, Hernández-Herrera R. Metabolic responses of the white shrimp, Penaeus vannamei, to ambient ammonia. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2000, 125(4): 437-443 DOI:10.1016/S1095-6433(00)00171-9 |
Reddy N, Crohn DM. Effects of soil salinity and carbon availability from organic amendments on nitrous oxide emissions. Geoderma, 2014, 235-236: 363-371 DOI:10.1016/j.geoderma.2014.07.022 |
Richardson DJ, Wehrfritz JM, Keech A, et al. The diversity of redox proteins involved in bacterial heterotrophic nitrification and aerobic denitrification. Biochemical Society Transactions, 1998, 26(3): 401-408 |
Shen LD, Zheng P, Hu BL. Anaerobic ammonium oxidation in natural ecosystems. Acta Ecologica Sinica, 2011, 31(15): 4447-4454 [沈李东, 郑平, 胡宝兰. 自然生态系统中的厌氧氨氧化. 生态学报, 2011, 31(15): 4447-4454] |
Shi Z, Zhang Y, Zhou J, et al. Biological removal of nitrate and ammonium under aerobic atmosphere by Paracoccus uersutus LYM. Bioresource Technology, 2013, 148(7): 144-148 |
Song ZF, An J, Fu GH, et al. Isolation and characterization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds. Aquaculture, 2011, 319(1-2): 188-193 |
Sun Z. The application of flocculent producing microbial in the culture of shrimp (Litopenaeus vannamei). Masterxs Thesis of Ocean University of China, 2013 [孙振.产絮团微生物在凡纳滨对虾养殖中的作用.中国海洋大学硕士研究生学位论文, 2013]
|
van Neil EW, Braber KJ, Robertson LA, et al. Heterotrophic nitrification and aerobic denitrification in Alcaligenes faecalis strain TUD. Antonie van Leeuwenhoek, 1992, 62(3): 231-237 DOI:10.1007/BF00582584 |
Wang HY, Yang K, Ji B, et al. Isolation and molecular identification of an aerobic denitrifier. International Journal of Environmental Science and Development, 2013, 4(5): 525-528 |
Wang L, Wang ZJ, Gao G, et al. Identification and application of a probiotic strain functioning in both ammonia nitrogen removal and Vibrio parahaemolyticus antagonism. Progress in Fishery Sciences, 2016, 37(3): 78-84 [王磊, 王志杰, 高戈, 等. 一株兼具氨氮去除能力和对副溶血弧菌拮抗作用的有益菌的筛选及其初步应用. 渔业科学进展, 2016, 37(3): 78-84] |
Wang Y, Cheng Y, Li QF, et al. Effects of different nitrogen sources and environmental factors on the nitrogen removal performance of Bacillus hwajinpoensis SLWX2. Progress in Fishery Sciences, 2019, 40(1): 133-140 [王越, 成钰, 李秋芬, 等. 不同氮源和环境因子对花津滩芽孢杆菌SLWX2脱氮性能的影响. 渔业科学进展, 2019, 40(1): 133-140] |
Wei HF, Zhou JT, Qiao S, et al. Research progress in marine anaerobic ammonium oxidation. Environmental Science and Technology, 2014, 37(9): 70-75 [魏海峰, 周集体, 乔森, 等. 海洋厌氧氨氧化研究进展. 环境科学与技术, 2014, 37(9): 70-75] |
Yang L, Ren YX, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high strength nitrogenous wastewater. Bioresource Technology, 2015, 193: 227-233 DOI:10.1016/j.biortech.2015.05.075 |
Zhang HH, Wang XH, Li C, et al. Isolation and identification of a bacterial strain with Vibrios-antagonism from shrimp ponds. Progress in Fishery Sciences, 2016, 37(3): 85-92 [张欢欢, 王秀华, 李晨, 等. 对虾养殖池中一株弧菌拮抗菌的分离鉴定. 渔业科学进展, 2016, 37(3): 85-92] |
Zhang HH. Isolation of three probiotics and the application of Bacillus sp. in bioflocs shrimp culture system. Masterxs Thesis of Ocean University of China, 2015 [张欢欢.三株有益菌的初步分离鉴定及芽孢杆菌在生物絮团对虾养殖中的应用.中国海洋大学硕士研究生毕业论文, 2015]
|



