2. 上海海洋大学水产与生命学院 上海 201306
Farmed Spotted Knifejaw, Oplegnathus punctatus
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
斑石鲷(Oplegnathus punctatus)属温、热带近海鱼类,广泛分布于中国黄海、东海、南海以及朝鲜半岛、日本列岛和中国台湾等周边海域,具有形态优美、肉质细腻、生长速度快、当年上市等优点。2014年以来,随着大规模人工繁育和养殖获得成功,斑石鲷已成为我国名贵海水养殖鱼类新品种之一,养殖经济效益很高(高小强等, 2018)。由于规模化养殖的时间较短,斑石鲷病害尚不多见。已报道的斑石鲷疾病主要有上皮囊肿病(Egusa et al, 1987; 范超等, 2017)、黏孢子虫病(Yanagida et al, 2008)和卵鞭虫病(付泉洁等, 2017)等。有学者曾经从斑石鲷中分离到鱼类神经坏死病毒和虹彩病毒,但未见由这些病毒导致斑石鲷大规模死亡的报道(Skliris et al, 2001; Dong et al, 2010)。
虹彩病毒主要感染无脊椎动物和低等脊椎动物,属大型二十面体状、细胞质型DNA病毒。虹彩病毒科(Iridoviridae)共分为5个病毒属,即虹彩病毒属(Iridovirus)、绿虹彩病毒属(Chloriridovirus)、淋巴囊肿病毒属(Lymphocystivirus)、蛙病毒属(Ranavirus)和肿大细胞病毒属(Megalocytivirus)(Jancovich et al, 2012)。其中,隶属于肿大细胞病毒属的真鲷虹彩病毒(Red sea bream iridovirus, RSIV)是鱼类的重要病毒性病原之一,可导致真鲷(Pagrus major)、条石鲷(Oplegnathus fasciatus)、杂交石斑鱼——褐龙斑(Epinephelus bruneus ♀×E. lanceolatus ♂)等海水养殖鱼类发病并大量死亡,造成巨大的经济损失(Inouye et al, 1992; 李华等, 2011; 刘冉阳等, 2019)。真鲷虹彩病毒病一直被世界动物卫生组织列为必须向其通报的鱼类重要疫病,受到严格监控(OIE, 2018)。
2017年8月,山东省烟台市某养殖场网箱养殖的斑石鲷幼鱼突然发病,并大量死亡,2周内累积死亡率超过90%。本研究通过疾病调查和分子生物学分析等方法,首次证实RSIV可导致斑石鲷大规模死亡,研究结果为防治斑石鲷病毒病提供了重要参考。
1 材料与方法 1.1 实验材料实验用斑石鲷取自山东省烟台市某海水鱼养殖场,自然发病的斑石鲷和人工感染用健康斑石鲷全长为14~18 cm,体重为150~200 g。
2216E培养基、弧菌选择性培养基(TCBS)购自北京陆桥生物制品有限公司;2%多聚甲醛–2.5%戊二醛固定液购自索莱宝科技有限公司;海洋动物组织基因组DNA提取试剂盒和琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司,高保真Ex Taq DNA聚合酶、dNTPs、DNA Marker购自TaKaRa公司。其他试剂均为国产分析纯。
1.2 实验方法 1.2.1 流行情况调查及临床症状检查疾病暴发时,深入现场调查养殖水温、养殖密度、鱼龄、发病率、死亡率等情况,观察病鱼的活动状态。取症状典型的病鱼,置于解剖盘中,检查其体表症状,然后解剖打开腹腔,观察体腔及各内脏组织器官的病变情况,并做好记录。
1.2.2 寄生虫和细菌检查取病鱼的鳃丝、体表黏液、内脏器官和血液进行寄生虫检查。鳃丝、体表黏液采取水浸片法,脾、肾和肝采用压片法,血液用涂片法,制片后分别置于显微镜下观察。使用75%酒精棉球对病鱼体表消毒后,无菌条件下取病鱼的肝、肾、脾等内脏,在2216E和TCBS平板上划线接种,28℃培养48 h,观察细菌生长情况。
1.2.3 组织病理观察分别取健康鱼和病鱼的脾、肾组织,切成小块,置于Davidson′s AFA中固定24 h,常规石蜡切片、苏木精–伊红(HE)染色,光学显微镜下观察、拍照。将肾脏组织切成2 mm×2 mm× 2 mm的小块,在4℃固定于2%多聚甲醛–2.5%戊二醛固定液中,在0.1 mol/L磷酸缓冲液中漂洗,再用1%锇酸溶液固定,经过一系列浓度的乙醇脱水,样品块经环氧树脂包埋后制备超薄切片,透射电镜观察、拍照。
1.2.4 人工感染取病鱼的脾组织约1 g,加入9 ml 0.9%的生理盐水,用玻璃匀浆器在碎冰上匀浆,然后,转移组织匀浆液到无菌50 ml离心管中。在–40℃和室温下反复冻融3次后,4℃ 3000 r/min离心30 min。取上清液,经0.22 μm滤膜过滤,收集到新的50 ml离心管中,加入10%体积的100×双抗,充分混匀、备用。健康斑石鲷随机分成3组,每组10尾,置于26℃~28℃的海水中养殖。其中,2组作为感染组,腹腔注射上述制备的病鱼组织匀浆液,0.2 ml/尾;另外1组作为对照组,腹腔注射无菌生理盐水,0.2 ml/尾。注射后,每日观察实验鱼的状况、并做好记录,持续观察14 d以上。取濒死实验鱼的脾、肾等组织,一部分同1.2.3制作组织切片,另一部分提取DNA、检测病毒。
1.2.5 样品DNA提取取脾、肾、肝等样品提取组织DNA,用微量核酸测定仪(NanoDrop 2000c, Thermo, 美国)测定DNA浓度和纯度,稀释至100 ng/μl备用。
1.2.6 PCR检测依照行业标准《真鲷虹彩病毒病检疫技术规范》(SN/T 1675-2014),使用引物1-F(5′-CTCAAACACTCTGGCTCATC-3′)和1-R(5′-G-CACCAACACATCTCCTATC-3′)进行PCR检测,目标扩增产物大小为570 bp。
25 μl PCR反应体系:1 μl模板DNA,2.5 μl 10× Reaction buffer,2 μl Mg2+(2 mmol/L),2 μl dNTPs(各2.5 mmol/L),1 μl引物1-F(10 μmol/L),1 μl引物1-R (10 μmol/L),0.5 μl Taq酶(5 U/μl),15 μl超纯水。PCR反应程序:95℃预变性2 min;94℃ 30 s,58℃ 60 s,72℃ 60 s,共30个循环;最后,72℃延伸5 min,4℃保存。反应结束,用10 g/L琼脂糖凝胶电泳检查结果。
1.2.7 斑石鲷虹彩病毒主要衣壳蛋白基因的扩增及分析采用引物MCP-iridoF (5′-GTGCAGGTTTCC AGAAGA-3′)和MCP-iridoR (5′-CATGGTACGTAACG CATAG-3′)对虹彩病毒主要衣壳蛋白基因(Major capsid protein gene, MCP)全长序列进行扩增,目标扩增产物为1.6 Kb (史成银, 2004)。
25 μl PCR反应体系:1 μl模板DNA,2.5 μl 10× Reaction buffer,2 μl Mg2+(2 mmol/L),2 μl dNTPs(各2.5 mmol/L),1 μl引物MCP-iridoF (10 μmol/L), 1 μl引物MCP-iridoR (10 μmol/L), 0.5 μl Ex Taq酶(5U/μl),15 μl超纯水。PCR反应程序:94℃预变性5 min;94℃ 2 min,57℃ 1 min,72℃ 1 min,共35个循环;最后,72℃延伸10 min,4℃保存。反应结束后,用10 g/L琼脂糖凝胶电泳检查结果。将阳性扩增产物送生工生物工程(上海)股份有限公司测序,用Blast比对分析测序结果。从GenBank上下载16种虹彩病毒分离株的MCP基因序列,连同测序得到的斑石鲷虹彩病毒MCP基因序列,采用MEGA 7.0软件进行多序列比对与同源性分析,构建系统发育树。
2 结果 2.1 现场调查及临床症状检查2017年8月末,养殖海域水温为26℃~28℃,山东省烟台市某养殖场近海网箱养殖的斑石鲷突然发病死亡。起初个别网箱的斑石鲷少量死亡,但病情进展迅速。第1天仅发现死鱼100余尾,第2天死鱼便高达6000余尾,1周内3个最早发病网箱中的30000尾鱼全部死亡。养殖的80万尾幼鱼发病后,日死亡率为5%~10%,2周内累积死亡率高达90%~ 95%,损失惨重。调查发现,发病斑石鲷为4~5月龄,全长为(16.3±1.6) cm,体重为(156.9±37.0) g,养殖密度为10~15尾/m3水体。病鱼体表无明显损伤,仅表现为体色发黑,游动缓慢,活力明显下降(图 1)。解剖可见,多数病鱼空胃空肠,脾、肾严重肿大、易碎;肝出血,胆囊充盈。其他组织器官无明显异常。

|
图 1 斑石鲷病鱼 Fig.1 Diseased spotted knifejaw (O. punctatus) |
经制片和显微观察,所检斑石鲷病鱼均未观察到寄生虫。将病鱼的肝、肾、脾等内脏病料接种于2216E和TCBS平板上,28℃培养48 h,未见细菌生长。
2.3 病理切片观察结果在石蜡切片中,可以观察到病鱼脾、肾的造血组织中存在大量嗜碱性的、直径达20 μm的肿大细胞,其细胞核固缩。病鱼肾小管上皮细胞崩解、管腔变大;肾小球毛细血管内皮细胞肿大(图 2A和图 2B)。

|
图 2 斑石鲷病鱼的组织病理变化
Fig.2 Histopathological changes in the diseased fish
A:脾组织中细胞质嗜碱性的肿大细胞(箭头);B:肾组织中细胞质嗜碱性的肿大细胞(箭头)、肾小管(Rt)和肾小球(G)
Enlarged cells with basophilic cytoplasm (solid arrow) in the spleen tissues; B: Enlarged cells with basophilic cytoplasm (solid arrow), renal tubules (Rt) and glomerulus (G) in the kidney tissues |
在病鱼肾组织的超薄切片中,也观察到许多直径约为20 μm的肿大细胞,其内可见大量的病毒粒子(图 3A)。病毒粒子无囊膜、直径约为(145±5) nm,具有典型的虹彩病毒样结构:最外层是截面呈六边形的病毒外壳,最内层为高电子密度的球状核心,在病毒外壳和核心之间为低电子密度的间隔区(图 3B)。

|
图 3 斑石鲷病鱼肾中的肿大细胞及病毒粒子 Fig.3 Enlarged cell and virions in the kidney tissues of diseased fish A:肾组织中的肿大细胞(Ec)和肾小管(Rt);B:肿大细胞内的病毒粒子(箭头) A: Enlarged cell (Ec) and renal tubules (Rt) in the kidney tissues; B: Virions (solid arrow) in the enlarged cell |
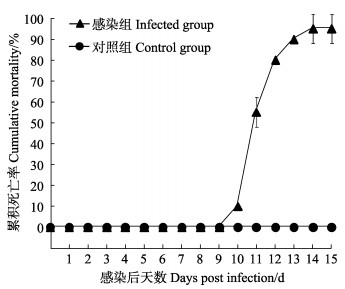
养殖水温为26℃~28℃时,用自然发病鱼的脾和肾组织匀浆液腹腔注射感染健康斑石鲷。感染后第10天开始死亡,至14 d时,感染组累积死亡率达95%,对照组未发生死亡(图 4)。人工感染病鱼体色变黑、游泳无力,表现出与自然发病鱼相似的临床症状。人工感染病鱼的脾和肾组织中也可见大量细胞质嗜碱性的肿大细胞,且其内存在大量典型的类似虹彩病毒的颗粒。人工感染病鱼与自然发病鱼的病理特征相似,但人工感染病鱼的组织细胞病变更严重。
|
图 4 斑石鲷的人工感染实验 Fig.4 Artificial infection experiment of spotted knifejaw |
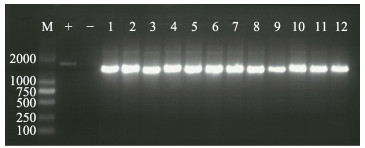
依照中华人民共和国出入境检验检疫行业标准(SN/T 1675-2014),利用合成的真鲷虹彩病毒特异性检测引物,对所提取的斑石鲷各组织病料DNA进行PCR检测。4尾病鱼的肝、脾、肾组织中均能扩增出约570 bp的单一条带,与目的片段大小相符(图 5)。上述结果表明,感染斑石鲷的病毒为真鲷虹彩病毒,检测结果为强阳性。

|
图 5 使用真鲷虹彩病毒特异性引物检测斑石鲷病鱼
Fig.5 PCR result of diseased spotted knifejaw using RSIV-specific primers
M:DL2000 DNA Marker;+:阳性对照;–:阴性对照;1~3:1号病鱼肝、脾、肾;4~6:2号病鱼肝、脾、肾; 7~9:3号病鱼肝、脾、肾;10~12:4号病鱼肝、脾、肾 M: DL2000 DNA marker; +: Positive control; –: Negative control; 1~3: Sample from liver, spleen and kidney of diseased fish #1; 4~6: Sample from liver, spleen and kidney of diseased fish #2; 7~9: Sample from liver, spleen and kidney of diseased fish #3; 10~12: Sample from liver, spleen and kidney of diseased fish #4 |
使用鱼类虹彩病毒特异性引物MCP-iridoF/ MCP-iridoR,从4尾病鱼的肝、脾、肾组织中均扩增得到约1.6 Kb的单一条带,与目的片段大小相符(图 6)。测序结果显示,各扩增产物的长度均为1581 bp,且序列完全相同。经Blast分析,该序列包含了肿大细胞虹彩病毒1362 bp的MCP基因开放阅读框(ORF)的全长序列,及其上游57 bp和下游162 bp的序列。
|
图 6 病毒主要衣壳蛋白基因(MCP)的扩增
Fig.6 Amplification of viral major capsid protein gene (MCP)
M:DL2000 DNA Marker;+:阳性对照;–:阴性对照;1~3:1号病鱼肝、脾、肾;4~6:2号病鱼肝、脾、肾; 7~9:3号病鱼肝、脾、肾;10~12:4号病鱼肝、脾、肾 M: DL2000 DNA marker; +: Positive control; –: Negative control; 1~3: Sample from liver, spleen and kidney of diseased fish #1; 4~6: Sample from liver, spleen and kidney of diseased fish #2; 7~9: Sample from liver, spleen and kidney of diseased fish #3; 10~12: Sample from liver, spleen and kidney of diseased fish #4 |
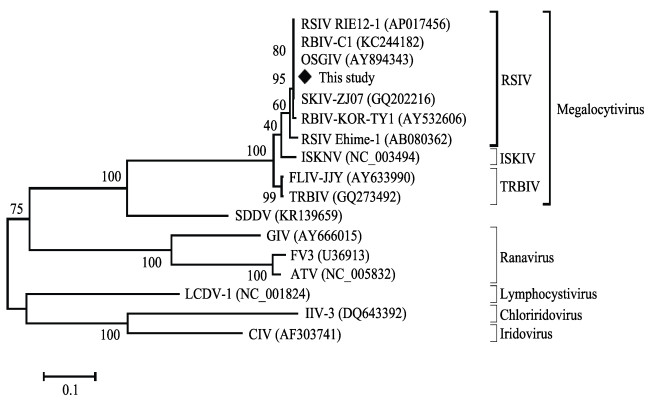
将测定的1362 bp病毒MCP基因ORF序列与GenBank数据库中16种(株)虹彩病毒的相应序列进行比对,结果发现,感染斑石鲷的虹彩病毒与虹彩病毒科肿大细胞病毒属的9种(株)病毒序列相似度很高,超过94%;而与虹彩病毒科其他4个病毒属(蛙病毒属、淋巴囊肿病毒属、绿虹彩病毒属和虹彩病毒属)的6种(株)病毒的相似度低,低于55%。因此,可以将感染斑石鲷的虹彩病毒鉴定为肿大细胞病毒属虹彩病毒。进一步分析发现,在肿大细胞病毒属内,引起此次斑石鲷大规模死亡的病毒与感染真鲷的RSIV RIE12-1、感染条石鲷的RBIV-C1、感染斜带石斑鱼的OSGIV的MCP基因ORF序列100%相同,与分离自湛江的斑石鲷虹彩病毒的SKIV-ZJ07仅有1个核苷酸不同,相似度为99.93%。因此,将引起此次斑石鲷大规模死亡的虹彩病毒鉴定为真鲷虹彩病毒RSIV。依据MCP基因ORF序列的多序列比对结果,采用Mega 7软件构建了虹彩病毒科17种(株)病毒的系统发育树。结果显示,引起此次斑石鲷大规模死亡的虹彩病毒与肿大细胞病毒属各病毒聚在一起,是RSIV的一个分离株(图 7)。
|
图 7 依据MCP基因ORF序列构建的17种(株)虹彩病毒系统发育树 Fig.7 The phylogenetic tree of 17 iridovirus isolates (stains) based on the ORF sequence of MCP gene |
近年来,肿大细胞虹彩病毒病已成为鱼类最主要的病毒病之一。该属病毒可感染多种海水养殖鱼类,如真鲷、大黄鱼(Larimichthys crocea)、大菱鲆(Scophthalmus maximus)、条石鲷、褐篮子鱼(Siganus fuscescens)、眼斑拟石首鱼(Sciaenop socellatus)、尖吻鲈(Lates calcarifer)、褐龙斑等(Inouye et al, 1992; Chen et al, 2003; 史成银, 2004; 李华等, 2011; 雷燕等, 2014; 席云清等, 2018; Senapin et al, 2019; 刘冉阳等, 2019),也可感染罗非鱼(Oreochromis niloticus)、翘嘴鳜(Siniperca chuatsi)、斑鳜(Siniperca scherzeri)、斑马鱼(Danio rerio)等淡水鱼类(Subramaniam et al, 2016; 吴淑勤等, 1997; Kim et al, 2018; Bermúdez et al, 2018),危害巨大。本研究通过疾病流行情况调查、临床症状观察、病原检测、组织病理观察、人工感染实验、分子生物学诊断和系统发育分析,确定2017年夏季引起养殖斑石鲷暴发性死亡的疾病为肿大细胞虹彩病毒病,其病原为真鲷虹彩病毒。虽已有从斑石鲷中分离到肿大细胞虹彩病毒的报道(Dong et al, 2010),但本研究首次证实RSIV可以导致斑石鲷大规模发病死亡。
不同种类的鱼感染肿大细胞虹彩病毒病后,临床症状存在一定的差异。比如,大黄鱼感染该病后体色发白,鳃丝极度贫血、发白且溃烂(Chen et al, 2003)。眼斑拟石首鱼感染该病后的主要症状为体色变为银黑色,鳍基出血,鳃丝贫血并有出血点(席云清等, 2018)。尖吻鲈感染该病后,出现脱鳞、鳍腐烂、腹部损伤、皮肤发红出血等症状(Senapin et al, 2019)。翘嘴鳜感染肿大细胞虹彩病毒后,鳃、肝苍白,内脏局部充血(吴淑勤等, 1997)。本研究发现,斑石鲷感染该病后,体色变暗、游动无力,但体表并没有明显的出血或者溃烂等症状,与大菱鲆感染该病后的症状相似(史成银, 2004)。因此,仅从外观症状上很难诊断斑石鲷虹彩病毒病,必须借助于病原检测技术才能对斑石鲷虹彩病毒病进行准确诊断。
组织病理学研究表明,鱼类肿大细胞虹彩病毒病最重要的特征是脾和肾等靶器官中存在肿大细胞,肿大细胞内含有大量的虹彩病毒粒子(Inouye et al, 1992; 史成银, 2004)。本研究在斑石鲷病鱼的脾和肾组织中也发现了大量的细胞质嗜碱性的肿大细胞,这些肿大细胞内存在大量直径约为145 nm的虹彩病毒粒子。而且,与自然发病鱼相比,人工感染斑石鲷的脾和肾组织中存在更多的肿大细胞,组织病变也更严重。疾病调查和人工感染实验都显示,斑石鲷是真鲷虹彩病毒的易感宿主,病鱼的组织病理变化广泛且严重。
本研究通过病毒MCP基因ORF序列的测定和虹彩病毒系统发育分析,将导致此次斑石鲷暴发性死亡的病毒鉴定为真鲷虹彩病毒。值得注意的是,该养殖场的褐龙斑此前曾暴发过真鲷虹彩病毒病(刘冉阳等, 2019)。经序列比对发现,感染斑石鲷和褐龙斑的虹彩病毒MCP基因序列100%相同,表明它们是同一种病毒。因此,该养殖场不同品种的养殖鱼类之间很可能存在病原交叉感染。因此,在生产中各养殖车间要严格执行消毒和隔离制度,通过检测、检疫防止病原侵入,采取生物安保措施防范虹彩病毒病的发生和蔓延。
斑石鲷虹彩病毒病一旦暴发就难以控制,幼鱼2周内累积死亡率高达90%以上,危害严重。在斑石鲷的规模化养殖过程中必须对该病高度重视,采取有效措施控制疾病的发生和蔓延。
Bermúdez R, Losada AP, de Azevedo AM, et al. First description of a natural infection with spleen and kidney necrosis virus in zebrafish. Journal of Fish Diseases, 2018, 41(8): 1283-1294 |
Chen XH, Lin KB, Wang XW. Outbreaks of an iridovirus disease in maricultured large yellow croaker, Larimichthys crocea (Richardson), in China. Journal of Fish Diseases, 2003, 26(10): 615-619 |
Dong CF, Weng SP, Luo YW, et al. A new marine megalocytivirus from spotted knifejaw, Oplegnathus punctatus, and its pathogenicity to freshwater mandarinfish, Siniperca chuatsi. Virus Research, 2010, 147(1): 98-106 |
Egusa S, Miyazaki T, Shiomitsu T, et al. Epitheliocystis-like disease occurred among hatchery-reared fly of Oplegnathus punctatus [in Japanese]. Fish Pathology, 1987, 22(1): 33–34
|
Fan C, Shi CY, Liu JC. First report and microscopic examination of epitheliocystis in cultured spotted knifejaw (Oplegnathus puncatus) in China. Progress in Fishery Sciences, 2017, 38(2): 177-180 [范超, 史成银, 刘江春. 中国养殖斑石鲷(Oplegnathus puncatus)上皮囊肿病的发现及显微观察. 渔业科学进展, 2017, 38(2): 177-180] |
Fu QJ, Fan C, Xie GS, et al. Molecular identification and phylogenetic analysis of a pathogenic dinoflagellate isolated from spotted knifejaw (Oplegnathus puncatus). Journal of Anhui Agricultural Sciences, 2017, 45(13): 135-140 [付泉洁, 范超, 谢国驷, 等. 斑石鲷卵鞭虫病病原的分子鉴定与系统发育分析. 安徽农业科学, 2017, 45(13): 135-140] |
Gao XQ, Hong L, Huang B, et al. Development of the breeding and rearing technology for Oplegnathus punctatus. Open Journal of Fisheries Research, 2018, 5(2): 112-122 [高小强, 洪磊, 黄滨, 等. 斑石鲷种苗繁育与养殖技术研究进展. 水产研究, 2018, 5(2): 112-122] |
Inouye K, Yamano K, Maeno Y, et al. Iridovirus infection of cultured red sea bream, Pagrus major. Fish Pathology, 1992, 27(1): 19-27 DOI:10.3147/jsfp.27.19 |
Jancovich JK, Chinchar VG, Hyatt A, et al. Family Iridoviridae. In: King AMQ, Lefkowitz E, Adams MJ, et al, eds. Virus taxonomy. Classification and nomenclature of viruses. Ninth Report of the International Committee on Taxonomy of Viruses. London: Academic Press, 2012, 193-210
|
Kim KI, Hwang SD, Cho MY, et al. A natural infection by the red sea bream iridovirus-type Megalocytivirus in the golden mandarin fish Siniperca scherzeri. Journal of Fish Diseases, 2018, 41(11): 1229-1233 DOI:10.1111/jfd.12815 |
Lei Y, Qi RR, Tang SL, et al. Diagnosis of iridovirus disease in spinefoot Siganus fuscescens. Journal of Dalian Ocean University, 2014, 29(3): 236-240 [雷燕, 戚瑞荣, 唐绍林, 等. 褐篮子鱼虹彩病毒病的诊断. 大连海洋大学学报, 2014, 29(3): 236-240] |
Li H, Sun ZP, Li Q, et al. Characterization of an iridovirus detected in rock bream (Oplegnathus fasciatus; Temminck and Schlegel). Chinese Journal of Virology, 2011, 27(2): 158-164 [李华, 孙志鹏, 李强, 等. 条石鲷检出的虹彩病毒特性研究. 病毒学报, 2011, 27(2): 158-164] |
Liu RY, Shi CY, Xie GS, et al. Histopathology of hybrid grouper (Epinephelus bruneus ♀×E. lanceolatus ♂) naturally infected with red sea bream iridovirus (RSIV). Progress in Fishery Sciences, 2019, 40(3): 1-11 [刘冉阳, 史成银, 谢国驷, 等. 真鲷虹彩病毒自然感染杂交石斑鱼"褐龙斑"的组织病理分析. 渔业科学进展, 2019, 40(3): 103-112] |
OIE. Aquatic animal health code, 21st Edition. Paris: OIE, 2018, 249–253
|
Senapin S, Dong HT, Meemetta W, et al. Mortality from scale drop disease in farmed Lates calcarifer in Southeast Asia. Journal of Fish Diseases, 2019, 42(1): 119-127 |
Shi CY. Studies on virial reddish body syndrome of farmed turbot Scophthalmus maximus in China. Doctoral Dissertation of Ocean University of China, 2004 [史成银.我国养殖大菱鲆病毒性红体病的研究.中国海洋大学博士研究生学位论文, 2004]
|
Skliris GP, Krondiris JV, Sideris DC, et al. Phylogenetic and antigenic characterization of new fish nodavirus isolates from Europe and Asia. Virus Research, 2001, 75(1): 59-67 |
Subramaniam K, Gotesman M, Smith CE, et al. Megalocytivirus infection in cultured Nile tilapia Oreochromis niloticus. Diseases of Aquatic Organisms, 2016, 119(3): 253-258 |
Wu SQ, Li XH, Pan HJ, et al. Research on the pathogen of the outbreak-infective disease of Siniperca chuastsi. Journal of Fisheries of China, 1997, 21(Suppl): 56-60 [吴淑勤, 李新辉, 潘厚军, 等. 鳜暴发性传染病病原研究. 水产学报., 1997, 21(Suppl): 56-60] |
Xi YQ, Qi RR, Tian JX, et al. Diagnosis of iridovirus disease in Sciaenop socellatus. Acta Hydrobiologica Sinica, 2018, 42(5): 929-934 [席云清, 戚瑞荣, 田佳鑫, 等. 眼斑拟石首鱼虹彩病毒病的诊断. 水生生物学报, 2018, 42(5): 929-934] |
Yanagida T, Palenzuela O, Hirae T, et al. Myxosporean emaciation disease of cultured red sea bream Pagrus major and spotted knifejaw Oplegnathus punctatus. Fish Pathology, 2008, 43(1): 45-48 DOI:10.3147/jsfp.43.45 |




