2. 上海海洋大学食品学院 上海 201306;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 海洋药物与生物制品功能实验室 青岛 266071;
4. 青岛大学医学院 青岛 266071;
5. 中国科学院天津工业生物研究所 天津 300308;
6. 江苏省海洋生物资源开发利用协同创新中心 连云港 222005
2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Drugs and Bioproducts, Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. School of Basic Medicine, Qingdao University, Qingdao 266071;
5. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308;
6. Jiangsu Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resource, Lianyungang 222005
沙雷氏蛋白酶是锌金属蛋白酶的亚家族蛋白酶,分子量约为50 kDa,活性中心由锌离子构成,具有降解蛋白的活性(Basu et al, 2008; Hooper, 1994)。沙雷氏蛋白酶抑制剂稳定性较强,热处理后大多可恢复抑制活性,分子量约为10 kDa(Arumugam et al, 2008)。蛋白酶的酶活可被金属离子及化学抑制剂等所影响(陈怡炫等, 2018),但本研究描述的抑制剂是特指专一性抑制沙雷氏蛋白酶的小分子蛋白质抑制剂,在体外可抑制沙雷氏蛋白酶。专一性沙雷氏蛋白酶抑制剂是在对产沙雷氏蛋白酶的微生物进行基因组分析时发现的,一般在沙雷氏蛋白酶的序列前后会有一段可编码小分子蛋白质的基因序列,编码的小分子蛋白质即为沙雷氏蛋白酶抑制剂(Rivera et al, 2010)。
沙雷氏蛋白酶在细菌生理学中的功能被认为是水解周围环境中的蛋白质底物,为细菌细胞提供简单的营养(Maeda et al, 1995; 郝贵杰等, 2010)。沙雷氏蛋白酶可不同程度地加重炎症、软组织感染、败血症等人类疾病,甚至会进一步引起菌血症和各种全身感染,特别是对免疫低下的癌症和艾滋病患者尤为严重(Feltzer et al, 2000, Kida et al, 2008)。
根据沙雷氏蛋白酶在细菌病原体导致的病症中的关键作用,或可将其作为新的抗毒性靶向对象,通过抑制沙雷氏蛋白酶活性而达到抑制细菌的效果,相比于抗生素,可在减弱毒性的同时,不直接作用于细菌细胞,潜在地防止抗性菌株的出现(Carson et al, 2012)。研究沙雷氏蛋白酶抑制剂的抑制原理可进一步研发沙雷氏蛋白酶抑制剂衍生药物,预防及治疗沙雷氏蛋白酶造成的细胞感染等相关疾病。虽然蛋白酶抑制剂具有良好的发展潜力,但目前对其研究较为空白,只有少数报道描述了沙雷氏蛋白酶抑制剂的特征,对沙雷氏蛋白酶及其抑制剂的复合物晶体研究则仅有2种,分别为APR-APRin (Hege et al, 2001)和SMP-Inh (Baumann et al, 1995)。
沙雷氏蛋白酶MP来源于菌株Flavobacterium sp. YS-80-122,通过悬滴法已经得到了MP晶体(PDB ID 3U1R),对其X-射线衍射及解析,确定晶体的空间群为P 21 21 21,参数为a=45.91 Å、b=75.2 Å、c=115.42 Å、α=β=γ=90°,精修至Rwork为0.16、Rfree为0.21(Zhang et al, 2011)。和以往的沙雷氏蛋白酶类似,蛋白酶MP的基因下游有一个抑制剂基因LupI(GenBank No. JN689327.1),编码的沙雷氏蛋白酶抑制剂LupI耐热性好,与同源抑制剂APRin的同源性为55%,对靶蛋白酶MP的抑制常数为0.64 μmol/L(Liang et al, 2017)。本研究通过对沙雷氏蛋白酶与抑制剂复合物MP-LupI纯化,结晶初筛,以期获得完整的晶体供X-射线衍射分析,为了解复合物MP-LupI的晶体结构及明确抑制作用中的关键位点奠定基础。
1 材料与方法 1.1 蛋白酶MP的原核表达根据基于蛋白酶MP的基因序列(GenBank: GU084389.1)及pET22b(+)载体设计引物,上游引物(F1)为5'-CAGCATATGATGTCGAAACTTAAAGAG-AAAGCAGCGCT-3+'(划线部分为NdeⅠ位点),下游引物(R1)为5'-ATGCTCGAGCGCGACGATGTCGTAAGTT-3'(划线部分为XhoⅠ位点)。以全基因组DNA作为模板,通过两端引物对MP基因进行PCR扩增。用酶切后的pET22b(+)载体和MP基因构建pET22b- MP原核表达质粒。采用添加氨苄青霉素的LB培养基选择平板挑选阳性重组质粒,转化至大肠杆菌BL21扩大培养,菌液用原始引物F1和R1进行PCR扩增并测序验证。
将转化成功的菌体转接至2个三角瓶,于37℃、200 r/min条件扩大培养。当培养至菌液OD600 nm为0.6时,一瓶加入0.4 mmol/L的诱导剂IPTG作为实验组;另一瓶不加诱导剂作为对照组。2瓶菌液均继续培养6 h,离心收集菌体。按菌液总量的0.1倍加入50 mmol/L的Tris-HCl (pH=8)缓冲液,混合均匀,破碎菌体,分别取上清液进行酶活检测和电泳检测。
1.2 蛋白酶MP的纯化将大肠杆菌BL21 pET22b-MP基因工程菌接种到50 ml LB培养基中制备种子液,加入20 μl 100 mg/ml氨苄青霉素,于37℃、200 r/min培养12 h。将种子液按2%接种量添加到4 L LB培养基中,加入200 μl 100 mg/ml氨苄青霉素,于37℃、200 r/min培养。当菌液OD600 nm达到0.6时,加入IPTG至终浓度0.5 mmol/L诱导表达靶基因。在16℃和200 r/min下再培养6 h即可完成诱导表达。
在4℃以8000 r/min离心20 min沉淀菌体细胞,然后重悬于400 ml (菌液总量的0.1倍)Tris-HCl缓冲液(50 mmol/L,pH=8.0)进行超声破碎。破碎条件为:200 W,10 s工作,10 s休息,交替共破碎40 min。以8000 r/min离心去除沉淀后,用10 kDa超滤杯浓缩至约50 ml。
选用亲和HisTrap HP色谱柱纯化MP酶液。上样缓冲液为50 mmol/L pH=8的Tris-HCl、500 mmol/L NaCl和20 mmol/L咪唑混合液;洗脱缓冲液为50 mmol/L pH=8的Tris-HCl、500 mmol/L NaCl和500 mmol/L咪唑混合液。收集的MP酶液用10 kDa的超滤离心管浓缩并除盐,测蛋白酶活性、浓度并进行SDS-PAGE电泳。
1.3 抑制剂LupI的诱导表达及纯化LupI基因(GenBank: JN689327.1)被构建在pET28a(+)载体上,含有该目的基因的质粒被转化到大肠杆菌BL21(DE3)中进行诱导表达(王昆等, 2017)。将大肠杆菌BL21 pET28a-lupI基因工程菌接种到50 ml LB培养基中,加入20 μl 100 mg/ml卡那霉素,其余诱导表达和破碎过程与MP类似,不做赘述。
参考王昆(2017)的方法,选用HiLoadTM 26/600 Superdex 200 prep grade凝胶柱和HiPrepTM Q-FF 16/10柱纯化LupI粗蛋白液。尺寸排阻色谱的缓冲液仅1种,本实验采用50 mmol/L Tris-HCl,pH=8.0。根据峰型分管收集流出的溶液,先流出的溶液为分子量大的样品。离子交换色谱的上样缓冲液(A液)为50 mmol/L Tris-HCl,pH=8.0;洗脱缓冲液(B液)为50 mmol/L Tris-HCl,1 mol/L NaCl,pH=8.0。梯度洗脱设定为30 min从0到100% B液,收集洗脱峰,用3 kDa的超滤离心管浓缩并除盐,测蛋白酶抑制活性、浓度并进行SDS-PAGE电泳。
1.4 复合物MP-LupI的制备及纯化按照等摩尔混合计算方法,将上述已纯化的MP和LupI按1:1的比例混合。LupI适当过量,充分震荡保证充分结合。将此溶液用0.45 μm的滤头过滤,即得到复合物和过量抑制剂掺杂的混合液样品。
选择HiLoadTM 26/600 Superdex 200 prep grade凝胶柱,将混合物用尺寸排阻色谱法分离。复合物的分子量约为60 kDa,抑制剂的分子量为11.5 kDa,利用二者分子量大小的差异进行分离。尺寸排阻色谱的方法和上样缓冲液与纯化LupI时一致。将收集的样品用10 kDa的超滤离心管浓缩,测浓度,电泳检测确定条带是否正确。进一步浓缩至20~40 mg/ml的高纯度高浓度蛋白溶液,用于后续结晶实验。复合物溶液如果不需立即使用,放入液氮中储存。
1.5 复合物MP-LupI晶体的筛选和优化本实验采用悬滴蒸发扩散法对MP-LupI复合物进行结晶条件筛选。MP-LupI复合物在MP和LupI单体结晶条件的基础上,选用Hampton Research公司HR2-110 Crystal ScreenTM、HR2-112 Crystal Screen2TM和HR2-144 IndexTM试剂盒和Molecular Dimension公司的PEG ION1/2和MD38-1/2试剂盒在24孔板上进行结晶条件初筛。在结晶筛选的过程中,调高清水条件下悬滴的蛋白浓度,降低沉淀条件下悬滴的蛋白浓度。如果出现黑色的沉淀可能是结晶溶液中含有使蛋白变性的成分。如果晶体始终较小,可用晶体捞取专用工具loop挑取晶种,接种到新的溶液中。如果出现簇状结晶及片状结晶,可对结晶底液的沉淀剂浓度及pH等影响因素设置梯度进行优化。
1.6 复合物MP-LupI晶体挑取验证当观察到类似晶体出现时,首先要区分是蛋白晶体还是盐晶,其次是分辨是否为目的蛋白晶体。本实验使用紫外成像拍摄和SDS-PAGE电泳法分别鉴定。在显微镜下用loop挑取晶体,洗涤后置于装有纯水的离心管中,加Loading Buffer煮样,进行SDS-PAGE电泳检测。
1.7 复合物MP-LupI晶体衍射数据的收集晶体送至上海同步辐射光源SSRF处用BL17U1 synchrotron进行衍射和数据收集。晶体衍射图片用HKL2000进行初步处理,综合分析晶体的空间群,确定晶胞参数(Otwinowski et al, 1997)。
2 结果与讨论 2.1 蛋白酶MP的原核表达结果通过上述流程构建了pET22b-MP表达载体,菌液PCR的条带如图 1所示,约与预期的蛋白酶MP基因的长度1443 bp一致。菌液送至青岛擎科公司进行测序,结果经NCBI数据库BLAST验证,与MP序列相符,确定MP原核表达载体构建成功。
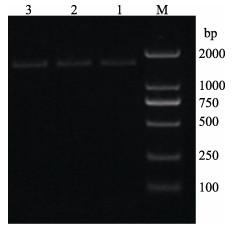
|
图 1 pET22b-MP菌液扩增结果 Fig.1 Amplification result of pET22b-MP M: Trans2K® Plus DNA marker; 1~3: MP |
用该pET22b-MP重组质粒诱导表达得到的粗酶液用酪蛋白测活法测得具有蛋白酶活性,凝胶电泳结果如图 2所示,与未加诱导剂的对照组相比,在约48 kDa处有明显的蛋白电泳条带,且与蛋白酶MP分子大小一致,符合原始蛋白酶MP特征。

|
图 2 MP在大肠杆菌中的诱导表达结果 Fig.2 Induced expression of MP in E. coli M: BlueRAY prestained protein marker; 1: Uninduced supernatant; 2: IPTG induced supernatant |
粗分离后的MP粗酶液浓缩至20~30 ml,经过HisTrap HP色谱柱纯化、10 kDa超滤离心管浓缩除盐后,可达到电泳纯。每4 L培养基培养的样品可以纯化约10 mg的蛋白酶,浓缩至3.5 ml时,蛋白含量可达1.96 mg/ml,此浓度不固定,但必须测量,在与抑制剂进行复合物结合时用于添加比例的计算。色谱如图 3所示,1号峰为杂蛋白流出峰,2号峰为洗脱峰,是纯化的样品。经浓缩除盐后的蛋白电泳如图 4所示,约48 kDa,符合MP的分子量大小。

|
图 3 蛋白酶MP的亲和色谱 Fig.3 Affinity chromatogram of protease MP |
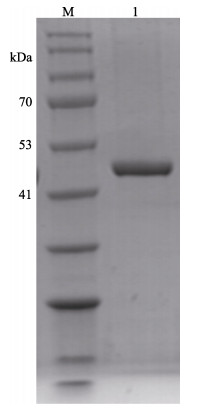
|
图 4 蛋白酶MP纯化后的SDS-PAGE电泳 Fig.4 SDS-PAGE electrophoresis of purified protease MP M: BlueRAY prestained protein marker; 1: MP |
LupI经过超滤等分离后,可将溶液中分子量在10~30 kDa范围外的杂质去除,并浓缩至40 ml。用HiLoadTM 26/600 Superde 200 prep grade凝胶柱进行尺寸排阻色谱纯化,色谱如图 5所示。经测活和电泳验证收集的2号峰为LupI的峰,电泳如图 6所示,在上方仍有一些微弱条带没有完全分离。

|
图 5 抑制剂LupI的尺寸排阻色谱 Fig.5 Size exclusion chromatography of inhibitor LupI |
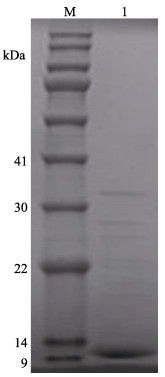
|
图 6 抑制剂LupI尺寸排阻色谱后的SDS-PAGE电泳 Fig.6 SDS-PAGE electropherogram of inhibitor LupI after size exclusion chromatography M: BlueRAY prestained protein marker; 1: LupI |
经过尺寸排阻色谱后收集的样液约45 ml,用HiPrepTM Q-FF 16/10柱进行离子交换色谱纯化。收集到的LupI样品用3 kDa的超滤离心管浓缩除盐,每次发酵的4 L样品可以纯化约8 mg纯样品,浓缩至800 μl时,LupI蛋白含量可达10 mg/ml。最后浓缩后的样液浓度和MP一样必须测量,用于复合物比例的计算。色谱如图 7所示,20~40 ml处的小峰为流出峰,洗脱峰共2个,经测活和电泳验证洗脱峰的1号峰即为抑制剂LupI,电泳如图 8所示,获得单一的抑制剂条带,约为11 kDa,符合抑制剂LupI的分子量。
|
图 7 抑制剂LupI的离子交换色谱 Fig.7 Ion exchange chromatogram of inhibitor LupI |

|
图 8 抑制剂LupI离子交换色谱后的SDS-PAGE电泳 Fig.8 SDS-PAGE electropherogram of inhibitor LupI after ion exchange chromatogram M: BlueRAY prestained protein marker; 1: LupI |
根据蛋白酶MP和抑制剂LupI的含量,换算为等摩尔比进行混合。经换算后,3.5 ml的MP与150 μl的LupI混合,LupI稍过量50 μl以保证抑制完全,约获得95 μl蛋白含量为20 mg/ml的MP-LupI复合物样液。
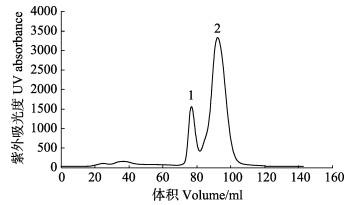
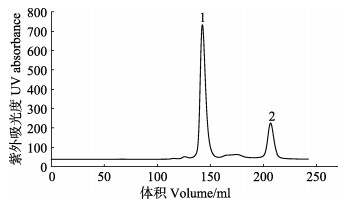
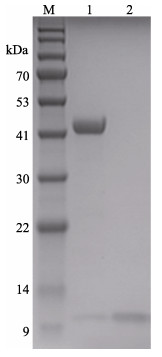
尺寸排阻色谱如图 9所示,1号峰代表MP-LupI复合物,2号峰代表可回收的抑制剂LupI。回收的抑制剂浓缩后可以继续进行复合物的制备。复合物的电泳结果如图 10所示,达到电泳纯,适用于研究结构测定及理化参数(陈旭等, 2004),也符合蛋白结晶的要求。
|
图 9 MP-LupI复合物的尺寸排阻色谱 Fig.9 Size exclusion chromatogram of MP-LupI complex |
|
图 10 MP-LupI复合物纯化后的SDS-PAGE电泳图 Fig.10 SDS-PAGE electropherogram of purified MP-LupI complex M: BlueRAY prestained protein marker; 1: MP-LupI; 2: Recovered LupI |
MP-LupI复合物的浓度开始时为20 mg/ml,用MP和LupI的结晶条件进行筛选,在20 d的持续观察中,发现大部分液滴中生长的是沉淀、盐晶和不规则晶体小粒,其余液滴前后无变化。改变结晶条件并加大复合物浓度至40 mg/ml,设置沉淀剂和pH梯度,于4℃和20℃两种温度培养晶体,仍未见有蛋白晶体生长。因此,扩大筛选范围,用Hampton Research公司HR2-110 Crystal ScreenTM、HR2-112 Crystal Screen2TM和HR2-144 IndexTM试剂盒和Molecular Dimension公司的PEG ION1/2和MD38-1/2试剂盒,同时对MP-LupI复合物筛选,浓度仍保持为40 mg/ml。
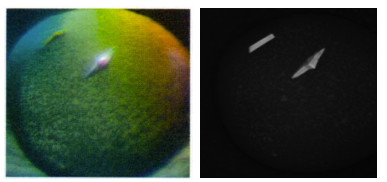
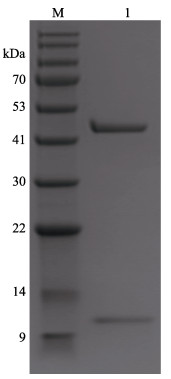
扩大筛选范围后,在2种条件下获得晶体:PEG ION1/2试剂盒的0.1 mol/L DL-Malic acid、pH 7.0和12% (w/v) PEG 3350条件,得到MP-LupI复合物的菱形晶体;MD38-1/2试剂盒的0.2 mol/L NaCl、0.1 mol/L MES、pH 6.5和10% (w/v) PEG 4000,得到MP-LupI复合物的棱形晶体。晶体生长时间约为7 d。MP-LupI复合物晶体采用Minstrel HT UV拍照系统及Nikon SMZ800倒置显微镜拍照系统进行晶体图片采集,如图 11所示,经紫外成像拍摄可以确定该结晶为蛋白结晶。经蛋白电泳验证,符合复合物条带(图 12)。
|
图 11 MP-LupI复合物结晶 Fig.11 Crystalline diagram of MP-LupI complex |
|
图 12 蛋白晶体挑取验证 Fig.12 SDS-PAGE of crystal M: BlueRAY prestained protein marker; 1: Picked crystal |
通过X-射线衍射进行数据收集,并对收集的数据进行处理。在0.1 mol/L DL-Malic acid、pH 7.0和12% (w/v) PEG 3350条件下得到的MP-LupI复合物的菱形晶体,分辨率在1.5 Å左右,由于衍射时晶体裂开,未能进行数据收集。在0.2 mol/L NaCl、0.1 mol/L MES、pH 6.5和10% (w/v) PEG 4000条件下得到的MP-LupI复合物晶体,收集到分辨率为2 Å的高质量衍射数据(图 13),初步确定其晶胞空间为P1 21 1,晶胞参数为a=51.66 Å、b=51.85 Å、c=102.14 Å、α=γ=90°、β=97.68°。其余衍射数据如表 1所示。

|
图 13 MP-LupI复合物晶体X-射线衍射图 Fig.13 X-ray diffraction of complex MP-LupI crystal |
|
|
表 1 MP-LupI复合物晶体衍射数据 Tab.1 Collection of complex MP-LupI crystal diffraction data |
本研究通过对MP和LupI的单独纯化,再以等摩尔比混合得到MP-LupI复合物,用尺寸排阻色谱对MP-LupI复合物进行纯化,达到可供结晶的电泳纯级样液。通过悬滴蒸发扩散法,在2种条件下成功获得MP-LupI复合物晶体,并在上海光源进行X-射线衍射数据收集,得到分辨率达2 Å的高质量衍射数据,其晶胞空间为P1 21 1,晶胞参数为a=51.66 Å、b=51.85 Å、c=102.14 Å、α=γ=90°、β=97.68°。
MP-LupI复合物晶体衍射数据还需进一步精修及分析,构建完整的三维结构图,在结构上确定沙雷氏蛋白酶与抑制剂的结合区域,从而明确沙雷氏蛋白酶抑制剂的抑制原理,为以后生产抑制剂药物等提供理论依据。
Arumugam S, Gray RD, Lane AN. NMR structure note: Alkaline proteinase inhibitor APRin from Pseudomonas aeruginosa. Journal of Biomolecular NMR, 2008, 40(3): 213-217 DOI:10.1007/s10858-008-9218-6 |
Basu B, Apte SK. A novel serralysin metalloprotease from Deinococcus radiodurans. Biochimica et Biophysica Acta, 2008, 1784(9): 1256-1264 DOI:10.1016/j.bbapap.2008.05.009 |
Baumann U, Letoffe S, Delepelaire PWC, et al. Crystal structure of a complex between Serratia marcescens metallo-protease and an inhibitor from Erwinia chrysanthemi. Journal of Molecular Biology, 1995, 248(3): 653-661 |
Carson L, Cathcart GR, Ceri H, et al. Comparison of the binding specificity of two bacterial metalloproteases, LasB of Pseudomonas aeruginosa and ZapA of Proteus mirabilis, using N -alpha mercaptoamide template-based inhibitor analogues. Biochemical and Biophysical Research Communications, 2012, 422(2): 316-320 DOI:10.1016/j.bbrc.2012.04.157 |
Feltzer RE, Gray RD, Dean WL, et al. Alkaline proteinase inhibitor of Pseudomonas aeruginosa. Interaction of native and N-terminally truncated inhibitor proteins with Pseudomonas metalloproteinases. Journal of Biological Chemistry, 2000, 275(28): 21002-21009 DOI:10.1074/jbc.M002088200 |
Hege T, Feltzer RE, Gray RD, et al. Crystal structure of a complex between Pseudomonas aeruginosa alkaline protease and its cognate inhibitor. Journal of Biological Chemistry, 2001, 276(37): 35087-35092 DOI:10.1074/jbc.M104020200 |
Hooper NM. Families of zinc metalloproteases. FEBS Letters, 1994, 354(1): 1-6 DOI:10.1016/0014-5793(94)01079-X |
Kida Y, Higashimoto Y, Inoue H, et al. A novel secreted protease from Pseudomonas aeruginosa activates NF-kappaB through protease-activated receptors. Cell Microbiology, 2008, 10(7): 1491-1504 DOI:10.1111/j.1462-5822.2008.01142.x |
Liang PJ, Li SY, Wang K, et al. A thermostable serralysin inhibitor from marine bacterium Flavobacterium sp. YS-80-122. Chinese Journal of Oceanology and Limnology, 2017, 36(2): 483-489 |
Maeda H, Morihara K. Serralysin and related bacterial proteinases. Methods in Enzymology, 1995, 248: 395-413 DOI:10.1016/0076-6879(95)48026-9 |
Otwinowski Z, Minor W. Processing of X-ray diffraction data. Methods in Enzymology, 1997, 276(10): 307-326 |
Rivera S, Khrestchatisky M, Kaczmarek L, et al. Metzincin proteases and their inhibitors: Foes or friends in nervous system physiology?. Journal of Neuroscience, 2010, 30(46): 15337-15357 DOI:10.1523/JNEUROSCI.3467-10.2010 |
Zhang SC, Sun M, Li T, et al. Structure analysis of a new psychrophilic marine protease. PLoS One, 2011(6): e26939 |
Chen X, Huang HQ, Kong B, et al. Preparation technology of electrophoresis of shark and squid liver ferritin. Marine Science, 2004, 28(1): 15-19 [陈旭, 黄河清, 孔波, 等. 鲨鱼和 |
Chen YX, Chen X, Wang F, et al. Study on the basic enzymatic properties of proteases in crude enzyme solution of Antarctic krill and the development of inhibitors. Progress in Fishery Sciences, 2018, 39(5): 152-157 [陈怡炫, 陈昕, 王芳, 等. 南极磷虾粗酶液中蛋白酶的基础酶学性质研究及抑制剂的开发. 渔业科学进展, 2018, 39(5): 152-157] |
Hao GJ, Shen JY, Pan XY, et al. Preparation and immunogenicity of extracellular protease of Vibrio harveyi GYC1108-1. Progress in Fishery Sciences, 2010, 31(3): 107-112 [郝贵杰, 沈锦玉, 潘晓艺, 等. 哈维氏弧菌GYC1108-1胞外蛋白酶的制备及免疫原性研究. 渔业科学进展, 2010, 31(3): 107-112 DOI:10.3969/j.issn.1000-7075.2010.03.015] |
Wang K. Prokaryotic expression, purification and initial screening of crystal conditions of alkaline protease inhibitor LupI-MSSS. Masterxs Thesis of Shanghai Ocean University, 2017 [王昆.碱性蛋白酶抑制剂LupI-MSSS的原核表达、纯化及晶体条件初筛.上海海洋大学硕士研究生学位论文, 2017]
|
Wang K, Liang PJ, Li SY, et al. Construction of prokaryotic expression vector of alkaline protease inhibitor lupI-MSSS and its protein expression and purification. Food and Fermentation Industries, 2017, 43(7): 20-26 [王昆, 梁朋娟, 李尚勇, 等. 碱性蛋白酶抑制剂lupI-MSSS原核表达载体的构建及其蛋白表达、纯化. 食品与发酵工业, 2017, 43(7): 20-26] |



