2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出 过程功能实验室 青岛 266071;
3. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071;
4. 上海海洋大学水产与生命学院 上海 201306;
5. 莱州明波水产有限公司 莱州 261400
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory of Marine Science and Technology (Qingdao), Qingdao 266071;
3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
5. Laizhou Mingbo Aquatic Co., Ltd., Yantai 261400
褐石斑鱼(Epinephelus bruneus)、云纹石斑鱼(Epinephelus moara)和鞍带石斑鱼(Epinephelus lanceolatus)均隶属于鲈形目(Perciformes)、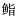
杂交育种可将双亲的优良性状结合,目前,已经广泛用于石斑鱼新品种的培育。本研究利用鞍带石斑鱼冷冻精子分别与褐石斑鱼、云纹石斑鱼进行杂交实验,并对2个杂交后代的胚胎发育、仔稚幼鱼的生长发育情况进行观察记录,同时对其变态原因进行分析,比较同一父本与2个相近母本杂交后代的发育生物学特点及杂交优势,旨在为石斑鱼杂交育种和新品种培育及规模化繁育提供基础数据。
1 材料与方法 1.1 鞍带石斑鱼与褐石斑鱼、云纹石斑鱼杂交受精及仔稚幼鱼培育实验于2018年5月25日在山东省烟台市莱州明波水产有限公司进行。实验所用褐石斑鱼亲鱼和云纹石斑鱼亲鱼均为野生驯养群体,雄鱼采用精子冷冻库中鞍带石斑鱼精子,褐石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代为实验组(简称褐龙石斑鱼)、云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代为对照组(简称云龙石斑鱼)。在亲鱼成熟期,分别选取发育良好的雌鱼,利用MS-222进行麻醉,胸鳍基部注射绒毛膜促性腺激素(HCG) 500~800 IU/kg进行催产。48 h后,轻压雌鱼腹部将卵挤出至盆中,同时,将同一鞍带石斑鱼冷冻精子在37℃水浴中解冻,分别加到盛有褐石斑鱼和云纹石斑鱼卵的盆中,精液:卵体积比=1:500,充分搅拌,使精液和卵混匀,后加入2倍体积海水激活精子进行受精,静置10 min后,筛绢过滤上浮卵,洗去黏液,放入孵化缸中孵化。孵化缸中水温为24℃,盐度为30,微充气。24 h后,将孵化缸中的受精卵投放到育苗池中,培育温度为24℃~26℃,盐度为29~31,DO≥10 mg/L。前期仔鱼采取静水培育,后期逐渐增大换水量。3 d后,向池中添加小球藻(Chlorella),开口饵料为牡蛎(Crassostrea gigas)受精卵,后期按生长需求投喂S型轮虫(Brachionus plicatilis)、L型轮虫、卤虫(Artemia salina)无节幼体、大卤虫及配合饲料等。
1.2 仔稚幼鱼变态发育观测胚胎发育及仔鱼前期利用DSY2000X倒置生物显微镜进行观察,详细记录各个发育时间及相应特征,并用OPTPro2012软件进行拍照,同时,测量卵径和油球径。卵黄囊消失后,利用Olympus解剖镜(日本)观察鱼苗形态特征及发育情况,发育至36 d时,改用数码相机进行拍照,同时,利用AJ-VERT软件对全长、第2背鳍棘长、腹鳍棘长和肛前距等生长性状进行测量记录。
1.3 杂交后代生长比较褐龙石斑鱼与云龙石斑鱼仔鱼生长前期形态每天变化较大,幼鱼期形态变化放缓,因此,孵化后1~13 d,每天取样1次;13 d后,每隔4~6 d取样1次。取样时,观察鱼的形态变化、运动及生活习性,并对每尾鱼的卵黄囊长径、短径、油球直径、鱼苗全长、肛前距、第2背鳍棘长和腹鳍棘长进行测量记录并拍照。
1.4 数据处理与分析受精卵发育至囊胚期时,每次从孵化缸中随机抽取100~200颗受精卵统计受精率,统计3次;发育至尾芽期、孵化期时,采用相同办法对畸形率、孵化率进行观察统计。
受精率(%)=发育至囊胚期卵数/总卵数
畸形率(%)=发育至尾芽期畸形卵数/受精卵数
孵化率(%)=孵化出膜仔鱼数/受精卵数
胚胎和仔稚幼鱼的可量性状数据采用Excel和SPSS 18.0统计软件进行分析,数据以平均值±标准差(Mean±SD)表示。
全长日增长率、肛前距日增长率按如下公式计算:
全长日增长率(%)=(lgL2-lgL1)/[0.4343(t2-t1)]
肛前距日增长率(%)=(lgP2-lgP1)/[0.4343(t2-t1)]
式中,L为全长,P为肛前距,t为日龄。
2 结果与分析 2.1 仔稚幼鱼形态发育 2.1.1 受精率、畸形率和孵化率褐龙石斑鱼受精率、畸形率和孵化率分别为(87.38±0.03)%、(47.71± 0.05)%、(43.58±0.04)%。云龙石斑鱼受精率、畸形率和孵化率分别为(86.19±0.06)%、(37.34±0.14)%和(52.51±0.05)%。2个杂交后代受精率相差无几,褐龙石斑鱼畸形率高于云龙石斑鱼,孵化率低于云龙石斑鱼。
2.1.2 仔鱼期从胚体出膜至第2背鳍棘和腹鳍棘绝对长度达到最长为仔鱼期。
刚出膜的仔鱼通体透明,尾部弯曲,无色素细胞。脊索细长、清晰可见,消化管细长,肛门未开口于体外。腹部下方有一椭圆形卵黄囊,较宽的一侧起始于头部1/2处,较窄的一侧终止于肛门前方,油球位于卵黄囊下方靠近肛门处,背部、尾部及腹部下方有透明鳍膜(图 1-1)。

|
图 1 褐石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔稚幼鱼形态发育 Fig.1 Morphological development of larval, juvenile and young fish of E.bruneus(♂)×E.lanceolatus(♂) 1:初孵仔鱼;2:1日龄仔鱼;3:2日龄仔鱼;4:3日龄仔鱼;5:4日龄仔鱼;6:5日龄仔鱼;7:10日龄仔鱼;8:15日龄仔鱼;9:19日龄仔鱼;10:23日龄仔鱼;11:27日龄仔鱼;12:32日龄仔鱼;13:41日龄仔鱼;14:46日龄稚鱼;15:51日龄稚鱼;16:56日龄幼鱼 1: Newly hatched larvae; 2: 1 d larvae; 3: 2 d larvae; 4: 3 d larvae; 5: 4 d larvae; 6: 5 d larvae; 7: 10 d larvae; 8: 15 d larvae; 9: 19 d larvae; 10: 23 d larvae; 11: 27 d larvae; 12: 32 d larvae; 13: 41 d larvae; 14: 46 d juvenile; 15: 51 d juvenile; 16: 56 d young fish |
1日龄仔鱼:头部变大,体表出现色素点,肌节进一步加深。消化管变粗,末端垂直,整体呈“L”型。卵黄囊显著缩小,油球变化微小,鳍褶变高,此时,仔鱼均匀分布于池中,悬浮于海水上层,偶尔游动或进行旋转运动(图 1-2)
2日龄仔鱼:口裂出现,尚不能摄食,中脑隆起明显,靠近尾部腹侧、背部及体表出现色素块,眼部开始出现色素点,肌节形状呈“ < ”型,胸鳍芽出现。脊索加粗,直肠膨大,肛门尚未开口于体外,下方出现一个半圆形膀胱。卵黄囊进一步缩小,背、腹、尾部鳍膜连成一片,不运动时,头朝下、尾朝上倒挂于海水中,偶尔进行间歇运动(图 1-3)。
3日龄仔鱼:尾部、消化道前半部分散布色素点,眼部色素点增多。消化道前端弯曲,管壁增厚,偶尔可见胃蠕动,但尚未开口摄食,仍以内源性营养为主。卵黄囊急剧缩小,运动能力明显增强(图 1-4)。
4日龄仔鱼:吻端突出,上位口,视囊色素点密集,呈黑色,鱼体1/3及2/3处脊索下方分布有长条状黑色素,尾部脊索下方出现2~3条辐射状黑色素。开口摄食,消化道进一步弯曲,管壁变粗,肛门开口于体外。卵黄囊几乎消失,油球变小,此时,由内源性营养向外源性营养过渡。胸鳍变长,仔鱼开始有集群趋势(图 1-5)。
云龙石斑鱼1日龄时体表开始出现色素点,3日龄口裂明显,躯干末端1/3处出现色素块,4日龄仔鱼开口摄食,肛门开口于体外,鱼体1/3处脊索下方出现长条状黑色素。褐龙石斑鱼与云龙石斑鱼的卵黄囊均在第5天时完全消失。
5日龄仔鱼:第2背鳍棘、腹鳍棘出现,腹腔靠近脊索一边被黑色素包裹。鳃耙出现,可见胃部蠕动,肠开始分化。卵黄囊和油球彻底消失,转变成外源性营养。仔鱼开始有集群行为,通常聚集于池边或池角处(图 1-6)。
10日龄仔鱼:第2背鳍棘、腹鳍棘显著增长,腹鳍棘长度长于第2背鳍棘,末端均出现黑色素,尾鳍鳍条出现。腹腔几乎被黑色素包围,体表色素点增多(图 1-7)。
15日龄仔鱼:第1背鳍棘长出。第2背鳍棘长于腹鳍棘,鳍棘上黑色素占鳍棘总长度的1/2,黄色素呈块状分布,腹腔上黑色素减少,黄色素增加,尾鳍鳍条上黑色素点增多。可见心脏内血液流动,鳃盖骨分化显著,最后1枚尾椎骨上翘,尾鳍从外形看仍是对称状态(图 1-8)。
19日龄仔鱼:第3背鳍棘长出,臀鳍长出2根鳍棘。黑色素和黄色素向头部上方扩伸,脑颅骨加厚,透明度降低(图 1-9)。
23日龄仔鱼:背鳍鳍条数增多,第2背鳍棘、腹鳍棘上倒钩状小刺数目增加,膀胱膨大呈椭圆形(图 1-10)。
27日龄仔鱼:上枕骨位置星状黑色素增加,腹鳍棘前半部分覆盖黄色素,后半部分覆盖黑色素,尾椎骨处出现黄色素。此时,大部分仔鱼开始摄食配合饲料,配合投喂卤虫无节幼体(图 1-11)。
32日龄仔鱼:背鳍棘数目增加,鳍棘末端黑色素开始消退。颅骨更加发达,眼眶上缘出现锯齿状突起,脊椎分节明显,下方可见2条清晰血管(图 1-12)。
41日龄仔鱼:第2背鳍棘长(9.74±0.42) mm,腹鳍棘长(7.79±0.39) mm,绝对长度均达到仔、稚、幼鱼阶段最大值。各鳍鳍条基本形成,大部分器官发育已定型(图 1-13)。
褐龙石斑鱼与云龙石斑鱼第2背鳍棘、腹鳍棘绝对长度均在41日龄时达到最大,此后进入稚鱼期。
2.1.3 稚鱼期第2背鳍棘和腹鳍棘绝对长度开始缩减,身体出现鳞片为稚鱼期。
46日龄稚鱼:第2背鳍棘、腹鳍棘相对长度开始缩减,鳍棘上小刺数目同样开始减少。背部可见白色点状凸起,鳞片开始生长。侧线、头部后方、体中部、尾鳍基部前方出现带状黑色素,逐渐向全身扩展。此时,稚鱼喜欢栖息在底部或有遮蔽物的阴暗处(图 1-14)。
51日龄稚鱼:第2背鳍棘、腹鳍棘长度较之前大幅缩小,第2背鳍棘长度长于腹鳍棘。头背部中间下凹。体表背侧黑色素下方开始出现鳞片(图 1-15)。
褐龙石斑鱼51日龄时进入幼鱼期。云龙石斑鱼在56日龄时,腹鳍棘绝对长度缩减至最小,体表鳞片开始出现,进入幼鱼期稍晚于褐龙石斑鱼。
2.1.4 幼鱼期第2背鳍棘和腹鳍棘绝对长度缩减至最小,进入幼鱼期。
56日龄稚鱼:第2背鳍棘、腹鳍棘收缩完成,鳍棘上小刺完全消失。背鳍基部黑色素迅速向身体两侧伸展,形成4条斑带。全身被鳞,形态与幼鱼基本一致(图 1-16)。
62日龄幼鱼:幼鱼体色加深,腹鳍棘长度长于第2背鳍棘,眼睛向外凸出。此时,幼鱼喜欢栖息于底部,出现互相残食现象(图 2-1)。
|
图 2 褐龙石斑鱼(1)与云龙石斑鱼(2) 62 d幼鱼 Fig.2 Young fish of E.bruneus(♀)×E.lanceolatus(♂)(1) and E.moara(♀)×E.lanceolatus(♂)(2) at 62 d |
褐龙石斑鱼体表出现4条褐色斑带,第2条中部、第3条下部出现白色斑块,云龙石斑鱼体表出现6条褐色斑带(图 2-2),尚未出现与成鱼相似的斑块。
2.2 褐龙石斑鱼与云龙石斑鱼发育及生长指标对比 2.2.1 卵黄囊的吸收褐龙石斑鱼初孵仔鱼卵黄囊容积为(0.1948±0.0240) mm3,云龙石斑鱼卵黄囊容积为(0.1871±0.0130) mm3。1日龄开始,卵黄囊容积不断缩小,至5日龄时,褐龙石斑鱼与云龙石斑鱼的卵黄囊均完全消失(表 1)。
|
|
表 1 褐龙石斑鱼与云龙石斑鱼卵黄囊的吸收 Tab.1 Absorption of yolk sac of E.bruneus(♀)×E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) |
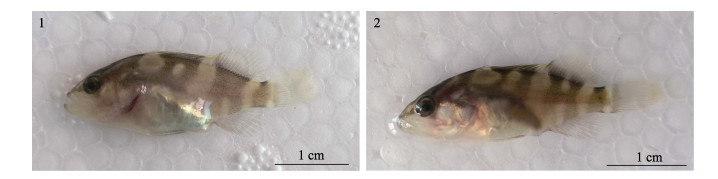
褐龙石斑鱼和云龙石斑鱼2个杂交后代仔、稚、幼鱼全长生长情况见图 3。从图 3可以看出,褐龙石斑鱼初孵仔鱼全长为(1.71± 0.01) mm,云龙石斑鱼初孵仔鱼全长为(1.77±0.03) mm,发育至62 d时,褐龙石斑鱼幼鱼全长达到(34.20± 2.40) mm,云龙石斑鱼全长达到(33.86±3.13) mm。仔鱼期云龙石斑鱼生长稍快于褐龙石斑鱼,36 d时,褐龙石斑鱼日平均全长开始大于云龙石斑鱼。2组的日增长率无明显规律,褐龙石斑鱼和云龙石斑鱼日增长率最高值均出现在1 d,分别为27.89%和30.03%;其次,12 d时,云龙石斑鱼日增长率达到次高(25.64%),13 d时,褐龙石斑鱼日增长率达到次高(26.73%)(表 2)。对褐龙石斑鱼全长生长曲线进行多项式回归分析,平均全长(L)与日龄(x)的关系式为L=2.6208e0.0465x,相关系数R2=0.9603,平均全长与日龄显著相关。云龙石斑鱼平均全长(L)与日龄(x)的关系式为L= 2.7158e0.0453x,相关系数R2=0.9451。
|
图 3 褐龙石斑鱼与云龙石斑鱼仔稚幼鱼生长比较 Fig.3 The growth of larval, juvenile and young fish of E.bruneus(♀)×E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) 不同小写字母表示性状之间具有显著性差异(P < 0.05) Different small letters indicates that the traits have significant differences (P < 0.05) |
|
|
表 2 褐龙石斑鱼与云龙石斑鱼仔稚幼鱼全长、肛前距日增长率 Tab.2 The daily growth rate of total length and preanal distance for the larval, juvenile, and young fish of crossbreed F1 by E.bruneus(♀)×E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) |
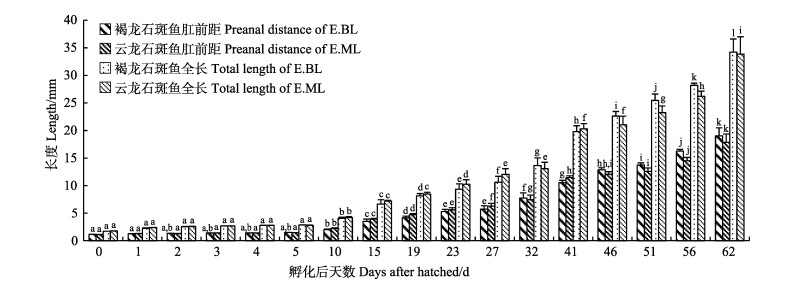
褐龙石斑鱼与云龙石斑鱼肛前距变化趋势相似,总体呈上升趋势(图 3)。褐龙石斑鱼初始肛前距为(1.15±0.04) mm,云龙石斑鱼稍短于褐龙石斑鱼,肛前距为(1.13±0.01) mm。褐龙石斑鱼肛前距日增长率波动范围为0.43%~25.21%,13 d日增长率达到仔、稚、幼鱼阶段最高(25.21%),云龙石斑鱼日增长率波动范围为0.36%~27.01%,12 d日增长率最高,二者与全长日增长率最高值出现时间相同(表 2)。肛前距/全长在发育过程中无明显变化规律(图 4)。对褐龙石斑鱼肛前距的生长曲线进行多项式回归分析,肛前距(P)与日龄(x)的方程式为P=1.3371e0.0483x,相关系数R2=0.9643,肛前距与日龄显著相关。云龙石斑鱼肛前距(P)与日龄(x)的方程式为P=1.4017e0.0467x,相关系数R2=0.944。
|
图 4 褐龙石斑鱼与云龙石斑鱼肛前距/全长变化的比较 Fig.4 Preanal distance/total length rate of juveniles, young fish of crossbreed F1 by E.bruneus(♀)×E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) |
第2背鳍棘和腹鳍棘的伸长与缩回是杂交子一代最明显的特征,也是石斑鱼仔、稚、幼鱼生长过程中所特有的。褐龙石斑鱼与云龙石斑鱼的第2背鳍棘和腹鳍棘绝对长度生长趋势相似,均呈先增加后缩短的趋势(图 5)。41 d时,褐龙石斑鱼第2背鳍棘绝对长度达到最大,为(9.74± 0.42) mm,随后开始缩回变短;腹鳍棘绝对长度同样在41 d时达到最长,为(7.79±0.39) mm,可达全长的1/2;至51 d时,缩短至(4.21±0.29) mm,此时,外形特征与成鱼相似,第2背鳍棘和腹鳍棘开始正常生长,即将进入幼鱼期。云龙石斑鱼第2背鳍棘绝对长度在41 d时达到仔、稚鱼期最长,为(9.59±0.46) mm;此时腹鳍棘绝对长度达到最大,为(5.81±0.09) mm,进入幼鱼期恢复正常生长。褐龙石斑鱼和云龙石斑鱼的第2背鳍棘、腹鳍棘相对长度总体呈先上升后下降趋势(图 6)。褐龙石斑鱼在23 d时,其第2背鳍棘和腹鳍棘相对长度均达到最大,分别为56.70%和42.06%。云龙石斑鱼第2背鳍棘和腹鳍棘相对长度在19 d时,分别达到最大59.29%和43.24%。
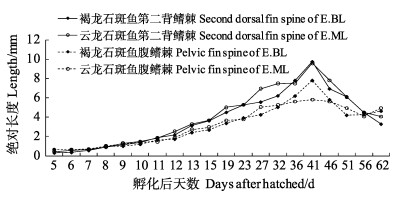
|
图 5 褐龙石斑鱼与云龙石斑鱼第2背鳍棘、腹鳍棘绝对长度变化 Fig.5 The length of second dorsal fin spine and first pelvic fin spine of crossbreed F1 by E.bruneus(♀)×E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) |
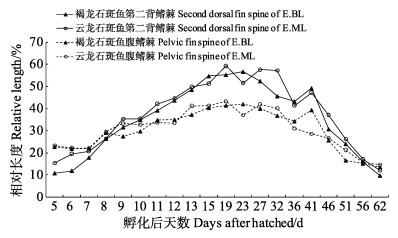
|
图 6 褐龙石斑鱼与云龙石斑鱼第2背鳍棘、腹鳍棘相对长度变化 Fig.6 The relative length of second dorsal fin spine and first pelvic fin spine of crossbreed F1 by E.bruneu s(♀)× E.lanceolatus(♂) and E.moara(♀)×E.lanceolatus(♂) |
早年石斑鱼市场主要依赖于野生捕捞,但近年来随着石斑鱼养殖业的不断发展,育苗技术也日益成熟。目前,养殖品种主要有云纹石斑鱼、鞍带石斑鱼、棕点石斑鱼(E. fuscoguttatus)、赤点石斑鱼(E. akaara)、七带石斑鱼(E. septemfasciatus)、驼背鲈(C. altivelis)等。但在养殖过程中发现,石斑鱼纯种鱼苗病害多、畸形率高、活率低、生长周期长。为促进石斑鱼种质改良,获得生长速度快、抗病害能力强、肉质好的石斑鱼优质新品种,杂交育种技术在石斑鱼养殖新品种培育中发挥了重要的作用(李炎璐等, 2012)。目前,国内外已报导的石斑鱼杂交组合有云纹石斑鱼(♀)×鞍带石斑鱼(♂)(田永胜等, 2017)、斜带石斑鱼(E. coioides)(♀)×赤点石斑鱼(♂)(刘付永忠等, 2007)、棕点石斑鱼(♀)×鞍带石斑鱼(♂)(陈超等, 2014)、云纹石斑鱼(♀)×七带石斑鱼(♂)(李炎璐等, 2012)、地中海石斑鱼(E. costae)(♀)×东大西洋石斑鱼(E. marginatus) (♂)(Glamuzina et al, 2001)、棕点石斑鱼(♀)×蓝身大斑石斑鱼(E. tukula)(♂)(田永胜等, 2019)、鞍带石斑鱼(♀)×蓝身大斑石斑鱼(E. tukula)(♂)(成美玲等, 2019)、等。其中,大多数杂交后代由于成活率低、畸形率高或无明显生长优势,无法在生产中大量应用,目前,虎龙杂交斑(张海发等, 2014)和云龙石斑鱼(田永胜等, 2017) 2种杂交石斑鱼得到广泛推广。
染色体数量及核型是进行鱼类杂交育种的遗传学基础,褐石斑鱼染色体核型为2n=48、2m+4sm+42t (NF=54) (郭明兰, 2009),云纹石斑鱼的染色体核型为2n=48、2st+46t (NF=50) (郭丰等, 2006),鞍带石斑鱼的核型为2n=48、2sm+6st+40t (NF=50) (舒琥等, 2012),褐石斑鱼与鞍带石斑鱼的核型更相近,3种鱼染色体核型虽有差异,但染色体数量相同,3种鱼的染色体数量相同,具备杂交的细胞学基础。褐石斑鱼卵与鞍带石斑鱼精子可正常受精且受精卵发育正常,孵化后仔、稚、幼鱼正常生长,表明褐石斑鱼(♀)×鞍带石斑鱼(♂)杂交是可行的。褐石斑鱼、云纹石斑鱼与鞍带石斑鱼线粒体基因组序列长度分别为16686、16696和16714 bp,均编码37个基因(黄小林等, 2013)。黄小林等(2013)构建了基于6种石斑鱼线粒体基因组全序列、13种蛋白质编码基因合并序列的分子系统树,表明褐石斑鱼与云纹石斑鱼亲缘关系较近,与鞍带石斑鱼亲缘关系相对较远,但二者中云纹石斑鱼与鞍带石斑鱼的亲缘关系较褐龙石斑鱼近(黄小林等, 2013; Oh et al, 2012)。这可能是导致褐龙石斑鱼畸形率高于云龙石斑鱼的遗传因素。
3.2 变态发育第2背鳍棘和腹鳍棘的伸长与收回是石斑鱼变态过程中最显著的特征。第2背鳍棘和腹鳍棘的变化与石斑鱼的生活习性转变有密切的联系。吕雪娇等(2018)利用骨骼染色技术和显微测量的方法对鞍带石斑鱼仔、稚、幼鱼的骨骼发育及生长特性进行连续观察和测量,表明骨骼发育过程中与摄食、呼吸及游泳功能相关的骨骼优先发育,如颅骨(颌骨、鳃)和鳍元件,且骨化顺序与发育顺序基本一致。鲆鲽鱼类拥有极不对称的体型,在变态发育过程中,一只眼睛迁移到颅骨的对侧,这种迁移伴随着广泛的颅面转变和身体色素沉着不对称现象同时发展(Shao et al, 2016)。Miwa等(1987)研究表明,牙鲆仔鱼的变态与T4 (Thyroxine, 甲状腺激素)浓度有关。Shao等(2016)通过对变态发育不同时期褐牙鲆进行比较基因组学和转录组学分析表明,褐牙鲆眼睛的移动受到甲状腺激素和视黄酸信号通路的拮抗调控。唐啸尘等(2006)用T4处理斜带石斑鱼仔鱼,表明T4能够促进仔鱼变态;Jesus等(1998)利用不同浓度的T4对点带石斑鱼仔鱼进行处理,表明T4能够促进点带石斑鱼色素出现及第2背鳍棘收缩,但存在剂量依赖,高浓度T4会导致仔鱼存活率下降;Buchholz(2017)研究认为,甲状腺激素受体在脊椎动物变态过程中起到了重要作用。因此,内分泌干扰因素对石斑鱼等脊椎动物变态发育格外重要(Opitz et al, 2010),目前,对于调控第2背鳍棘和腹鳍棘伸长与收回的生物学机制的相关研究还未见报道,通过全基因组和网络分析方法及表观遗传现象研究,会更好地阐述石斑鱼变态的遗传机制(Sachs et al, 2017)。
3.3 石斑鱼体色变化体色是石斑鱼仔、稚、幼鱼生长阶段最明显的变化之一,研究过程中发现,杂交子一代离开水体后出现应激反应,即体色变暗、花纹消失。硬骨鱼类生理学体色变化主要是由内分泌和交感神经系统调控的皮肤色素细胞聚集或发散引起的,而软骨鱼类体色变化主要由激素调节控制(Fujii, 2000; Fujii et al, 1986)。目前,在神经调节方面研究较多的是肾上腺素和乙酰胆碱对色素细胞的作用。肾上腺素能够引起色素颗粒的聚集,而乙酰胆碱作用正好相反(李欢等, 2014)。遗传因素和环境因素相互作用,对鱼类体色产生了一定的影响。黑素皮质激素受体(Mc1r, melanocortin-1 receptor)基因在鱼类皮肤中高度表达,其激活可刺激黑色素的产生和鱼类黑色素团的分散,Mc1r的功能调控被认为是脊椎动物色素表型的关键机制(Gross et al, 2009; Cal et al, 2017)。Greenwood等(2011)研究发现,三刺鱼(Gasterosteus aculeatus)幼鱼在不同水域(淡水和海水)中所呈现的色素带不同,淡水中的幼鱼出现竖状条纹,通过对2个水域的三刺鱼杂交F2代幼体进行QTL定位,阐明了该色素沉积模式下潜在的遗传架构差异,表明LG1和LG6两个QTL与条带变化显著相关。石斑鱼幼鱼体色的变化机制还需进一步研究。
Buchholz DR. Xenopus, metamorphosis as a model to study thyroid hormone receptor function during vertebrate developmental transitions. Molecular and Cellular Endocrinology, 2017, 459: 64-70 |
Cal L, Suarez-Bregua P, Cerdá-Reverter JM, et al. Fish pigmentation and the melanocortin system. Comparative Biochemistry and Physiology Part A Molecular and Integrative Physiology, 2017, 211: 26-33 |
Chen C, Kong XD, Li YL, et al. Embryonic and morphological development in the larva, juvenile, and young stages of Epinephelus fuscoguttatus(♀)×E. lanceolatus(♂). Progress in Fishery Sciences, 2014, 35(5): 135-144 [陈超, 孔祥迪, 李炎璐, 等. 棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代胚胎及仔稚幼鱼发育的跟踪观察. 渔业科学进展, 2014, 35(5): 135-144] |
Cheng ML, Tian YS, Wu YP, et al. Analysis of metamorphosis development and growth characteristics of hybrid offspring of Epinephelus lanceolatus(♀)×Epinephelus tukula(♂). Acta Oceanologica Sinica, 2019, 41(8): 52-62 [成美玲, 田永胜, 吴玉萍, 等. 鞍带石斑鱼(♀)×蓝身大斑石斑鱼(♂)杂交F1代变态发育和生长特征分析. 海洋学报, 2019, 41(8): 52-62] |
Fujii R, Oshima N. Control of chromatophore movements in teleost fishes. Zoological Science, 1986, 3: 13-47 |
Fujii R. The regulation of motile activity in fish chromatophores. Pigment Cell Research, 2000, 13(5): 300-319 |
Glamuzina B, Glavić N, Skaramuca B, et al. Early development of the hybrid Epinephelus costae♀×E. marginatus♂. Aquaculture, 2001, 198(1-2): 55-61 |
Greenwood AK, Jones FC, Chan YF, et al. The genetic basis of divergent pigment patterns in juvenile threespine sticklebacks. Heredity, 2011, 107(2): 155-66 |
Gross JB, Borowsky R, Tabin CJ. A novel role for Mc1r in the parallel evolution of depigmentation in independent populations of the cavefish, Astyanax mexicanus. PLoS Genetics, 2009, 5(1): 1-14 |
Guo F, Wang J, Su YQ, et al. Study on the karpyotype of Epinephelus moara. Marine Sciences, 2006, 30(8): 1-3 [郭丰, 王军, 苏永全, 等. 云纹石斑鱼染色体核型研究. 海洋科学, 2006, 30(8): 1-3] |
Guo ML. Comparative studies of Epinephelus moara and Epinephelus bruneus. Doctoral Dissertation of Xiamen University, 2009 [郭明兰.云纹石斑鱼与褐石斑鱼的比较研究.厦门大学博士研究生学位论文, 2009]
|
Huang XL, Lü GM, Liufu YZ, et al. Mitochondrial genome characteristics and phylogenetic information of genus Epinephelus (Perciformes: Serranidae) fishes. Journal of Biology, 2013, 30(3): 9-13 |
Jesus EGTD, Toledo JD, Simpas MS. Thyroid hormones promote early metamorphosis in grouper (Epinephelus coioides) larvae. General and Comparative Endocrinology, 1998, 112(1): 10-16 |
Li H, Sang WG, Duan QY, et al. Advance of fish color mechanism and its regulation. Marine Sciences, 2014, 38(8): 109-115 [李欢, 桑卫国, 段青源, 等. 鱼类体色成因及调控研究进展. 海洋科学, 2014, 38(8): 109-115] |
Li YL, Chen C, Zhai JM, et al. Fish hybridization and its application in grouper. Marine Fisheries, 2012, 34(1): 102-109 [李炎璐, 陈超, 翟介明, 等. 鱼类杂交育种技术及其在石斑鱼类中的应用. 海洋渔业, 2012, 34(1): 102-109] |
Li YL, Wang QY, Chen C, et al. Embryonic and morphological development in larva, juvenile, and young stages of F1 by Epinephelus moara (♀) × E. septemfasciatus (♂). Journal of Fishery Sciences of China, 2012, 19(5): 821-832 [李炎璐, 王清印, 陈超, 等. 云纹石斑鱼(♀)×七带石斑鱼(♂)杂交子一代胚胎发育及仔稚幼鱼形态学观察. 中国水产科学, 2012, 19(5): 821-832] |
Liu M, Li JL, Ding SX, et al. Epinephelus moara: A valid species of the family Epinephelidae (Pisces: Perciformes). Journal of Fish Biology, 2013, 82(5): 1684-1699 |
Liufu YZ, Zhao HH, Liu XC, et al. Preliminary study on the hybrid red-spotted grouper (Epinephelus akaara)♂× orange-spotted grouper (Epinephelus coioides) ♀. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2007(3): 72-75 [刘付永忠, 赵会宏, 刘晓春, 等. 赤点石斑鱼♂与斜带石斑鱼♀杂交的初步研究. 中山大学学报(自然科学版), 2007(3): 72-75] |
Lü XJ, Wang YN, Liu QH, et al. Research on skeletal development and allometric growth in larval and juvenile Epinephelus lanceolatus. Marine Sciences, 2018, 42(5): 116-121 [吕雪娇, 王雨浓, 刘清华, 等. 鞍带石斑鱼仔稚幼鱼骨骼发育与生长特性研究. 海洋科学, 2018, 42(5): 116-121] |
Miwa S. Effects of various doses of thyroxine and triiodothyronene on the metamorphosis of flounder (Paralichythy olivaceus). General and Comparative Endocrinology, 1987, 67(3): 356-363 |
Oh BS, Oh DJ, Jung MM, et al. Complete mitochondrial genome of the longtooth grouper Epinephelus bruneus (Perciformes, Serranidae). Mitochondrial DNA, 2012, 23(2): 137-138 |
Opitz R. Description and initial evaluation of a Xenopus metamorphosis assay for detection of thyroid system- disrupting activities of environmental compounds. Environmental Toxicology and Chemistry, 2010, 24(3): 653-664 |
Sachs LM, Buchholz DR. Frogs model man: In-vivo, thyroid hormone signaling during development. Genesis, 2017, 55(1-2): e23000 |
Shao CW, Bao BL, Xie ZY, et al. The genome and transcriptome of Japanese flounder provide insights into flatfish asymmetry. Nature Genetics, 2016, 49(1): 119-124 |
Shu H, Wei QL, Luo LJ, et al. Karyotypes analysis of four grouper fishes from coastal waters of Guangdong. Guangdong Agricultural Sciences, 2012, 39(8): 124-127 [舒琥, 魏秋兰, 罗丽娟, 等. 广东沿海4种石斑鱼的染色体组型分析. 广东农业科学, 2012, 39(8): 124-127] |
Tang XC, Liu XC, Lin HR, et al. Effects of thyroxine on metamorphosis of orange-spotted grouper (Epinephelus coioides) larvae. Journal of Tropical Oceanography, 2006(1): 33-37 [唐啸尘, 刘晓春, 林浩然, 等. 甲状腺素对斜带石斑鱼仔鱼变态的影响. 热带海洋学报, 2006(1): 33-37] |
Tian YS, Chen ZF, Duan HM, et al. The family line establishment of the hybrid Epinephelus moara (♀) × E. lanceolatus (♂) by using cryopreserved sperm and the related genetic effect analysis. Journal of Fisheries of China, 2017, 41(12): 1817-1828 [田永胜, 陈张帆, 段会敏, 等. 鞍带石斑鱼冷冻精子与云纹石斑鱼杂交家系建立及遗传效应. 水产学报, 2017, 41(12): 1817-1828] |
Tian YS, Tang J, Ma WH, et al. Development and growth of hybrid offspring brown grouper Epinephelus fuscoguttatus (♀) blue speckled grouper Epinephelus tulcula (♂) by using cryopreserved sperm. Progress in Fishery Sciences, 2019, 40(6): 36-47 [田永胜, 唐江, 马文辉, 等. 蓝身大斑石斑鱼冷冻精子(♂)与棕点石斑鱼卵(♀)杂交后代发育及生长特征分析. 渔业科学进展, 2019, 40(6): 36-47] |
Wang B, Sun PX, Zhang CH, et al. Preliminary study on biological characteristics and indoor culture of Epinephelus bruneus. Fishery Modernization, 2006(1): 28-29 [王波, 孙丕喜, 张朝晖, 等. 褐石斑鱼的生物学特性及室内养殖初步试验. 渔业现代化, 2006(1): 28-29] |
Zhang HF, Lin HR, Zhang Y, et al. Breeding method of hybrid "tiger dragon grouper". Patent number: ZL201010249402. 2014.03.05 [张海发, 林浩然, 张勇, 等.杂交"虎龙斑"的培育方法.专利号: ZL201010249402, 授权公告日2014.03.05]
|
Zhou L, Weng WM, Li JL, et al. Studies on embryonic development, morphological development and feed changeover of Epinephelus lanceolatus larva. Chinese Agricultural Science Bulletin, 2010, 26(1): 293-302 [周玲, 翁文明, 李金亮, 等. 鞍带石斑鱼胚胎发育及仔鱼形态发育、饵料转变的观察研究. 中国农学通报, 2010, 26(1): 293-302] |



