2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs, Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
鳗弧菌(Vibrio anguillarum)广泛存在于大洋、河口等环境,也是多种海洋生物的正常菌群之一,一些致病性菌株可感染多种鱼类,引起出血性败血症(Austin et al, 2007; 丁山等, 2018)。鳗弧菌致病包括粘附、侵袭、体内增殖、产生毒素等一系列过程,而这些过程又与细菌产生的各种致病因子有关(Frans et al, 2011)。已知的致病因子包括外膜蛋白、鞭毛、蛋白酶、脂多糖和溶血素等(Norqvist et al, 1990; Austin et al, 1995; Hirono et al, 1996; Milton et al, 1996)。鞭毛参与鳗弧菌的运动,当细菌失去运动能力或运动能力下降时,其感染宿主细胞的能力明显减弱(Ormonde et al, 2000)。很多胞外蛋白酶是病原菌的主要致病因子,它们可以水解组织细胞,增强其通透性,产生细胞毒性,最终造成组织损伤等(Naka et al, 2011)。鳗弧菌的金属蛋白酶基因prtV发生突变时,其对宿主红细胞的溶血活性下降、毒力减弱(Mo et al, 2010)。Stewart等(2001)研究表明,几乎所有的细菌都可以形成菌膜,为细菌提供物理和化学屏障,营造一种相对稳定的状态。菌膜使鳗弧菌能够对消毒剂、抗生素等不利环境具有一定的耐受力,使其保持持续感染和耐药性(Hall-Stoodley et al, 2004; Lindell et al, 2012)。一些基因参与调控鳗弧菌菌膜和毒力的形成,如luxR能够抑制胞外蛋白的产生、调控菌膜的形成,进而参与细菌毒力和耐药性的调控(Croxatto et al, 2002)。可见,鳗弧菌在运动、胞外蛋白酶产生、菌膜形成等表型方面的变化与细菌的致病性相关。
转座子mini-Tn10是一种微型转座子,已被广泛应用于多种细菌基因的功能研究,如用于鉴定炭疽杆菌(Anthrax bacillus)未知的调控因子及代谢途径研究(Wilson et al, 2007),用于鉴定影响苏云金杆菌(Bacillus thuringiensis)细菌素产生的基因(Kamoun et al, 2009)。为找到影响鳗弧菌表型变化的基因,本研究使用转座子mini-Tn10 (pLOF/Kana)构建鳗弧菌M3突变菌株文库,筛选影响表型变化的菌株及相关基因,为进一步研究鳗弧菌的致病机理提供基础。
1 材料与方法 1.1 菌株、实验鱼、引物和培养条件鳗弧菌M3(AmpR)由本实验室保存,用胰大豆蛋白胨培养基(TSA和TSB)培养,培养条件为28℃,静置或150 r/min摇床培养。
大肠杆菌(Escherich coli) CC118 (pLOF/Kana, KanaR, AmpR)和大肠杆菌SM10(KanaR)由集美大学鄢庆枇教授惠赠,用含卡那霉素(Kana) 100 μg/ml的LB液体培养基培养,培养条件为37℃、静置或150 r/min摇床培养。
斑马鱼(Barchydanio rerio var),体长为3~4 cm,购于青岛市南山花鸟虫鱼市场。实验前暂养于15 L水族箱中1周,正常换水、喂食,养殖水温为22℃。
TCBS固体培养基(含Kana 600 μg/ml)用于筛选带有Kana抗性的鳗弧菌突变子。
1.2 鳗弧菌M3 mini-Tn10转座子文库构建突变文库的构建参照Herrero等(1990)方法并适当改进。供体菌E.coli SM10 (pLOF/ Kana)在LB [氨苄青霉素(Amp),50 μg/ml;Kana,100 μg/ml]培养基中37℃震荡培养过夜,受体菌(鳗弧菌) M3在TSB培养基中28℃震荡培养过夜。分别离心,收集供体菌和受体菌,用新鲜培养基洗涤,并重悬菌体,供体菌与受体菌按1:4的比例混合均匀,用0.22 μm的微孔滤膜过滤混合菌液,取出滤膜置于TSA平板上,28℃培养4 h后,用1 ml TSB培养基洗脱滤膜上的细菌,取50 μl涂布TCBS+Kana平板,28℃培养24 h。从TCBS+Kana平板上挑取单菌落,–80℃保存于96孔板中。
1.3 突变子表型检测对鳗弧菌转座子突变文库进行泳动、酪蛋白酶活性、明胶酶活性、菌膜形成能力等表型检测。具体方法:将鳗弧菌M3及其突变文库菌株在TSB过夜培养,调节菌液为OD540 nm=0.5,取2 μl菌液分别点种于含0.35%琼脂、含1%酪蛋白、含1%明胶的TSA平板上,每组设3个重复。28℃静置培养24 h后,分别测量平板上细菌的泳动圈直径(Schaber et al, 2004)、酪蛋白酶产生直径(Wilhelm et al, 2007)、明胶酶产生直径(Zhou et al, 2013)。
应用结晶紫染色法检测突变菌株菌膜形成能力(Lazarevic et al, 2005)。取OD540 nm为0.5的菌液150 μl加入96孔板中,以TSB作为空白对照。在28℃静置培养24 h,用磷酸盐缓冲液(PBS, 浓度0.2 mol/L, pH 7.0)洗涤5次后,用包音氏固定液(Bouin’s stationary liquid)固定,37℃下静置培养1 h,用PBS缓冲液清洗除去残留物,置于37℃恒温培养箱完全干燥后,加入结晶紫染色、蒸馏水清洗,加入乙醇溶解吸附结晶紫,然后,测定其在OD595 nm的吸光度。
1.4 转座子插入突变子的数量及基因的确定根据Lee等(2008)的方法确定转座子插入突变子的数量,具体步骤:鳗弧菌M3 rpoB基因为单拷贝基因,选取其作为内参基因,neoR基因为转座子特有,选取其为目的基因,根据引物rpoB-for/rev、neo-for/rev(表 1)扩增rpoB和neoR片段。连接rpoB片段和neoR片段,构建重组载体质粒,根据该质粒计算DNA拷贝数,并以该重组质粒为模板,rpoB- SYBR-for/rev、neoR-SYBR-for/rev为引物,制作标准曲线,得到扩增效率E值(ErpoB和EneoR),再以突变子DNA为模板,进行相对定量PCR,得到ΔCtrpoB和ΔCtneoR,由公式计算转座子插入个数。
|
|
表 1 本实验所用引物 Tab.1 Primers used in this study |
| $转座子插入个数 = \frac{{{{(1 + {E_{neoR}})}^{-\Delta {C_{tneoR}}}}}}{{{{(1 + {E_{rpoB}})}^{-\Delta {C_{trpoB}}}}}} $ |
式中,ΔCtneoR为扩增neoR基因时,突变子株DNA为模板的Ct与重组质粒为模板的Ct差值。ΔCtrpoB为扩增rpoB基因时,突变子株DNA为模板的Ct与重组质粒为模板的Ct差值。
根据Xie等(2011)的方法适当改进,确定转座子插入基因,具体步骤:根据转座子mini-Tn10中neoR基因序列进行特异性引物设计,具体引物序列见表 1。对筛选出的8株菌株进行基因步移(Genome walking)扩增。以8株突变子菌株基因组DNA为模板,使用外引物neo-Rrev-0a和M3-1-1进行第1轮PCR;取适量的第1轮PCR产物反应液稀释50倍后,使用内引物neoR-rev-1a和M3-1进行第2轮PCR;取适量的第2轮PCR产物反应液稀释50倍后,使用内引物neoR-rev-b1和M3-1进行第3轮PCR反应。PCR产物经1%琼脂糖凝胶电泳检测,确认目的条带后,经1.5%琼脂糖凝胶电泳,切胶回收目的片段、连接至载体,送上海派森诺生物技术有限公司测序,测序结果与已公布的M3基因组信息在NCBI上进行比对。
1.5 突变子毒力检测利用斑马鱼作为实验动物,检测突变子的毒力变化,根据杨茂成(1990)的方法,鳗弧菌野生型M3及8株突变菌株作为感染组,无菌生理盐水作为对照组,设置细菌浓度梯度为108、107、106和105 CFU/ml,TSA平板检测活菌数。每个梯度10尾鱼,每尾鱼注射10 μl菌液,进行肌肉注射攻毒,记录感染后斑马鱼的死亡情况,采用改进的寇氏法计算细菌对斑马鱼的半数致死量(Lethal dose 50%, LD50)。
1.6 数据分析细菌的泳动圈直径、酪蛋白酶产生直径、明胶酶产生直径和成膜能力的吸光度采用平均值±标准差(Mean±SD)表示,并使用SPSS软件对这些数据进行单因素方差分析(One-way ANOVA)。
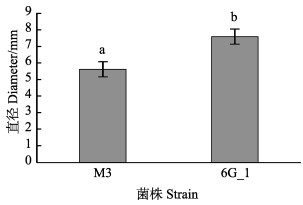
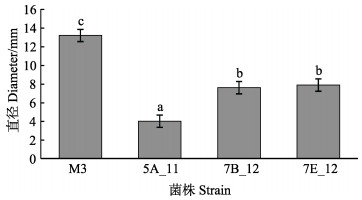
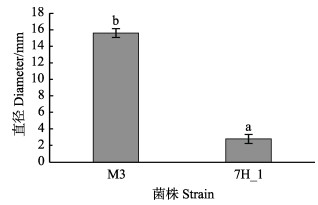
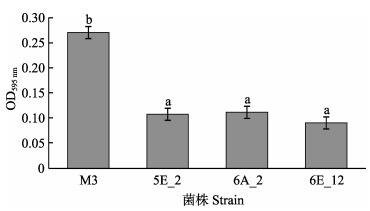
2 结果 2.1 鳗弧菌M3 mini-Tn10转座子文库的构建和筛选利用mini Tn10转座子构建鳗弧菌M3的突变文库,得到1152株突变子。对突变子进行泳动、酪蛋白酶活性、明胶酶活性、菌膜形成能力的检测,发现与野生型M3相比,突变子株6G_1的泳动能力明显增强(P < 0.05)(图 1),5A_11、7B_12、7E_12的酪蛋白酶活性显著减弱(P < 0.05)(图 2),7H_1的明胶酶活性显著减弱(P < 0.05)(图 3),5E_2、6A_2、6E_12的菌膜形成能力显著减弱(P < 0.05)(图 4)。
|
图 1 鳗弧菌M3转座子文库突变子泳动能力检测 Fig.1 Detection of swimming ability of V. anguillarum M3 transposon library 不同字母表示组间差异显著(P < 0.05),下同 Data with different letters are significantly different among different groups (P < 0.05), the same as below |
|
图 2 鳗弧菌M3转座子文库突变子酪蛋白酶活性检测 Fig.2 Detection of casein activity of V. anguillarum M3 transposon library |
|
图 3 鳗弧菌M3转座子文库突变子明胶酶酶活性检测 Fig.3 Detection of luciferase activity of V. anguillarum M3 transposon library |
|
图 4 鳗弧菌M3转座子文库突变子菌膜形成能力检测 Fig.4 Detection of membrane formation ability of V. anguillarum M3 transposon library |
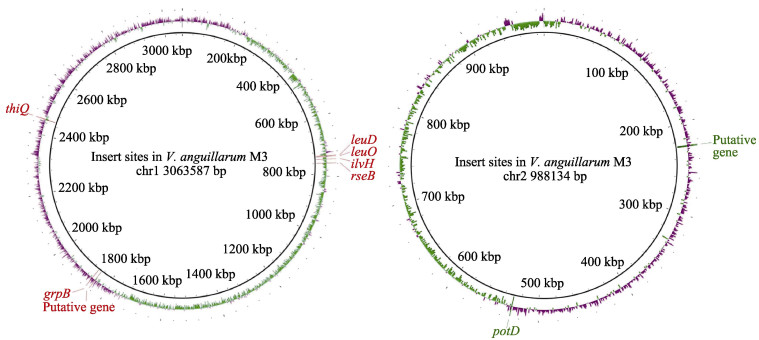
选取筛选的8株菌,利用实时PCR相对定量标准曲线法和ΔCt法确定了转座子插入个数(表 2)。通过基因步移扩增法获得转座子插入位点,将得到的序列与M3全基因组序列进行比对,得到插入基因在M3基因组上的位置信息和编码蛋白信息(图 5,表 3)。leuD、rseB、thiQ、ilvH、grpB位于M3染色体Ⅰ上,1个磷酸二酯酶相关基因和potD位于染色体Ⅱ上。其中,磷酸二酯酶相关基因影响M3的运动能力,leuD、rseB、thiQ影响M3酪蛋白酶产生,potD影响M3明胶蛋白酶产生,leuO、ilvH和grpB影响M3的菌膜形成能力。
|
|
表 2 目的基因neoR和内参基因rpoB的扩增效率及ΔCt值 |
|
图 5 转座子插入位点及基因 Fig.5 Transposon insertion sites and genes |
|
|
表 3 转座子插入位点信息 Tab.3 Information of transposon insertion site |
肌肉注射攻毒实验结果见表 4。由表 4可知,突变子6G_1的LD50为5.439×104 CFU/尾,野生型M3是该突变子的2.04倍,突变子5A_11、7B_12和7E_12的LD50分别为3.29×105、3.734×105、和3.734×105 CFU/尾,分别为野生型M3的2.96、3.25和3.36倍。7H_1的LD50为1.374×105 CFU/尾,是野生型M3的1.25倍,5E_2、6A_2和6E_12的LD50分别为3.716×105、4.453×105和2.052×105 CFU/尾,分别为野生型M3的3.34、4.08和1.84倍。
|
|
表 4 鳗弧菌M3野生型及其突变子株攻毒实验结果 Tab.4 Experimental results of virulence of V. anguillarum M3 wild type and its mutants |
本研究利用mini-Tn10转座子构建了鳗弧菌M3的突变文库,筛选得到影响细菌泳动、酪蛋白酶活性、明胶酶活性、菌膜形成能力的突变子菌株,通过基因步移和序列比对,找到影响上述表型的相关基因。结果显示,1个磷酸二酯酶相关基因的突变引起泳动能力增强(P < 0.05),毒力相对增强,leuD、rseB、thiQ的突变引起酪蛋白酶活性明显减弱(P < 0.05),potD的突变引起明胶蛋白酶活性显著减弱(P < 0.05),leuO、ilvH和grpB的突变引起菌膜形成能力明显减弱(P < 0.05)且这些菌株毒力相对减弱。研究表明,细菌毒力产生主要包括铁摄取系统、外膜蛋白、胞外蛋白酶、脂多糖和溶血素等(Weber et al, 2009; Naka et al, 2011)。O’Toole等(1996)研究发现,鳗弧菌鞭毛被破坏后,泳动能力减弱的菌株毒力较野生型减弱了几百倍,表明趋化运动是鞭毛对鳗弧菌毒力的一种必需功能。Hao等(2013)研究表明,鳗弧菌rpoN基因缺失突变株因为其各种表型缺陷和调控能力丧失,致使鳗弧菌在宿主体内存活能力下降,致病力减弱,证实了表型和毒力存在相关性。
磷酸二酯酶(PDES)具有水解细胞内第二信使(环磷酸腺苷cAMP或环磷酸鸟苷cGMP)的功能,降解细胞内cAMP或cGMP,从而终结这些第二信使所传导的生化作用(田慧等, 2003)。Fahmin等(2017)研究显示,PDES、二腺苷酸环化酶(DACS)和c-di-AMP合成酶构成环二腺苷单磷酸(c-di-AMP),PDES和DACS协同调节c-di-AMP的稳态,PDES的缺失可导致革兰氏阳性细菌的细胞壁发生改变、钾离子吸收失调、c-di-AMP水平改变、细菌的存活率下降。c-di-AMP在不同的细菌体内具有不同的作用,可以影响生物膜的形成、毒力因子的表达、运动性和碳代谢(Corrigan et al, 2013),但其调控细菌表型和毒力的机制尚不清楚(Pham et al, 2016; Corrigan et al, 2013)。本研究中,由于转座子插入,使鳗弧菌的1个PDES失活,有可能影响了细菌细胞壁离子代谢和生物膜形成,而导致细菌运动能力改变,具体的影响机制还需进一步探究。
leuD编码异丙基苹果酸异构酶,将α-异丙基苹果酸催化为β-异丙基苹果酸,为亮氨酸的合成提供前体(Kohlhaw et al, 2003)。qsdS编码异丙基苹果酸脱氢酶,具有N-酰基-L-高丝氨酸内酯(AHL)降解酶活性(Ma et al, 2018)。AHL参加细菌密度感应系统(QS)的调节,调控生物膜形成(Parsek et al, 2000)、蛋白酶活性(Waters et al, 2005)等。在染色体上,qsdS位于leuD和leuO之间,由此推测,leuD的插入失活间接影响了qsdS的功能,从而影响鳗弧菌QS的功能,使蛋白酶活性、生物膜形成能力受到影响。
rseB编码一种细胞质蛋白,与内层锚定蛋白RseA结合,调节膜内蛋白水解与蛋白酶活性(Kim et al, 2010);thiQ编码硫胺素ABC转运ATP结合蛋白,参与细菌的能量代谢,该基因的缺失不仅使细菌整体的能量代谢下降,还使细菌的生长减慢,细菌生物膜合成所需的蛋白、胞外多糖等合成能力减弱(Huang et al, 2014)。potD编码一种胞浆蛋白,参与亚精胺和腐胺的转运(Shah et al, 2008)。因此,这些基因的缺失可能导致鳗弧菌多种蛋白或蛋白酶合成能力、转运能力下降,间接影响蛋白酶的活性。这些基因对蛋白酶活性的影响机制有待阐明。
ilvH编码乙酰乳酸合酶,催化2-乙酰乳酸的合成,参与三羧酸循环(Zhao et al, 2013);grpB编码2-甲基异柠檬酸裂解酶,促进2-甲基异柠檬酸酯催化丙酮酸和琥珀酸酯的形成,参与碳源合成(Hubstenberger et al, 2015),说明ilvH和grpB与ATP合成相关。因此,猜测这2个参与能量合成的基因间接影响鳗弧菌菌膜的形成,它们对菌膜形成的影响机制有待阐明。
总之,本研究通过转座子文库,鉴定出8个与鳗弧菌运动、胞外蛋白酶活性、菌膜形成有关的基因。由于转座子的插入突变可能会引发极性效应,使得插入位点的下游基因受到影响。因此,后期还需要通过基因敲除、基因回补实验来确证它们与表型变化的关系,在此基础上研究基因的功能及作用机制。
Austin B, Alsina M, Austin DA, et al. Identification and typing of Vibrio anguillarum:A comparison of different methods. Systematic and Applied Microbiology, 1995, 18(2): 285-302 |
Austin B, Austin D.Characteristics of the pathogens: Gram-negative bacteria.In: Bacterial fish pathogens.Springer Praxis Books.Springer, Dordrecht, 2007
|
Corrigan RM, Campeotto I, Jeganathan T, et al. Systematic identification of conserved bacterial c-di-AMP receptor proteins. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 9084-9089 DOI:10.1073/pnas.1300595110 |
Croxatto A, Chalker VJ, Lauritz J, et al. VanT, a homologue of Vibrio harveyi LuxR, regulates serine, metalloprotease, pigment, and biofilm production in Vibrio anguillarum. Journal of Bacteriology, 2002, 184(6): 1617-1629 DOI:10.1128/JB.184.6.1617-1629.2002 |
Ding S, Li SF, Li J, et al. Long-term protection effect of Vibrio anguillarum trivalent inactivated vaccine. Progress in Fishery Sciences, 2018, 39(5): 137-142 [丁山, 李淑芳, 李杰, 等. 鳗弧菌三价灭活疫苗的长期免疫保护效果. 渔业科学进展, 2018, 39(5): 137-142] |
Fahmin T, Port GC, Cho KH. c-di-AMP:An essential molecule in the signaling pathways that regulate the viability and virulence of gram-positive bacteria. Genes (Basel), 2017, 8(8): 197 DOI:10.3390/genes8080197 |
Frans I, Michiels CW, Bossier P, et al. Vibrio anguillarum as a fish pathogen:Virulence factors, diagnosis and prevention. Journal of Fish Diseases, 2011, 34(9): 643-661 DOI:10.1111/j.1365-2761.2011.01279.x |
Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms:From the natural environment to infectious diseases. Nature Reviews Microbiology, 2004, 2: 95-108 DOI:10.1038/nrmicro821 |
Hao B, Mo ZL, Xiao P, et al. Role of alternative sigma factor 54(RpoN) from Vibrio anguillarum M3 in protease secretion, exopolysaccharide production, biofilm formation, and virulence. Applied Microbiology and Biotechnology, 2013, 97(6): 2575-2585 DOI:10.1007/s00253-012-4372-x |
Herrero M, de Lorenzo V, Timmis KN. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. Journal of Bacteriology, 1990, 172(11): 6557-6567 DOI:10.1128/JB.172.11.6557-6567.1990 |
Hirono I, Masuda T, Aoki T. Cloning and detection of the hemolysin gene of Vibrio anguillarum. Microbial Pathogenesis, 1996, 21(3): 173-182 DOI:10.1006/mpat.1996.0052 |
Huang H, Tao YX. A small molecule agonist thiQ as a novel pharmacoperone for intracellularly retained melanocortin-4 receptor mutants. International Journal of Biological Sciences, 2014, 10(8): 817-24 DOI:10.7150/ijbs.9625 |
Hubstenberger A, Cameron C, Noble SL, et al. Modifiers of solid RNP granules control normal RNP dynamics and mRNA activity in early development. Journal of Cell Biology, 2015, 211(3): 703-716 DOI:10.1083/jcb.201504044 |
Kamoun F, Fguira IB, Tounsi A, et al. Generation of mini-Tn10 transposon insertion mutant library of Bacillus thuringiensis for the investigation of genes required for its bacteriocin production. FEMS Microbiology Letters, 2009, 294(2): 141-149 DOI:10.1111/j.1574-6968.2009.01559.x |
Kim DY, Kwon E, Choi JK, et al. Structural basis for the negative regulation of bacterial stress response by RseB. Protein Science, 2010, 19(6): 1258-1263 |
Kohlhaw GB. Leucine biosynthesis in fungi:Entering metabolism through the back door. Microbiology and Molecular Biology Reviews, 2003, 67(1): 1-15 |
Lazarevic V, Soldo B, Médico N, et al. Bacillus subtilis α-phosphoglucomutase is required for normal cell morphology and biofilm formation. Applied and Environmental Microbiology, 2005, 71(1): 39-45 |
Lee C, Lee S, Shin SG, et al. Real-time PCR determination of rRNA gene copy number:Absolute and relative quantification assays with Escherichia coli. Applied Microbiology and Biotechnology, 2008, 78(2): 371-376 DOI:10.1007/s00253-007-1300-6 |
Lindell K, Fahlgren A, Hjerde E, et al. Lipopolysaccharide O-antigen prevents phagocytosis of Vibrio anguillarum by rainbow trout (Oncorhynchus mykiss) skin epithelial cells. PLoS One, 2012, 7(5): e37678 DOI:10.1371/journal.pone.0037678 |
Ma H, Wang X, Zhang Y, et al. The diversity, distribution and function of N-acyl-homoserine lactone (AHL) in industrial anaerobic granular sludge. Bioresource Technology, 2018, 247: 116-124 DOI:10.1016/j.biortech.2017.09.043 |
Milton DL, O'Toole R, Hörstedt P, et al. Flagellin A is essential for the virulence of Vibrio anguillarum. Journal of Bacteriology, 1996, 178(5): 1310-1319 DOI:10.1128/JB.178.5.1310-1319.1996 |
Mo ZL, Guo DS, Mao YX, et al. Identification and characterization of the Vibrio anguillarum prtV gene encoding a new metalloprotease. Chinese Journal of Oceanology and Limnology, 2010, 28(1): 55-61 DOI:10.1007/s00343-010-9246-4 |
Naka H, Crosa JH. Genetic determinants of virulence in the marine fish pathogen Vibrio anguillarum. Fish Pathology, 2011, 46(1): 1-10 DOI:10.3147/jsfp.46.1 |
Norqvist A, Norrman B, Wolf-Watz H. Identification and characterization of a zinc metalloprotease associated with invasion by the fish pathogen Vibrio anguillarum. Infection and Immunity, 1990, 58(11): 3731-3736 DOI:10.1128/IAI.58.11.3731-3736.1990 |
Ormonde P, Hörstedt P, O'Toole R, et al. Role of motility in adherence to and invasion of a fish cell line by Vibrio anguillarum. Journal of Bacteriology, 2000, 182(8): 2326-2328 DOI:10.1128/JB.182.8.2326-2328.2000 |
O'Toole R, Milton DL, Wolf-Watz H. Chemotactic motility is required for invasion of the host by the fish pathogen Vibrio anguillarum. Molecular Microbiology, 1996, 19(3): 625-637 DOI:10.1046/j.1365-2958.1996.412927.x |
Parsek MR, Greenberg EP. Acyl-homoserine lactone quorum sensing in gram-negative bacteria:A signaling mechanism involved in associations with higher organisms. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(16): 8789-8793 DOI:10.1073/pnas.97.16.8789 |
Pham TH, Liang ZX, Marcellin E, et al. Replenishing the cyclic-di-AMP pool:Regulation of diadenylate cyclase activity in bacteria. Current Genetics, 2016, 62(4): 731-738 DOI:10.1007/s00294-016-0600-8 |
Schaber JA, Carty NL, McDonald NA, et a1. Analysis of quorum sensing-deficient clinical isolates of Pseuomonas aeruginosa. Journal of Medical Microbiology, 2004, 53(Pt 9): 841-853 |
Shah P, Swiatlo E. A multifaceted role for polyamines in bacterial pathogens. Molecular Microbiology, 2008, 68(1): 4-16 |
Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms. The LANCET, 2001, 358(9276): 135-138 DOI:10.1016/S0140-6736(01)05321-1 |
Tian H, Zhang Q, Zhu JS. New phosphodiesterase and its new function. Chinese Journal of Clinical Pharmacology, 2003, 19(6): 458-460 [田慧, 张奇, 朱景申. 新的磷酸二酯酶及其功能. 中国临床药理学杂志, 2003, 19(6): 458-460] |
Waters CM, Bassler BL. Quorum sensing:Cell-to-cell communication in bacteria. Annual Review of Cell and Developmental Biology, 2005, 21: 319-346 DOI:10.1146/annurev.cellbio.21.012704.131001 |
Weber B, Hasic M, Chen C, et al. Type Ⅵ secretion modulates quorum sensing and stress response in Vibrio anguillarum. Environmental Microbiology, 2009, 11(12): 3018-3028 DOI:10.1111/j.1462-2920.2009.02005.x |
Wilhelm S, Gdynia A, Tielen P, et al. The autotransporter esterase EstA of Pseudomonas aeruginosa is required for rhamnolipid production, cell motility, and biofilm formation. Journal of Bacteriology, 2007, 189(18): 6695-6703 DOI:10.1128/JB.00023-07 |
Wilson AC, Perego M, Hoch JA. New transposon delivery plasmids for insertional mutagenesis in Bacillus anthracis. Journal of Microbiological Methods, 2007, 71(3): 332-335 DOI:10.1016/j.mimet.2007.09.006 |
Xie C, Zhang B, Wang D, et al. Molecular cloning and characterization of an achene-seed-specific promoter from motherwort (Leonurus japonicus Houtt). Biotechnology Letters, 2011, 33(1): 167-172 DOI:10.1007/s10529-010-0392-8 |
Yang MC. Veterinary statistics. Beijing: China Prospect Press, 1990 [杨茂成. 兽医统计学. 北京: 中国展望出版社, 1990]
|
Zhao Y, Niu C, Wen X, et al. The minimum activation peptide from ilvh can activate the catalytic subunit of AHAS from different species. Chembiochem, 2013, 14(6): 746-752 DOI:10.1002/cbic.201200680 |
Zhou MY, Wang GL, Li D, et al. Diversity of both the cultivable protease-producing bacteria and bacterial extracellular proteases in the coastal sediments of King George Island, Antarctica. PLoS One, 2013, 8(11): e79668 DOI:10.1371/journal.pone.0079668 |



