2. 山东省海水养殖病害防治重点实验室 山东省海洋生物研究院 青岛 266104
2. Shandong Key Laboratory of Disease Control in Mariculture, Marine Biology Institute of Shandong Province, Qingdao 266104
随着凡纳滨对虾(Litopenaeus vannamai)养殖业的不断发展,急性肝胰腺坏死综合征(Acute Hepatopancreatic Necrosis Disease, AHPND) (Soto-Rodriguez et al, 2015)、发光病(Luminous Bacterial Disease) (Lavilla-Pitogo et al, 1990)、红体病(Red Body Disease) (Cao et al, 2014)等细菌性病害频发,给对虾养殖业造成了严重的经济损失,阻碍了其进一步健康发展。使用抗菌药物是控制细菌性病害的主要方法,但会造成病原菌耐药性的产生,并对生态环境及人类健康有危害(Elmahdi et al, 2016)。因此,亟待探索新的环境友好型的对虾细菌性病害防治手段。
群体感应(Quorum sensing, QS)是广泛存在于细菌之间的一种特殊的通讯手段,细菌可以通过向环境中释放特定的信号分子,如不同碳链长度的N-酰基高丝氨酸内酯(N-acylhomoscrine lactones, AHLs)、自诱导肽(Autoinducing peptides, AIPs)和自诱导物-2 (Autoinducter-2, AI-2)等,并通过感知信号分子浓度的变化调控特定基因的表达(Whiteley et al, 2017)。对虾养殖过程中常见的病原菌包括哈维氏弧菌(Vibrio harveyi)、坎贝氏弧菌(V. campbellii)、副溶血弧菌(V. parahaemolyticus)等(Austin et al, 2006; Haldar et al, 2011; Joshi et al, 2014)。Ng等(2009)研究表明,多数病原菌的毒力因子表达及致病性的产生与其QS系统具有密切联系。抑制病原菌的QS系统,即群体感应淬灭(Quorum quenching, QQ) (Grandclément et al, 2015)可以在不杀死病原菌的前提下减轻其致病性(王岩等,2017)。Tinh等(2007)曾从凡纳滨对虾体内筛选得到3株QQ菌,并发现该3株菌能对哈维氏弧菌产生的信号分子起到降解作用,进而调控其代谢活动。Vinoj等(2014)研究发现,具有QQ功能的地衣芽孢杆菌(Bacillus licheniformis)能有效减少由副溶血弧菌引起的印度明对虾(Fenneropenaeus indicus)死亡率。这些研究均表明,基于QQ角度防治水产动物细菌性病害问题的可行性及巨大潜力。
本研究以根癌农杆菌(Agrobacterium tumefaciens) A136株为报告菌,在实验室已筛选得到的菌株基础上,进一步采用Tang等(2013)所构建的A136液体X-gal法,从凡纳滨对虾体内及养殖环境中筛选到具有QQ功能的活性菌株,探讨了活性菌株的安全性,并通过单因素实验探究了不同培养条件对活性菌株生长及其对己酰基高丝氨酸内酯(C6-HSL)降解率的影响,为基于QQ角度防治对虾细菌性病害提供优良菌种和基础研究资料。
1 材料与方法 1.1 群体感应猝灭菌株的筛选从健康凡纳滨对虾体内及养殖环境中分离出纯菌株后,以根癌农杆菌A136株为报告菌,参照并改进Tang等(2013)所构建的A136液体X-gal法进行QQ菌的筛选。A136于培养基(蛋白胨10 g、酵母粉5 g、NaCl 10 g、H2O 1000 ml、pH 7.0;灭菌后加入终浓度为50 μg/ml的壮观霉素和终浓度为4.5 μg/ml的四环素)中活化24 h后,调节OD600 = 0.5,并按1%接种量接种于新的A136培养基中,加入终浓度为250 μg/ml的5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal)共同培养24 h。待测菌株在LB液体培养基(蛋白胨10 g、酵母粉5 g、NaCl 30 g、H2O 1000 ml、pH 7.2~7.4)中活化24 h后稀释至OD600 nm = 0.5,然后,按2%接种量接种于新的LB液体培养基中培养24 h。取178 μl培养好的待测菌发酵液与2 μl 5 mmol/L的信号分子C6-HSL (Cayman Chemical公司, 美国)及20 μl哌嗪-1, 4-二乙磺酸(PIPEs)缓冲液(1 mol/L, pH 6.7)混合,制成孵育体系,并于30℃条件下孵育。阳性对照(Positive control, PC)组的孵育体系中,以178 μl无菌LB液体培养基代替待测菌发酵液,阴性对照(Negative control, NC)组中无信号分子C6-HSL。孵育24 h后,离心(9570×g, 10 min)取上清液10 μl,与190 μl培养好的A136菌液混合加入96孔板中培养12 h。测定混合体系的OD630 nm和OD490 nm,根据公式:
| ${\rm{ \mathit{ β} - gal}} = \frac{{0.653 \times {\rm{O}}{{\rm{D}}_{490\;{\rm{nm}}}} - {\rm{O}}{{\rm{D}}_{630\;{\rm{nm}}}}}}{{0.267 \times {\rm{O}}{{\rm{D}}_{630\;{\rm{nm}}}} - {\rm{O}}{{\rm{D}}_{490\;{\rm{nm}}}}}}$ |
计算β-gal活性,活性越高表明混合体系中信号分子C6-HSL的含量越高,即待测菌株的QQ活性越弱。同时,通过检测活性菌株AHL降解活性的耐热性,初步判断活性菌株是否存在AHL降解酶。将筛选出的活性菌株在LB液体培养基中培养24 h后,沸水浴处理5 min,再采用A136液体X-gal法检测其C6-HSL降解活性是否丧失。
1.2 菌株16S rDNA鉴定测定活性菌株的基因16S rDNA序列,并于NCBI进行基因序列同源性比较分析,利用MEGA 5.0软件邻接法(Neighbor-joining method)构建系统发育树。目标菌株的16S rDNA序列由生工生物工程(上海)股份有限公司提取并测定。
1.3 活性菌株的体外安全性评估 1.3.1 溶血性采用滤纸片法(王晓琳等, 2016)检测活性菌株的溶血性,血琼脂平板培养基购自贝瑞特生物技术(郑州)有限责任公司。将无菌滤纸片置于血琼脂培养基上方,将培养好的活性菌株发酵液稀释至OD600 nm = 1.0后,取10 μl加在滤纸片上,每个功能菌重复3次,30℃条件下培养24 h,观察血琼脂培养基上是否有溶血圈产生。
1.3.2 药敏性采用抗菌药物药敏纸片琼脂扩散法(K-B法)(王岚等, 2017)进行活性菌株药敏性实验,药敏纸片购自杭州微生物试剂有限公司。将活性菌株接入LB液体培养基中培养24 h后,取100 μl OD600 nm = 1.0的发酵液均匀涂布于LB固体培养基上,并将药敏纸片贴于上方,每种药敏纸片重复3次。在30℃条件下,培养24 h后,观察是否出现抑菌圈并用游标卡尺测量抑菌圈直径。参照CLSI标准–2011的标准判断菌株对各抗生素的敏感性。
1.4 活性菌株的体内安全性评估 1.4.1 实验对虾与菌株实验凡纳滨对虾购自山东乳山某对虾养殖场,平均体长为(5.7±0.4) cm,平均体重为(1.9±0.9) g,体色正常,游泳活泼,暂养7 d后进行实验。
从上述实验中筛选得到的菌株BDZ5和W1B作为实验材料,以实验室前期保存的副溶血弧菌为PC组。将各菌株于LB液体培养基中培养24 h,然后离心(1531×g, 10 min),弃上清液,并用无菌生理盐水稀释至浓度为1×106和1×104 CFU/ml的菌悬液。
1.4.2 实验设计采用肌肉注射的方法进行体内安全性评估,注射部位为凡纳滨对虾第Ⅳ、Ⅴ腹节之间,注射剂量为50 μl/尾。实验共分为7组,阴性对照组(NC组)注射等剂量的无菌生理盐水;L-BDZ5、L-W1B和L-PC组为低浓度(Low, L-)菌液组,分别注射浓度为1×104 CFU/ml的BDZ5、W1B和副溶血弧菌菌悬液;H-BDZ5、H-W1B和H-PC组为高浓度(High, H-)菌液组,即分别注射浓度为1×106 CFU/ml的相应菌悬液。每组设置3个重复,每个重复放15只虾。实验持续96 h,实验期间,不投喂,不换水,连续充氧。
1.4.3 样本采集与指标测定实验期间,定期观察、记录凡纳滨对虾的死亡情况并计算累积死亡率。在实验的第96小时采集各实验组对虾的血清,用于免疫指标的测定。免疫指标包括超氧化物歧化酶(SOD)、一氧化氮合酶(NOS)、溶菌酶(LZM)活力和抗菌酶活力(Ua)。其中,SOD、NOS和LZM活力采用南京建成生物科技有限公司试剂盒测定;Ua的测定参照Xu等(2013)的方法,将哈维氏弧菌用磷酸钾盐缓冲溶液(1 mol/L, pH = 6.4)稀释成OD570 nm = 0.4的菌悬液,在试管(冰水浴条件下)中加入3 ml哈维氏弧菌菌悬液和50 μl血清,混匀后立即测定其OD570 nm值A1,再将试管于37℃条件下水浴30 min,立即取出并测定其OD570 nm值A2,根据公式:Ua = [(A1–A2)/A2]1/2计算Ua。
1.5 活性菌株发酵条件优化以LB液体培养基为基础培养基,采用分光光度计法探究不同发酵条件对菌株生长的影响,采用1.1中的A136液体X-gal法探究不同发酵条件对菌株降解信号分子C6-HSL能力的影响。
培养时间:保持其他条件一致,设置12、24、36、48和60 h共5个发酵时间,在28℃、180 r/min条件下,培养以探究功能菌的最适培养时间。
起始pH:设置5.0、6.0、7.0、7.5和8.0共5个起始pH,其他条件一致,在28℃、180 r/min条件下培养48 h,以确定最适起始pH。
盐度:向培养基中添加NaCl,设置0、10、20、30和40共5个盐度,在其他发酵条件及发酵时间一致的情况下,探究最适发酵盐度。
金属离子:参照叶云峰等(2011)的方法,根据菌株对K+、Mg2+、Ca2+、Fe2+和Mn2+利用情况的差异,按0.5%的量加入K2HPO4·3H2O,按0.05%的量加入MgSO4·7H2O和CaCl2, 按0.0005%的量加入FeSO4·7H2O和MnCl2,保持其他发酵条件及发酵时间一致,确定最适发酵金属离子。
1.6 数据统计与分析实验数据均采用平均值±标准差(Mean±SD),运用SPSS 22.0软件进行数据统计与分析。分析之前测试数据的正态性(Shapiro-wilk test)和方差齐性(Levene's test),若数据不具有方差齐性,则对数据进行lg转化并进一步测试。采用Tukey多重比较检验对符合正态分布和方差齐性的数据进行单因素方差(One-way ANOVA)分析。对于不符合正态分布及lg转化后仍不具有方差齐性的数据,采用非参数检验并通过Kruskal-Wallis测试进行显著性差异分析。P < 0.05表示各组数据差异显著。
2 结果与分析 2.1 群体感应淬灭活性菌株的筛选经A136液体X-gal法筛选发现,2株细菌(BDZ5和W1B)的菌液对信号分子C6-HSL具有显著的降解作用(P < 0.05)(图 1),且经沸水处理后,2株QQ活性菌株均丧失了C6-HSL降解活性。

|
图 1 2株活性菌株菌液的标准化β-半乳糖苷酶(β-gal)活性 Fig.1 The normalized β-galactosidase (β-gal) activity of two bacteria H-:沸水浴后的菌液;PC:阳性对照组;NC:阴性对照组。不同字母表示各组间差异显著(P < 0.05) H-: The bacteria after boiling water bath; PC: Positive control; NC: Negative control. Different letters indicate significant differences between groups (P < 0.05) |
菌株BDZ5和W1B的系统发育树见图 2。从图 2可以看出,BDZ5被鉴定为芽孢杆菌属(Bacillus),且与枯草芽孢杆菌(B.subtilis)具有最高的相似度(100%),W1B被鉴定为科贝特氏菌属(Cobetia),且与海科贝特氏菌(C. marina)亲缘关系最近(98%)。
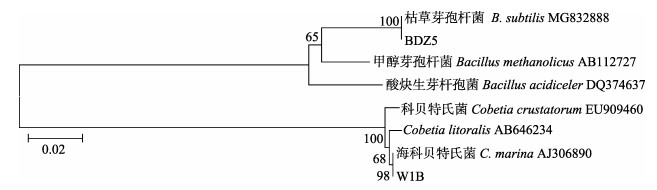
|
图 2 菌株BDZ5和W1B基于Neighbor-Joining方法的16S rDNA基因序列系统发育树(比例尺代表遗传距离) Fig.2 Phylogenetic tree of strains BDZ5 and W1B based on concatenated sequences of 16S rDNA genes using Neighbor-Joining method (The scale represents the genetic distance) |
从图 3可以看出,菌株BDZ5和菌株W1B在血平板上无明显的溶血现象,表明菌株BDZ5和W1B在该实验条件下不产生溶血素。药物敏感性实验结果显示(表 1),菌株BDZ5对头孢氨苄(Cephalexin)、头孢唑林(Cefamezin)、头孢拉定(Cefradine)等13种抗生素高度敏感;对苯唑西林(Oxacillin)中度敏感;菌株W1B对羧苄西林(Carbenicillin)、头孢他啶(Ceftazidime)、头孢曲松(Ceftriaxone)等8种抗生素高度敏感;对氨苄西林(Ampicillin)、哌拉西林(Piperacillin)、头孢氨苄(Cephalexin)等8种抗生素中度敏感。
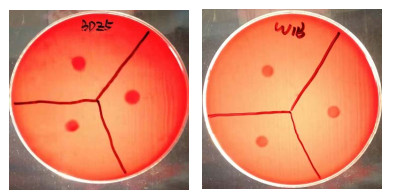
|
图 3 菌株BDZ5和W1B溶血性实验 Fig.3 The hemolytic test of strains BDZ5 and W1B |
|
|
表 1 菌株BDZ5和W1B药敏性实验结果 Tab.1 The antibiotic susceptibility test result of strains BDZ5 and W1B |
注射感染96 h后,L-BDZ5、H-BDZ5、L-W1B和H-W1B组凡纳滨对虾累积死亡率均低于NC组,且H-W1B组最低(图 4),但与NC组相比无显著差异(P > 0.05)。L-PC和H-PC组累积死亡率均高于NC组,且H-PC组最高,与NC组之间相比无显著差异(P > 0.05)。此外,H-PC组的凡纳滨对虾累积死亡率显著高于H-W1B组(P < 0.05)。
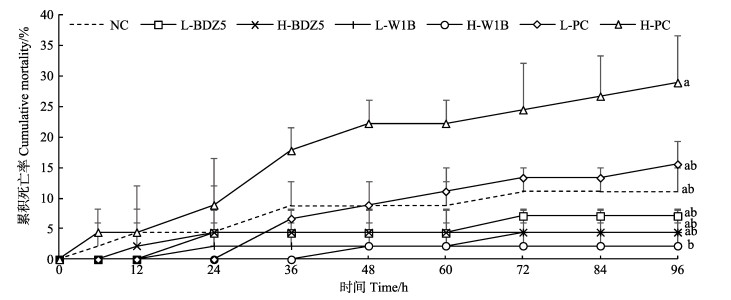
|
图 4 感染细菌后各组对虾累积死亡率 Fig.4 Cumulative mortality of shrimp in each group after infection of bacteria PC:阳性对照组;NC:阴性对照组。96 h时不同字母表示各组间差异显著(P < 0.05) PC: Positive control; NC: Negative control. Different letters at 96 h indicate significant difference between the groups (P < 0.05) |
注射1×104 CFU/ml的BDZ5菌悬液使凡纳滨对虾血清中SOD活性显著提高(P < 0.05)(图 5A),其余各组与NC组相比无显著差异(P > 0.05);注射不同浓度的BDZ5和W1B菌悬液对凡纳滨对虾血清中的NOS活性无显著影响(P > 0.05) (图 5B),但观察到H-PC组凡纳滨对虾血清中NOS活性显著高于NC组(P < 0.05);各组凡纳滨对虾血清中LZM活性与NC组相比均无显著差异(P > 0.05) (图 5C),但H-W1B组的LZM活性显著高于H-PC组(P < 0.05);注射不同浓度的BDZ5和W1B菌悬液对凡纳滨对虾血清中的抗菌酶活性无显著影响(P > 0.05)(图 5D),但注射1×106 CFU/ml的副溶血弧菌菌悬液使凡纳滨对虾血清中抗菌酶活性显著降低(P < 0.05)。
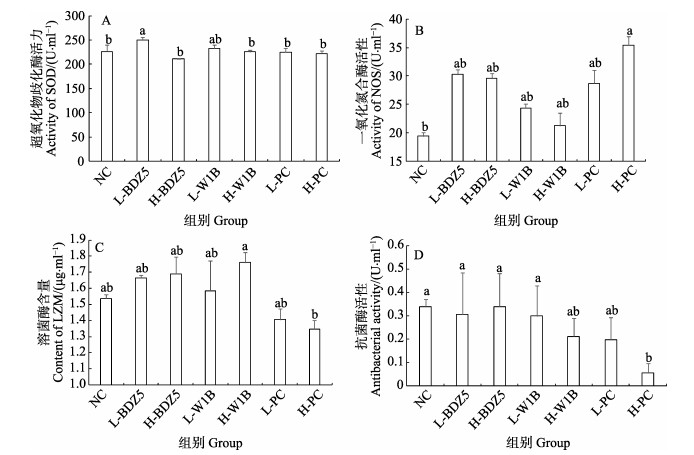
|
图 5 感染细菌后各组对虾血清超氧化物歧化酶(A),一氧化氮合酶(B),溶菌酶(C)和抗菌酶(D)活性 Fig.5 Activities of shrimp serum superoxide dismutase (A), nitric oxide synthase (B), lysozyme (C) and antibacterial (D) in each group after infection of bacteria PC:阳性对照组;NC:阴性对照组。不同字母表示各组间差异显著(P < 0.05) PC: Positive control; NC: Negative control. Different letters indicate significant difference between the groups (P < 0.05) |
随着培养时间的延长,菌株BDZ5和W1B的生长及信号分子C6-HSL降解率均逐渐提高(图 6A、图 7A),48 h时达到最高,继续延长培养时间,菌株BDZ5和W1B的生长及信号分子C6-HSL降解率呈下降趋势。起始pH为7.0时,最有利于菌株BDZ5生长(图 6B);起始pH为7.5时,菌株BDZ5的信号分子C6-HSL降解率达到最高。起始pH为6时,菌株W1B生长最好(图 7B);起始pH为7.5时,菌株W1B对信号分子C6-HSL的降解率最高。菌株BDZ5的生长随盐度的提高呈先上升后下降的趋势(图 6C),盐度为20条件下,菌株BDZ5生长情况最好;当盐度为30时,菌株BDZ5对信号分子C6-HSL的降解率达到最高。菌株W1B在盐度≤20的条件下无法培养(图 7C),且在盐度为40条件下的生长情况显著好于盐度为30 (P < 0.05);但在盐度为30条件下,菌株W1B对信号分子C6-HSL的降解率显著高于盐度为40 (P < 0.05)。培养基中添加一定量的Mn2+和Fe2+使菌株BDZ5的生长显著提高(P < 0.05)(图 6D),其中,Mn2+的效果最好;且Mn2+能显著提高菌株BDZ5对信号分子C6-HSL的降解能力(P < 0.05)。Mn2+、Fe2+、Mg2+和Ca2+均能使菌株W1B的生长显著提高(P < 0.05) (图 7D),且Ca2+效果最好;Mn2+和Ca2+能提高菌株W1B对信号分子C6-HSL的降解率,但与对照组相比未达到显著水平(P > 0.05)。
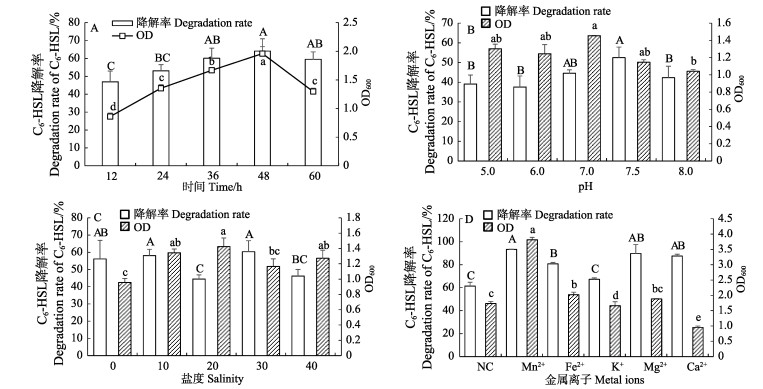
|
图 6 不同培养时间(A)、pH (B)、盐度(C)和金属离子(D)对菌株BDZ5的C6-HSL降解率及生长的影响 Fig.6 Effects of different culture time (A), pH (B), salinity (C) and metal ions (D) on the degradation rate of C6-HSL and the growth of strain BDZ5 NC:阴性对照组。不同大写字母表示菌株对信号分子C6-HSL降解率具有显著差异(P < 0.05),不同小写字母表示菌株的生长具有显著差异(P < 0.05),下同 NC: Negative control. Different uppercase letters indicate that the C6-HSL degradation rate of the strains with different metal ions were significantly different (P < 0.05). Different lowercase letters indicate that the growth of the strains with different metal ions were significantly different (P < 0.05), the same as bellow |
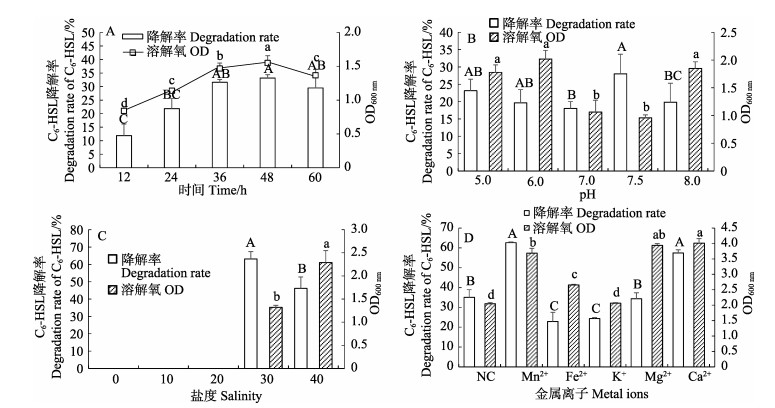
|
图 7 不同培养时间(A)、pH (B)、盐度(C)和金属离子(D)对菌株W1B的C6-HSL降解率及生长的影响 Fig.7 Effects of different culture time (A), pH (B), salinity (C) and metal ions (D) on the degradation rate of C6-HSL and the growth of strain W1B |
本研究采用A136液体X-gal法从健康的凡纳滨对虾体内及养殖环境中筛选得到2株对信号分子C6-HSL具有降解作用的活性菌株BDZ5和W1B,经鉴定分别为芽孢杆菌属和科贝特氏菌属。近年来,QQ菌的相关研究已经成为了微生物领域的热点,但其在水产养殖领域的应用尚处于起步阶段。此前,已有研究表明,芽孢杆菌属的某些细菌,如短小芽孢杆菌(B. pumilus)、苏云金芽孢杆菌(B.thuringiensis)、蜡样芽孢杆菌(B. cereus)、巨大芽孢杆菌(B. megaterium)和枯草芽孢杆菌等能抑制某些病原菌的QS系统,降低病原菌的毒力并对水产动物起到保护作用(Bai et al, 2008; Pan et al, 2008; 宋增福等,2013; Tinh et al, 2014; 韦存等,2018),本研究结果再一次表明了芽孢杆菌属细菌的QQ功能。科贝特氏菌是生活在海水环境中的一种革兰氏阴性菌,目前,针对科贝特氏菌的研究相对较少,尤其是在QQ方面。Trentin等(2011)曾从干扰病原菌QS系统的角度探究了海科贝特氏菌对表皮葡萄球菌(Staphylococcus epidermidis)生物膜形成的影响,但并未给出直接研究结果来证明海科贝特氏菌的QQ活性。该研究是首次报道关于科贝特氏菌属对信号分子C6-HSL具有强降解作用。
本研究发现,经沸水浴处理后,2株功能菌株均丧失了对信号分子C6-HSL的降解活性。QQ菌通过QQ活性物质起到抑制病原菌QS系统的作用,根据分子量的大小,可分为大分子QQ酶和小分子QS阻抑物(于敏等, 2018)。其中,AHL降解酶是目前大分子QQ物质研究的重点,根据降解机制的不同,AHL降解酶又分为AHL内酯酶、AHL酰基转移酶和AHL氧化还原酶,多数的AHL降解酶不具有耐热性,因此,可通过检测功能菌株降解信号分子的耐热性,初步判断菌株是否具有AHL降解酶。本研究结果表明,功能菌株可能存在AHL降解酶活性,但菌株BDZ5和W1B各具有何种QQ酶仍需进一步深入探讨。
益生菌的安全性问题备受关注,目前,还没有形成完善的安全性评价体系。当前,针对益生菌安全性的研究主要集中在体外研究和体内研究2个方面(郝生宏等, 2004)。溶血实验和药物敏感性实验是体外安全性评估的2个重要方面(Baumgartner et al, 1998; 刘勇等, 2011)。某些细菌能释放溶血素引起红细胞膜裂解而导致严重的细菌性疾病(Craig et al, 2017),甚至对人类具有潜在的危害。本研究中,枯草芽孢杆菌BDZ5和海科贝特氏菌W1B均未表现出明显的溶血现象,表明在实验条件下,该2株菌株均不产生溶血素。药物敏感性实验是体外安全性评价的另一个重要方面,其主要目的是测试待测菌株对抗生素是否具有耐药性,从而防止耐药益生菌无限生长及对机体内源性菌株产生耐药性诱导(王晓琳, 2016)。本研究发现,菌株BDZ5对头孢氨苄、头孢唑林等13种抗生素敏感,菌株W1B对羧苄西林、头孢他啶等8种抗生素敏感,并对多数抗生素中度敏感,表明多数抗生素能对该2株菌株进行有效控制。根据体外安全性评估结果,可以将该2株菌作为潜在益生菌应用于水产养殖。
除了体外安全性评估,对养殖动物进行体内安全性测试也是十分重要的。对水产动物进行体内安全性测试的方式主要包括注射、浸浴和投喂等。张欢欢等(2016)采用注射和浸浴的方式检测功能菌对凡纳滨对虾的安全性;陈文斌等(2017)采用浸浴的方式发现降氮菌株NB9对对虾的成活率无显著影响。本研究发现,与副溶血弧菌不同,向凡纳滨对虾体内注射1×104 CFU/ml和1×106 CFU/ml的BDZ5及W1B菌悬液均不会引起对虾死亡率的升高,进一步表明这2株菌对凡纳滨对虾无明显毒害作用。
本研究进一步测试了感染细菌后,各组凡纳滨对虾血清中的免疫及抗氧化相关酶活性,包括SOD、NOS、LZM和抗菌活性。其中,SOD在清除凡纳滨对虾体内自由基方面具有重要作用(Trenzado et al, 2006);NOS在细菌感染后被激活,通过释放NO对病原起到灭杀作用(Yao et al, 2010);LZM和抗菌酶在破坏和清除体内病原方面十分重要(Chang et al, 2018)。这些免疫及抗氧化酶活性的变化反映出凡纳滨对虾受刺激的情况。本研究中,未观察到注射BDZ5和W1B菌悬液对凡纳滨对虾的免疫及抗氧化酶活性具有显著影响,表明这2株菌对凡纳滨对虾未造成明显的刺激。相反,注射1×106 CFU/ml的副溶血弧菌后,NOS活性显著提高,表明凡纳滨对虾受到了病原的刺激;抗菌酶活性显著降低,表明凡纳滨对虾的免疫系统受到了病原的破坏。此外,还观察到凡纳滨对虾注射1×106 CFU/ml的副溶血弧菌后的LZM活性显著低于注射1×106 CFU/ml的W1B,与该2组的累积死亡率数据一致。总之,通过凡纳滨对虾血清中免疫及抗氧化酶活性的变化进一步说明了BDZ5和W1B具有安全性。
为探究不同的培养条件对这2株活性菌株生长及功能的影响,本研究以LB液体培养基为基础培养基进行单因素实验,分别研究了不同培养时间、起始pH、盐度和金属离子对活性菌株生长和信号分子C6-HSL降解率的影响,研究结果可为菌株的大规模发酵及实际应用提供参考。此外,本研究还发现,不同培养条件对活性菌株的生长和功能的影响具有不一致性,即最适生长条件下,菌株并不一定具有最高的信号分子C6-HSL降解活性,二者之间甚至可能完全相反,这与丁碧婷(2012)的研究结果相似。
综上所述,本研究从凡纳滨对虾养殖体系中筛选得到2株具有QQ功能的活性菌株,经鉴定分别是芽孢杆菌属和科贝特氏菌属。安全性评价结果表明,这2株活性菌对凡纳滨对虾无明显毒害作用,可以作为潜在益生菌应用于对虾养殖,最终通过单因素条件优化实验确定了2株活性菌的最适生长和信号分子C6-HSL降解条件,为基于QQ角度防治对虾细菌性病害提供了优良菌种,并为菌株的大规模发酵及后续应用提供了参考资料。后续研究将集中在QQ活性物质的分离、纯化及实际应用效果方面,探究活性菌株的主要功能组分及对对虾的保护作用,为在实际生产中应用QQ菌株防治细菌性病害提供基础研究资料。
Austin B, Zhang XH. Vibrio harveyi: A significant pathogen of marine vertebrates and invertebrates. Letters in Applied Microbiology, 2006, 43(2): 119-124 DOI:10.1111/j.1472-765X.2006.01989.x |
Bai F, Han Y, Chen J, et al. Disruption of quorum sensing in Vibrio harveyi by the AiiA protein of Bacillus thuringiensis. Aquaculture, 2008, 274(1): 36-40 DOI:10.1016/j.aquaculture.2007.11.024 |
Baumgartner A, Kueffer M, Simmen A, et al. Relatedness of Lactobacillus rhamnosus strains isolated from clinical specimens and such from food-stuffs, humans and technology. LWT-Food Science and Technology, 1998, 31(5): 489-494 DOI:10.1006/fstl.1998.0395 |
Cao H, He S, Lu L, et al. Identification of a Proteus penneri isolate as the causal agent of red body disease of the cultured white shrimp Penaeus vannamei and its control with Bdellovibrio bacteriovorus. Antonie van Leeuwenhoek, 2014, 105(2): 423-430 DOI:10.1007/s10482-013-0079-y |
Chang ZQ, Ge QQ, Sun M, et al. Immune responses by dietary supplement with Astragalus polysaccharides in the Pacific white shrimp, Litopenaeus vannamei. Aquaculture Nutrition, 2018, 24(2): 702-711 |
Chen WB, Pan LQ, Huang F. Isolation, identification and safety evaluation of efficient nitrite-N degradation strain from biofloc- based shrimp culture ponds. Transactions of Oceanology and Limnology, 2017(3): 121-129 [陈文斌, 潘鲁青, 黄飞. 对虾生物絮团中亚硝态氮降解菌分离鉴定与安全性评价. 海洋湖沼通报, 2017(3): 121-129] |
Craig TK, Cech CA, Dorwart M, et al. Alpha-hemolysin variants. United States Patent Application, 2017, 15: 274-770 |
Ding BT. Screen for the quorum sensing inhibitory activity from marine bacterial isolates and the study of active compounds. Master's Thesis of Yangzhou University, 2012 [丁碧婷.具有群体感应抑制活性的海洋细菌的筛选与活性物质研究.扬州大学硕士研究生学位论文, 2012]
|
Elmahdi S, DaSilva LV, Parveen S. Antibiotic resistance of Vibrio parahaemolyticus and Vibrio vulnificus in various countries: A review. Food Microbiology, 2016, 57: 128-134 DOI:10.1016/j.fm.2016.02.008 |
Grandclément C, Tannières M, Moréra S, et al. Quorum quenching: Role in nature and applied developments. FEMS Microbiology Reviews, 2015, 40(1): 86-116 |
Haldar S, Chatterjee S, Sugimoto N, et al. Identification of Vibrio campbellii isolated from diseased farm-shrimps from south India and establishment of its pathogenic potential in an Artemia model. Microbiology, 2011, 157(1): 179-188 |
Hao SH, Tong JM, Sa RN, et al. Research progress on the safety and potential function of probiotics. China Animal Husbandry and Veterinary Medicine, 2004(9): 9-12 [郝生宏, 佟建明, 萨仁娜, 等. 益生菌安全性及其潜在功能研究进展. 中国畜牧兽医, 2004(9): 9-12] |
Joshi J, Srisala J, Truong VH, et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND). Aquaculture, 2014, 428-429: 297-302 DOI:10.1016/j.aquaculture.2014.03.030 |
Lavilla-Pitogo CR, Baticados MCL, Cruz-Lacierda ER, et al. Occurrence of luminous bacterial disease of Penaeus monodon larvae in the Philippines. Aquaculture, 1990, 91(1-2): 1-13 DOI:10.1016/0044-8486(90)90173-K |
Liu Y, Zhang Y, Zhang HP. Evaluating methods of probiotic's safety in the world. Journal of Chinese Institute of Food Science and Technology, 2011, 11(6): 141-151 [刘勇, 张勇, 张和平. 世界益生菌安全性评价方法. 中国食品学报, 2011, 11(6): 141-151] |
Ng WL, Bassler BL. Bacterial quorum-sensing network architectures. Annual Review of Genetics, 2009, 43: 197-222 DOI:10.1146/annurev-genet-102108-134304 |
Pan J, Huang T, Yao F, et al. Expression and characterization of aiiA gene from Bacillus subtilis BS-1. Microbiological Research, 2008, 163(6): 711-716 DOI:10.1016/j.micres.2007.12.002 |
Song ZF, Fan B, Guo J, et al. Screening and identification of Bacillus to inhibit quorum sensing. Acta Hydrobiologica Sinica, 2013, 37(6): 1059-1065 [宋增福, 范斌, 郭婧, 等. 具有群体感应抑制效果芽孢杆菌的筛选与鉴定. 水生生物学报, 2013, 37(6): 1059-1065] |
Soto-Rodriguez SA, Gomez-Gil B, Lozano-Olvera R, et al. Field and experimental evidence of Vibrio parahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp (Litopenaeus vannamei) in Northwestern Mexico. Applied and Environmental Microbiology, 2015, 81(5): 1689-1699 DOI:10.1128/AEM.03610-14 |
Tang K, Zhang Y, Yu M, et al. Evaluation of a new high-throughput method for identifying quorum quenching bacteria. Scientific Reports, 2013, 3: 2935 DOI:10.1038/srep02935 |
Tinh NTN, Asanka Gunasekara R, Boon N, et al. N-acyl homoserine lactone-degrading microbial enrichment cultures isolated from Penaeus vannamei shrimp gut and their probiotic properties in Brachionus plicatilis cultures. FEMS Microbiology Ecology, 2007, 62(1): 45-53 DOI:10.1111/j.1574-6941.2007.00378.x |
Tinh NTN, Dung NV, Thuy VT, et al. Inhibition of quorum sensing-mediated bioluminescence in Vibrio harveyi by a recombinant AHL-lactonase from Bacillus cereus. Journal of Pure and Applied Microbiology, 2014, 8: 353-360 |
Trenzado C, Hidalgo M C, García-Gallego M, et al. Antioxidant enzymes and lipid peroxidation in sturgeon Acipenser naccarii and trout Oncorhynchus mykiss. A comparative study. Aquaculture, 2006, 254(1-4): 758-767 |
Trentin DS, Gorziza DF, Abraham WR, et al. Antibiofilm activity of Cobetia marina filtrate upon Staphylococcus epidermidis catheter-related isolates. Brazilian Journal of Microbiology, 2011, 42(4): 1329-1333 DOI:10.1590/S1517-83822011000400013 |
Vinoj G, Vaseeharan B, Thomas S, et al. Quorum-quenching activity of the AHL-lactonase from Bacillus licheniformis DAHB1 inhibits Vibrio biofilm formation in vitro and reduces shrimp intestinal colonisation and mortality. Marine Biotechnology, 2014, 16(6): 707-715 DOI:10.1007/s10126-014-9585-9 |
Wang L, Wang YG, Zhang Z, et al. Diversity and drug resistance of bacterial pathogens isolated from bacterial ascetic disease in cultured turbot Scophthalmus maximus. Progress in Fishery Sciences, 2017, 38(4): 17-24 [王岚, 王印庚, 张正, 等. 养殖大菱鲆(Scophthalmus maximus)腹水病的病原多样性及其耐药性分析. 渔业科学进展, 2017, 38(4): 17-24] |
Wang XL, Ma S, Shan HW. Safety evaluation of two probiotics strains and their effects on the immunity and the ability of anti-WSSV of Litopenaeus vannamei. Journal of Ocean University of China(Natural Science), 2016, 46(10): 39-47 [王晓琳, 马甡, 单洪伟. 两株潜在益生菌安全性评价及其对凡纳滨对虾免疫力和抗WSSV能力影响. 中国海洋大学学报(自然科学版), 2016, 46(10): 39-47] |
Wang Y, Yu YM, Zhang JJ, et al. Exploitation and application of quorum sensing and quorum quenching in marine microorganism. Biotic Resources, 2017, 39(6): 413-422 [王岩, 于雅萌, 张静静, 等. 海洋微生物群体感应与群体感应淬灭的开发利用. 生物资源, 2017, 39(6): 413-422] |
We C, Yu P, Yu MC, et al. Preliminary study of screening and characteristics of strains with quorum sensing inhibition activity in shrimp culture environment. South China Fisheries Science, 2018, 14(1): 27-34 [韦存, 于鹏, 于明超, 等. 对虾养殖体系中细菌群体感应抑制菌株的筛选及其特性初步研究. 南方水产科学, 2018, 14(1): 27-34] |
Whiteley M, Diggle SP, Greenberg EP. Progress in and promise of bacterial quorum sensing research. Nature, 2017, 551(7680): 313-320 DOI:10.1038/nature24624 |
Xu WJ, Pan LQ. Enhancement of immune response and antioxidant status of Litopenaeus vannamei juvenile in biofloc-based culture tanks manipulating high C/N ratio of feed input. Aquaculture, 2013, 412-412: 117-124 |
Yao CL, Ji PF, Wang ZY, et al. Molecular cloning and expression of NOS in shrimp, Litopenaeus vannamei. Fish and Shellfish Immunology, 2010, 28(3): 453-460 DOI:10.1016/j.fsi.2009.12.002 |
Ye YF, Li QQ, Yuan GQ, et al. Optimization of culture medium and fermentation conditions for high production of antimicrobial substance by Bacillus subtilis strain B47. Microbiology China, 2011, 38(9): 1339-1346 [叶云峰, 黎起秦, 袁高庆, 等. 枯草芽孢杆菌B47菌株高产抗菌物质的培养基及发酵条件优化. 微生物学通报, 2011, 38(09): 1339-1346] |
Yu M, Liu N, Zhao YB, et al. Quorum quenching enzymes of marine bacteria and implication in aquaculture. Journal of Ocean University of China(Natural Science), 2018, 48(S1): 34-43 [于敏, 刘娜, 赵友彬, 等. 海洋细菌密度感应淬灭酶及在水产养殖中的应用. 中国海洋大学学报(自然科学版), 2018, 48(S1): 34-43] |
Zhang HH, Wang XH, Li C, et al. Isolation and identification of a bacterial strain with Vibrios-antagonism from shrimp ponds. Progress in Fishery Sciences, 2016, 37(3): 85-92 [张欢欢, 王秀华, 李晨, 等. 对虾养殖池中一株弧菌拮抗菌的分离鉴定. 渔业科学进展, 2016, 37(3): 85-92] |



