2. 鲁东大学农学院 烟台 264025;
3. 威海市渔业技术推广站 威海 264200;
4. 上海海洋大学水产与生命学院 上海 201306
2. College of Agriculture, Ludong University, Yantai 264025;
3. Weihai Fisheries Technology Extension Station, Weihai 264200;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
近年来,随着市场需求的增加,刺参养殖业发展迅速,但养殖效率不高、良种匮乏、生长性状稳定性较差等一直影响刺参产业的发展(曲洪霞等, 2016),因此,不同品种和品系的刺参逐步进入养殖和消费市场。俄罗斯红参(Apostichopus japonicus)简称“红参”,原产于俄罗斯远东近海,是本地刺参的地理远缘种,由于环境及摄食等因素体表呈红棕色。海参崴附近纬度高,海水温度较低,食物较少,俄罗斯红参生长缓慢,代谢及生命力较为旺盛,且体积略小,被认为其体内可以积蓄更多营养(关崇新等, 2015)。目前,俄罗斯红参已引入我国养殖。
线粒体基因组(mtDNA)为闭合的环状双链结构,大部分动物的mtDNA由37个基因与1段长度可变的控制区组成,基因排列较为保守,结构相对紧凑。mtDNA遗传方式为母性遗传方式,不存在双亲遗传的遗传差异,很少发生重组,无组织特异性,易于取材与测序分析(康立森, 2018)。相比核基因组,mtDNA的分子量相对较小,仅占细胞的1%,易于分离纯化。具有选择压力更小、结构相对稳定、编码速率更快等特点(赵娜娜, 2013)。线粒体DNA包含更全面的信息,利用其进行系统进化分析的可信度更高(Cui et al, 2009)。目前,针对水产动物mtDNA已有大量研究,但海参mtDNA的研究较少。俄罗斯红参与普通养殖刺参在生长及营养含量方面稍有差异,为了解俄罗斯红参在遗传上的特点及其与其他海参间的差异,本研究对俄罗斯红参线粒体全基因组进行测序,分析其线粒体基因组的构成及其系统发育关系,为海参线粒体基因组的研究及后续俄罗斯红参的种质创新应用提供遗传数据基础。
1 材料与方法 1.1 样品采集实验所用俄罗斯红参取自山东华春渔业有限公司,2010年引入,养殖于黄河三角洲滩涂区刺参池塘,持续进行生长性状的养殖选育。2017年11月取样,数量为20个,参龄约为1年半,平均体质量为(48.96±7.56) g。清洗、解剖并取肌肉部分,将所取组织送至上海天昊生物公司进行测序。
1.2 实验方法 1.2.1 基因组DNA提取及质量检测本实验取约30 mg肌肉组织,按常规酚–氯仿法获得俄罗斯红参总DNA。使用NanoDrop检测样品的浓度和纯度;琼脂糖凝胶电泳检测样品的完整度。
1.2.2 随机文库构建及PCR扩增DNA文库采用转座酶建库试剂盒构建随机测序文库。利用转座酶随机打断DNA,同时在片段两端加接头,并使用高保真聚合酶扩增原始文库,利用PCR(扩增循环数控制在12~15之间)在文库两端引入特异性标签(Index)和测序接头。
1.2.3 文库片段筛选及质量检测使用Agencourt SPRIselect核酸片段筛选试剂盒纯化放大的文库,同时筛选片段的大小。采用两步法筛选(Double size selection),先用SPRI磁珠去掉目标区域左侧小片段(Left-side sizes election),再除去位于目标片段区域右侧的大片段(Right-side size selection),最终筛选片段峰值在300 bp的测序文库。使用Qubit准确定量文库浓度,均匀混合样品,确保每个样本的数据量合适均衡。并用Agilent 2100 Bioanalyzer确定文库片段大小分布,评估是否适合上机。
1.2.4 混样并进行上机测序将质检合格的样品稀释,以等摩尔数对多个样品混样并上机。使用Illumina Hiseq平台,以2×150原始双端测序策略来测序文库。
1.3 数据处理所用序列经串联后,使用BioEdit 7.0.9(Hall, 1999)软件中的ClustalW进行序列比对,利用软件Gblocks 0.91b (Castresana 2000)去除不可信区间。利用Mega 4.0软件统计碱基组成、密码子使用等。使用tRNAscanSE在线网站(http://lowelab.ucsc.edu/tRNAscan-SE/)预测tRNA的二级结构。
1.4 系统发生分析本研究使用俄罗斯红参、半索动物门及棘皮动物门共28个物种的线粒体序列构建系统发生树,线粒体序列为13个蛋白编码基因串联的氨基酸序列与核苷酸序列,线粒体序列均从NCBI获得(表 1)。以半索动物门的囊舌虫(Saccoglossus kowalevskii)与肉花柱头虫(Balanoglossus carnosus)为外类群,将处理后的核苷酸序列使用jModelTest2.1.5 (2014)软件AIC标准选择出最佳替代模型为GTR+F+R5,氨基酸序列使用ProtTest 2.4 (Abascal et al, 2005)软件AIC标准选择出最佳替代模型为CpREV+I+G+F,根据最佳模型使用应用最大似然法PhyML3.0 (http://www.atgcmontpellier.fr/phyml/?tdsourcetag=s_pcqq_aiomsg)构建系统发生树。最大似然法节点的支持度通过1000次重抽样获得。
|
|
表 1 构建系统发生树所用物种及其GenBank号 Tab.1 The GenBank number of the species used to construct the phylogenetic tree |
提取的俄罗斯红参DNA浓度≥20 ng/µl,总量≥100 ng,OD260 nm/OD280 nm=1.8~2.2;基因组DNA主带清晰可见,无明显降解弥散存在,可用于下一步实验。
2.2 测序质量测序获得序列根据比对结果(表 2),Q20=94.42%, Q30=88.13%测序错误率在正常范围内,测序结果可进行后续分析。
|
|
表 2 比对结果统计 Tab.2 Statistics of comparison results |
本研究测得俄罗斯红参线粒体基因组全长为16111 bp,共含有37个基因(图 1),为环状DNA结构,与目前已知的棘皮动物相似。37个基因(表 3)包括13个蛋白编码基因、22个tRNA基因、2个核糖体RNA基因。13个蛋白编码基因由11个电子传递系统的基因(复合体Ⅰ、复合体Ⅳ、Cytb基因)与2个氧化磷酸化基因(ATP6、ATP8)组成,其中包括7个还原酶复合体的亚单位复合体Ⅰ(ND4L、ND1、ND2、ND3、ND4、ND5和ND6)、3个氧化酶的亚单位复合体Ⅳ基因(COX1、COX2和COX3)、1个细胞色素b基因(Cytb)、2个ATP合成酶基因(ATP6和ATP8)。除tRNA-Gln、tRNA-Ala、tRNA-Val、tRNA-Asp和tRNA-Ser与ND6位于L链外,其他基因均位于H链上。

|
图 1 俄罗斯红参线粒体基因组结构 Fig.1 Gene organization of Russian red sea cucumber mitochondrial genome |
|
|
表 3 俄罗斯红参线粒体基因组中基因位置及特征 Tab.3 Localization and features of genes in the mitochondrial genome of Russian red sea cucumber |
俄罗斯红参线粒体的基因间隔较多,共存在24处基因间隔(表 3),tRNA-Thr与tRNA-Pro间隔最大为460 bp,占全长序列的2.86%,其次为ND6与ND5基因间隔,为189 bp,以及ND4与ND3间隔为181 bp。全序列共存在5处基因重叠区,在tRNA-Pro与tRNA-Gln之间存在4 bp的重叠,l-rRNA与COX1之间存在6 bp的重叠,COX3与tRNA-Ser存在3 bp的重叠。ND4与tRNA-His间存在10 bp的重叠,tRNA-His与tRNA-Ser2间存在1 bp的重叠。
2.3.3 碱基含量线粒体基因全序列碱基组成中,A、G、C和T分别为31.79%、17.87%、20.17%和30.17%。A+T和C+G含量分别为61.96%和38.04%,A+G含量高于G+C,表现为较强A、T偏倚。蛋白编码基因碱基组成中,A、T、C和G含量分别为30.03%、31.34%、20.89%和17.74%,A+T和C+G的含量分别为61.37%和38.63%,蛋白编码基因的碱基使用与全序列相似,均表现出A、T偏倚。
2.4 蛋白编码基因的密码子使用13个编码蛋白基因全长为10868 bp,占全序列的67.5%,共编码3186个氨基酸(除终止密码子外)。氨基酸编码频率最高为丝氨酸Ser(S),其次为亮氨酸Leu(L)。使用Mega软件统计密码子使用情况(表 4),13个编码蛋白基因的密码子完整,且存在30个偏好密码子,其中第3位点对A或T(U)的使用频率较高。除ND1以GTG为起始密码子,其他均以ATN为起始密码子。ND2、ND4L、COX2,ATP8、COX3、ND3、ND5和Cytb起始密码子为ATG,COX1、ATP6和ND6以ATT为起始密码子,而ND4以ATA为起始密码子。终止密码子都是完整密码子,除ND2与ND4的终止密码子分别为TTG与TAG外,其他终止密码子以TAA为主。
|
|
表 4 俄罗斯红参线粒体全基因组编码蛋白基因密码子使用情况 Tab.4 Codon usage of the protein-coding genes in Russian red sea cucumber mitogenome |
俄罗斯红参mtDNA序列包含22个tRNA,长度范围为66~72 bp,tRNA-Gln、tRNA-Ala、tRNA-Val、tRNA-Asp和tRNA-Ser位于轻链,其他tRNA位于重链。tRNA-Ser与tRNA-Leu各重复1次,最小的为tRNA-Cys,最大的为tRNA-Leu和tRNA-Ser。除1个tRNA-Ser2缺少D环,无法形成三叶草结构,其他tRNA使用tRNAscanSE在线软件预测tRNA的二级结构均为三叶草结构(图 2),包括受体臂、TΨC臂、反密码子臂,D臂。受体臂:tRNA-Met、tRNA-Gly和tRNA-Ala发生1对碱基错配,tRNA-Tyr插入1个碱基,tRNA-Arg发生2对碱基错配。TΨC臂碱基组成变化不大,tRNA-Cys、tRNA-His在TΨC臂上存在4对碱基,其他为5对。D臂:tRNA-Ile只有1对碱基,tRNA-Gly、tRNA-Leu、tRNA-Tyr、tRNA-Leu2、tRNA-Thr、tRNA-Gln和tRNA-Val为3对碱基,其他均为4对。反密码子臂:tRNA-Pro存在1对碱基错配,tRNA-Lys、tRNA-Asp、tRNA-Ser、tRNA-Tyr的反密码子臂存在4对碱基,其他tRNA为5对。
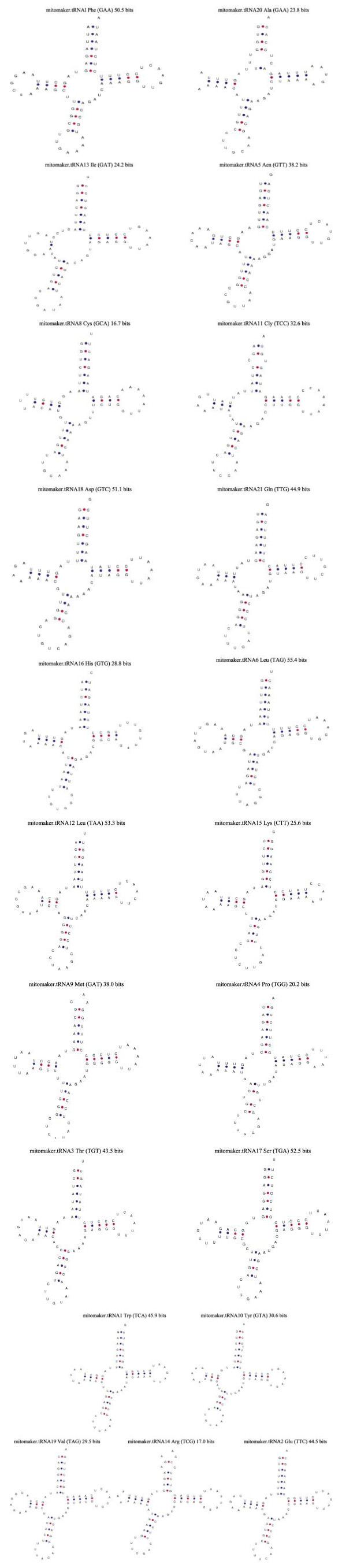
|
图 2 俄罗斯红参的tRNA的二级结构 Fig.2 The secondary structure of tRNA genes from Russian red sea cucumber |
俄罗斯红参线粒体全基因组中只存在2个rRNA,分别是位于tRNA-Phe与tRNA-Glu之间的s-rRNA和位于tRNA-Ile与COX1之间的l-rRNA。s-rRNA位于H链,长度为731 bp,碱基A、G、C和T的含量分别为37.76%、18.74%、18.74%和23.12%,A+T为60.88%。l-rRNA位于H链上,长度为1516 bp。碱基A、G、C和T的含量分别为37.86%、19.92%、18.14%、24.08%,A+T的含量为61.94%。2个基因的长度和位置不相同,但对碱基的使用相似。
2.7 基因排列比较从NCBI下载的动物线粒体编码蛋白基因顺序与所测俄罗斯红参序列对比(图 3),发现这些物种间基因排列顺序有一定相似性。俄罗斯红参与海参纲(Holothuroidea)及海胆纲(Echinoidea)基因排列顺序相同,海星纲(Asteroidea)与海百合纲(Crinoidea)中的花形羽枝(Florometra serratissima)、栉羽星(Phanogenia gracilis)及蛇尾纲(Ophiuroidea)中的紫蛇尾(Ophiopholis aculeata)基因排列顺序相同,白色真蛇尾(Ophiura albida)与灰色真蛇尾(Ophiura lutkeni)基因排列顺序相同。俄罗斯红参、海参纲、海胆纲与海星纲等相同基因排序的物种共享COX1-ND4L-COX2- ATP8-ATP6-COX3-ND3-ND4-ND5-ND6-CYTB基因模块,与白色真蛇尾和灰色真蛇尾共享COX1-ND4L- COX2-ATP8-ATP6-COX3-ND3-ND4-ND5-ND6基因模块。几乎每个物种都与其他物种间共享某些特定模块,最多为海百合(Neogymnocrinus richeri)与肉花柱头虫,存在ND1-COX1-COX2-ATP8-ATP6、COX3- ND3和ND4-ND5共3个基因模块,并与海星纲等相同基因排序物种共享ND1-COX1、COX2-ATP8-ATP6、COX3-ND3-ND4-ND5-ND6-CYTB-ND2共3个基因模块,剩余物种都同其他物种存在共享特定模块。

|
图 3 基因排列对比 Fig.3 Gene arrangement contrast |
根据不同种类海参及不同地理分布刺参的线粒体核苷酸序列,利用Mega软件计算遗传距离,使用Kimura-2-parameter计算其遗传距离(表 5)。结果显示,俄罗斯红参与所选海参的遗传距离范围为0.017~ 0.385,相较其他海参的遗传距离,俄罗斯红参与青岛仿刺参、威海仿刺参和大连仿刺参间的遗传距离更为接近,分别为0.017、0.019和0.021。
|
|
表 5 不同海参核苷酸序列的遗传距离 Tab.5 Genetic distances of nucleotide sequences of different sea cucumbers |
将俄罗斯红参线粒体全序列与NCBI上的物种比对(表 6),结果显示,其与同名物种的相似率达98%以上,与同源性最高的仿刺参(GenBank序列号:AB525437.1)的相似性为99.59%,存在24处碱基的插入与缺失(图 4),突变的基因存在转换与颠换,其中,保守位点16024个,变异位点81个,变异位点约占分析位点的0.5%。
|
|
表 6 俄罗斯红参BLAST分析表 Tab.6 Analysis of on Russian red sea cucumber BLAST |
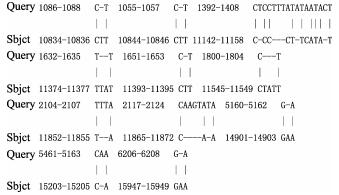
|
图 4 BLAST比对碱基的缺失与插入 Fig.4 Deletion and insertion of alignment bases by BLAST Query为俄罗斯红参序列,Sbjct为参考序列 Query is Russian red sea cucumber sequence, and Sbjct is the reference sequence |
基于表 1及俄罗斯红参的蛋白编码基因的氨基酸序列,利用最大似然法构建系统发生树(图 5),结果显示,海百合纲聚为一枝。俄罗斯红参与具疣拟刺参(P.parvimensis)聚为一枝,并与海参纲其他物种以及多棘槭海星(Astropecten polyacanthus)、蓝海燕(Patiria pectinifera)、灰色真蛇尾、紫蛇尾聚为一大枝。海星纲的长棘海星(Acanthaster planci)、棘冠海星(Acanthaster brevispinus)、砂海星(Luidia quinaria)、多棘海盘车(Asterias amurensis)与海胆科(Temnopleuridae)聚为一大枝。基于表 1及俄罗斯红参的蛋白编码基因核苷酸序列,利用最大似然法构建系统发生树(图 6),结果显示,俄罗斯红参与3个海域的仿刺参聚为一枝,这4种海参再与海参纲的其他物种聚为一大枝,并与海百合纲4个物种构成姊妹群。海星纲与海胆纲构成姊妹群。蛇尾纲聚为一枝。
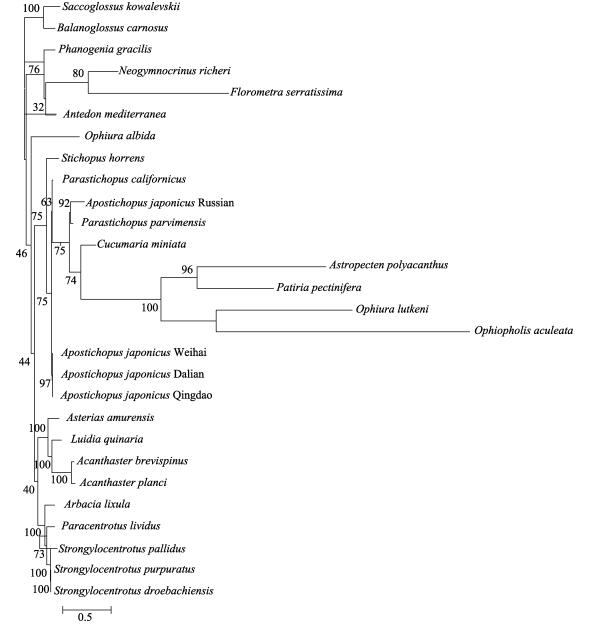
|
图 5 氨基酸序列基于最大似然法构建的系统发生树 Fig.5 Phylogenetic tree of amino acid sequences based on maximum likelihood method |
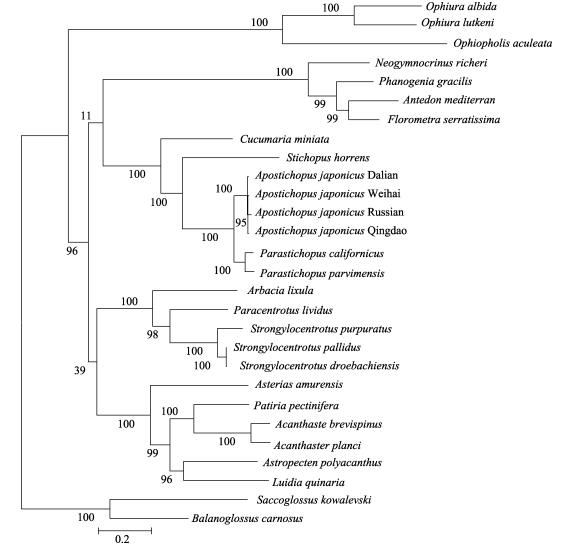
|
图 6 核苷酸序列基于最大似然法构建系统发生树 Fig.6 Phylogenetic tree of nucleotide sequences based on maximum likelihood method |
本研究通过高通量测序技术对俄罗斯红参的线粒体基因组进行随机测序并分析,利用线粒体序列进行系统发生分析,结果发现,俄罗斯红参与棘皮动物门下的其他动物存在较高的相似性,均存在37个基因(13个蛋白编码基因、2个rRNA以及22个tRNA基因),31个基因编码在H链上,5个tRNA (RNA-Gln、tRNA-Ala、tRNA-Val、tRNA-Asp和tRNA-Ser)和1个蛋白编码基因(ND6)编码在L链上。基因的组成与分布情况均与孙秀俊(2013)所研究的刺参完全相同。全序列与蛋白编码基因的A、T碱基含量同大部分后生动物一样存在A、T偏向性(付婉莹, 2015),分别为61.96%与61.37%,且同脊椎及无脊椎动物的mtDNA蛋白编码基因的第3位点也存在明显的A、T偏向性,但碱基的含量存在差异,A、T含量因物种的差异略有不同。
俄罗斯红参的13个蛋白编码基因的密码子使用分析表明,除ND1以GTG为起始密码子外,其他均以ATN为起始密码子。终止密码子与大连仿刺参(李云峰等, 2012)相同,均为完整密码子,大多以TAA为主。基因重叠区与基因间隔区同糙刺参(Stichopus horrens)(范嗣刚等, 2011)及某些水产动物线粒体相似(李亚莉, 2012; 袁亮等, 2015)。22个tRNA中除tRNA-Ser外,其余的tRNA均能预测其三叶草结构,这同魏峦峦等(2011)研究的瘤背石磺(Onchidium struma) tRNA一样,都是由于缺少D臂而无法预测其结构,Cheng等(2012)证明了缺失D臂并不会影响其进入核糖体及转运氨基酸等功能;相比细胞质中tRNA,线粒体中的tRNA存在差异,在受体臂与反密码子臂等部分均有碱基错配的情况。此外,俄罗斯红参的tRNA(tRNA-Cys、tRNA-Trp、tRNA-Ala、tRNA-Leu和tRNA-Asn)同某些后生动物一样,均出现簇集现象,即几个tRNA集中在一起的现象。tRNA的重复与闫锦锦(2014)所研究的光唇鱼(Acrossocheilus fasciatus)相同,皆存在tRNA-Ser与tRNA-Leu基因重复1次。俄罗斯红参的2个rRNAs (s-rRNA和l-rRNA)及位置均与申欣等(2011)研究的威海仿刺参和范嗣刚等(2011)研究的糙刺参相同。线粒体基因组排列顺序在研究系统进化关系等方面起着重要作用(李石磊等, 2015),俄罗斯红参线粒体编码基因的排列与大部分棘皮动物具有一定相似性,且与其他物种共享基因模块。
线粒体基因组数据广泛应用于系统进化生物学、保护生物学及种质鉴定等领域的研究,如利用线粒体基因组中的COⅠ及16S rRNA进行分子标记对海参品种及产品进行鉴别(Wen et al, 2013)。An等(2013)对韩国红海参野生种群与养殖种群进行微卫星位点多重分析,发现两种群间存在高水平的多态性及遗传异质性。本研究通过对所选海参的核苷酸序列进行遗传距离分析,发现俄罗斯红参与3个海域的仿刺参较为接近,与青岛仿刺参遗传距离最近,为0.017。将俄罗斯红参的线粒体全序列进行BLAST分析,与仿刺参(GenBank序列号:AB525437.1)的相似度为99.59%。基于28个物种的编码蛋白基因的氨基酸及核苷酸序列,利用最大似然法分别构建系统发生树,结果发现,2种方法所建的发生树有一定相似性,但在俄罗斯红参与其他海参聚簇上存在差异。在利用核苷酸构建的系统发生树中,俄罗斯刺参与3个海域的仿刺参聚支的节点的自展值(bootstrap值)都在95%以上,具有较高可信性;利用氨基酸构建系统发生树在较远距离的系统进化分析中更具有优势和可信性。通常考虑这2种序列的进化信息,才可能得到更自然的系统发生关系,本研究中核苷酸序列建树结果与传统分类学更为相似。
目前,利用物种线粒体全基因组序列的测定与分析已成为研究物种进化必不可少的手段,广泛应用于各个领域。通过对线粒体基因组的比对和分析,为种质鉴定、地理种群划分和亲缘关系鉴定等提供基础信息。本研究对引入养殖的俄罗斯红参线粒体全基因组进行随机测序,分析发现,其基因结构、碱基含量、密码子、tRNA、rRNA、基因间隔与重叠、组成排列等皆与棘皮动物相似;遗传距离及BLAST分析发现,俄罗斯红参与仿刺参较为接近。本研究中,俄罗斯红参为引入养殖,作为刺参的地理远缘种,其遗传特点、结构等方面与仿刺参差异较小,具有较高相似性。本研究可为引入养殖俄罗斯红参进一步的遗传系统进化和分类等研究提供资料,同时,对后续俄罗斯红参养殖的推广发展和种质创新与应用提供参考。
Abascal F, Zardoya R, Posada D. ProtTest: Selection of best-fit models of protein evolution. Bioinformatics, 2005, 21(9): 2104-2105 DOI:10.1093/bioinformatics/bti263 |
An HS, Lee JW, Hong SW, et al. Genetic differences between wild and hatchery populations of red sea cucumber (Stichopus japonicus) inferred from microsatellite markers: Implications for production and stocking programs design. Genes and Genomics, 2013, 35(6): 709-717 DOI:10.1007/s13258-013-0139-8 |
Cheng Y, Wang R, Sun Y, et al. The complete mitochondrial genome of the small yellow croaker and partitioned Bayesian analysis of Sciaenidae fish phylogeny. Genetics and Molecular Biology, 2012, 35(1): 191-199 DOI:10.1590/S1415-47572012005000006 |
Cui Z, Liu Y, Lic P, et al. The complete mitochondrial genome of the large yellow croaker, Larimichthys crocea (Perciformes, Sciaenidae): Unusual features of its control region and the phylogenetic position of the Sciaenidae. Gene, 2009, 432(1-2): 33-43 DOI:10.1016/j.gene.2008.11.024 |
Fan SG, Hu CQ, Wen J, et al. Mitochondrial genome of Stichopus horrens and a new genetic sequence. Scientia Sinica (Vitae), 2011, 41(4): 281-288 DOI:10.1360/zc2011-41-4-281 |
范嗣刚, 胡超群, 文菁, 等. 糙刺参(Stichopus horrens)线粒体基因组及一种新的基因排列顺序. 中国科学:生命科学, 2011, 41(4): 281-288 |
Fu WY. The study on microstructure of spines from four sea urchins and phylogenetic based on complete mitochondrial genome. Masterxs Thesis of Ocean University of China, 2015
|
付婉莹.四种海胆棘的显微结构和基于线粒体基因组全序列的系统发育学研究.中国海洋大学硕士研究生学位论文, 2015
|
Guan CX, Diao QP, Hou DY, et al. Study on fatty acids in Russian sea cucumbers by GC-MS. Journal of Anshan Normal University, 2015, 17(4): 33-35 |
关崇新, 刁全平, 侯冬岩, 等. 俄罗斯海参脂肪酸的气相色谱-质谱分析. 鞍山师范学院学报, 2015, 17(4): 33-35 |
Hall TA. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium Series, 1999, 41: 95-98 |
Kang LS. Phylogenetic analysis of the family Loliginidae based on complete mitochondrial sequences. Masterxs Thesis of Zhejiang Ocean University, 2018
|
康立森.基于mtDNA全基因组探究枪乌贼科的系统发生关系.浙江海洋大学硕士研究生学位论文, 2018
|
Li SL, Zhang M, Wang QZ, et al. Gene order, characteristics and phylogenetic analysis of mitochondrial genomes in sixteen members in Annelida. Fisheries Science, 2015, 34(2): 104-112 |
李石磊, 张明, 王庆志, 等. 16种环节动物线粒体基因排列、特征比较及系统发育分析. 水产科学, 2015, 34(2): 104-112 |
Li YF, Li MY, Wang J, et al. Comparative structure of complete mitochondrial genome in sea cucumber Apostichopus japonicus. Fisheries Science, 2012, 31(8): 454-462 |
李云峰, 李梦遥, 王健, 等. 仿刺参线粒体全基因组序列结构及比较研究. 水产科学, 2012, 31(8): 454-462 |
Li YL. Mitochondrial complete genome determination and molecular evolution analysis of three Schizothoracinaes in Qinghai-Tibet Plateau. Doctoral Dissertation of Fudan University, 2012
|
李亚莉.青藏高原三种裂腹鱼线粒体全基因组的测定及分子进化分析.复旦大学博士研究生学位论文, 2012
|
Qu HX, Liu XT, Yang YN. Problems and countermeasures in the development of sea cucumber industry. Agriculture and Technology, 2016, 36(22): 138 |
曲洪霞, 刘心田, 杨燕妮. 刺参产业发展存在的问题及应对措施. 农业与技术, 2016, 36(22): 138 |
Shen X, Tian M, Cheng HL, et al. Characteristics and exploration of molecular markers in Holothuroidea mitochondrial genomes. Fisheries Science, 2011, 30(7): 400-404 |
申欣, 田美, 程汉良, 等. 海参纲线粒体基因组特征分析及分子标记探讨. 水产科学, 2011, 30(7): 400-404 |
Sun XJ. Studies on larval development and genetics and breeding in the sea cucumber Apostichopus japonicus. Doctoral Dissertation of Ocean University of China, 2013
|
孙秀俊.刺参的幼体发育与遗传育种学研究.中国海洋大学博士研究生学位论文, 2013
|
Wei LL, Shen HD, Zhang Y, et al. Analysis of complete mitochondrial genome of Onchidium struma (Mollusca: Gastropoda: Pulmonata: Onchidiidae). Journal of Fisheries of China, 2011, 35(4): 493-500 |
魏峦峦, 沈和定, 张雨, 等. 瘤背石磺线粒体基因组全序列分析. 水产学报, 2011, 35(4): 493-500 |
Wen J, Hu CQ, Zhang LP, et al. Corrigendum to "Genetic identification of global commercial sea cucumber species on the basis of mitochondrial DNA sequences". Food Control, 2011, 22: 72-77 DOI:10.1016/j.foodcont.2010.06.010 |
Yan JJ. Sequence and organization of Acrossocheilus fasciatus andZacco platypus complete mitochondrial genome. Masterxs Thesis of Anhui Normal University, 2014
|
闫锦锦.光唇鱼和宽鳍鱲线粒体全序列测定及分析.安徽师范大学硕士研究生学位论文, 2014
|
Yuan L, Li WY, Ye XF, et al. Analysis of population genetic diversity of Ranodon sibiricus in China inferred from mitochondrial DNA control region. Journal of Xiamen University (Natural Science), 2015, 54(2): 194-198 |
袁亮, 李伟业, 叶小芳, 等. 基于线粒体DNA控制区的新疆北鲵种群遗传多样性分析. 厦门大学学报(自然科学版), 2015, 54(2): 194-198 |
Zhao NN. Cryptic species of China Coelomactra antiqvata based on complete mitochondrial genomic evidence. Masterxs Thesis of Nanjing Agricultural University, 2013
|
赵娜娜.中国西施舌隐种的线粒体全基因组证据.南京农业大学硕士研究生学位论文, 2013
|



