2. 上海海洋大学 大洋渔业资源可持续开发省部共建教育部重点实验室 国家远洋渔业工程技术研究中心 农业农村部大洋渔业开发重点实验室心 上海 201306
2. Shanghai Ocean University; Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education; National Engineering Research Center for Oceanic Fisheries; Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306
鸢乌贼(Sthenoteuthis oualaniensis)为暖水性较强的大洋性种类,为重要的头足类渔业捕捞对象,主要有4个渔场:琉球群岛渔场、台湾西南渔场、亚丁湾渔场和印度洋西北海域渔场(陈新军等, 2009)。鸢乌贼在南海的资源量丰富,具有较大开发潜力(Jereb et al, 2005; 张俊等, 2014),尤其在金乌贼(Sepia esculenta) (李达等, 2017)等沿海渔业资源衰退的背景下更具开发价值。在声学调查中发现,不同季节的南海鸢乌贼资源量波动明显,该种群资源的变动机制既与栖息地的洋流、海水温度、营养丰度等相关(陈新军等, 2005),也受其自身的繁殖特性和洄游习性等内在机理的影响调节(Stearns, 1992; McGraw et al, 1996)。同时,鸢乌贼在南海生态系统中占据着重要位置,既是多种浮游动物和小型游泳动物的捕食者,也是多种大型游泳动物的饵料来源,起着连接低营养级和高营养级的桥梁作用(Wormuth, 1976; Wetherall, 1991; Ménard et al, 2007)。鸢乌贼主要存在5个群体,其中,微型群主要分布于赤道海域(Nesis, 1977),在南海和印度洋海域均有分布。
繁殖是生物体生活史的关键阶段,了解每个物种的生殖特征是揭示其整个生命周期的关键(王腾等, 2013; 滕广亮等, 2018)。头足类(除鹦鹉螺属外)寿命短、终生1次繁殖,其产卵策略具有很高的属种特殊性和环境适应性(Nigmatullin et al, 2009)。鸢乌贼的交配活动发生于海表面,以抱头式的方式完成(童逸修, 1976),卵巢中的卵母细胞数量巨大,输卵管1次储存的卵子并不能将其全部排出(Harman et al, 1989),而是分批次排出。1个产卵周期的卵子可能以众多卵块的形式排出(Chembian, 2013)。繁殖力作为产卵策略的重要性状之一,决定着补充群体的大小,是种群资源评估的关键参数(Stearns, 1992; McGraw et al, 1996)。目前,关于南海鸢乌贼的研究,多集中在资源评估(Jereb et al, 2005; 张俊等, 2014)、渔场环境(范江涛等, 2016)、摄食生态(颜云榕等, 2012; 龚玉艳等, 2016、2018)、种群结构(张鹏等, 2015)和生长发育(招春旭等, 2017)等方面,个体繁殖力及卵母细胞发育模式方面的研究则鲜有报道。本研究根据2017年在我国南海海域采集的鸢乌贼样本,进行微型群雌性个体的繁殖力研究,分析该群体的潜在繁殖力、分批繁殖力、卵母细胞大小及其发育成熟模式,以期探索其产卵策略,进一步丰富鸢乌贼的繁殖生物学研究,为可持续开发和管理南海鸢乌贼资源提供科学基础。
1 材料与方法 1.1 材料来源本研究的鸢乌贼样本采自我国南海海域作业的灯光罩网船渔获物(111°15′36″~115°52′12″E,9°11′16″~ 11°22′55″N);采集时间为2017年6~7月。样本采集后,经–20℃冷冻保藏运回实验室。
1.2 生物学测定样本在实验室常温解冻后,进行胴长(Mantle length, ML)、体重(Body weight, BW)、卵巢重、输卵管重、性腺成熟度等生物学测定。长度测定精确到1 mm,重量测定精确到0.1 g。性腺成熟度划分参照林东明等(2014),结合实验样本观察,划分为Ⅰ~Ⅷ共8个时期,其中,Ⅰ和Ⅱ期为发育前期,卵巢呈现透明或白色;Ⅲ期为生理性发育期,卵巢中可见颗粒状的卵母细胞;Ⅳ~Ⅵ期为成熟期,卵巢发育显著,输卵管积聚成熟卵子;Ⅶ期为排卵期,卵巢膨大,鳃基部可见精荚,缠卵腺灰白变软;Ⅷ期为排卵后期,卵巢松软萎缩,可见少量卵母细胞附着于中央组织。本研究共分析微型群雌性样本84尾,各成熟度尾数分别为Ⅰ期18尾、Ⅱ期45尾、Ⅲ期3尾、Ⅳ期5尾、Ⅴ期9尾、Ⅵ期4尾。
本研究随机选取性腺成熟度为Ⅲ~Ⅵ期雌性个体21尾(Ⅲ期3尾、Ⅳ期5尾、Ⅴ期9尾、Ⅵ期4尾),进行繁殖力分析。繁殖力的测定采用重量比例法(陈新军等, 2017)。卵巢卵母细胞测定:卵巢整体称重后,随机剪取部分卵巢组织(中部位置),称重(约100 mg),并计数卵母细胞,用于换算整体卵巢的卵母细胞数量。输卵管成熟卵子测定:性腺成熟度为Ⅳ期样本的输卵管饱满程度不高,进行输卵管卵子的整体计数;性腺成熟度为Ⅴ~Ⅵ期样本,整体称量输卵管重量后,称取一定量的卵团(约100 mg),计数卵子,用于换算整体输卵管的卵子数量。卵巢卵母细胞或输卵管卵子数量的换算公式为:
| $ N = n \times W/w $ |
式中,N为卵巢卵母细胞或输卵管成熟卵子的总数量;W为卵巢总重或输卵管总重;w为选取的部分卵巢重量或输卵管卵团重量;n为选取部分卵巢组织的卵母细胞数或选取部分输卵管卵团的成熟卵子数。
单个成熟卵子重量为输卵管取样重与其卵子数量的商。
卵径的测定:计数后,卵巢卵母细胞或输卵管成熟卵子置于培养皿中,加入0.9%生理盐水,并用铁针将其分离开来,然后,置于解剖显微镜(1~6倍)下,用相配套的Digimizer Image Analysis软件拍照,并测量卵子直径,测量精确度为0.01 mm。
1.3 数据分析鸢乌贼潜在繁殖力(Potential fecundity, PF)为卵巢卵母细胞数目和输卵管成熟卵子数目之和,单位为cell。相对繁殖力(Relative fecundity, RP)为潜在繁殖力与相应个体体重的商数,单位为cell/g。潜在繁殖投入指数(Index of potential reproduction investment, PRI)为相对繁殖力与相应个体单个成熟卵子重量的乘积(Laptikhovsky et al, 1992; Nigmatullin et al, 1995; Gonzalez et al, 1996)。批次排卵量计算为性腺成熟Ⅵ期时输卵管的成熟卵子数量(Harman et al, 1989),单位为cell;并计算批次排卵量与潜在繁殖力的商数,作为潜在的排卵次数。
利用线性、幂函数和指数等函数分别拟合潜在繁殖力、相对繁殖力、潜在繁殖投入指数3项与胴长、体重的关系,选择拟合R2值最高者作为最终的拟合函数。卵巢卵母细胞的大小分布,以0.05 mm为组距来确定卵巢卵母细胞的分布特征及其生长发育模式。
数据采用Excel 2007和SPSS 20.0软件进行分析。
2 结果 2.1 潜在繁殖力和分批繁殖力分析显示,南海鸢乌贼微型群雌性个体的潜在繁殖力为1218~32843 cell,平均值为(6487±8527) cell。随着性腺发育,个体的潜在繁殖力增加显著(ANOVA: F=20.172, P < 0.01),在Ⅵ期达到最大值,为(21919± 9004) cell(表 1)。其中,随着性腺发育,卵巢卵母细胞数量增加显著(ANOVA: F=16.09, P < 0.01),在Ⅵ期时达到最值为(19629±9045) cell,占潜在繁殖力的(87.41±5.64)%。Ⅳ~Ⅵ期的输卵管成熟卵子数为113~2904 cell,占潜在繁殖力的4.09%~22.33%;成熟期后期输卵管载卵量增加迅速(ANOVA: F=98.43, P < 0.01)。根据成熟后期(Ⅵ期)个体的输卵管载卵量,微型群繁殖产卵批次为6~15次,平均为(9.87±4.36)次;批次排卵量为1895~2904 cell,占潜在繁殖力的16.45%~6.69%,平均占比为10.13%。
|
|
表 1 南海鸢乌贼微型群雌性个体不同性腺成熟度个体的潜在繁殖力 Tab.1 The potential fecundity (PF, cell) between different maturity stages of dwarf form of S. oualaniensis in the South China Sea |
随着个体的生长,微型群雌性个体的潜在繁殖力也逐步增大,与胴长和体重分别呈幂函数和线性函数关系(PF=8.578e–23ML12.926, R2=0.909; PF=986.1BW– 20512, R2=0.775)(图 1),表明,潜在繁殖力与个体大小呈正相关关系。
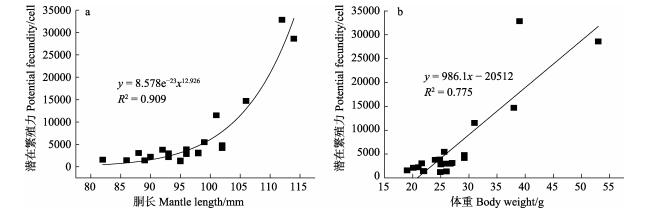
|
图 1 南海鸢乌贼微型群雌性个体潜在繁殖力与胴长(a)和体重(b)的关系 Fig.1 Relationship between potential fecundity and dorsal mantle length (a) and body weight (b) of dwarf form of S. oualaniensis in the South China Sea |
微型群雌性个体相对繁殖力为48.93~842.12 cell/g,平均值为(195.38±188.35) cell/g (表 2)。随着性腺的发育,个体相对繁殖力呈上升趋势(ANOVA:F=21.77, P < 0.01),生理发育期(Ⅲ期)为48.93~66.16 cell/g,平均值为(56.02±7.35) cell/g。性腺成熟期(Ⅳ~Ⅵ期)为63.87~842.12 cell/g,平均值为(218.60±193.91) cell/g,在Ⅴ~Ⅵ期相对繁殖力增加显著(Tukey HSD: P= 1.00)。在个体生长过程中,相对繁殖力与个体胴长呈指数函数关系(RF=0.026e0.090ML, R2=0.770),与个体体重呈线性相关关系(RF=19.61BW–341.7, R2=0.629)(图 2)。
|
|
表 2 南海鸢乌贼微型群雌性个体不同性腺成熟度个体的相对繁殖力 Tab.2 The relative fecundity (RF, cell/g) between different maturity stages of dwarf form of S. oualaniensis in the South China Sea |
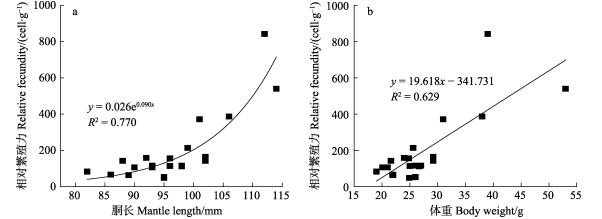
|
图 2 南海鸢乌贼微型群雌性个体相对繁殖力与胴长(a)和体重(b)的关系 Fig.2 Relationship between the relative fecundity and mantle length (a) and body weight (b) of dwarf form of S. oualaniensis in the South China Sea |
微型群雌性个体的潜在繁殖投入指数见表 3。从表 3可以看出,性腺成熟期为0.005~0.213,平均值为0.055±0.048。随着性腺发育,个体的潜在繁殖投入指数也随之增加(ANOVA:F=29.63, P < 0.05)。根据检验,潜在繁殖投入指数在Ⅳ~Ⅴ期无显著差异(Tukey HSD: P=0.17),之后增加迅速(Tukey HSD: Ⅵ期为P < 0.05)。同时,个体的潜在繁殖投入指数与胴长和体重的关系分别符合幂函数和线性函数模型(PRI=1.983e–19 ML8.721, R=0.609; PRI=0.0047BW–0.0749, R2=0.609)(图 3)。表明,在个体生长发育过程中,其潜在繁殖投入指数呈增长趋势。
|
|
表 3 南海鸢乌贼不同个体的潜在繁殖投入指数 Tab.3 The index of potential reproductive investment of dwarf form of S. oualaniensis in South China Sea |
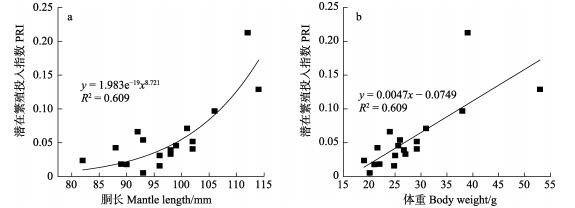
|
图 3 南海鸢乌贼潜在繁殖投入指数与胴长(a)和体重(b)的关系 Fig.3 Relationship between the index of potential reproductive investment and mantle length (a) and body weight (b) of dwarf form of S. oualaniensis in the South China Sea |
研究发现,卵巢卵母细胞的卵径范围为0.17~ 0.99 mm,平均值为(0.51±0.14) mm。不同性腺成熟度之间,卵巢卵母细胞的卵径存在显著差异(ANOVA: F=10.68, P < 0.01)(图 4)。其中,生理发育期(Ⅲ期)的卵巢卵母细胞最小(Tukey HSD, P < 0.05),卵径为0.20~0.85 mm,平均值为(0.49±0.12) mm;Ⅴ期时卵巢卵母细胞最大(Tukey HSD, P < 0.05),卵径为0.23~ 0.99 mm,平均值为(0.54±0.16) mm。
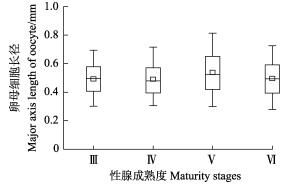
|
图 4 南海鸢乌贼不同性腺成熟度卵母细胞的长径 Fig.4 The major axis length of oocyte at different maturity stages of S.oualaniensis in South China Sea |
分析显示,每个性腺成熟度(Ⅲ~Ⅵ期)的卵巢卵母细胞大小均呈单峰值区间分布(图 5)。其中,Ⅲ、Ⅳ期时的卵母细胞峰值区间均为0.35~0.60 mm,Ⅲ期时峰值区间内的卵母细胞数占比为76.79%,Ⅳ期峰值区间内卵母细胞数占比为68.05%;Ⅴ、Ⅵ期的峰值区间均为0.40~0.75 mm,Ⅴ期时峰值区间内卵母细胞数占比为78.75%,Ⅵ期峰值区间内卵母细胞数占比为63.01%(图 5)。
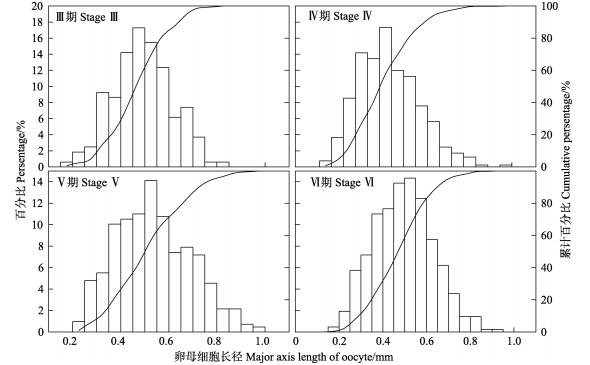
|
图 5 南海鸢乌贼不同性腺成熟度卵母细胞大小分布 Fig.5 The oocyte size distribution at different maturity stages of S. oualaniensis in South China Sea |
此外,输卵管成熟卵子的卵径为0.50~1.08 mm,平均值为(0.68±0.11) mm。ANOVA检验显示,Ⅳ~Ⅵ每个成熟期的成熟卵子卵径无显著差异(F=2.879, P=0.057),且均呈单峰值区间分布,Ⅳ期的峰值区间为0.60~0.80 mm,Ⅴ期和Ⅵ期的峰值区间均为0.50~ 0.70 mm。
3 讨论 3.1 繁殖力大小头足类具有灵活的生活史特性以适应多变的海洋环境,进化出了多种环境适应性的繁殖策略,其繁殖模式可由繁殖力和卵子大小等进行定义(Zuyev et al, 2002; Rocha et al, 2001)。本研究表明,微型群雌性个体的最大潜在繁殖力为32842 cell,远小于其他群体的最大潜在繁殖力。日本及邻近海域中型群的最大潜在繁殖力大于25万cell (Okutani et al, 1978),大型群的最大潜在繁殖力为2200万cell (Zuyev et al, 2002)。这可能与微型群成熟个体较小的特性密切相关。通常头足类(尤其是柔鱼类)的繁殖力与其成熟个体大小密切相关,成熟体型越大,其繁殖力也越大(Zuyev et al, 2002)。因此,若研究海域的鸢乌贼存在多个群体时,其繁殖力分布将具有较大的波动性。南海海域分布有微型群和中型群2个群体,粟丽等(2016)发现,混合群体的个体繁殖力随着胴长增加,波动较为明显,呈现出2个峰值区间分布。其中,第一个峰值区间的结果与本研究结果相近,可推测,该峰值区间由小个体(微型群)所组成,另一个峰值区间则应该为体型较大的中型群所组成。本研究也发现,南海鸢乌贼微型群雌性个体的潜在繁殖力在不同的性腺发育时期变化较大,这是由于个体的胴长随着性腺的发育而增长显著,而个体的潜在繁殖力与其胴长呈显著的正相关关系,因此,潜在繁殖力随体型大小变化。潜在繁殖力还与发育时期相关,卵巢的发育具有阶段性(Boyle et al, 2005),在发育后期增长显著,相应的繁殖力也增长较为明显。该结果与印度洋海域的鸢乌贼繁殖力研究结果类似(Chembian, 2013),也与其他大洋性头足类相一致(Laptikhovsky et al, 2002、2005; Vellathi et al, 2013)。
同时,Chembian(2013)研究发现,南海鸢乌贼微型群的繁殖力远低于印度洋微型群的繁殖力,后者潜在繁殖力可高达60万cell卵母细胞。这种差异性可能与鸢乌贼微型群对不同海域环境的适应性相关。因为,头足类对栖息环境具有高度的适应性,而南海作为一个半封闭性海域,其在食物丰度、叶绿素浓度、温度等方面均与印度洋海域差异明显(邱永松, 2013)。然而,与其他头足类相比,南海鸢乌贼微型群的潜在繁殖力是相对可观的,大于近岸生活的大部分头足类,诸如莱氏拟乌贼(Sepioteuthis lessoniana) (Sivashanthini et al, 2010)等。
此外,本研究还发现,南海鸢乌贼微型群雌性个体输卵管中的成熟卵子数目与其胴长和体重也具有一定的正相关关系。该结果与印度洋海域鸢乌贼的研究一致(Chembian, 2013),但与夏威夷海域的鸢乌贼群体有所差异(Harman et al, 1989),并且与其他大洋性种类,如茎柔鱼(Dosidicus gigas)(Nigmatullin et al, 2009)及产卵批次较小的阿根廷滑柔鱼(Illex argentinus)也有不同(林东明等, 2015)。理论上,头足类输卵管中的成熟卵子数量是随机的,且与其繁殖产卵策略密切相关(Gonzalez et al, 1996)。Harman等(1989)的研究也显示,批次产卵的种类其输卵管中的卵子数目与胴长没有显著相关性。本研究结果表明,鸢乌贼微型群的输卵管成熟卵子积累具有一定属种特殊性和(或者)海域特异性。但是,值得注意的是本研究的样本均处于产卵前阶段,并且鸢乌贼个体性腺成熟后仍保持肌肉组织持续增长的生活史特性(Harman et al, 1989),这些特性也可能是引起输卵管成熟卵子数目与其个体大小呈正相关关系的原因之一,具体原因仍需后续深入研究。
3.2 产卵批次头足类(除鹦鹉螺属)为终生1次繁殖产卵,但是,其产卵模式则表现出单批次的瞬时终端产卵,或者多批次的间歇性或多次性产卵等(Rocha et al, 2001)。有研究表明,鸢乌贼的产卵模式为多次产卵,在产卵活动前,将成熟卵子暂存于输卵管中,待交配后排出体外(Harman et al, 1989, Nigmatullin et al, 2009)。本研究结果显示,鸢乌贼成熟雌性个体输卵管中的成熟卵子数目远小于其潜在繁殖力和卵巢卵母细胞数,说明卵巢卵母细胞不可能一次性全部发育成熟,输卵管也不可能一次性集聚与繁殖力相当地成熟卵子;卵巢卵母细胞分批次成熟、多次排卵应该是该种类产卵策略的一种选择(Harman et al, 1989)。卵巢卵母细胞和输卵管成熟卵子的单峰值区间分布模式,也在一定程度上证明了该种类卵巢卵母细胞批次成熟的发育模式。
本研究基于分析性腺成熟度Ⅵ期时饱满输卵管成熟卵子数目,推算鸢乌贼微型群的产卵批次为6~ 15次。该产卵批次与其他海域群体相一致,且不受群体体型大小影响。例如,阿拉伯海域大型群输卵管中成熟卵子数为30万cell (Snÿder, 1998),其产卵批次为6~16次。这种一致的产卵批次也进一步证实了鸢乌贼多次产卵的产卵策略选择(Harman et al, 1989)。同时,鸢乌贼的产卵批次数目与其他大洋性柔鱼类诸如茎柔鱼(Nigmatullin et al, 2009)的10~14个产卵批次数目相当,但大于近海或浅海水层生活柔鱼类如阿根廷滑柔鱼的产卵批次数目(林东明等, 2014)。这种大洋性种类和近海性种类产卵批次数目的差异,一方面,可能是二者之间的产卵策略有别,前者为多次产卵型,后者多为间歇性产卵型;另一方面,则可能是大洋性种类为了适应远洋多变环境而作出产卵策略等适应性的进化,并反映了头足类栖息地从近海向远洋的进化适应过程(Laptikhovsky et al, 2005)。
此外,头足类的产卵策略与其生殖投入密切相关,并在一定程度上决定着其产卵批次(Lin et al, 2017)。鸢乌贼的多次产卵策略表现为卵巢卵母细胞异步发育、批次成熟,产卵期间持续摄食,产卵周期持续约3个月(Harman et al, 1989),1个批次的卵子以多个卵块的形式排出(Chembian 2013),2次产卵之间肌肉细胞持续生长等(Harman et al, 1989)。生殖投入类型为外源性,即生殖所需能量来源于性腺发育期间和产卵期间的食物摄取(Harman et al, 1989)。性腺成熟个体在繁殖期间存在正常的摄食行为是柔鱼科产卵策略的一个重要特征(Nigmatullin et al, 1994, Laptikhovsky et al, 2005, Nigmatullin, 2007),这种摄食行为可为其配子发生提供持续的、稳定的能量供给(Wells et al, 1996),并增加其生殖产出,提高生殖效率(Harman et al, 1989)。因此,本研究发现,鸢乌贼雌性个体的潜在繁殖力投入指数与其个体大小的正相关关系,应该是其外源性生殖投入策略的一种体现。这种能量投入模式使得该种类更灵活地投入生殖活动,使其生殖产出及生殖效率最大化(Wells et al, 1996)。
综上所述,南海鸢乌贼微型群雌性个体具有较大的潜在繁殖力,且与个体大小密切相关。同时,该种类的卵巢卵母细胞表现为批次发育成熟、分批次产卵,产卵活动可能由6~15个排卵事件构成,潜在繁殖力投入指数随着个体生长发育呈增长趋势。这些繁殖力特性进一步说明鸢乌贼对多次产卵策略的选择适应性,以使其生殖产出及生殖效率最大化;并且,这种繁殖力特性也可能是其对栖息环境的一种选择适应性。但是,具体的繁殖力特性与时间因素和环境因素之间的关系仍需后续深入研究,尤其需要深入开展不同季节个体的繁殖力特征与其栖息环境的比较分析。
Boyle P, Rodhouse P. Cephalopods: Ecology and fisheries. Oxford: Wiley-Blackwell, 2005: 464
|
Chembian AJ. Studies on the biology, morphometrics and biochemical composition of the ommastrephid squid, Sthenoteuthis oualaniensis (Lesson, 1830) of the south west coast of India. Doctoral Dissertation of Cochin University of Science and Technology, 2013
|
Chen XJ, Liu BL, Wang YG. The world Cephalopods. Beijing: China Ocean Press, 2009: 312-313
|
陈新军, 刘必林, 王尧耕. 世界头足类. 北京: 海洋出版社, 2009: 312-313
|
Chen XJ, Liu BL. Fishery resources biology. Beijing: Science Press, 2017
|
陈新军, 刘必林. 渔业资源生物学. 北京: 科学出版社, 2017
|
Chen XJ, Ye XC. Preliminary study on the relationship between fishing ground of Symlectoteuthis oualaniensis and environmental factors in northwestern Indian Ocean. Journal of Shanghai Fisheries University, 2005, 14(1): 55-60 |
陈新军, 叶旭昌. 印度洋西北部海域鸢乌贼渔场与海洋环境因子关系的初步分析. 上海水产大学学报, 2005, 14(1): 55-60 |
Fan JT, Chen ZZ, Zhang J, et al. Sthenoteuthis oualaniensis fishing grounds analysis based on marine environmental factors and different weight coefficients in the Zhongxisha and Xisha Islands, South China Sea. South China Fisheries Science, 2016, 12(4): 57-63 |
范江涛, 陈作志, 张俊, 等. 基于海洋环境因子和不同权重系数的南海中沙西沙海域鸢乌贼渔场分析. 南方水产科学, 2016, 12(4): 57-63 |
Gong YY, Kong XL, Yang YT, et al. Feeding habits of dwarf-form Sthenoteuthis oualaniensis population in the South China Sea. Marine Fisheries, 2018, 40(4): 394-403 |
龚玉艳, 孔啸兰, 杨玉滔, 等. 南海鸢乌贼微型群体的摄食习性研究. 海洋渔业, 2018, 40(4): 394-403 |
Gong YY, Zhan FP, Yang YT, et al. Feeding habits of Symplectoteuthis oualaniensis in the South China Sea. South China Fisheries Science, 2016, 12(4): 80-87 |
龚玉艳, 詹凤娉, 杨玉滔, 等. 南海鸢乌贼摄食习性的初步研究. 南方水产科学, 2016, 12(4): 80-87 |
Gonzalez AF, Guerra A. Reproductive biology of the short- finned squid Illex coindetii (Cephalopoda, Ommastrephidae) of the Northeastern Atlantic. Sarsia, 1996, 81(2): 107-118 |
Harman RF, Young RE, Reid SB, et al. Evidence for multiple spawning in the tropical oceanic squid Sthenoteuthis oualaniensis (Teuthoidea: Ommastrephidae). Marine Biology, 1989, 101(4): 513-519 |
Jereb P, Roper C. Cephalopods of the world, an annotated and illustrated catalogue of cephalopod species known to date. Volume 1. Chambered nautiluses and sepioids (Nautilidae, Sepiidae, Sepiolidae, Sepiadariidae, Idiosepiidae and Spirulidae). Rome: FAO, 2005
|
Laptikhovsky V, Nigmatullin C. Caracteristicas reproductivas de machos y hembras del calamar (Illex argentinus). Frente Marítimo, 1992, 12(A): 23-37 |
Laptikhovsky VV, Arkhipkin AI, Middleton DAJ, et al. Ovary maturation and fecundity of the squid Loligo gahi on the southeast shelf of the Falkland Islands. Bulletin of Marine Science, 2002, 71(1): 449-464 |
Laptikhovsky VV, Nigmatullin CM. Aspects of female reproductive biology of the orange-back squid, Sthenoteuthis pteropus (Steenstrup) (Ommastrephidae: Oegopsidae) in the eastern tropical Atlantic. Scientia Marina, 2005, 69(3): 383-390 |
Li D, Liu CL, Li A, et al. Principal component analysis of the morphometric traits of the cuttlebone of Sepia esculenta at early developmental stages. Progress in Fishery Sciences, 2017, 38(5): 41-49 |
李达, 刘长琳, 李昂, 等. 金乌贼(Sepia esculenta)早期发育阶段内壳形态学指标的主成分分析. 渔业科学进展, 2017, 38(5): 41-49 |
Lin DM, Chen XJ, Fang Z. Preliminary study on reproductive biology of summer spawning stock of Illex argentinus in the southwestern Atlantic Ocean. Journal of Fisheries of China, 2014, 38(6): 843-852 |
林东明, 陈新军, 方舟. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究. 水产学报, 2014, 38(6): 843-852 |
Lin DM, Fang XY, Chen XJ. Fecundity and oocyte development of Argentine shortfin squid Illex argentinus summer spawning stock in the Southwest Atlantic. Marine Fisheries, 2015, 37(5): 389-398 |
林东明, 方学燕, 陈新军. 阿根廷滑柔鱼夏季产卵种群繁殖力及其卵母细胞的生长模式. 海洋渔业, 2015, 37(5): 389-398 |
Lin DM, Chen XJ, Wei YR, et al. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography. Fisheries Research, 2017, 185: 102-114 |
McGraw JB, Caswell H. Estimation of individual fitness from life-history data. American Naturalist, 1996, 147(1): 47-64 |
Ménard F, Potier M, Romanov E, et al. New information from predator diets on the importance of two Ommastrephidae: Sthenoteuthis oualaniensis in the Indian Ocean and Hyaloteuthis pelagica in the Atlantic Ocean. Global Ocean Ecosystem Dynamics, 2007, 24: 49-52 |
Nesis KN. Population structure of the squid Sthenoteuthis oualaniensis (Lesson, 1830) in the tropical West Pacific. Proceedings of the Academy of Science Union of Soviet Socialist Republics, Shirsch Institute of Oceanography, 1977, 107: 15-29 |
Nigmatullin CM, Arkhipkin AI, Sabirov RM. Age, growth and reproductive biology of diamond-shaped squid Thysanoteuthis rhombus (Oegopsida: Thysanoteuthidae). Marine Ecology Progress Series, 1995, 124(5): 73-87 |
Nigmatullin CM, Laptikhovsky VV. Reproductive strategies in the squids of the family Ommastrephidae. Ruthenica, 1994, 4(1): 79-82 |
Nigmatullin CM, Markaida U. Oocyte development, fecundity and spawning strategy of large sized jumbo squid Dosidicus gigas (Oegopsida: Ommastrephinae). Journal of the Marine Biological Association of the United Kingdom, 2009, 89(4): 789-801 |
Nigmatullin CM. Brief review on evolutionary and ecological aspects of biology of squids family Ommastrephidae (Cephalopoda: Teuthida). Proceedings of the Kazan State University. Series Natural Sciences, 2007, 149: 182–193
|
Okutani T, Tung IH. Reviews of biology of commercially important squids in Japanese and adjacent waters. I. Symplectoteuthis oualaniensis (Lesson). Veliger, 1978, 21(1): 87-94 |
Qiu YS. Ocean fertilization and its potential for fishery development in the oligotrophic South China Sea. Journal of Fishery Sciences of China, 2013, 20(1): 223-233 |
邱永松. 海洋施肥及其在南海外海渔业开发方面的应用前景. 中国水产科学, 2013, 20(1): 223-233 |
Rocha F, Guerra A, Gonzalez AF. A review of reproductive strategies in cephalopods. Biological Reviews, 2001, 76(3): 291-304 |
Sivashanthini K, Thulasitha WS, Charles GA. Reproductive characteristics of squid Sepioteuthis lessoniana (Lesson, 1830) from the Northern coast of Sri Lanka. Journal of Fisheries and Aquatic Science, 2010, 5: 12-22 |
Snÿder R. Aspects of the biology of the giant form of Sthenoteuthis oualaniensis (Cephalopoda: Ommastrephidae) from the Arabian Sea. Journal of Molluscan Studies, 1998, 64(1): 21-34 |
Stearns SC. The evolution of life histories. Oxford, UK: Oxford University Press, 1992
|
Su L, Chen ZZ, Zhang P. Reproductive biology of purpleback flying squid (Symplectoteuthis oualaniensis) in the south-central South China Sea in spring and autumn. South China Fisheries Science, 2016, 12(4): 96-102 |
粟丽, 陈作志, 张鹏. 南海中南部海域春秋季鸢乌贼繁殖生物学特征研究. 南方水产科学, 2016, 12(4): 96-102 |
Teng GL, Shan XJ, Jin XS, et al. A study on the ovary-development characters and oocyte size-distribution of Cleisthenes herzensteini in the Yellow Sea. Progress in Fishery Sciences, 2018, 39(1): 12-20 |
滕广亮, 单秀娟, 金显仕, 等. 黄海高眼鲽卵巢发育特征及卵径分布. 渔业科学进展, 2018, 39(1): 12-20 |
Tung IS. On the reproduction of common squid, Symplectoteuthis oualaniensis (Lesson). Reports on the Institute of Fisheries Biology, Taiwan University, 1976, 3: 26-48 |
童逸修. 南鱿生殖之研究. 台大渔业生物实验所研究报告, 1976, 3: 26-48 |
Vellathi V, Rajagopal S. Fecundity of bigfin squid, Sepioteuthis lessoniana (Lesson, 1830) (Cephalopoda: Loliginidae). Jordan Journal of Biological Sciences, 2013, 6(1): 39-44 |
Wang T, Huang D, Sun GW, et al. The research progress of fish batch fecundity and spawning frequency. Chinese Journal of Zoology, 2013, 48(1): 143-149 |
王腾, 黄丹, 孙广文, 等. 鱼类分批繁殖力和繁殖频率的研究进展. 动物学杂志, 2013, 48(1): 143-149 |
Wells MJ, Clarke A. Energetics: The costs of living and reproducing for an individual cephalopod. Philosophical Transactions of the Royal Society B Biological Sciences, 1996, 351(1343): 1083-1104 |
Wetherall JA. Biology, oceanography, and fisheries of the North Pacific transition zone and subarctic frontal zone. NOAA Technical Report NMFS, 1991, 105 |
Wormuth JH. The biogeography and numerical taxonomy of the oegopsid squid family Ommastrephidae in the Pacific Ocean. University of California Press, 1976, 23: 1-90 |
Yan YR, Feng B, Lu HS, et al. Fishery biology of purpleback flying squid Sthenoteuthis oualaniensisin northern sea areas around Nansha Islands in summer. Oceanologia et Limnologia Sinica, 2012, 43(6): 1177-1186 |
颜云榕, 冯波, 卢伙胜, 等. 南沙群岛北部海域鸢乌贼(Sthenoteuthis oualaniensis)夏季渔业生物学研究. 海洋与湖沼, 2012, 43(6): 1177-1186 |
Zhang J, Chen GB, Zhang P, et al. Estimation of purpleback flying squid (Sthenoteuthis oualaniensis) resource in the central and southern South China Sea based on fisheries acoustics and light-falling net. Journal of Fishery Sciences of China, 2014, 21(4): 822-831 |
张俊, 陈国宝, 张鹏, 等. 基于渔业声学和灯光罩网的南海中南部鸢乌贼资源评估. 中国水产科学, 2014, 21(4): 822-831 |
Zhang P, Yan L, Yang BZ, et al. Population structure of purpleback flying squid (Sthenoteuthis oualaniensis) in Nansha area in spring. South China Fisheries Science, 2015, 11(5): 11-19 |
张鹏, 晏磊, 杨炳忠, 等. 春季南沙海域鸢乌贼种群结构特征的研究. 南方水产科学, 2015, 11(5): 11-19 |
Zhao CX, Chen ZP, He XB, et al. Age, growth and population structure of purple back flying squid, sthenoteuthis oualaniensis in the South China Sea in spring based on statolith microstructure. Acta Hydrobiologica Sinica, 2017, 41(4): 884-890 |
招春旭, 陈昭澎, 何雄波, 等. 基于耳石微结构的南海春季鸢乌贼日龄、生长与种群结构的研究. 水生生物学报, 2017, 41(4): 884-890 |
Zuyev G, Nigmatullin C, Chesalin M, et al. Main results of long- term worldwide studies on tropical nektonic oceanic squid genus Sthenoteuthis: An overview of the Soviet investigations. Bulletin of Marine Science, 2002, 71(2): 1019-1060 |



