2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071
中国是世界上唯一一个水产养殖产量超过捕捞产量的国家,水产养殖总产量约占世界水产养殖总产量的70% (陈雨生等, 2012)。水产养殖产业不仅是我国主要的食物来源之一,也是农产品出口贸易的重要组成部分。
随着沿海工业化的发展,海洋重金属污染已成为十分突出的环境问题。已有研究表明,在渤海中部、山东半岛南部近海、深圳湾海域、珠江口海域、江苏近海、广西廉州湾、南海等近海海水中诸多重金属离子如铜(Cu2+)、铅(Pb2+)、砷(As3+, As5+)、汞(Hg2+)和镉(Cd2+)的浓度逐年升高,已经超过第一类海水水质标准(徐勇等, 2017; 李月等, 2010; 彭鹏飞等, 2017; 时运红等, 2017; 顾莉等, 2012; 崔振昂, 2018; 王璐等, 2017)。虽然,大部分水体中重金属浓度均控制在轻度或无污染程度,但是由于Cu、Pb和As等重金属具有较高的富集因子(孙玲玲等, 2018),会在生物体内慢慢蓄积并沿食物链逐级放大,这不仅对水产养殖动物的生长和繁殖造成直接影响,食用这些受污染的生物会严重威胁人类的健康(Rastegar et al, 2014; Ekino et al, 2007; Mukherjee et al, 2006; Nawrot et al, 2010)。
As是一种具有类似于重金属元素毒性的非金属元素,以有机砷(Org-As)和无机砷(In-As)的形式广泛存在于自然界中(Braman et al, 1973)。本研究中,所提到总砷即为这二者的总和。通常来说,无机砷比有机砷具有更高的生物毒性。其中,无机砷主要以亚砷酸盐(As3+)和砷酸盐(As5+)形式存在,而As3+的毒性更高,为As5+的11倍(赵凤, 2012; 陈丽竹等, 2017)。有机砷的种类相对无机砷要复杂得多,主要以甲基砷(Monomethylarsonate, MMA)、二甲基砷酸(Dimethylarsinate, DMA)、三甲基砷(Trimethylarsine, TMA)、砷–谷胱甘肽等形式存在(杜森等, 2019)。生物体会将一部分的无机砷通过生成甲基化砷和砷–谷胱甘肽等毒性较低的有机化合物来降低砷的毒害(赵凤, 2012),此外,As被生物体吸收后易在体内蓄积,长期过量会对生物体造成严重危害(Grund et al, 1987; Casarett et al, 2001; 刘静等, 2018)。美国疾病控制中心(Centers for Disease Control and Prevention,CDC)和国际癌症研究机构(International Agency for Research on Cancer,LARC)将As确定为第一类致癌物质(赵素莲等, 2002)。诸多研究表明,在青梭子蟹(Portunus segnis)、截形斧蛤(Donax trunculus)、红鲻鱼(Mullus barbatus)等海产品中都检测出不同程度的As (Ghaeni et al, 2015; Ferrante et al, 2019; Copat et al, 2018; Filippini et al, 2018),而这些含As的海产品是人类摄入As的主要途径之一(Jia et al, 2018)。
虾、蟹等甲壳类水产生物是人们所喜爱的食品,同时,也是As富集因子较高的水产生物之一(程家丽等, 2017; 蒋玉艳等, 2017; 胡立成等, 2017)。虽然国内外学者对甲壳类重金属污染特征和蓄积特异性进行了大量的研究(Hosseini et al, 2014; Ip et al, 2005; Protasowicki et al, 2008; Flores et al, 2014),但目前大部分研究集中于As在甲壳类体内的生物富集情况进行了研究(Ghaeni et al, 2015; Bakker et al, 2017; Liu et al, 2017),结果发现,各个器官中,污染物浓度在肝胰腺中最高,肌肉中最低。而关于甲壳类总砷的蓄积特异性研究则尚未见报道。
三疣梭子蟹(Portunus trituberculatus)具有经济价值高、生长快、繁殖技术成熟等特点,是我国北部产量最高的海产食用蟹类之一(戴爱云等, 1997)。关于三疣梭子蟹As的蓄积特异性研究尚未报道。本研究通过分析三疣梭子蟹不同组织中总砷的含量,运用双箱动力学模型研究三疣梭子体内As的富集动力学过程,阐明三疣梭子蟹中As的蓄积特异性,以期为未来的防控技术提供理论基础。
1 材料与方法 1.1 实验生物实验选用规格相近、活力旺盛的健康三疣梭子蟹240只,平均壳长为(70.32±2.46) mm,平均壳宽为(140.23±2.66) mm,平均体重为(139.86±5.22) g,于2018年9月购自山东日照市某养殖场,该海域As的环境背景值为0.91 μg/L。
1.2 试剂与仪器实验用硫脲、NaOH、硼氢化钾均为上海国药试剂厂的分析纯试剂;实验所用As的标准溶液为中国计量科学研究院1000 mg/ml五价砷的标准溶液;分析用水为Millipore-F2BN 43517C型超纯水装置制备的超纯水;所用水箱为聚乙烯塑料水箱(规格为106 cm× 64 cm×20 cm)。实验所有玻璃器皿均以硝酸溶液(1+4)浸泡24 h,用自来水反复冲洗后,再用去离子水冲洗3遍。消化仪器为X42A铝模块自动消化装置,分析仪器为AFS-933原子荧光光度计。
1.3 实验方法 1.3.1 三疣梭子蟹的暂养将三疣梭子蟹暂养于聚乙烯塑料水箱中。暂养期间,连续充氧,每天于18:00投喂1次(投喂量为三疣梭子蟹体重的10%,根据饵料食用情况增减)。投喂2 h后,完全换水1次,所用海水盐度为30.4~30.7,水温为22℃~25℃,pH为8.0~8.3,溶解氧(DO)>6.5 mg/L。
1.3.2 暴露实验实验分为富集和释放2个阶段,均进行15 d。实验暴露浓度以渔业水质标准为中间值,选择低于5倍和高于10倍,同时,又根据实际情况进行调整,最终将实验浓度梯度设为4组,其中,3组为实验组,1组为海水对照组,每组设3个平行。实验组的暴露浓度分别为5、20、100 μg/L。
富集过程采用半静态法进行暴露实验。充氧,使海水中DO>6.5 mg/L,每24 h换水1次,换水量为100%。实验开始加As前,采集三疣梭子蟹样品,以测量总砷的本底值。定期查看三疣梭子蟹健康状况,及时将行为异常或者死亡的三疣梭子蟹捞出。实验期间,三疣梭子蟹饵料为鲜活饲料[菲律宾蛤仔(Ruditapes philippinarum)],投喂情况与暂养期间一致。分别于第0、3、5、10、15天采集三疣梭子蟹样品,取生物体肌肉、肝胰腺组织,匀浆,迅速冷冻,以备分析。同时,采集水体样品,存放于–20℃冰箱备用。
蓄积实验结束后,将余下的三疣梭子蟹移入盛有天然海水的水箱内进行体内总砷的释放实验。每天定时、定量喂食和换水(与蓄积实验相同),分别于第18、20、25、30天采集三疣梭子蟹样品,取生物体肌肉、肝胰腺组织,匀浆,迅速冷冻,以备分析。同时,采集水体样品,存放于–20℃冰箱备用。
1.3.3 样品前处理参照《食品中总砷及无机砷的测定中的方法》(GB 5009.11–2014),采用湿法消解法对所取样品进行消解,准确称取1~2 g (精确至0.01 g)样品放入消化管,向消化管中分别加入8 ml浓硝酸和2 ml高氯酸,静置过夜使样品组织初步消解。后经X42A铝模块自动消化装置高温加热消解至管内有大量白烟冒出,管底约剩1 ml澄清透明溶液后,将得到的内溶物移入100 ml容量瓶使用蒸馏水定容,采用原子荧光光度计进行检测,检测的同时进行试剂空白实验。
1.4 数据处理与实验应用模型 1.4.1 数据处理采用Excel 2003软件对数据进行计算和非线性拟合;采用SPSS13.0软件进行显著性差异分析;使用Origin 7.5软件绘图。
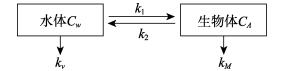
1.4.2 实验应用模型在重金属的富集研究过程中,双箱动力学模型能较好地描述水体与生物体之间的作用过程(Kahle et al, 2002),通常假设污染物在生物体内的生物富集,可以近似看作是污染物在水体和生物体之间的两相分配过程,因此,其吸附、解吸过程可用一级动力学过程进行描述。目前,许多应用研究都运用了该模型(王亚炜等, 2008; 张聪等, 2012; Martins et al, 2012; 苑旭洲等, 2012), 其主要描述见图 1。
|
图 1 生物富集双箱动力学模型 Fig.1 Model of two-compartment bioconcentration |
从图 1可以看出,k1为生物富集速率常数,k2为生物排出速率常数,kv为水体的挥发常数,kM为生物的代谢速率常数,Cw为水体重金属浓度(mg/L),CA为生物体内重金属浓度(mg/kg)。
水相(含有重金属污染物的水体)公式:
| $ \frac{{d{C_w}}}{{dt}} = 0 $ | (1) |
生物体相公式:
| $ \frac{{d{C_A}}}{{dt}} = {k_1}{C_w} - \left( {{k_2} + {k_M}} \right){C_A} $ | (2) |
因实验周期较短,故忽略水体中污染物的自然挥发及生物体的代谢。由方程(1)和方程(2)可得:
| $ {C_A} = {C_0} + {C_w}\frac{{{k_1}}}{{{k_2}}}\left( {1 - {e^{ - {k_2}t}}} \right)富集过程\left( {0 < t < {t^*}} \right) $ | (3) |
| $ {C_A} = {C_0} + {C_w}\frac{{{k_1}}}{{{k_2}}}\left[ {{e^{ - {k_2}}}\left( {t - {t^*}} \right){e^{ - {k_2}t}}} \right]释放过程\left( {t > {t^*}} \right) $ | (4) |
式中,t为实验进行的时间(d),t*为富集阶段结束的时间(d),C0为实验开始前生物体内金属的浓度(mg/kg)。由方程(3)和方程(4)对富集和释放进行非线性拟合即可得到k1和k2。
理论上,在平衡状态下,生物富集系数(BCF)和生物学半衰期B1/2分别使用以下公式得到:
| $ {\rm{BCF}} = \frac{{{k_1}}}{{{k_2}}} = {\rm{lim}}\frac{{{C_A}}}{{{C_w}}}\left( {t \to \infty } \right) $ | (5) |
| $ {B_{1/2}} = \frac{{{\rm{ln}}2}}{{{k_2}}} $ | (6) |
双箱动力学模型可用来计算即使没有达到浓度平衡情况下,理论平衡状态下的动力学参数。
2 结果 2.1 水体中总砷的浓度从表 1可以看出,对照组第30天水体中的总砷浓度低于对照组其他天数的取样点,原因可能是海水批次不同。在富集阶段,各实验组水体中总砷浓度比实验设置的浓度稍微偏低,可能是随着三疣梭子蟹的滤食等行为,有少量的As被摄入,导致实际测得的浓度低于实验设置的浓度。而在释放阶段,实验组与对照组相比,实验组水体中总砷浓度高于对照组,且高浓度组水体中总砷的浓度比低浓度组稍高,且随着时间的推移,总砷浓度有所降低,但总体下降幅度较小,表明在释放阶段三疣梭子蟹体内的As随着代谢有一定程度的释放,且随着时间的推移,释放明显减弱或者基本无明显释放。同时,实验组中三疣梭子蟹身体表面富集的As也会在释放过程中重新释放到水体中,这也可能导致实验组水体中总砷浓度高于对照组。
|
|
表 1 水体中总砷的浓度(μg/L) Tab.1 The concentration of total arsenic in water (μg/L) |
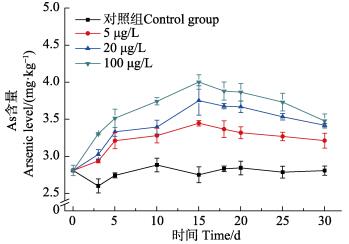
在富集实验阶段,与对照组取样点相比,5、20和100 μg/L实验组中,每个对应的取样点肝胰腺总砷浓度均有显著升高(P < 0.05)。除20μg/L组第5天与第10天总砷浓度无显著差异外,其他各实验组中,三疣梭子蟹肝胰腺总砷浓度均随着暴露时间的增加而显著增加(P < 0.05),且前5 d增长速度较快,5 d以后增长速度减缓,在富集实验结束(15 d)时,总砷浓度达到最大值,5、20和100 μg/L实验组的总砷浓度依次为3.447、3.754和4.004 mg/kg (湿重)。在释放实验阶段,高浓度组三疣梭子蟹肝胰腺中总砷的释放比低浓度组快,到释放实验结束(30 d)时,各实验组中的总砷浓度仍显著高于空白组(P < 0.05) (图 2)。
|
图 2 肝胰腺中总砷的浓度 Fig.2 The concentration of total arsenic in hepatopancreas |
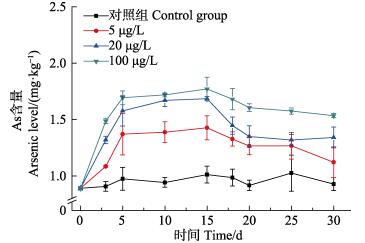
在富集实验阶段,三疣梭子蟹肌肉中总砷浓度的增长趋势同肝胰腺类似,均随着时间的增加而增加,在0~5 d中,总砷浓度显著增加(P < 0.05),5~ 15 d上升趋势不变,但相较0~5 d的快速上升,其总砷浓度进入平稳期,在富集实验结束(15 d)时,总砷浓度达到最大值,5、20和100 μg/L实验组的总砷浓度分别为1.426、1.684和1.770 mg/kg(湿重);在释放实验15~20 d时,肌肉中的总砷有较为明显的排出,其中,20 μg/L实验组肌肉中总砷浓度降低较快,20 d以后,20和100 μg/L浓度组肌肉中总砷浓度基本趋于不变。与肝胰腺中相同,到释放实验结束(30 d)时,各实验组中的总砷含量仍显著高于对照组(P < 0.05) (图 3)。
|
图 3 肌肉中总砷的浓度 Fig.3 The concentration of total arsenic in muscle |
根据双箱动力学模型对实验得到的数据进行计算,然后再根据公式(3)~公式(6),分别得到三疣梭子蟹对总砷生物富集的其他动力学参数k1、k2、BCF、B1/2。三疣梭子蟹对总砷的生物富集动力学参数见表 2。
|
|
表 2 三疣梭子蟹对不同浓度下总砷的各生物富集动力学参数 Tab.2 The kinetic parameters of bioconcentration of total arsenic by P. trituberculatus in the different concentration |
从表 2可以看出,5、20和100 μg/L实验组中肝胰腺的BCF分别为21.21、15.07和10.31,B1/2分别为5.92、4.36和3.00。因此,三疣梭子蟹肝胰腺对总砷的富集能力由低到高浓度逐渐降低,代谢能力逐渐增强。其中,k1随水体中As暴露浓度的增加而减小,k2随水体中As浓度的增加而增加。肌肉中,5和100 μg/L实验组各动力学参数较为接近,但20 μg/L实验组的k1最小,k2最大,因此,其BCF和生物学半衰期最小。
3 讨论与结论在本研究中,三疣梭子蟹肝胰腺组织对总砷的富集能力比肌肉组织高。肝胰腺中,总砷的浓度在富集实验结束(15 d)时显著高于肌肉,并且与Perry等(2015)、Ghaeni等(2015)、Cheng等(2018)大部分研究的结果相一致。
总体上来看,不同浓度实验组中,肝胰腺的总砷浓度随着水体中As的浓度增加而增加,并且差异较为明显;而不同浓度实验组中,肌肉的总砷浓度随着水体中As浓度的增加而增加,但20和100 μg/L实验组的结果相比无明显差异。Yilmaz等(2007)研究表明,重金属离子在螃蟹体内器官的累积程度取决于器官的生理作用,肝胰腺作为螃蟹体内的代谢解毒器官被认为是金属蓄积的靶器官,这也是肝胰腺对总砷的富集能力高于肌肉的主要原因。
总砷在三疣梭子蟹肝胰腺和肌肉中富集和释放都是前期(0~5和15~20 d)增加或降低迅速,后期(5~15和20~30 d)增加或降低趋于缓慢,这与许高鹏等(2014)对苯并[a]芘在三疣梭子蟹体内的富集动力学研究结果相一致。在富集阶段,总砷富集的动力主要是As从高浓度的水相向低浓度的生物相扩散的渗透势能,随着暴露时间的增加,生物相中富集总砷不断增加,生物相–水相之间的渗透势能也不断降低,从而导致实验中富集速率随着时间推移不断降低。而在释放阶段前期,总砷释放的动力同样是高浓度的生物相向低浓度的水相扩散的渗透势能;在释放阶段后期,渗透势能作用不断降低,同时,部分As和生物相中如谷胱甘肽、S-腺苷甲硫氨酸、巯基组氨酸三甲基内盐、金属硫蛋白以及其他生物大分子相结合(赵凤, 2012; 薛启祥等, 2016; 李晓等, 2016),从而导致实验组生物相所含有的总砷高于对照组,并且这种趋势随着实验组浓度增加而加重。
Bakker AK, Dutton J, Sclafani M, et al. Accumulation of nonessential trace elements (Ag, As, Cd, Cr, Hg and Pb) in Atlantic horseshoe crab (Limulus polyphemus) early life stages. Science of the Total Environment, 2017, 596-597: 69-78 DOI:10.1016/j.scitotenv.2017.04.026 |
Braman RS, Foreback CC. Methylated forms of arsenic in the environment. Science, 1973, 182(4118): 1247-1249 DOI:10.1126/science.182.4118.1247 |
Casarett LJ, Doull J, Klaassen CD. Casarett and Doull's toxicology. Ulster Medical Journal, 2001, 50(1): 73 |
Chen YS, Fang RJ, Qiao J. Research on the development of marine aquaculture in China. Issues in Agricultural Economy, 2012(6): 72-77 |
陈雨生, 房瑞景, 乔娟. 中国海水养殖业发展研究. 农业经济问题, 2012(6): 72-77 |
Chen LZ, Wang D, Cao RW, et al. Bioaccumulation and biotransformation of inorganic arsenic in Ruditapes philippinarum. Marine Science Bulletin, 2017, 36(3): 326-332 |
陈丽竹, 王丹, 曹瑞文, 等. 菲律宾蛤仔对三价和五价无机砷的富集转化规律. 海洋通报, 2017, 36(3): 326-332 |
Cheng JL, Ma YN, Liu TT, et al. Accumulation and health risks of heavy metals in the seafood from China. Journal of Hygiene Research, 2017, 46(1): 148-154 |
程家丽, 马彦宁, 刘婷婷, 等. 中国部分海产品重金属污染特征及健康风险评价. 卫生研究, 2017, 46(1): 148-154 |
Cheng L, Zhou JL, Cheng J. Bioaccumulation, tissue distribution and joint toxicity of erythromycin and cadmium in Chinese mitten crab (Eriocheir sinensis). Chemosphere, 2018, 210: 267-278 DOI:10.1016/j.chemosphere.2018.07.005 |
Copat C, Grasso A, Fiore M, et al. Trace elements in seafood from the Mediterranean Sea: An exposure risk assessment[. Food and Chemical Toxicology, 2018, 115: 13-19 DOI:10.1016/j.fct.2018.03.001 |
Cui ZA, Teng DQ, Zhang L, et al. Comprehensive monitoring of seawater environmental quality in Lianzhou Bay of Guangxi. Geological Survey of China, 2018, 5(5): 76-86 |
崔振昂, 滕德强, 张亮, 等. 广西廉州湾海水环境质量综合监测. 中国地质调查, 2018, 5(5): 76-86 |
Dai AY, Feng ZQ, Song YZ, et al. Preliminary investigation on fishery biology of Portunus trituberculatus. Chinese Journal of Zoology, 1977(2): 36-39 |
戴爱云, 冯钟琪, 宋玉枝, 等. 三疣梭子蟹渔业生物学的初步调查. 动物学杂志, 1977(2): 36-39 |
Du S, Zhang L. Biomagnification potential and the mechanisms of arsenic in marine food chains. Asian Journal of Ecotoxicology, 2019, 14(1): 54-66 |
杜森, 张黎. 砷在海洋食物链中的生物放大潜力及发生机制探讨. 生态毒理学报, 2019, 14(1): 54-66 |
Kahle J, Zauke GP. Bioaccumulation of trace metals in the copepodCalanoides acutus from the Weddell Sea (Antarctica): comparison of two-compartment and hyperbolic toxicokinetic models. Aquatic Toxicology (Amsterdam, Netherlands), 2002, 59(1-2): 115-135 DOI:10.1016/S0166-445X(01)00245-4 |
Editorial Office of Fisheries and Fisheries Administration of the Ministry of Agriculture. 2017 China fisheries statistical yearbook. Beijing: China Agriculture Press, 2017
|
农业部渔业渔政管理局编. 2017年中国渔业统计年鉴. 北京: 中国农业出版社, 2017
|
Ekino S, Susa M, Ninomiya T, et al. Minamata disease revisited: an update on the acute and chronic manifestations of methyl mercury poisoning. Journal of the Neurological Sciences, 2007, 262(1-2): 131-144 DOI:10.1016/j.jns.2007.06.036 |
Ferrante M, Napolis S, Grasso A, et al. Systematic review of arsenic in fresh seafood from the Mediterranean Sea and European Atlantic coasts: A health risk assessment. Food and Chemical Toxicology, 2019, 126: 322-331 DOI:10.1016/j.fct.2019.01.010 |
Filippini T, Malavolti M, Cilloni S, et al. Intake of arsenic and mercury in a northern Italy community from fish and seafood. Food and Chemical Toxicology, 2018, 116: 20-26 |
Flores IO, Meyerwillerer AO, Olivosortiz A, et al. Lead in shrimp Litopenaeus vannamei boone in sublethal concentrations. Journal of Toxicology and Environmental Health, 2014, 77(18): 1084-1090 DOI:10.1080/15287394.2014.905224 |
Ghaeni M, Pour NA, Hosseini M. Bioaccumulation of polychlorinated biphenyl (PCB), polycyclic aromatic hydrocarbon (PAH), mercury, methyl mercury, and arsenic in blue crab Portunus segnis from Persian Gulf. Environmental Monitbring and Assessment, 2015, 187(5): 253 DOI:10.1007/s10661-015-4459-9 |
Grund SC, Kunibert H, Uwe WH. Arsenic and arsenic compounds. Iarc Monographs on Evaluation of Carcinogenic Risks to Man, 1987, 7: 39 |
Gu L, Hua ZL, Shu J, et al. Assessment of water quality in coastal water areas of Jiangsu Province. Journal of Hehai University (Natural Science),, 2012(5): 498-502 |
顾莉, 华祖林, 树锦, 等. 江苏近海水域水环境质量现状评价. 河海大学学报(自然科学版), 2012(5): 498-502 |
Hu LC, Zhang JH. Investigation of heavy metal and arsenic pollution in aquatic products in Yueqing. Chinese Journal of Health Laboratory Technology, 2017(13): 123-125 |
胡立成, 张金怀. 乐清市水产品中的重金属及砷污染状况调查. 中国卫生检验杂志, 2017(13): 123-125 |
Hosseini M, Nabavi SMB, Parsa Y, et al. Mercury accumulation in selected tissues of shrimp Penaeus merguiensis from Musa estuary, Persian Gulf: Variations related to sex, size, and season. Environmental Monitoring and Assessment, 2014, 186(9): 5439-5446 DOI:10.1007/s10661-014-3793-7 |
Ip CCM, Li XD, Zhang G, et al. Heavy metal and Pb isotopic compositions of aquatic organisms in the Pearl River Estuary, South China. Environmental Pollution, 2005, 138(3): 494-504 DOI:10.1016/j.envpol.2005.04.016 |
Jia Y, Wang L, Ma L, et al. Speciation analysis of six arsenic species in marketed shellfish: Extraction optimization and health risk assessment. Food Chemistry, 2018, 244: 311-316 DOI:10.1016/j.foodchem.2017.10.064 |
Jiang YY, Meng HY, Chen H, et al. Risk assessment on the dietary exposure of arsenic in Guangxi residents. Chinese Journal of Food Hygiene, 2017, 29(6): 745-749 |
蒋玉艳, 蒙浩洋, 陈晖, 等. 广西主要食品中砷污染及居民膳食暴露风险评估. 中国食品卫生杂志, 2017, 29(6): 745-749 |
Li X, Wang Y, Wu ZH, et al. Safety levels of three heavy metals in clam Scapharca broughtonii culturing water. Fisheries Science., 2016, 35(5): 578-582 |
李晓, 王颖, 吴志宏, 等. 魁蚶对3种重金属生物富集动力学研究. 水产科学, 2016, 35(5): 578-582 |
Li Y, Tan LJ, Wang JT. The temporal and spatial distribution of cadmium, plumbum, mercury, arsenic of Shandong Southern coastal surface seawater. Periodical of Ocean University of China (Natural Science), 2010(S1): 179-184 |
李月, 谭丽菊, 王江涛. 山东半岛南部近海表层海水中镉、铅、汞、砷的时空变化. 中国海洋大学学报(自然科学版), 2010(S1): 179-184 |
Liu J, Li SX, Zhu J, et al. Discussion on the harm to human body by several kinds of heavy metal elements and preventive measures. China Resources Comprehensive Utilization, 2018, 36(3): 182-184 |
刘静, 李树先, 朱江, 等. 浅谈几种重金属元素对人体的危害及其预防措施. 中国资源综合利用, 2018, 36(3): 182-184 |
Liu Y, Liu G, Yuan Z, et al. Presence of arsenic, mercury and vanadium in aquatic organisms of Laizhou Bay and their potential health risk. Marine Pollution Bulletin, 2017, 125(1-2): 334-340 DOI:10.1016/j.marpolbul.2017.09.045 |
Martins RJE, Freitas OMM, Vilar JPV, et al. Accumulation and release of Pb(II) in aqueous solution by aquatic mosses (Fontinalis antipyretica). International Journal of Environment and Waste Management, 2012, 9(3-4): 270-283 |
Mukherjee A, Sengupta MK, Hossain MA, et al. Arsenic contamination in groundwater: A global perspective with emphasis on the Asian scenario. Journal of Health Population and Nutrition, 2006, 24(2): 142-163 |
Nawrot TS, Staessen JA, Roels HA, et al. Cadmium exposure in the population: From health risks to strategies of prevention. Biometals, 2010, 23(5): 769-782 DOI:10.1007/s10534-010-9343-z |
Peng PF, Li XL, Yang Q, et al. Distribution and evaluation of heavy metals in surface seawaters and sediments in Huangmao Sea of the Pearl River Estuary. The Administration and Technique of Environmental Monitoring, 2017, 29(4): 28-32 |
彭鹏飞, 李绪录, 杨琴, 等. 珠江口黄茅海表层海水和沉积物中重金属的分布及评价. 环境监测管理与技术, 2017, 29(4): 28-32 |
Perry H, Isphording W, Trigg C, et al. Heavy metals in red crabs, Chaceon quinquedens, from the Gulf of Mexico. Marine Pollution Bulletin, 2015, 101(2): 845-851 DOI:10.1016/j.marpolbul.2015.11.020 |
Protasowicki M, Dural M, Jaremek J. Trace metals in the shells of blue mussels (Mytilus edulis) from the Poland coast of Baltic Sea. Environmental Monitoring and Assessment, 2008, 139(1-3): 329-337 DOI:10.1007/s10661-007-9839-3 |
Rastegar SO, Mousavi SM, Shojaosadati SA. Cr and Ni recovery during bioleaching of dewatered metal-plating sludge using Acidithiobacillus ferrooxidans. Bioresource Technology, 2014, 167: 61-68 DOI:10.1016/j.biortech.2014.05.107 |
Shi YH, Li MY, Li B, et al. Spatial and temporal distribution of heavy metals in the sediment of Shenzhen bay. Marine Environmental Science, 2017, 36(2): 186-191 |
时运红, 李明远, 李波, 等. 深圳湾沉积物重金属污染时空分布特征. 海洋环境科学, 2017, 36(2): 186-191 |
Sun LL, Song JM, Yu Y, et al. Preliminary evaluation of heavy metal levels and food risks in 14 marine economic organisms in Rongcheng Bay. Oceanologia et Limnologia Sinica, 2018, 49(1): 52-61 |
孙玲玲, 宋金明, 于颖, 等. 荣成湾14种海洋经济生物体中的重金属水平与食用风险初步评价. 海洋与湖沼, 2018, 49(1): 52-61 |
Wang L, Yu KF, Wang YH, et al. Distribution characteristic of heavy metals in coral reefs located in the Zhongsha Islands and Xisha Islands of South China Sea. Tropical Geography, 2017, 37(5): 718-727 |
王璐, 余克服, 王英辉, 等. 南海中沙群岛、西沙群岛珊瑚岛礁区海水重金属的分布特征. 热带地理, 2017, 37(5): 718-727 |
Wang YW, Wei YS, Liu JX. Heavy metal bioaccumulation model of aquatic organisms: An overview. Acta Scientiae Circumstantiae, 2008, 28(1): 12-20 |
王亚炜, 魏源送, 刘俊新. 水生生物重金属富集模型研究进展. 环境科学学报, 2008, 28(1): 12-20 |
Xu GP. Kinetics of benzo[a]pyrene bioconcentration in Portunus trituberculatus. Marine Fisheries, 2014, 36(4): 357-363 |
许高鹏. 三疣梭子蟹体内苯并[a]芘的富集动力学. 海洋渔业, 2014, 36(4): 357-363 |
Xu Y, Qu KM, Zhao J, et al. Assessment of environmental water quality in the central region of the Bohai Sea in summer. Progress in Fishery Science, 2017, 38(2): 8-15 |
徐勇, 曲克明, 赵俊, 等. 渤海中部海区水域夏季环境质量综合评价. 渔业科学进展, 2017, 38(2): 8-15 |
Xue QX, Shen X, Tian T, et al. Metallothionein decreases the expression of GRP78 and CHOP proteins followed by apoptosis of liver cells in arsenic poisoning rats. Basic and Clinical Medicine., 2015, 35(6): 739-743 |
薛启祥, 沈雪, 田甜, 等. 金属硫蛋白降低GRP78和CHOP蛋白表达减轻大鼠砷中毒肝细胞凋亡. 基础医学与临床, 2015, 35(6): 739-743 |
Yuan XZ, Cui Y, Chen BJ, et al. Kinetic study on the bioconcentration of six heavy metals in Ruditapes philippinarum. Progress in Fishery Sciences, 2012, 33(4): 49-56 |
苑旭洲, 崔毅, 陈碧鹃, 等. 菲律宾蛤仔对6种重金属的生物富集动力学. 渔业科学进展, 2012, 33(4): 49-56 |
Yilmaz AB, Yilmaz L. Influences of sex and seasons on levels of heavy metals in tissues of green tiger shrimp (Penaeus semisulcatus de Hann, 1844). Food Chemistry, 2007, 101: 1664-1669 DOI:10.1016/j.foodchem.2006.04.025 |
Zhang C, Chen JF, Ma SS, et al. Kinetic study on the bioconcentration and elimination of heavy metals Cu and Cd in Crassostrea plicatula. Progress in Fishery Sciences, 2012, 33(5): 64-72 |
张聪, 陈聚法, 马绍赛, 等. 褶牡蛎对水体中重金属铜和镉的富集动力学特性. 渔业科学进展, 2012, 33(5): 64-72 |
Zhao F. Study on the degradation of arsenic-glutathione and the influence of arsenicals for free radical scavenging by glutathione. Master's Thesis of Tianjin University, 2012
|
赵凤.砷–谷胱甘肽复合物的降解及含砷化合物对谷胱甘肽清除自由基的影响.天津大学硕士研究生学位论文, 2012
|
Zhao SL, Wang LF, Liang JH. Harm of arsenic in drinking water and measures to remove arsenic. Modern Preventive Medicine, 2002, 29(5): 651-652 |
赵素莲, 王玲芬, 梁京辉. 饮用水中砷的危害及除砷措施. 现代预防医学, 2002, 29(5): 651-652 |



