2. 中国水产科学研究院黄海水产研究所 农村农业部海洋渔业可持续发展重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 中国海洋大学 海水养殖教育部重点实验室 青岛 266003
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
4. Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003
副溶血弧菌(Vibrio parahaemolyticus)是一种革兰氏阴性嗜盐菌,广泛存在于养殖水域、底泥和沉积物中,附着于海洋生物的体表进行生长繁殖,为重要的病原性弧菌,其引发的水产动物疾病不仅会对水产养殖业造成重大的经济损失,还对人体健康构成潜在威胁(黄梦诗等, 2019; 王娜等, 2016; 李国等, 2008; Su et al, 2007)。目前,副溶血弧菌已成为世界上多个沿海国家和地区急性胃肠炎的重要病原菌之一,严重者可引起伤口感染和败血症等。在我国,副溶血弧菌引起的食物中毒高居微生物性食物中毒的第2位(Hu et al, 2016; Chen et al, 2016)。与副溶血弧菌致病力相关的毒力因子主要为溶血素类,包括耐热直接溶血素(Thermostable direct hemolysin, TDH)、不耐热直接溶血素(Thermolabile hemolysin, TLH)和耐热相关溶血素(TDH-related hemolysin, TRH)(Wang et al, 2008)。其中,分别由tdh和trh基因编码的TDH和TRH被认为是副溶血弧菌的主要致病因子,几乎存在于所有临床分离株中,而来自美国、欧洲和亚洲的研究分析显示,环境样品中的tdh和trh基因的阳性率仅为0~6% (Alam et al, 2002; Hervio-Heath et al, 2002; Depaola et al, 2000)。
使用抗生素是治疗和预防细菌性感染的重要手段,在水产养殖过程中抗生素的过度使用和不规范使用,导致副溶血弧菌耐药性逐年上升,甚至出现交叉耐药和多重耐药等现象,给水产疾病的治疗带来巨大挑战(张德福等, 2018; Li et al, 2014)。耐药细菌一旦通过食物链等途径传播给人类,将会导致临床抗生素治疗的失效,严重威胁人类健康。
本研究旨在调查山东地区对虾养殖池中副溶血弧菌的耐药状况,并从分子层面对其毒力基因的携带情况进行调查,以期为我国临床治疗副溶血弧菌感染及水产养殖业合理使用抗生素提供依据。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株2018年4~8月期间,分别从山东省日照、青岛、烟台和潍坊4个地区养殖场内,随机采集12个对虾健康生长无病害的养殖池内的水样,每个池塘随机取4个不同地点的水样,每个地点15 ml,混合均匀后,取100 μl涂板。经分离纯化,共得到50株副溶血弧菌,具体采样信息及菌株数见表 1。药敏性测定标准质控菌株大肠杆菌(Escherichia coli) ATCC25922,购自北纳生物。
|
|
表 1 50株副溶血弧菌采样点信息 Tab.1 Sampling site information of 50 strains of V. parahaemolyticus |
庆大霉素、盐酸多西环素、氟苯尼考、氯霉素、硫酸新霉素、磺胺甲噁唑、复方新诺明、恩诺沙星、诺氟沙星、头孢他啶、氨苄西林和呋喃唑酮12种抗生素药敏纸片均购自杭州微生物试剂公司。TSB液体培养基、TCBS培养基和MH琼脂培养基,均购自青岛海博生物技术有限公司。
1.1.3 实验仪器超净工作台(北京东联哈尔仪器制造有限公司)、PCR扩增仪(美国Bio-Rad公司)、麦氏比浊仪(法国Bio-Meriux公司)、电泳仪(美国Bio Rad公司)和凝胶成像系统(美国Kodak公司)等。
1.2 实验方法 1.2.1 菌株的分离纯化在超净工作台内,将水样均匀涂布于TCBS琼脂培养基,置于28℃恒温培养箱内培养20~24 h,观察菌落形态。将培养出的细菌进行划线纯化,再挑取单菌落接种到TSB培养基,过夜培养,部分菌液置于4℃冰箱保存备用,部分菌液加20%甘油冻存于–80℃冰箱。
1.2.2 菌株鉴定挑取TCBS平板上的疑似副溶血弧菌蓝绿色单菌落,利用副溶血弧菌生化检测试剂盒进行生化鉴定,生化实验阳性的菌株,利用细菌基因组DNA提取试剂盒提取基因组DNA,具体方法按照说明书进行。针对副溶血弧菌16S rRNA和HSP60设计2对特异性引物进行PCR扩增,PCR反应体系为:DNA模板2 μl;上下游引物F/R (10 μmol/L)各1 μl;2×Reaction Mix 10 μl;灭菌ddH2O 5.9 μl;Golden DNA聚合酶0.1 μl。扩增产物经琼脂糖凝胶电泳分析后,选取条带明亮的样品送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI (http://www.ncbi.nlm.nih.gov)上进行同源比对。本研究所用全部引物序列及反应条件见表 2。
|
|
表 2 引物序列及反应条件 Tab.2 Primer sequence and reaction condition |
采用美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)推荐的Kirby-Bauer纸片法对副溶血弧菌进行12种常见抗生素的药物敏感性实验,副溶血弧菌过夜培养后,用0.85%无菌生理盐水调菌液浓度至0.5麦士比浊度,用无菌棉签涂布整个MH培养基后贴药敏纸片,28℃恒温培养箱内培养24~28 h,测量抑菌圈直径。以大肠杆菌菌ATCC25922作为质控菌株。记录各类药物对副溶血弧菌菌株产生的抑菌圈直径,并根据CLSI标准对实验结果进行判定(表 3)。
|
|
表 3 抗菌药物抑菌圈直径判定标准(mm) Tab.3 Criteria for judging the diameter of antimicrobial circle (mm) |
用细菌基因组DNA提取试剂盒提取副溶血弧菌基因组DNA,采用PCR对毒力基因tdh、trh进行检测。引物由生工生物工程(上海)股份有限公司合成,引物序列及反应条件见表 2。PCR反应体系为同1.2.2。PCR产物于1.5%琼脂糖(1.0×TAE)凝胶电泳20 min后,使用凝胶成像系统分析结果。将条带明亮的样品送至生工生物工程(上海)股份有限公司进行测序。
2 结果 2.1 副溶血弧菌的分离鉴定从山东省日照、青岛、烟台和潍坊4个地区采集的对虾养殖池中的水样,经TCBS分离纯化培养后,对其进行16S rRNA和HSP60基因扩增,将单一明亮的目的条带送至生工生物工程(上海)股份有限公司进行测序,测序结果在NCBI-Blast比对后,确定50株副溶血弧菌(GenBank登录号分别为MN419060、MN419061、MN419062、MN419063、MN419064、MN419065、MN419066、MN419067、MN419068、MN419069、MN419070、MN419071、MN419072、MN419073、MN419074、MN419075、MN419076、MN419077、MN419078、MN419079、MN419080、MN419081、MN419082、MN419083、MN419084、MN419085、MN419086、MN419087、MN419088、MN419089、MN419090、MN419091、MN419092、MN419093、MN419094、MN419095、MN419096、MN419097、MN419098、MN419099、MN419100、MN419101、MN419102、MN419103、MN419104、MN419105、MN419106、MN419107、MN419108和MN419109),47株分离自山东青岛卓越海洋集团有限公司对虾养殖池,3株分离自山东海阳黄海水产养殖有限公司对虾养殖池。
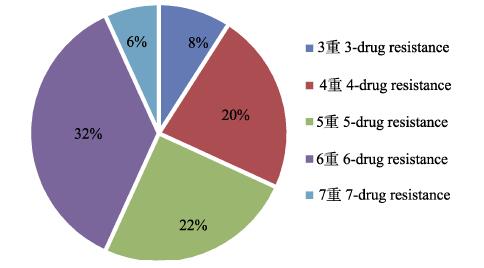
2.2 副溶血弧菌的药物敏感性分析50株副溶血弧菌的药物敏感性结果见表 4。仅1株副溶血弧菌对所有抗生素均表现为敏感,其余49株呈现出不同程度的抗生素抗性,98%的菌株具有耐药性。耐药率最高的是氨基糖苷类药物庆大霉素和硫酸新霉素,分别达98%和90%;其次是青霉素类药物氨苄西林,耐药率为86%;此外,水产养殖中禁止使用的硝基呋喃类药物呋喃唑酮,耐药率高达74%。所分离副溶血弧菌对酰氨醇类药物氟苯尼考、氯霉素较敏感,耐药率均为10%。副溶弧菌分离株多重耐药情况严重,多重耐药菌44株,占总菌株数的88%,最严重的可耐7种抗菌药物,其中,耐6种抗生素的菌株数量最多(32%),多重耐药菌株的比例见图 1。
|
|
表 4 50株副溶血弧菌的药敏实验结果 Tab.4 Drug susceptibility test results of 50 strains of V. parahaemolyticus |
|
图 1 副溶血弧菌多重耐药菌株比例 Fig.1 Proportion of multidrug resistance of V. parahaemolyticus |
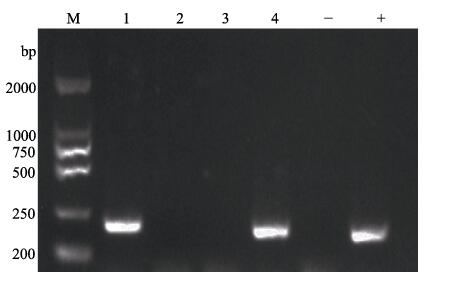
耐热直接溶血素和耐热相关溶血素是副溶血弧菌的主要毒力因子,通过PCR对毒力基因进行检测,并将条带明亮的样品测序,结果显示,50株副溶血弧菌均未检测到tdh基因,仅2株副溶血弧菌检测到trh基因,trh携带率为4%。trh毒力基因PCR扩增结果见图 2。
|
图 2 部分副溶血弧菌trh基因扩增电泳图谱 Fig.2 Electrophoretogram of the trh gene amplification from some of the V. parahaemolyticus M:Marker;1~4:trh;+:阳性对照Positive control (ATCC17802);–:阴性对照Negative control (ddH2O) |
现阶段,细菌耐药性问题已经引起世界范围的广泛关注,世界卫生组织(WHO)将其作为21世纪威胁人类健康的重大挑战之一(Levy et al, 2004; Neu, 1992)。2016年9月5日,G20峰会上通过的《二十国集团领导人杭州峰会公报》中明确指出,抗生素耐药性严重威胁公共健康、经济增长和全球经济稳定,并认为有必要从体现20国集团自身优势的角度,采取包容的方式应对抗生素耐药性问题,以实证方法预防和减少抗生素耐药性,同时推动研发新的和现有的抗生素。《2017年食品安全关键技术研发重点专项申报指南》中,将重要食源性致病菌耐药机制及传播规律研究作为首要研究任务,要求针对我国食源性致病菌耐药性不断加重的严峻形势,重点关注水产品和畜禽产品等具有世界性优势的农产品,以食源性致病菌为对象,研究细菌耐药性产生与传播的机制。耐药性副溶血弧菌不仅给海水养殖业带来巨大的经济损失,还可通过食物链传播给人类,严重威胁人类食品安全和身体健康,并给临床治疗带来巨大挑战(Li et al, 2015; Willis, 2000)。作为最重要的食源性致病菌之一的副溶血弧菌的耐药性及致病性应引起足够重视。
美国最早于1978年发现了氨苄西林抗性的副溶血性弧菌菌株(Blake et al, 1979),到目前为止,抗药性副溶血性弧菌在全球都有检出,并随着抗药能力的提高,研究者从临床和水产品中分离得到越来越多的副溶血性弧菌多重耐药菌株。2009年上海市售水产品分离的副溶血弧菌,有近70%的菌株对氨苄西林表现为耐药,并有20株表现为多重耐药,对萘啶酸等3种抗生素完全敏感(安秀华等, 2009)。广东省2014年分离病例源、食品源副溶血弧菌共60株,其对氨苄西林均耐药,磺胺复合物耐药率达43.3%,对庆大霉素等其他抗生素的耐药率均低于10.0%(李柏生等, 2015)。在大西洋海岸美国马里兰州沿海海湾分离的副溶血弧菌,对青霉素类抗生素的耐药率很高,其中,青霉素耐药率为68.00%,氨苄西林耐药率为53.00%,对哌拉西林和链霉素的耐药率较低,均为4.00%(Shaw et al, 2014)。根据魏大伟(2018)报道,临床及水产品中副溶血弧菌抗生素耐药率较高,环境中除了青霉素类耐药以外,总体表现为对抗生素敏感。这与本研究结果有所不同,本研究从山东省4个地区水产养殖环境分离得到50株副溶血弧菌,这50株副溶血弧菌对抗生素的耐药现象已相当普遍,除对青霉素类的氨苄西林产生较高的耐药率外,对氨基糖苷类的庆大霉素和硫酸新霉素的耐药率也极高,分别达98%和90%。对氟苯尼考、氯霉素和头孢他啶具有较高的敏感性。绝大部分菌株出现多重耐药现象。此外,47株耐药菌株均分离自山东青岛卓越海洋集团有限公司对虾养殖池,调查资料显示,该养殖场早年常用的抗生素包括庆大霉素和硫酸新霉素,可能是本研究结果中庆大霉素和硫酸新霉素耐药率高的重要原因。但值得注意的是,无论是临床分离株、水产品分离株,还是环境分离株,均对氨苄西林有较强的耐药性,揭示副溶血弧菌耐药问题已越来越严重,不仅临床分离株耐药现象严重,环境分离株耐药现象也越来越严重,同样需要加强防范。副溶血弧菌耐药性的产生与传播应引起足够的重视。为实现水产养殖健康发展,有必要继续开展菌株耐药监测,及时发现各类致病性弧菌菌株的耐药变化趋势,并在水产养殖过程中合理使用抗生素。
副溶血弧菌有一系列的毒力相关因子,包括黏附素、生物膜、铁载体、胞外蛋白酶、耐热直接溶血素、耐热直接相关溶血素、Ⅲ型分泌系统和Ⅵ型分泌系统(Raghunath, 2015)。其中,TDH和TRH是副溶血弧菌的主要毒力因子,与副溶血弧菌引起的肠胃炎密切相关。研究表明,约90%的临床分离株携带溶血素基因,而环境分离株极少携带tdh和trh (Banerjee et al, 2014; Mahoney et al, 2010)。本研究与其研究结果相吻合,山东地区50株环境分离副溶血弧菌均不携带tdh基因,4%的菌株表现为trh阳性,本研究50株副溶血环境分离株均分离自对虾健康生长无病害的养殖池塘,可能是毒力因子阳性率低的重要原因。虽然,环境分离株和水产品分离株tdh和trh的携带率低,多为非致病性和弱致病性,但最近研究表明,越来越多的临床株被发现不携带此类基因。例如,Jones等(2012)报道,发现约27%的临床菌株为tdh和trh基因阴性。WHO的《2011年关于海产品中副溶血弧菌风险评估报告》显示,不携带tdh或trh基因的临床分离株比率在增加,这些菌株可能携带其他导致肠毒性毒力因子,并且可产生重症病例(李柏生等, 2015; 郑文龙等, 2015)。因此,仍需加强对这一食源性疾病重要致病因子的了解,从而更好地预防和控制副溶血弧菌的感染和流行,减轻副溶血弧菌导致的经济损失和疾病负担。
为研究副溶血弧菌耐药性与毒力因子的相关性,娄阳(2016)从上海水产品中分离出的副溶血性弧菌菌株中发现,氨苄青霉素和头孢唑林的抗性分别为85%和30%,而携带tdh基因的分离菌,其耐药率明显高于别的菌株。但Baker-Austin等(2008)在不同的季节,采集了美国乔治亚州和南卡罗来纳州附近大西洋海岸3个位置的海水和沉积物,共分离350株副溶血弧菌,对其毒力基因进行分析,却发现毒力株的耐药性略低。本研究分离得到携带trh的副溶血弧菌2株,均为多重耐药菌株,耐药种类分别为耐庆大霉素、硫酸新霉素、磺胺甲恶唑、恩诺沙星、氨苄西林、呋喃唑酮和耐庆大霉素、硫酸新霉素、恩诺沙星、诺氟沙星、头孢他啶、氨苄西林和呋喃唑酮,但其他不携带毒力基因的菌株也多为耐药菌株,且耐药谱包含以上几种抗生素。因此,不能得出副溶血弧菌耐药性与毒力因子相关的结论,仍需要进一步研究探讨。
Alam MJ, Tomochika KI, Miyoshi SI, et al. Environmental investigation of potentially pathogenic Vibrio parahaemolyticus in the Seto-Inland Sea, Japan. FEMS Microbiology Letters, 2002, 208(1): 83-87 DOI:10.1111/j.1574-6968.2002.tb11064.x |
An XH, Ning XB. Isolation, identification and drug-resistance of Vibrio parahaemolyticus isolated from the aquatic products in Shanghai markets. Chinese Journal of Zoonoses, 2009, 25(7): 657-659 |
安秀华, 宁喜斌. 上海市市售水产品中副溶血性弧菌的分离、鉴定及耐药性研究. 中国人兽共患病学报, 2009, 25(7): 657-659 |
Baker-Austin C, McArthur JV, Tuckfield RC, et al. Antibiotic resistance in the shellfish pathogen Vibrio parahaemolyticus isolated from the coastal water and sediment of Georgia and South Carolina, USA. Journal of Food Protection, 2008, 71(12): 2552-2558 DOI:10.4315/0362-028X-71.12.2552 |
Banerjee SK, Kearney AK, Nadon CA, et al. Phenotypic and genotypic characterization of Canadian clinical isolates of Vibrio parahaemolyticus collected from 2000 to 2009. Journal of Clinical Microbiology, 2014, 52(4): 1081-1088 DOI:10.1128/JCM.03047-13 |
Blake PA, Merson MH, Weaver RE, et al. Disease caused by a marine vibrio-clinical characteristics and epidemiology. New England Journal of Medicine, 1979, 300(1): 1-5 DOI:10.1056/NEJM197901043000101 |
Chen Y, Chen X, Yu F, et al. Serology, virulence, antimicrobial susceptibility and molecular characteristics of clinical Vibrio parahaemolyticus strains circulating in southeastern China from 2009 to 2013. Clinical Microbiology and Infection, 2016, 22(3): 258-259 |
Depaola A, Kaysner CA, Bowers J, et al. Environmental investigations of Vibrio parahaemolyticus in oysters after outbreaks in Washington, Texas, and New York (1997 and 1998). Applied and Environmental Microbiology, 2000, 66(11): 4649-4654 DOI:10.1128/AEM.66.11.4649-4654.2000 |
Hervio-Heath D, Colwell RR, Derrien A, et al. Occurrence of pathogenic vibrios in coastal areas of France. Journal of Applied Microbiology, 2002, 92(6): 1123-1135 DOI:10.1046/j.1365-2672.2002.01663.x |
Hu QX, Chen LM. Virulence and antibiotic and heavy metal resistance of Vibrio parahaemolyticus isolated from crustaceans and shellfish in Shanghai, China. Journal of Food Protection, 2016, 79(8): 1371-1377 DOI:10.4315/0362-028X.JFP-16-031 |
Huang MS, Yang QQ, Zhang Y, et al. Study on the effects of temperature, salinity, pH, phosphate, nitrate, and ammonium on the growth of Vibrio parahaemolyticus using response surface methodology. Progress in Fishery Sciences, 2019, 40(2): 132-140 |
黄梦诗, 杨倩倩, 张艳, 等. 响应面法研究温度、盐度、pH及磷酸盐、硝氮、氨氮对副溶血弧菌生长的影响. 渔业科学进展, 2019, 40(2): 132-140 |
Jones JL, Lüdeke CHM, Bowers JC, et al. Biochemical, serological, and virulence characterization of clinical and oyster Vibrio parahaemolyticus isolates. Journal of Clinical Microbiology, 2012, 50(7): 2343-2352 DOI:10.1128/JCM.00196-12 |
Levy SB, Marshall B. Antibacterial resistance worldwide: Causes, challenges and responses. Nature Medicine, 2004, 10: S122-S129 DOI:10.1038/nm1145 |
Li BS, Tan HL, Ke BX, et al. Etiologic characteristics of foodborne Vibrio parahaemolyticus strains isolated in Guangdong, 2014. Chinese Journal of Epidemiology, 2015(11): 1283-1287 |
李柏生, 谭海玲, 柯碧霞, 等. 广东省2014年食源性副溶血弧菌病原学特征分析. 中华流行病学杂志, 2015(11): 1283-1287 |
Li G, Yan MC, Chang WS, et al. Review on studying of Vibriosis of shellfish farming in China. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(3): 327-334 |
李国, 闫茂仓, 常维山, 等. 我国海水养殖贝类弧菌病研究进展. 浙江海洋学院学报(自然科学版), 2008, 27(3): 327-334 |
Li RC, Lin DC, Chen KC, et al. First detection of AmpC β-Lactamase bla (CMY-2) on a conjugative IncA/C plasmid in a Vibrio parahaemolyticus isolate of food origin. Antimicrobial Agents and Chemotherapy, 2015, 59(7): 4106-4111 DOI:10.1128/AAC.05008-14 |
Li YH, Xie X, Shi XL, et al. Vibrio parahaemolyticus, southern coastal region of China, 2007–2012. Emerging Infectious Diseases, 2014, 20(4): 685-688 |
Lou Y. Study on antimicrobial resistance and risk analysis of Vibrio parahaemolyticus from different sources in Shanghai. Masterxs Thesis of Shanghai Ocean University, 2016, 65 |
娄阳.上海市不同来源副溶血性弧菌耐药性研究及潜在风险分析.上海海洋大学硕士研究生学位论文, 2016, 65
|
Mahoney JC, Gerding MJ, Jones SH, et al. Comparison of the pathogenic potentials of environmental and clinical Vibrio parahaemolyticus strains indicates a role for temperature regulation in virulence. Applied and Environmental Microbiology, 2010, 76(22): 7459-7465 DOI:10.1128/AEM.01450-10 |
Neu HC. The crisis in antibiotic resistance. Science, 1992, 257(5073): 1064-1073 DOI:10.1126/science.257.5073.1064 |
Raghunath P. Roles of thermostable direct hemolysin (TDH) and TDH-related hemolysin (TRH) in Vibrio parahaemolyticus. Frontiers in Microbiology, 2015(5): 805 |
Shaw KS, Rosenberg Goldstein RE, He X, et al. Antimicrobial susceptibility of Vibrio vulnificus and Vibrio parahaemolyticus recovered from recreational and commercial areas of Chesapeake Bay and Maryland Coastal Bays. PLoS One, 2014, 9(2): e89616 DOI:10.1371/journal.pone.0089616 |
Su YC, Liu CC. Vibrio parahaemolyticus: A concern of seafood safety. Food Microbiology, 2007, 24(6): 549-558 DOI:10.1016/j.fm.2007.01.005 |
Wang JW, Xu SW. Effects of cold stress on the messenger ribonucleic acid levels of corticotrophin-releasing hormone and thyrotropin-releasing hormone in hypothalami of broilers. Poultry Science, 2008, 87(5): 973-978 DOI:10.3382/ps.2007-00281 |
Wang N, Wang HL, Bai N, et al. Isolation of lysogenic phage in Vibrio parahaemolyticus and its relationship with the pathogenicity of the host bacteria. Progress in Fishery Sciences, 2016, 37(2): 105-110 |
王娜, 王海亮, 白楠, 等. 副溶血弧菌(Vibrio parahaemolyticus)中溶源噬菌体与其宿主菌致病力的相关性. 渔业科学进展, 2016, 37(2): 105-110 |
Wei DW. Epidemiologica investigation and genetic diversity of Vibrio parahaemolyticus isolated from coastal areas of China. Masterxs Thesis of Northwest A & F University, 2018, 16 |
魏大伟.中国沿海地区副溶血弧菌流行病学调查及遗传多样性分析.西北农林科技大学硕士研究生学位论文, 2018, 16
|
Willis C. Antibiotics in the food chain: Their impact on the consumer. Reviews in Medical Microbiology, 2000, 11(3): 153-160 DOI:10.1097/00013542-200011030-00005 |
Zhang DF, An H, Zhang J, et al. Research progress of the drug- resistance and its mechanism of Vibrio parahaemolyticus. Science and Technology of Food Industry, 2018, 39(9): 311-317, 324 |
张德福, 安慧, 张健, 等. 副溶血弧菌耐药及其机制的研究进展. 食品工业科技, 2018, 39(9): 311-317, 324 |
Zheng WL, Wang Z, Ma J, et al. Progress in research of etiological and molecular epidemiological characteristics of Vibrio parahaemolyticus. Disease Surveillance, 2015, 30(4): 337-341 |
郑文龙, 王卓, 马洁, 等. 副溶血性弧菌病原学和分子流行病学流行特征研究进展. 疾病监测, 2015, 30(4): 337-341 |



