2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
条斑紫菜(Pyropia yezoensis)是一种较为原始的大型红藻,主要分布在我国浙江舟山群岛以北的东海和黄、渤海沿岸及朝鲜半岛和日本沿海等地(许璞等, 2013)。条斑紫菜具有很高的营养、经济和生态价值,是我国重要的大型栽培海藻(李晓蕾等, 2017)。条斑紫菜生活史包括宏观配子体(叶状体)和微观孢子体(丝状体) 2个异形世代(马家海等, 1996)。丝状体分为丝状藻丝(营养藻丝)、孢子囊枝、壳孢子形成(张学成等, 2005) 3个阶段。环境适宜时,成熟的孢子囊枝放散壳孢子,继而发育生成新的叶状体。条斑紫菜叶状体生长于潮间带,藻体每天随潮汐的变化,经受温度、光照、盐度及水分等环境因子的胁迫(Davison et al, 2010),是研究植物抗逆性及其机理的良好实验材料。
目前,有关条斑紫菜的研究主要集中在适宜丝状体生长发育的环境生态条件(郭文竹, 2012; 张美如等, 2009)、叶状体抗逆性及机制(侯和胜等, 2008; 周向红等, 2013)与分子生物学等(贺剑云等, 2010; Yang et al, 2011; Cao et al, 2018)。丝状体是紫菜生活史的重要阶段,作为种质资源保存形式,调控其生长发育对生产和科研十分重要。孢子囊枝和营养藻丝是紫菜丝状体发育最典型的2个阶段,受环境因子影响显著(Green et al, 2015)。高温促进丝状体由营养藻丝发育为孢子囊枝。研究表明,温度达到12.5℃以上,才能形成孢子囊枝(任国忠等, 1979);15℃~25℃之间,壳孢子囊枝的增长率与温度成正比(陈翠芬等, 2008)。光是植物进行光合作用的能量来源,对植物体生长、发育具有重要影响(卢晓等, 2014; 夏云捷等, 2016)。光强过高或过低均不利于紫菜丝状体的生长和发育。骆其君等(1999)研究表明,15℃、60 μmol/(m2·s)是条斑紫菜丝状体适宜的温度和光照。陈翠芬等(2008)研究发现,8 L:16 D的短日照光周期、57 μmol/(m2·s)光强下,壳孢子囊枝形成率最高。Zhong等(2016)对长紫菜(Pyropia dentata)丝状体发育研究表明,较高温度有利于孢子囊枝的形成;在不高于12 h日照情况下,孢子囊枝形成率随日照时间的延长而增加;在一定的光照范围内,孢子囊枝的形成随光强的增加而增加。
紫菜发育和有性生殖的调控与环境紧密关联,而这个过程藻体光合作用也会发生相应变化(Katz et al, 2000; Jiang et al, 2013)。紫菜丝状体发育阶段,营养藻丝和孢子囊枝在形态上存在巨大差异(Shen et al, 2000; Varela-Alvarez et al, 2004; 周文君等, 2006),对环境因子需求也有所不同,但二者在不同环境条件下的光合生理差异尚未明确。本研究通过叶绿素荧光技术和液相氧电极技术,对条斑紫菜自由丝状体营养藻丝与孢子囊枝阶段在不同温度与光强下的光合生理进行比较研究,以比较二者光温适应能力,尤其是对高温和高光胁迫的光合耐受性,旨在为揭示条斑紫菜丝状体发育光温调控机制、建立苗种繁育精准调控技术奠定基础。
1 材料与方法 1.1 实验材料采用课题组培育的条斑紫菜“黄优1号”品系为实验材料。营养藻丝和孢子囊枝暂养条件:20℃,光强30 μmol/(m2·s),光周期12 L:12 D,灭菌海水中添加营养盐(5 mg/L NO3–-N,1 mg/L PO43–-P)为培养液。培养适应3 d后进行实验。
1.2 实验方法 1.2.1 温度和光强对丝状体Fv/Fm的影响实验于DGXM-508B光照培养箱中进行,称取等量营养藻丝和孢子囊枝分别放于培养皿中。设置3个温度(15℃、25℃和35℃)和3个光强[40、100和300 μmol/(m2·s)]。分别测定不同光温组合培养6 h、1 d、2 d和3 d的Fv/Fm。Fv/Fm测定采用叶绿素荧光仪(Imaging-Pam, WALZ, 德国),方法:取少量藻体于暗盒中,分别进行20 min暗适应,每个样品取6个平行,测定其Fv/Fm。
1.2.2 温度和光强对丝状体Pg、Rd和Pn的影响实验设置同1.2.1,采用液相氧电极(Hansatech Oxygraph, 英国)测定,反应介质为灭菌海水,光源为500 W碘钨灯,通过控制灯的远近,将光强控制在40 μmol/(m2·s)。每个条件下反应稳定5 min,测试时间控制在10 min内,取较为平滑曲线计算。由氧电极自带软件得出数据,每个处理组设置3个平行。
1.3 数据处理采用Excel分析数据并绘图,采用SPSS 18软件对各组数据进行单因子方差分析(One-way ANOVA)及Duncan多重比较,P < 0.05为差异显著。
2 结果 2.1 温度和光强对营养藻丝和孢子囊枝Fv/Fm的影响15℃时,除40 μmol/(m2·s)光强组,其他实验组孢子囊枝的Fv/Fm均显著高于营养藻丝(P < 0.05),此现象随光强增加而越明显,且二者Fv/Fm均随光强增加而下降。光强为40 μmol/(m2·s)时,6 h~2 d内,孢子囊枝与营养藻丝的Fv/Fm均呈上升趋势,3 d时显著下降(P < 0.05),2种藻丝的Fv/Fm在最优时相当。100 μmol/(m2·s)光照下,孢子囊枝的Fv/Fm呈线性下降趋势;当光强达到300 μmol/(m2·s)时,第3天时,孢子囊枝的Fv/Fm显著降低(P < 0.05);在光强为100~ 300 μmol/(m2·s)时,营养藻丝的Fv/Fm一直处在非常低的水平(P < 0.01)。
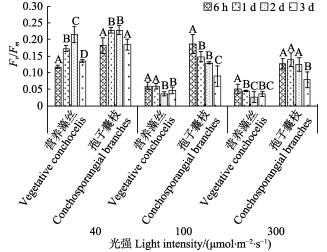
|
图 1 15℃下,不同光强对条斑紫菜丝状体Fv/Fm的影响 Fig.1 Fv/Fm of P. yezoensis under different light intensities at 15℃ 同组不同大写字母表示差异显著(P < 0.05),下同 Different letters in the same group represent significant differences(P < 0.05). The same as below |
温度为25℃时,孢子囊枝的Fv/Fm均显著高于营养藻丝(P < 0.05),但不同光强下情况不同:光强为40与100 μmol/(m2·s)组情况相同,营养藻丝Fv/Fm变化不大,孢子囊枝的Fv/Fm先下降(P < 0.05),后有所恢复。当光强达到300 μmol/(m2·s)时,营养藻丝Fv/Fm趋近于零,藻体发绿变白,接近死亡;孢子囊枝Fv/Fm先上升后有所下降(P < 0.05);但二者Fv/Fm均显著低于40~100 μmol/(m2·s)组(P < 0.05)。

|
图 2 25℃不同光强对条斑紫菜丝状体Fv/Fm的影响 Fig.2 Fv/Fm of P. yezoensis under different light intensities at 25℃ |
35℃时,营养藻丝与孢子囊枝的Fv/Fm显著低于15℃和25℃组。不同光强下,营养藻丝的Fv/Fm几乎检测不到(P>0.05)。40~100 μmol/(m2·s)光强下,孢子囊枝在培养初期(6 h),Fv/Fm随光强增加而急剧下降;当光强为300 μmol/(m2·s)时,孢子囊枝在6 h的Fv/Fm几乎为0。营养藻丝在6 h时,藻体变绿发白,孢子囊枝在1~2 d后,藻体也变绿发白、死亡。
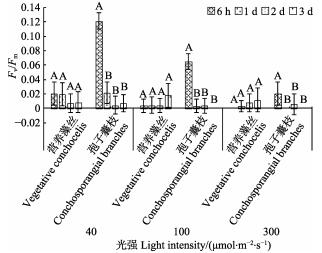
|
图 3 35℃不同光强对条斑紫菜丝状体Fv/Fm的影响 Fig.3 Fv/Fm of P. yezoensis under different light intensities at 35℃ |
15℃时,孢子囊枝的总光合速率均显著高于营养藻丝(P < 0.05)。随光强的增加,二者Pg逐渐降低。40和100 μmol/(m2·s)光照下,孢子囊枝Pg呈递增趋势,营养藻丝则呈先上升后下降的趋势(P < 0.05)。300 μmol/(m2·s)时,第2天,营养藻丝出现显著上升后又急剧下降,其余各组间无显著差异(P>0.05)。
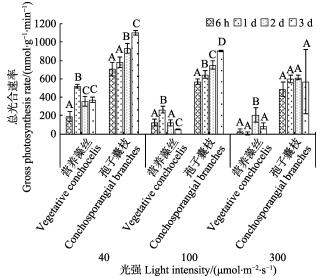
|
图 4 15℃不同光强对条斑紫菜丝状体总光合速率的影响 Fig.4 Gross photosynthesis rate of P. yezoensis under different light intensities at 15℃ |
当温度为25℃、光强为40 μmol/(m2·s)时,孢子囊枝Pg随培养时间延长而线性上升(P < 0.05),营养藻丝各组间无显著差异。3个组变化情况与15℃大体一致,且孢子囊枝Pg显著高于营养藻丝(P < 0.05)。
当温度为35℃、光强为40 μmol/(m2·s)时,培养1 d孢子囊枝的Pg上升显著(P < 0.05);第2天,营养藻丝Pg降为负值(P < 0.05),孢子囊枝Pg几乎为0 (P < 0.05);第3天,营养藻丝恢复到6 h水平。光强为100 μmol/(m2·s)时,2种藻丝的总体变化趋势和40 μmol/(m2·s)时大体一致。300 μmol/(m2·s)胁迫下,6 h~2 d中,营养藻丝和孢子囊枝的Pg在0上下波动,变化趋势不显著;第3天时,营养藻丝的Pg上升显著(P < 0.05)。

|
图 5 25℃不同光强对条斑紫菜丝状体总光合速率(Pg)的影响 Fig.5 Gross photosynthesis rate of P. yezoensis under different light intensities at 25℃ |
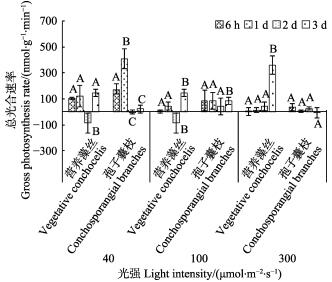
|
图 6 35℃不同光强对条斑紫菜丝状体总光合速率(Pg)的影响 Fig.6 Gross photosynthesis rate of P. yezoensis under different light intensities at 35℃ |
温度为15℃时,光强为40 μmol/(m2·s)时,1 d时孢子囊枝与营养藻丝的Rd均显著上升(P < 0.05)随后维持较为稳定的水平。当光强达到100 μmol/(m2·s)时,6 h时营养藻丝的Rd显著高于孢子囊枝(P < 0.05),随胁迫时间延长,孢子囊枝Rd逐渐升高,且显著高于营养藻丝(P < 0.05)。光强300 μmol/(m2·s)时,实验前期,营养藻丝和孢子囊枝Rd呈上升趋势,且二者之间无显著差异(P>0.05)。
温度达到25℃时,光照为40 μmol/(m2·s)时,营养藻丝的Rd均显著高于孢子囊枝(P < 0.05),且二者均呈上升趋势,此现象在孢子囊枝中尤为显著。光照为100 μmol/(m2·s)时,营养藻丝和孢子囊枝的Rd均呈先上升后下降趋势(P < 0.05)。300 μmol/(m2·s)光强胁迫下,6 h时,营养藻丝Rd显著高于孢子囊枝(P < 0.05),6 h~2 d时,孢子囊枝Rd上升(P < 0.05),其余时间二者均无显著差异。
在35℃高温、40 μmol/(m2·s)光照胁迫下,营养藻丝和孢子囊枝的Rd波动较大,呈先上升后下降再上升的趋势,第1天时,孢子囊枝Rd显著高于营养藻丝(P < 0.05)。100 μmol/(m2·s)光强中,6 h~1 d中,二者Rd呈显著上升(P < 0.05),孢子囊枝的Rd显著高于营养藻丝。光强达到300 μmol/(m2·s)时,二者Rd与前2组光照实验相比均有明显下降(P < 0.05),实验过程中,营养藻丝与孢子囊枝Rd均呈上升趋势,且实验后期营养藻丝Rd显著高于孢子囊枝(P < 0.05)。
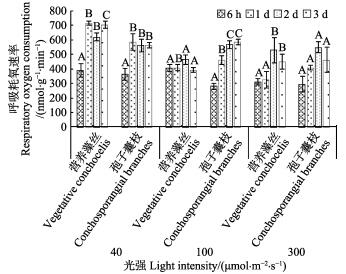
|
图 7 15℃不同光强对条斑紫菜丝状体呼吸耗氧速率(Rd)的影响 Fig.7 Respiratory oxygen consumption rate of P. yezoensis under different light intensities at 15℃ |
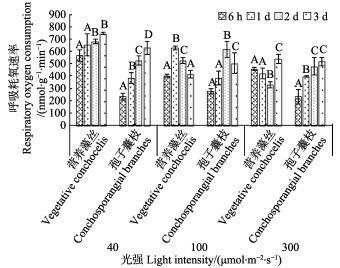
|
图 8 25℃不同光强对条斑紫菜丝状体呼吸耗氧速率(Rd)的影响 Fig.8 Respiratory oxygen consumption rate of P. yezoensis under different light intensities at 25℃ |
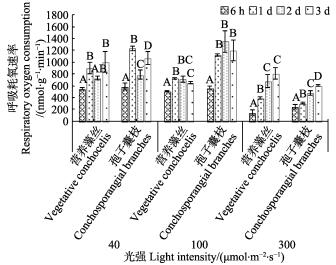
|
图 9 35℃不同光强对条斑紫菜丝状体呼吸耗氧速率(Rd)的影响 Fig.9 Respiratory oxygen consumption rate of P. yezoensis under different light intensities at 35℃ |
营养藻丝的净光合速率(Pn)均为负值。孢子囊枝在15℃和25℃时Pn为正值,且随光强增加而下降;当温度达到35℃时,Pn急剧降低为负(表 1)。
|
|
表 1 温度、光照对条斑紫菜营养藻丝和孢子囊枝净光合速率(Pn)的影响 Tab.1 The net photosynthetic rate of vegetative conchocelis and conchosporangial branches under different light intensities and temperatures |
藻类进行光化学反应和电子传递的成分位于叶绿体类囊体膜上(Chow et al, 2005),叶绿素荧光参数可以反映PSⅡ的活性以及对光能吸收、传递、分配、耗散等内在性的联系(Maxwell et al, 2000)。当藻类在逆境条件下产生光抑制时,叶绿素各荧光参数均呈下降趋势(Zhou et al, 2004)。PSⅡ原初光能转化效率Fv/Fm反映植物在充足的暗适应后,所有PSⅡ反映中心均处于开放状态时的量子产量,是衡量植物光合系统完整性的指标之一(张守仁, 1999)。当植物遭遇外界胁迫时,Fv/Fm值存在不同程度的下降,则表明PSⅡ反应中心受到不同程度的损伤。总光合速率(Pg)表示在光照条件下,单位时间内(叶绿体)所合成的有机物的量或同化CO2的量,表观光合速率(Pn)表示单位时间内植物所积累的有机物含量或者从外界环境所吸收CO2量(陈卫东, 2018),由总光合速率(Pg)减去呼吸耗氧速率(Rd)所得。温度变化会影响藻细胞新陈代谢、种群增长和叶绿素含量(梁英等, 2009)。温度过高或过低均会使藻体生长缓慢,甚至死亡(张美如等, 2009)。低温可以使植物类囊体膜上PSⅡ反应中心功能受到抑制(Terashima et al, 1989),降低PSⅡ的修复能力(Ottander et al, 1993);同时,PSⅡ也是对高温伤害最敏感的结构(Berry et al, 1980)。光是植物进行光合作用的能量来源,适宜的光强是保证植物正常生长发育的前提,但光强过高,则会对植物光合作用产生光抑制(郑宝福等, 1980; 陈国宜等, 1984; Zhang et al, 1997)。植物适应或抵抗外界胁迫过程需要消耗大量能量,呼吸作用为植物生命活动提供大部分能量,通过增强呼吸作用来抵抗胁迫是植物抗逆途径之一。
温度和光照是影响紫菜丝状体生长发育的2个最基本环境要素。通常在一定的光照和温度范围内,较高的温度、中短日长和较强的光照促进丝状体由营养藻丝发育为孢子囊枝(任国忠等, 1979; 骆其君等, 1999; 陈翠芬等, 2008; 卢晓等, 2014; 夏云捷等, 2016; Zhong et al, 2016),但有关调控机制尚不清楚。实践工作中,营养藻丝在适宜的情况下,只要培养条件不变,可以长久维持营养生长,而不会向孢子囊枝转化。那么,光温的升高是否因不利于营养藻丝的生长,从而启动相关内源信号调控藻丝转向另一个发育阶段?为了验证这一假设,本研究设置温度和光照强度较大,包括适宜范围与极端胁迫。结果显示,在适宜温度范围内(15℃~25℃),除了温度为15℃、光强为40 μmol/(m2·s)时,二者在多数时间点的Fv/Fm相当,其他条件下,孢子囊枝的Fv/Fm、Pg与Pn均高于营养藻丝(P < 0.05)。营养藻丝在25℃时,Fv/Fm、Pg与Pn值均低于15℃时,而孢子囊枝在25℃时,以上3个指标均高于或相当于15℃时,说明孢子囊枝比营养藻丝适于更高的温度。这从Rd的变化也可以看出,2种藻丝在15℃时,Rd差距不显著,在温度为25℃、光强为40 μmol/(m2·s)时,6 h~1 d时,营养藻丝显著高于孢子囊枝。光合作用降低、呼吸作用增强是植物遭遇胁迫时的常见反应。因此,推测营养藻丝在温度为25℃、光照强度为40 μmol/(m2·s)时已受到胁迫。研究表明,35℃对紫菜丝状体已是致死高温胁迫,2种藻丝的Fv/Fm趋于0,出现藻体死亡现象。2种藻丝的以上光合生理指标基本上都随实验光强的增加而下降。说明过高的光强可以显著降低丝状体PSⅡ的光能利用效率。温度为15℃、光强为40 μmol/(m2·s)时,营养藻丝和孢子囊枝在多数时间点具有相近的Fv/Fm值,相同温度下,光强增加至100 μmol/(m2·s),孢子囊枝Fv/Fm值则显著高出营养藻丝;在温度为15℃~ 25℃、光照为300 μmol/(m2·s)时,虽然孢子囊枝的光合生理指标数值相比温度为15℃~25℃、光强为40~ 100 μmol/(m2·s)时有所下降,但还维持在较高水平,而营养藻丝的数值已降至0附近,可见孢子囊枝对高光的耐受性显著高于营养藻丝。
孢子囊枝相对营养藻丝具备适应更高温度和光照的能力,可能与其在结构和成分上的改变有关。超微结构显示,首先,孢子囊枝中央液泡形成并增大(沈颂东等, 2000),液泡在多种逆境条件下起积极的渗透调节作用;第二,线粒体体积增大,数量变多(沈颂东等, 2000)。线粒体是进行呼吸代谢和能量转换的主要场所,细胞生命活动所需的能量大约有95%来自线粒体(Chance et al, 1979),条斑紫菜孢子囊枝中线粒体增多可能为机体抵抗外界胁迫提供了能量保障;第三,色素体被挤压分散排列在细胞边缘,并由大量的线粒体和淀粉粒分割开来(周文君等, 2006),极大提高了光能的吸收利用效率和有机物合成(光合碳固定);第四,细胞壁增厚疏松,外胶层变薄,内纤维质层极度加厚,细胞外壁凹凸不平,形成脊突,并随孢子囊枝日益成熟数量明显增加(朱家彦等, 1984)。植物细胞壁增厚是抵御逆境胁迫的有效途径之一(庄惠如等, 2001)。另外,前期研究表明,在紫菜丝状体发育过程中,磷脂酰胆碱(PC)和溶血磷脂酰胆碱(LPC)含量增加(Wang et al, 2015)。PC对PSⅡ膜复合物有保护作用(李冬海等, 2003),可以增强其放氧速率(Gounaris et al, 1983),同时,还可诱导Triton处理的光系统膜复合物的再活化(Ruan et al, 2002)。PC脂酰基侧链的不饱和程度对调节细胞的高温/低温适应能力具有重要影响。LPC是植物抗逆过程中重要的信号传递物质(卢静婵等, 2012)。同时,孢子囊枝中藻胆蛋白含量及其与叶绿素a含量的比值等均有所上升(陈烨等, 2007)。藻胆蛋白为红藻主要捕光色素(姚南瑜, 1987),直接参与光合作用能量吸收和传递(Glazer, 1984),同时,还具有抗逆功能(Zhong et al, 2016)。孢子囊枝藻胆蛋白含量上升,可增加光能捕获效率,促进光反应和碳水化合物合成。研究发现,在坛紫菜丝状体由营养藻丝发育到孢子囊枝过程,碳水化合物和蛋白质比值明显上升(陈烨等, 2007)。碳水化合物是细胞结构的主要成分和主要供能物质,碳水化合物的含量及其与蛋白质的比值是植物响应胁迫的重要指标,如,鹰嘴豆(Cicer arietinum)在干旱胁迫下,水溶性碳水化合物的含量显著升高(Mafakheri et al, 2011);细基江蓠(Gracilaria tenuistipitata var. Liui)碳水化合物和蛋白质比值随温度的降低和光照的减弱下降(刘静雯等, 2001)。紫菜孢子囊枝细胞内这些结构和组成的改变,为孢子囊枝应对高温和高光胁迫提供了支撑。
综上所述,在条斑紫菜营养藻丝的光合作用被严重抑制的光强、温度条件下,孢子囊枝仍然具备相对高的光合活力,说明温度和光强升高到不利于营养藻丝生长的情况下,刺激藻丝转向孢子囊枝发育阶段,后者同时具备适应更高温度和光照的能力。育苗实践中,可利用二者对高温/高光耐受阈值的差异来调控丝状体的生长和发育。
Berry J, Bjorkman O. Photosynthetic response and adaptation to temperature in higher plants. Annual Review of Plant Physiology, 1980, 31(1): 491-543 DOI:10.1146/annurev.pp.31.060180.002423 |
Cao Y, Wang WJ, Liu FL, et al. AFLP fingerprints of Pyropia yezoensis (Bangiales, Rhodophyta) populations revealed the important effect of farming protocols on genetic diversity. Botanica Marina, 2018, 61(2): 141-147 DOI:10.1515/bot-2017-0073 |
Chance B, Sies H, Boveris A. Hydroperoxide metabolism in mammalian organs. Physiological Reviews, 1979, 59(3): 527-605 DOI:10.1152/physrev.1979.59.3.527 |
Chen CF, Li XS, Yang L, et al. Effect of external factors on formation and growth of free-living conchosporangia in Porphyra yezoensis. Biotechnology Bulletin, 2008(4): 166-170 |
陈翠芬, 李信书, 杨玲, 等. 外界因子对条斑紫菜自由壳孢子囊枝形成和生长的影响. 生物技术通报, 2008(4): 166-170 |
Chen GY, Zhang XP, Zhou HQ, et al. The effect of some ecological factor on the photosynthetic activity of free- living filaments in early stage of Porphyra haitanensis. Journal of Fisheries of China, 1984, 8(2): 115-124 |
陈国宜, 张小平, 周鸿侨, 等. 不同生态因子对坛紫菜自由丝状体早期生长和光合作用活性的影响. 水产学报, 1984, 8(2): 115-124 |
Chen Y, Pei LQ, Yan XJ, et al. Changes of chemical components during sporangial branchlets formation of Porphyra haitanensis. Journal of Marine Science, 2007(2): 23-28 |
陈烨, 裴鲁青, 严小军, 等. 坛紫菜孢子囊枝形成过程中生化组分的变化. 海洋学研究, 2007(2): 23-28 |
Chen WD. Comparative analysis of gross photosynthesis rate and net photosynthetic rate. Science Exam Research (High School Edition), 2018(23): 61-63 |
陈卫东. 总光合速率、净光合速率的比较分析. 理科考试研究(高中版), 2018(23): 61-63 |
Chow WS, Kim EH, Horton P, et al. Granal stacking of thylakoid membranes in higher plant chloroplasts: The physicochemical forces at work and the functional consequences that ensue. Photochemical and Photobiological Sciences, 2005, 4(12): 1081 DOI:10.1039/b507310n |
Davison IR, Pearson GA. Stress tolerance in intertidal seaweeds. Journal of Phycology, 2010, 32(2): 197-211 |
Glazer AN. Phycobilisome a macromolecular complex optimized for light energy transfer. Biochimica et Biophysica Acta Reviews on Bioenergetics, 1984, 768(1): 29-51 DOI:10.1016/0304-4173(84)90006-5 |
Gounaris K, Whitford D, Barber J. The effect of thylakoid lipids on an oxygen-evolving photosystemⅡpreparation. FEBS Letters, 1983, 163(2): 230-234 DOI:10.1016/0014-5793(83)80825-4 |
Green LA, Neefus CD. Effects of temperature, light level, photoperiod, and ammonium concentration onPyropia leucosticta (Bangiales, Rhodophyta) from the Northwest Atlantic. Journal of Applied Phycology, 2015, 27(3): 1253-1261 DOI:10.1007/s10811-014-0421-4 |
Guo WZ. Effects of light and temperature on growth and development of sporophyte in different stages of Porphyra yezoensis. Science and Technology Information, 2012(17): 244-244 |
郭文竹. 光温对条斑紫菜孢子体各阶段生长发育的影响. 科技资讯, 2012(17): 244-244 |
He JY, He LW, Zhang X, et al. Analysis of genetic diversity of Porphyra yezoensis using AFLP. Oceanologia et Limnologia Sinica, 2010, 41(4): 489-494 |
贺剑云, 何林文, 张辛, 等. 条斑紫菜(Porphyra yezoensis)遗传多样性的AFLP分析. 海洋与湖沼, 2010, 41(4): 489-494 |
Hou HS, He WJ, Li HY, et al. Effects of high temperature stress on growth and physiology of conchocelis of Porphyra yezoensis. Journal of Liaoning Normal University (Natural Science), 2008, 31(4): 487-490 |
侯和胜, 何文君, 李洪艳, 等. 高温胁迫对条斑紫菜丝状体的生长和生理影响. 辽宁师范大学学报(自然科学版), 2008, 31(4): 487-490 |
Jiang H, Wang Y, Zhu J. Comparative studies on pigments and photosynthetic characteristics of sexually different vegetative and reproductive tissues of Porphyra katadai var. hemiphylla (Bangiales, Rhodophyta). Journal of Applied Phycology, 2013, 25(1): 73-79 DOI:10.1007/s10811-012-9840-2 |
Katz S, Kizner Z, Dubinsky Z, et al. Response of Porphyra linearis (Rhodophyta) to environmental factors under controlled culture conditions. Journal of Applied Phycology, 2000, 12(3-5): 535-542 |
Li DH, Xu Q, Gong YD, et al. Protective effect of phosphatidylcholine on PSⅡ membrane complex during heat treatment. Chinese Science Bulletin, 2003, 48(7): 3 |
李冬海, 许强, 公衍道, 等. 热处理过程中磷脂酰胆碱对光系统Ⅱ膜复合物的保护作用. 科学通报, 2003, 48(7): 3 |
Li XL, Wang WJ, Liang ZR, et al. Antioxidant physiological characteristics of wild Pyropia yezoensis under desiccation stress. Progress in Fishery Sciences, 2017, 38(5): 156-163 |
李晓蕾, 汪文俊, 梁洲瑞, 等. 野生条斑紫菜(Pyropia yezoensis)叶状体对干出胁迫的抗氧化生理响应特征. 渔业科学进展, 2017, 38(5): 156-163 |
Liang Y, Chen SX. Effects of temperatures on the chlorophyll fluorescence parameters and the astaxanthin content of Haematococcus pluvialis. Transactions of Oceanology and Limnology, 2009, 30(3): 112-120 |
梁英, 陈书秀. 温度对雨生红球藻叶绿素荧光特性及虾青素含量的影响. 海洋湖沼通报, 2009, 30(3): 112-120 |
Liu JW, Dong SL. Interactions between light and temperature on the growth and levels of chemical constituents of Gracilaria tenuistipitata var. Liui. Periodical of Ocean University of China (Natural Science), 2001, 31(3): 332-338 |
刘静雯, 董双林. 光照和温度对细基江蓠繁枝变型的生长及生化组成影响. 中国海洋大学学报(自然科学版), 2001, 31(3): 332-338 |
Lu JC, Wang MY, Jiang P, et al. Functioning mechanism of plant signal substances generated in mycorrhizal symbionts. Journal of Huaqiao University (Natural Science), 2012, 33(3): 290-295 |
卢静婵, 王明元, 姜攀, 等. 菌根共生体中植物信号物质的产生及其作用机制. 华侨大学学报(自然科学版), 2012, 33(3): 290-295 |
Lu X, Li MZ, Wang ZG, et al. Effects of different temperature and illumination intensity on growth and biochemical constituents of Gracilaria chouae. Journal of Fishery Sciences of China, 2014, 21(6): 1236-1243 |
卢晓, 李美真, 王志刚, 等. 光照和温度对脆江蓠的生长和生化组成的影响. 中国水产科学, 2014, 21(6): 1236-1243 |
Luo QJ, Lu D, Fei ZQ, et al. Effect of ecological factors on growth of freeliving conochocelis of Porphyra yezoensis Ueda in Zhejiang. Fisheries Science, 1999(4): 6-9 |
骆其君, 卢冬, 费志清, 等. 生态因子对条斑紫菜自由丝状体生长的影响. 水产科学, 1999(4): 6-9 |
Ma JH, Cai SQ. Cultivation and processing of Porphyra yezoensis. Beijing: Science Press, 1996
|
马家海, 蔡守清. 条斑紫菜的栽培与加工. 北京: 科学出版社, 1996
|
Maxwell K. Chlorophyll fluorescence—A practical guide. Journal of Experimental Botany, 2000, 51(345): 659-668 DOI:10.1093/jexbot/51.345.659 |
Mafakheri A, Siosemardeh A, Bahramnejad B, et al. Effect of drought stress and subsequent recovery on protein, carbohydrate contents, catalase and peroxidase activities in three chickpea (Cicer arietinum) cultivars. Australian Journal of Crop Science, 2011, 5(10): 1255-1260 |
Ottander C, Hundal T, Andersson B, et al. PhotosystemⅡreaction centres stay intact during low temperature photoinhibition. Photosynthesis Research, 1993, 35(2): 191-200 |
Ren GZ, Cui GF, Fei XG, et al. The Effect of Temperature on the growth and development of the conchocelis of Porphyra yezoensjs Ueda. Oceanologia et Limnologia Sinica, 1979, 110(1): 28-38 |
任国忠, 崔广法, 费修绠, 等. 温度对条斑紫菜丝状体生长发育的影响. 海洋与湖沼, 1979, 110(1): 28-38 |
Ruan X, Li DH, Xu Q, et al. Phosphatidylcholine-induced reactivation of photosystemⅡmembranes pretreated with Triton X-100. Journal of Photochemistry and Photobiology B: Biology, 2002, 67(2): 109-115 DOI:10.1016/S1011-1344(02)00235-X |
Shen SD, Dai JX, Zhou LR, et al. Ultrastructure of vegetative and reproductive conchocelis of Porphyra yezoensis. Marine Science Bulleten, 2000, 19(3): 38-44 |
沈颂东, 戴继勋, 周立冉, 等. 条斑紫菜(Porphyrayezoensis)丝状体的超微结构观察. 海洋通报, 2000, 19(3): 38-44 |
Teng YJ, Wang XQ, Wang P, et al. Effects of temperature and nutrients on the growth of somatic cells in Porphyra yezoensis. Agricultural Economics and Management, 2007(5): 37-40 |
滕亚娟, 王兴强, 王萍, 等. 温度和营养盐对条斑紫菜体细胞生长发育的影响. 农业经济与管理, 2007(5): 37-40 |
Terashima I, Huang LK, Osmond CB. Effects of leaf chilling on thylakoid functions, measured at room temperature, in Cucumis sativus L. and Oryza sativa L. Plant and Cell Physiology, 1989, 30(6): 841-850 DOI:10.1093/oxfordjournals.pcp.a077814 |
Varela-Alvarez E, Stengel DB, Guiry MD. The use of image processing in assessing conchocelis growth and conchospore production in Porphyra linearis. Phycologia, 2004, 43(3): 282-287 DOI:10.2216/i0031-8884-43-3-282.1 |
Wang X, Zhao P, Luo Q, et al. Metabolite changes during the life history of Porphyra haitanensis. Plant Biology, 2015, 17(3): 660-666 DOI:10.1111/plb.12273 |
Wang XL, Ma YC, Lu XP, et al. A review of species diversity of Pyropia and fundamental studies of Pyropia cultivation. Marine Sciences, 2017, 41(2): 125-135 |
王旭雷, 马颖超, 鲁晓萍, 等. 法紫菜生物多样性及其栽培生物学基础. 海洋科学, 2017, 41(2): 125-135 |
Xia YJ, Gong XZ, Gao W, et al. A comparative study on effects of light intensity and photoperiod on the growth and development of filaments of the northern and the southern Scytosiphon lomentaria in China. Journal of Fisheries of China, 2016, 40(7): 1039-1049 |
夏云捷, 宫相忠, 高伟, 等. 光照对中国南北方萱藻丝状体生长发育影响的比较. 水产学报, 2016, 40(7): 1039-1049 |
Xu P, Zhang XC, Wang SJ, et al. Reproduction and development of major economic marine algae in China. Beijing: China Agricultural Press, 2013
|
许璞, 张学成, 王素娟, 等. 中国主要经济海藻的繁殖与发育. 北京: 中国农业出版社, 2013
|
Yang H, Mao YX, Kong FN, et al. Profiling of the transcriptome of Porphyra yezoensis with Solexa sequencing technology. Chinese Science Bulletin, 2011, 56(20): 2119-2130 DOI:10.1007/s11434-011-4546-4 |
Yu NY. Physiology of algae. Dalian: Dalian Institute of Technology Press, 1987
|
姚南瑜. 藻类生理学. 大连: 大连工学院出版社, 1987
|
Zhang MR, Lu QQ, Zhu JY. The significance and influencing factors of amplification of free-living conchocelis in Porphyra yezoensis. Fisheries Science and Technology Information, 2009(2): 77-79 |
张美如, 陆勤勤, 朱建一. 条斑紫菜自由丝状体扩增的意义及影响因子. 水产科技情报, 2009(2): 77-79 |
Zhang SR. A discussion on chlorophyll fluorescence kinetics parameters and their significance. Chinese Bulletin of Botany, 1999, 16(4): 444-448 |
张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444-448 |
Zhang X, Brammer E, Pedersén M, et al. Effects of light photon flux density and spectral quality on photosynthesis and respiration in Porphyra yezoensis (Bangiales, Rhodophyta). Phycological Research, 1997, 45(1): 29-37 DOI:10.1111/j.1440-1835.1997.tb00059.x |
Zhang XC, Xu P, Qin S, et al. The genetics of marine algae. Beijing: China Agricultural Press, 2005
|
张学成, 许璞, 秦松, 等. 海藻遗传学. 北京: 中国农业出版社, 2005
|
Zheng BF, Chen MQ, Fei XG. On the effect of culture light intensity on the growth and development of the conchocelis phase of Porphyra yezoensis Ueda. Oceanologia et Limnologia Sinica, 1980, 11(4): 362-369 |
郑宝福, 陈美琴, 费修绠. 培养光强对条斑紫菜丝状体生长发育的影响. 海洋与湖沼, 1980, 11(4): 362-369 |
Zhong ZH, Wang WJ, Sun XT, et al. Developmental and physiological properties of Pyropia dentata (Bangiales, Rhodophyta) conchocelis in culture. Journal of Applied Phycology, 2016, 28(6): 3435-3445 DOI:10.1007/s10811-016-0877-5 |
Zhou R, Zhao H. Seasonal pattern of antioxidant enzyme system in the roots of perennial forage grasses grown in alpine habitat, related to freezing tolerance (EI). Physiologia Plantarum, 2004, 121(3): 399-408 DOI:10.1111/j.0031-9317.2004.00313.x |
Zhou WJ, Li Y, Dai JX. Observation on free-living conchocelis of Porphyra yezoensis. Journal of Fishery Sciences of China, 2006, 13(2): 217-223 |
周文君, 李赟, 戴继勋. 条斑紫菜自由丝状体的形态结构观察. 中国水产科学, 2006, 13(2): 217-223 |
Zhou XH, Yi LF, Xu JT, et al. Photosynthetic characteristics and SAMS gene expression in the red alga Porphyra yezoensis Ueda under high salinity. Acta Ecologica Sinica, 2013, 33(20): 6730-6735 DOI:10.5846/stxb201212291893 |
周向红, 易乐飞, 徐军田, 等. 高盐下条斑紫菜光合特性和S-腺苷甲硫氨酸合成酶基因表达的变化. 生态学报, 2013, 33(20): 6730-6735 |
Zhu JY, Ma JH, Jiang HX. Observation on the ultrastructure of free-living filament cells of Porphyra haitanensis. Journal of Fisheries of China, 1984, 8(3): 235-242 |
朱家彦, 马家海, 蒋虎祥. 坛紫菜自由丝状体细胞超微结构的初步研究. 水产学报, 1984, 8(3): 235-242 |
Zhuang HR, Chen WL, Lu HS, et al. The research of ultrastructure for different morphological cells of Haematococcus pluvialis. Chinese Journal of Applied and Environmental Biology, 2001, 7(5): 428-433 |
庄惠如, 陈文列, 卢海声, 等. 雨生红球藻不同形态细胞的超微结构研究. 应用与环境生物学报, 2001, 7(5): 428-433 |



