近年来,化石燃料的大量使用,导致CO2过度排放,气温升高、全球变暖、海洋酸化等问题随之出现。海水酸化最终会引起海洋系统内一系列化学变化,从而影响到大多数海洋生物的生理、生长、繁殖、代谢和生存(Haugan et al, 1996)。研究表明,在pH较低的海水中,贝类、甲壳类和棘皮动物等钙质生物外壳增厚,其作为饵料的价值也随之下降(Caldeira et al, 2005)。最新研究表明,地球正在经历近3亿年来最大规模的CO2排放,海洋生物与海洋生态系统将面临日益加剧的海洋酸化威胁(Ove et al, 2010)。
我国是世界上最大的水产养殖国,双壳贝类作为海水养殖重要经济种类之一,同样面临pH下降带来的威胁(何盛毅等, 2010)。目前,对厚壳贻贝(Mytilus crassitesta lischlk)、马氏珠母贝(Pinctada martensii)、太平洋牡蛎(Crassostrea gigas)及青蛤(Cyclina sinensis)的研究表明,酸化海水导致双壳贝类胚胎发育滞缓及幼虫生长缓慢等(Zheng et al, 2014; 刘文广等, 2012; 秦艳杰等, 2013)。另外,王晓琴等(2019)研究发现,pH变化会对贻贝的矿化、生长和生理过程造成不同程度的影响。海水pH变化对海湾扇贝(Argopecten irradia)幼贝的研究表明,偏酸环境和偏碱环境均会使幼贝附着力下降,触手不伸出,两壳紧闭,甚至错壳(张明亮等, 2011)。
海湾扇贝原产于美国东海岸,引进我国已30多年,主要在我国北方沿海养殖,已成为我国主要扇贝养殖品种之一。本研究以海湾扇贝为对象,分析探讨pH下降对海湾扇贝早期胚胎发育及幼虫生长发育的影响,评估pH下降对贝类养殖业的影响,旨在为贝类养殖产业在未来应对海洋酸化威胁提供科学数据,为中国海洋环境保护相关措施的制定提供理论依据。
1 材料与方法 1.1 亲贝采集及幼虫孵化海湾扇贝亲贝于2018年3月26日取自山东省莱州市长渔水产有限公司。亲贝在室内人工促熟,海水温度为22℃~23℃,采用阴干升温流水刺激法催产。待卵子排放后,洗卵并开始用于pH影响实验。
1.2 实验设计本实验以正常海水(pH 8.0~8.2)作为对照组,设置4个pH梯度(分别为7.6~7.7、7.3~7.4、7.0~7.1和6.7~6.8),每组设3个重复。
实验期间,受精完成后,按上述pH梯度转移至10 L水体的塑料桶内进行充气培养,水温为22℃~23℃,日常管理与亲贝促熟期间一致;期间投喂球等鞭金藻(Isochrysis galbana);为避免充气影响各组的pH值,实时监测和调节pH值,以减少实验误差。
1.3 pH对海湾扇贝胚胎发育的影响将受精卵迅速均分至预先设置的各实验组10 L小桶中,密度为8 ind./ml (取50 ml定量海水于显微镜下观察,多次测量的平均值作为受精卵密度);受精卵发育到D形幼虫时,从各实验组取10 ml样品,滴加碘液固定,在显微镜下测量壳高、壳长,观察并计算畸形率、孵化率等指标。
1.4 pH对海湾扇贝幼虫生长发育的影响取育苗场中发育至30 h的D形幼虫,均分至预先设置的各实验组10 L小桶中,密度为3 ind./ml,测量各实验组初始平均壳高。实验第1~8天,分别取样测量幼虫的壳高,通过与初始值对比,计算生长速率,每组测量重复3次。测量各实验组密度,计算各实验组的存活率。
1.5 pH对海湾扇贝眼点幼虫附着的影响取育苗场中海湾扇贝眼点幼虫,均分至预先设置的各实验组10 L小桶中,密度为3 ind./ml,当眼点幼虫比例>50%时,投放附着基(聚乙烯网片),分别于3、5、7 d后,测量各实验组眼点幼虫附着变态率。
1.6 数据统计分析海湾扇贝胚胎发育和幼虫生长各阶段胚胎畸形率(Deformity rate, DR, %)、孵化率(Hatching rate, HR, %)、存活率(Survival rate, SR, %)和综合评价指数(Comprehensive evaluation index, CEI)的计算公式:
| $ {\text{DR}}\left( \% \right) = 100 \times {D_t}/{S_t} $ |
| $ {\rm{HR}}\left(\% \right) = 100 \times {S_t}/F $ |
| $ {\rm{SR}}\left(\% \right) = 100 \times {L_t}/{L_o} $ |
| $ {\rm{CEI}} = - \left({{H_e} - {H_c}} \right) \times \left({{T_e} - {T_c}} \right) \times \left({{D_e} - {D_c}} \right) $ |
式中,Dt为实验结束时畸形D形幼虫密度;St为实验结束时D形幼虫总密度;F为实验起始时受精卵密度;Lo为实验起始时幼虫密度;Lt为实验结束时幼虫密度;He、Hc分别为实验组和对照组的孵化率;Te、Tc分别为实验组和对照组的孵化时间;De、Dc分别为实验组和对照组的畸形率。
采用SPSS 19.0软件对各组幼虫的生长指标进行单因素方差(One-way AVONA)分析,显著性水平设为P < 0.05。
2 结果 2.1 不同pH对海湾扇贝胚胎发育的影响在不同pH条件下,海湾扇贝胚胎孵化率、D形幼虫畸形率以及生长情况见表 1、图 1和图 2。
|
|
表 1 不同酸化程度下孵化时间、畸形率和孵化率差异 Tab.1 Differences in hatching time, deformity rate and hatching rate under different acidification level |

|
图 1 不同酸化程度下30 h时孵化率和畸形率 Fig.1 Hatching rate and deformity rate at different acidification level for 30 h 不同字母表示差异显著(P < 0.05),下同 Different superscript means significant difference (P < 0.05). The same as below |
|
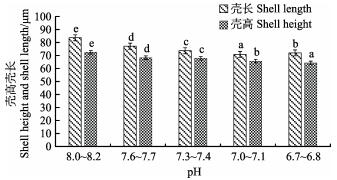
图 2 不同酸化程度下30 h时各组D形幼虫的壳长和壳高 Fig.2 Shell length and shell height of D larvae in each group at different acidification level for 30 h |
从表 1和图 1可以看出,不同pH对海湾扇贝孵化率、畸形率以及孵化时间均有显著影响(P < 0.05)。在孵化率方面,实验组与对照组均差异显著(P < 0.05),pH 7.6~7.7时,孵化率为43.75%,仅为对照组的一半;在畸形率方面,实验组与对照组同样差异显著(P < 0.05),pH 6.7~6.8时高达48.39%,而对照组仅为4.76%,相差近10倍,并且随着pH的降低,畸形率不断升高;孵化时间方面,孵化时间随着pH的下降呈现递增趋势,当pH下降至6.7~6.8时,孵化时间相比对照组延长了8 h。
为评估pH对海湾扇贝胚胎发育的综合影响,引入综合评价指数。从表 1可以看出,酸化程度越大,对海湾扇贝胚胎发育的影响越大。从图 2可以看出,对照组壳长、壳高明显高于各实验组,差异显著(P < 0.05);且各实验组壳长与壳高随着pH的降低明显下降,pH 7.0~7.1实验组与对照组相差近12 μm。
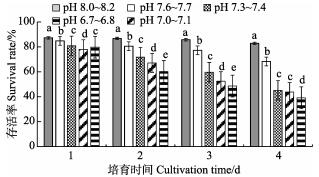
2.2 不同pH对海湾扇贝D形幼虫生长发育的影响不同pH条件下,海湾扇贝D形幼虫生长发育见图 3和图 4。从图 3可以看出,不同pH条件下,D形幼虫对照组存活率均高于实验组,且差异显著(P < 0.05)。4 d内,pH 7.6~7.7实验组存活率下降幅度较小,而pH 7.3~7.4、pH 7.0~7.1、pH 6.7~6.8实验组下降幅度较大,但各组内仍差异显著(P < 0.05),仅在第4天时,pH 7.3~7.4与pH 7.0~7.1两组差异不显著(P>0.05);第4天时,pH 6.7~6.8实验组存活率达到最低,为39.1%。
|
图 3 不同酸化程度下D形幼虫存活率 Fig.3 Survival rate of D-larvae at different acidification level |

|
图 4 不同酸化程度下D形幼虫的生长速率比较 Fig.4 Growth rate of D-larvae at different acidification level |
从图 4可以看出,不同pH条件下,D形幼虫期间对照组生长速率均显著高于实验组(P < 0.05)。4 d内,pH 7.6~7.7组生长速率均显著高于其他实验组(P < 0.05);第1天,除pH 7.0~7.1与pH 6.7~6.8两组间差异不显著(P>0.05)外,其余各组间均差异显著;第2天,pH 7.3~7.4、pH 7.0~7.1两组间差异不显著(P>0.05),其余各组间均差异显著;第4天时,实验组pH 6.7~6.8生长速率最慢,仅为5.5 μm/d,而对照组生长速率均保持在10 μm/d以上。
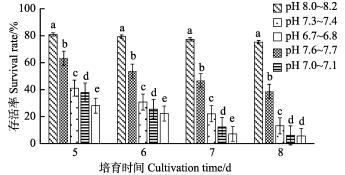
2.3 不同pH对海湾扇贝壳顶幼虫生长发育的影响从图 5可以看出,不同pH条件下,壳顶幼虫期对照组存活率与实验组差异显著(P < 0.05)。幼虫发育至第7天,pH下降0.7~0.8及更多时,存活率下降幅度较大,存活率均在20%以下;幼虫发育至第8天,实验组pH 7.0~7.1和pH 6.7~6.8的存活率分别为6.1%和5.6%。实验组pH 7.6~7.7与其他实验组相比,虽保持较高存活率,但幼虫发育至第8天时,存活率仅为38.7%,而对照组存活率仍保持较高水平,为75.2%。从图 6可以看出,壳顶幼虫期各组生长速率均差异显著(P < 0.05),壳顶幼虫发育期内,生长速率均随pH下降而降低。发育至第8天时,pH 7.3~7.4组及以下的生长速率极低,基本呈生长停滞状态。
|
图 5 不同酸化程度下壳顶幼虫存活率比较 Fig.5 Survival rate of umbo larvae at different acidification level |

|
图 6 不同酸化程度下壳顶幼虫生长速率 Fig.6 Growth rate of umbo larvae at different acidification level |
不同pH条件下,各组海湾扇贝眼点幼虫附着率情况见图 7。从图 7可以看出,除第7天,pH 7.0~7.1组比pH 7.3~7.4组附着率高,二者差异不显著(P>0.05),在第3天和第5天时,幼虫附着率均随pH的下降而降低,且对照组与各实验组间差异显著(P < 0.05)。第7天时,对照组附着率最高达到88.7%,而pH 6.7~6.8实验组附着率仅为31.7%。

|
图 7 不同酸化程度下各组海湾扇贝眼点幼虫附着率 Fig.7 Larval adhesive rate of gulf scallop larvae at different acidification level |
目前,全球海洋酸化正以前所未有的速度快速发展,据统计,海洋酸化已达到1400万年来未见的水平。环境的恶化对经济贝类的早期生长发育影响巨大,且直接关乎人工育苗的成败,环境的改变能够很大程度地影响幼虫的孵化以及生长存活(Goulletquer et al, 2002; Simon et al, 2006; Gazeau et al, 2011)。海水pH作为重要的环境因子之一,国内外对此研究较少,而主要集中于海水盐度、饵料、温度以及重金属方面(刘文广等, 2014; James et al, 2005)。
3.1 pH对海湾扇贝胚胎发育的影响研究表明,pH对海湾扇贝胚胎发育的孵化率、畸形率及孵化时间均有显著影响。在孵化率方面,与对照组相比差异显著(P < 0.05),且随着pH的降低,孵化率反而有上升趋势,pH 6.7~6.8实验组的孵化率达到60.0%,比pH 7.6~7.7实验组高出17.0%,这种情况可能是因为胚胎发育早期仅依靠自身卵黄发育,外界环境对其影响较小所致(刘文广等, 2012;
尼贝肯, 1991)。何盛毅等(2011)对马氏珠母贝的研究显示,pH=7.7时,D形幼虫孵化率[(16.6±12.0)%]显著低于对照组[(44.8±7.4)%],且畸形率[(48.2±9.1%)]比对照组高3倍;蔡娟等(2016)对青蛤的研究显示,低pH值和高pH时,胚胎发育没有明显滞后,但pH 7.4组与pH 9.0组的原肠期胚体转动速度较对照组慢;另外,Kurihara等(2008)研究pH 7.4的酸化海水对太平洋牡蛎和紫贻贝(M. edulis)胚胎发育的影响,表明胚胎发育基本不受酸化海水的影响;Gazeau等(2010)通过研究紫贻贝发现,pH为7.6条件下,其D形幼虫孵化率[(24.0±4.0)%],比对照组(pH=8.1)条件下低[(12.7±0.9)%],这些结果与本研究结果基本一致,说明pH的降低对海湾扇贝胚胎孵化具有较大影响。
在畸形率方面,D形幼虫畸形率在紫贻贝(Gazeau et al, 2010)、太平洋牡蛎(Kurihara et al, 2008)及中间球海胆(Strongylocentrotus intermedius)(秦艳杰等, 2013)中都出现过。本研究发现,畸形率随pH的下降呈现上升趋势,最高达到48.4%。Kurihara等(2008)研究发现,太平洋牡蛎幼虫也会出现明显的畸形,pH为7.4时,畸形率高达80%,这比海湾扇贝幼虫表现的更为明显。秦艳杰等(2013)对中间球海胆的研究显示,实验组长腕幼虫畸形均不同程度地表现为腕短小、萎缩、腕骨针折断、骨针弯曲变形等。这些研究结果均表明,D形幼虫的正常生长对外界酸性条件非常敏感,如果海洋酸化持续加剧,海湾扇贝幼虫将面临巨大的威胁(王有基等, 2014; Victoria et al, 2008)。
胚胎发育过程中,pH下降对其孵化时间也有显著影响。结果显示,在pH为6.7~6.8时,发育至D形幼虫的时间为29 h,而对照组仅为21 h。蔡娟等(2016)对青蛤(Cyclina sinensis)的研究报道了相似的结果,实验组与对照组相比,pH 7.4组匍匐期发育时间延迟约48 h,单水管期发育时间延迟约68 h,囊胚期纤毛轮转动慢于对照组,且一直延续至担轮幼虫。这可能是因为胚胎期完全暴露于酸化环境中,使幼虫改变了摄食渠道,从外界获取食物、环境适应能力差异导致(刘文广等, 2012; 尼贝肯, 1991)。相反,Kurihara等(2009)研究发现,地中海贻贝(Mytilus galloprovincialis)胚胎发育过程基本不受酸化海水的影响,同样,可能是胚胎发育早期仅依靠于自身的卵黄发育,外界环境对其影响较小所致(刘文广等, 2012; 尼贝肯, 1991)。
3.2 pH对海湾扇贝幼虫生长发育的影响存活率是反映贝类幼虫对环境耐受性的重要指标(尼贝肯, 1991)。当环境条件不适应时,可能会抑制贝类幼虫的钙化过程,导致其生长缓慢,甚至死亡(Kurihara et al, 2009)。结果显示,随着pH的降低,存活率也同时下降。Dove等(2007)对岩牡蛎(Saccostrea glomerata)的研究发现,被酸化的河口地区牡蛎死亡率高且生长速度慢。Watson等(2009)对岩牡蛎的研究中也发现同样的结果,在pH下降0.3的情况下,存活率下降了43.0%;在pH下降0.5的情况下,存活率下降了72.0%,这与本实验结果相近。
影响幼虫生长发育的因素包括环境因素、自身发育阶段因素以及幼虫的耐受性等(Gatos et al, 1998)。海水pH作为重要的环境因子之一,加之海洋酸化的加速,对于幼虫的生长发育是一个巨大的挑战。海洋酸化由于CO2的过度溶解,会打破海水中碳酸钙溶解平衡,而碳酸钙作为形成贝类贝壳及海洋生物骨骼的重要物质,pH下降会阻碍某些生物形成碳酸钙的能力,进而影响该生物的生长、繁育(Gatos et al, 1998)。对于双壳贝类,Green等(2004)研究发现,在pH为7.4的条件下,太平洋牡蛎幼虫发育缓慢,钙化程度降低,并且个体多数出现少壳缺壳现象;Gazeau等(2010)在紫贻贝的研究中发现,当pH下降0.25~0.34时,在2 d和13 d时的壳高分别下降了4.5%和6.0%;当pH下降0.5时,15 d时的壳厚下降了12.0%。本研究结果与前述研究结果基本相同,这说明酸化海水对于幼虫的影响仍然存在,并且幼虫的耐受性相比之前大幅下降。同样,在对马氏珠母贝(何盛毅等, 2011)的研究中发现,D型幼虫生长缓慢,且畸形率远远高于对照组;在Green等(2004)对幼年硬壳蛤(Mercenaria mercenaria)研究发现,在文石不饱和水体中死亡率显著增加,外壳在2周内全部溶解。研究表明,导致海洋生物生长发育缓慢可能是因为其细胞渗透压发生改变,为了维持体内的酸碱平衡,必然会转移部分用于其他生理过程的能量进行反馈补偿性代谢,影响了生物其他的正常生理活动,导致生长发育变慢(湛垚垚等, 2013)。这些研究结果均表明,酸化海水对贝类的生长发育影响巨大。Cooley等(2009)预测,到2060年,海洋酸化将会给美国贝类产业带来严重影响,将造成14亿美元的经济损失。
3.3 pH对海湾扇贝眼点幼虫附着的影响当眼点幼虫比例>50%时,需要投放附着基,此时是贝类由浮游幼虫向稚贝转变的重要发育阶段。当环境发生变化时,幼虫会出现附着延长或者不附着等,甚至死亡(张涛等, 2001)。本研究结果显示,随着pH的降低,附着率降低,第7天时,对照组附着率最高达到88.7%,而pH 6.7~6.8实验组附着率仅为31.7%。Welladsen等(2010)对合浦珠母贝(Pinctada fucata)研究显示,pH 7.8和7.6酸性条件下,足丝的生产数量和总长度与对照组相比,没有明显差异,但在pH 7.6条件下,珠母贝足丝明显比对照组细。另外,Donnell等(2013)研究发现,高浓度CO2条件下,贻贝足丝韧性下降,与对照组相差40.0%。结果表明,pH下降会削弱双壳贝类的附着能力。
4 结语通过研究不同pH条件下海湾扇贝胚胎发育及幼虫生长情况,证明pH下降对双壳贝类的影响巨大,说明海水酸化的不断加剧,将严重影响海洋中的生物,尤其是甲壳类、无脊椎生物的生存。总之,pH下降问题涉及各海域海洋生物及生态系统,尤其是近岸海域。需开展进一步研究,寻找不同贝类在遗传及生理等水平上对酸化海水的响应及适应情况,积极采取应对措施,构筑海洋生态屏障。
Cooley SR, Doney SC. Anticipating ocean acidification's economic consequences for commercia1 fisheries. Environmental Research Letters, 2009, 4: 024007 |
Caldeira K, Wickett ME. Ocean model predictions of chemistry changes from carbon dioxide emissions to the atmosphere and ocean. Journal of Geophysical Research: Oceans, 2005, 110(C9): S04 |
Cai J. Effects of pH on embryo development, larva growth and related enzyme activity of Green clam. Masterxs Thesis of Shanghai Ocean University, 2016
|
蔡娟. pH对青蛤胚胎发育、幼虫生长及相关酶活性的影响, 上海海洋大学硕士研究生学位论文, 2016
|
Donnell O, Michael J, Matthew N, et al. Mussel byssus attachment weakened by ocean acidification. Nature Climate Change, 2013, 3(6): 586-589 |
Dove MC, Sammut J. Histological and feeding response of Sydney rock oysters, Saccostrea glomerata, to acid sulfate soil outflows. Shellfish Research, 2007, 26(2): 509-518 |
Gazeau F, Gattuso JP, Mervyn G, et al. Effect of carbonate chemistry alteration on the early embryonic development of the Pacific oyster (Crassostrea gigas). Research Article, 2011, 6(8): 0023010 |
Gazeau F, Gattuso JP, Dawber C. Effect of ocean acidification on the early life stages of the blue mussel Mytilus edulis. Biogeosciences, 2010, 7(8): 2051-2060 |
Gatos JP. Effect of calcium carbonate saturation of seawater oncoral calcification. Global and Planetary Change, 1998, 18(1-2): 37-46 |
Green MA, Jones ME, Boudreau CL, et al. Dissolution mortality of juvenile bivalves in coastal marine deposits. Limnology and Oceanography, 2004, 49(3): 727-734 |
Welladsen HM, Southgate PC, Heimann K, et al. The effects of exposure to near-future levels of ocean acidification on shell characteristics of Pinctada fucata. Molluscan Research, 2010, 26(1): 246-250 |
Haugan PM, Drange H. Effects of CO2 on the ocean environment. Energy Conversation Management, 1996, 37(6-8): 1019-1022 |
Hoegh-Guldberg O, Bruno JF. The impact of climate change on the world's marine ecosystems. Science, 2010, 328(5985): 1523-1528 |
He SY, Lin CX, He MX, et al. Effects of ocean acidification on the development of embryo and early larva of Fritillaria martensis. Journal of Ecology, 2011, 30(4): 748-750 |
何盛毅, 林传旭, 何毛贤, 等. 海洋酸化对马氏珠母贝胚胎和早期幼虫发育的影响. 生态学杂志, 2011, 30(4): 748-750 |
James CO, Victoria J, Fabry AY. Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms. Nature, 2005, 437(7059): 681-686 |
Kurihara H, Asai T, Kato S. Effects of elevated pCO2 on early development in the mussel Mytilus galloprovincialis. Aquatic Biology, 2008, 4: 225-233 |
Liu WG, Lin JS. Effects of ocean acidification on fertilization and early development of Musculus maximus. Marine Sciences, 2012, 36: 19-23 |
刘文广, 林坚士. 海洋酸化对马氏珠母贝受精及早期发育的影响. 海洋科学, 2012, 36(4): 19-23 |
MS D, Southgate PC. The influence of algal ration and larval density on growth and survival of blacklip pearl oyster Pinctada margaritifera larvae. Aquaculture Research, 2000, 31(8-9): 621-626 |
Nybakken JW (translated by Lin GH, and Li HP). Marine biology, Ecological exploration. Beijing: Ocean Press, 1991
|
尼贝肯(林光恒, 李和平译).海洋生物学: 生态学探讨.北京: 海洋出版社, 1991
|
Qin YJ, Song XN, Li X, et al. Effects of ocean acidification and warming on larva development and growth of Middle bulb sea urchins. Journal of Dalian Ocean University, 2013, 28(5): 450-455 |
秦艳杰, 宋晓楠, 李霞, 等. 海洋酸化和升温对中间球海胆幼虫发育和生长的影响. 大连海洋大学学报, 2013, 28(5): 450-455 |
Simon M, Cra G. Development, physiology, behaviour and ecology of scallop larvae. Developments in Aquaculture and Fisheries Science, 2006, 35: 45-122 |
Victoria JF, Brad AS, Richard AF, et al. Impacts of ocean acidification on marine fauna and ecosystem processes. ICES Journal of Marine Science, 2008, 28(3): 414-432 |
Watson SA, Southgate PC, Tyler PA. Early larval development of the Sydney rock oyster Saccostrea glomerata under near-future predictions of CO2-driven ocean acidification. Journal of Shellfish Research, 2009, 28(3): 431-437 |
Wang YJ, Li LS, Li QZ, et al. Research progress of ocean acidification and global warming on the physiological ecology of shellfish. Acta Ecologica Sinica, 2014, 34(13): 3501-3502 |
王有基, 李丽莎, 李琼珍, 等. 海洋酸化和全球变暖对贝类生理生态的影响研究进展. 生态学报, 2014, 34(13): 3501-3502 |
Zhang T, Que HY. Effects of delayed metamorphosis on growth and development of marine invertebrates. Marine Sciences, 2001, 25(6): 28-30 |
张涛, 阙华勇. 延迟变态对海洋无脊椎动物生长发育的影响. 海洋科学, 2001, 25(6): 28-30 |
Wang XQ, Rastrick SPS, Wu YL, et al. Impact of seawater acidification on the energy budget of Mytilus galloprovincialis. Progress in Fishery Sciences, 2019, 40(3): 21-30 |
王晓芹, Rastrick SPS, 吴亚林, 等. 海水酸化胁迫对紫贻贝能量分配的影响. 渔业科学进展, 2019, 40(3): 21-30 |
Zhang ML, Zou J, Fang JG, et al. Effects of ocean acidification on calcification, respiration and energy metabolism of scallop Chlamys farreri. Progress in Fishery Sciences, 2011, 32(4): 48-54 |
张明亮, 邹健, 方建光, 等. 海洋酸化对栉孔扇贝钙化、呼吸以及能量代谢的影响. 渔业科学进展, 2011, 32(4): 48-54 |
Zhan YY, Huang XY, Duan LZ, et al. Effects of ocean acidification on offshore marine life. Journal of Dalian University, 2013, 34(3): 79-84 |
湛垚垚, 黄显雅, 段立柱, 等. 海洋酸化对近岸海洋生物的影响. 大连大学学报, 2013, 34(3): 79-84 |
Zhen XS, Liang MH, Yan Y, et al. The effect of different substrates on pearl oyster Pinctada martensii (Dunker) larvae settlement. Aquaculture, 2007, 271(1-4): 377-383 |



