2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006
2. Shandong Key Laboratory of Marine Ecological Restoration, Shandong Marine Resource and Environment Research Institute, Yantai 264006
维生素B6是一种水溶性维生素,以吡哆醇、吡哆醛和吡多胺3种形式存在(Halsted, 2003)。维生素B6与生物体内营养物质的代谢密切相关。首先,维生素B6作为生物体内转氨酶和脱羧酶的辅酶,参与催化氨基酸转氨、脱羧、消旋、脱硫和裂解等反应,在氨基酸代谢中起重要作用(Shiau et al, 2003);其次,作为糖原磷酸化酶的辅酶参与碳水化合物代谢,为糖异生提供碳架,维持血糖浓度;同时,其与必需脂肪酸的代谢、mRNA的合成,糖皮质激素及白蛋白的基因表达有关(Zehra et al, 2018 ; (Natori et al, 1997);此外,它还参与神经物质如γ-氨基丁酸(GABA)、多巴胺、组胺、5-羟色胺(5-HT)等的生物合成,从而影响神经系统的发育和功能(Huang et al, 2005;Akhtar et al, 2010 )。水产动物缺乏维生素B6会产生相应的缺乏症,但维生素B6过量并不会对水产动物产生明显的毒副作用。通过生长指标、肝脏维生素B6的含量、转氨酶活性等评价指标,确定了水产动物维生素B6的需求量约为1~12 mg/kg(He et al, 2009; Zehra et al, 2018; Hosokawa et al, 1992),其中,斜带石斑鱼(Epinephelus coioides)维生素B6需求量为1.75~2.22 mg/kg(Huang et al, 2005),缺乏时表现为厌食,生长不良,惊厥,螺旋状游泳等;大菱鲆(Scophthalmus maximus)维生素B6需求量为1~2.5 mg/kg(Adron et al, 1978),缺乏时表现为生长不良,厌食,运动失调,水肿,神经紊乱等;金头鲷(Spatrus aurata)维生素B6需求量为1.97 mg/kg (Kissil et al, 1981),缺乏时表现为生长迟缓,死亡率高,游泳行为不稳定和周围神经退行性改变等。
许氏平鲉(Sebastes schlegeli),隶属于鲉形目(Scorpaeniformes)、鲉科(Scorpaenidae)、平鲉属(Sebastes),又称黑鲪、黑头等,是一种冷温性卵胎生的鱼类,分布于我国黄海、渤海和东海,国外分布于朝鲜、日本和鄂霍次克海南部(刘蝉馨, 1988; 朱龙等, 1999)。许氏平鲉肉质鲜美,在沿海有黑石斑的美誉,是人工鱼礁资源增殖和网箱养殖的理想种类(冒树泉等, 2014)。目前,关于许氏平鲉营养需求研究主要涉及蛋白质、脂肪、糖类、矿物质及饲料添加剂等方面(Lee et al ,2002、2009; Cho et al, 2015; Katya et al, 2017),维生素营养需求的报道仅见维生素C (Lee et al ,1998)和维生素E (Bai et al, 1998),B族维生素研究方面尚处于空白。本研究通过在饲料中添加不同梯度的维生素B6,研究其对生长、肝脏酶活和转氨酶基因表达等指标的影响,确定许氏平鲉幼鱼对维生素B6的最适需求量,为其配合饲料的开发提供参考。
1 材料与方法 1.1 实验饲料以鱼粉、酪蛋白为主要蛋白源,鱼油为主要脂肪源,设计粗蛋白约为49.56%、粗脂肪约为9.12%的基础饲料配方。在基础饲料中分别添加0、1、2、4、8和32 mg/kg的盐酸吡哆醇(纯度为98.6%,购自上海麦克林生化科技有限公司),配制维生素B6实际含量为2.08、3.25、4.16、6.32、10.17和31.14 mg/kg 6组等氮等能的实验饲料,命名为D1、D2、D3、D4、D5和D6组,其中,D1为对照组。表 1为实验饲料的配方及营养组成。
|
|
表 1 饲料配方及营养组成 |
各原料经粉碎过80目标准筛,按配比称重后,逐级扩大法混合均匀,添加鱼油和适宜的蒸馏水,再次混合混匀,用小型饲料挤压机制成粒径为2和4 mm的颗粒饲料,60℃烘干,用塑料袋密封后于–20℃冰箱保存备用。
1.2 实验用鱼及饲养管理实验所用许氏平鲉幼鱼购自山东日照传真养殖场,养殖实验在山东日照片联绿色养殖示范基地的水泥养殖池内挂网箱(60 cm×60 cm×50 cm)中进行。正式实验前采用对照组饲料驯化,14 d后挑选体质健壮、大小均一、初始体重为(36.35±0.06) g的实验鱼540尾。实验随机分为6个组,每组3个重复,每个网箱30尾鱼,共18个网箱。养殖期间持续充气,养殖用水为深井海水,采用流水养殖。水温为16℃~18℃,溶解氧(DO) > 5.0 mg/L,pH为7.0左右,氨氮和亚硝态氮 < 0.05 mg/L。每天08:00和16:00投喂2次,初始投喂量为鱼体重的1%,并按其摄食情况调整,每日记录死鱼数量和重量。实验进行63 d。
1.3 样品采集及分析养殖实验结束后,禁食24 h,记录每个网箱鱼的数量并称重,每个网箱随机取4尾鱼,用于鱼体常规成分测定,另取8尾鱼测量体重及体长后,尾静脉取血,解剖分离内脏,分别称量内脏团、肝胰脏、肠道的重量。全鱼、背肌、肝脏样品置于–80℃条件下保存,待测。每桶中随机取2尾鱼,无菌环境下解剖,取肝尖置于无RNase离心管中并迅速置于液氮中速冻,后于–80℃超低温冰箱中保存,用于组织中相关基因表达量的分析。
实验饲料及样品中水分采用105℃恒重法测定(GB/T6435-2014),粗蛋白采用凯氏定氮法测定(GB/T6432-2018),粗脂肪采用索氏抽提法测定(GB/ T6433-2006),粗灰分采用550℃失重法测定(GB/T 6438-2007),能量采用燃烧法测定(IKA, C6000, 德国)。
肝脏中维生素B6的含量采用上海酶联生物科技有限公司试剂盒测定。超氧化物歧化酶(Superoxide dismutase, SOD)、丙二醛(Malondialdehyde, MDA)、谷草转氨酶(Glutamic oxalacetic transaminase, GOT)和谷丙转氨酶(Glutamic-pyruvic transaminase, GPT)均采用南京建成生物工程的试剂盒进行测定,肝脏组织蛋白含量采用考马斯亮兰法测定,酶活力单位定义参照试剂盒说明书。
使用Trizol法提取总RNA,提取完成后使用核酸蛋白仪(Nanoprop 2000,美国)检验RNA的浓度,并使用琼脂糖凝胶电泳检测RNA的完整性。采用PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒(Takara,日本)去除基因组DNA并反转录成cDNA后于–80℃保存待用。根据本实验室所得的许氏平鲉转录组数据,找到谷草转氨酶(GOT1和GOT2)、谷丙转氨酶(GPT1和GPT2)、酪氨酸转氨酶(TAT)、丝氨酸转氨酶(SerC)的基因序列,NCBI Nucleotide BLAST进行同源性比对分析,确定同源性较高的基因序列,利用Primer 5.0软件设计引物,选用核糖体蛋白L17(RPL17)作为内参基因(Ma et al, 2013),引物由上海生工生物技术有限公司合成,引物序列如表 2所示。实时荧光定量PCR试剂盒为TaKaRa的TB GreenTMPremix Ex TaqTMII (TliRNaseH Plus)。PCR程序:95℃预变性30 s,1个循环;95℃变性5 s,相应基因退火温度下退火30 s,72℃延伸60 s,共40个循环后增长至95℃。通过荧光定量PCR仪得出目的基因及内参基因的Ct值,按照2–∆∆Ct计算目的基因的相对表达量。本研究中,RPL17、GOT1、GOT2、GPT1、GPT2、TAT和SerC的扩增效率分别为0.992、0.962、0.979、0.965、0.989、1.055和1.027。
|
|
表 2 基因表达的引物序列 Tab.2 Primer sequences for gene expression |
增重率(Weight gain rate, WGR, %)=(鱼体末重–鱼体初重)/鱼体初重×100;
特定生长率(Specific growth rate, SGR, %/d) =(ln鱼体末重–ln鱼体初重)/养殖周期×100;
摄食率(Feed intake, FI, %/d)=摄食饲料量/[(鱼体初重+鱼体末重)/2×养殖天数] ×100;
饲料系数(Feed conversion ratio, FCR)=摄食饲料量/(鱼体末重–鱼体初重);
蛋白质效率(Protein efficiency ratio, PER, %)=(鱼体末重–鱼体初重)/(摄食饲料量×饲料中粗蛋白的含量)×100;
脏体比(Viscerosomtic index, VSI, %)=内脏团重/鱼体末重×100;
肝体比(Hepatosomatic index, HSI, %)=肝脏重/鱼体末重×100;
肠体比(Intestine-somatic index, ISI, %)=肠道重/鱼体末重×100;
肥满度(Condition factor, CF)=鱼体末重/体长3× 100;
存活率(Survival rate, SR, %)=终末鱼尾数/初始鱼尾数×100。
数据统计使用SPSS 18.0统计软件进行单因素方差分析(One-way ANOVA)。每组数据采用平均值±标准误(Mean±SE)表示,差异显著(P < 0.05)时用Duncan’s检验进行多重比较分析。采用折线模型拟合数据,确定许氏平鲉维生素B6的最适需求量。
2 结果 2.1 饲料中维生素B6对许氏平鲉幼鱼生长和形体指标的影响由表 3可知,随着维生素B6含量的升高,实验鱼增重率和特定生长率呈先上升后下降的趋势,D3组显著高于对照组(P < 0.05)。D2~D6组的摄食率无显著差异(P > 0.05),均显著高于对照组(P < 0.05)。D3组饲料系数最低,D3~D6组显著低于对照组(P < 0.05)。蛋白质效率呈现先上升后下降的趋势,D3组最高。D3组的脏体比显著高于对照组(P < 0.05);D2~D5组的肝体比显著高于对照组(P < 0.05);D2~D6组的肠体比显著高于对照组(P < 0.05),呈先升后降的趋势,在D3组达到最高值;各组间的肥满度和存活率无显著差异(P > 0.05)。
|
|
表 3 饲料中维生素B6对许氏平鲉幼鱼生长和形体指标的影响 Tab.3 Effects of dietary vitamin B6 on growth performance and body indices of juvenile S. schlegeli |
以增重率为评价指标,经折线模型拟合后得许氏平鲉幼鱼对饲料维生素B6的需求量为3.53 mg/kg(图 1)。
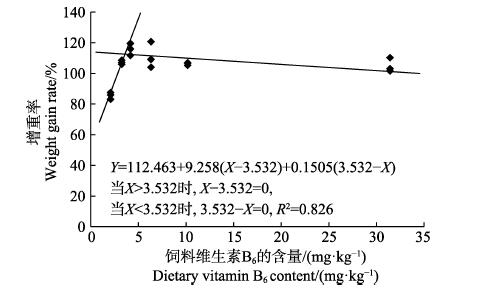
|
图 1 许氏平鲉幼鱼增重率与饲料中维生素B6含量的折线回归关系 Fig.1 The broken-line regression analysis based on weight gain rate and dietary vitamin B6 of juvenileS. schlegeli |
由表 4可知,维生素B6含量对许氏平鲉幼鱼全鱼水分和粗灰分含量无显著影响(P > 0.05),全鱼粗蛋白呈先上升后下降的趋势,D3~D6组的全鱼粗蛋白显著高于对照组(P < 0.05),且在D4组达到最高值;全鱼粗脂肪呈先上升后下降的趋势,对照组有最低值,D5组有最高值,D3~D6组之间无显著差异(P > 0.05)。
|
|
表 4 饲料中维生素B6对许氏平鲉幼鱼鱼体常规成分的影响(%湿重) Tab.4 Effects of dietary vitamin B6 on proximate composition of juvenile S. schlegeli (% wet weight) |
许氏平鲉幼鱼D3~D6组肌肉水分含量显著低于对照组(P < 0.05);肌肉粗蛋白随着维生素B6含量的增加呈先上升后下降的趋势,对照组含量最低,D3~D6组无显著差异(P > 0.05);对照组肌肉粗脂肪呈先上升后下降的趋势,D4组最高;肌肉粗灰分含量无显著变化(P > 0.05)。
2.3 饲料中维生素B6对许氏平鲉幼鱼肝脏酶活及维生素B6含量的影响由表 5可知,随着维生素B6含量的增加,肝脏超氧化物歧化酶活力呈先上升后下降的趋势,D3~D5组显著高于对照组(P < 0.05),D3组最高。丙二醛含量呈现先下降后上升的趋势,D2~D6组显著低于对照组(P < 0.05),D3组最低。D2~D6组的肝脏谷草转氨酶活力显著高于对照组(P < 0.05),D4~D6组之间无显著差异(P > 0.05)。肝脏谷丙转氨酶活力呈先上升后下降的趋势,D3~D6组显著高于对照组(P < 0.05)。肝脏维生素B6含量随着饲料维生素B6含量的增加,呈先升高后平稳的趋势,D2~D6组显著高于对照组(P < 0.05),D3~D6组间无显著差异(P > 0.05)。
|
|
表 5 饲料中维生素B6对许氏平鲉幼鱼肝脏酶活及维生素B6含量的影响 Tab.5 Effects of dietary vitamin B6 on liver enzyme activities and vitamin B6 content of juvenile S. schlegeli |
以肝脏维生素B6含量为评价指标,经折线模型拟合后得许氏平鲉幼鱼对饲料维生素B6的需求量为4.96 mg/kg(图 2);以肝脏谷丙转氨酶活力为评价指标,经折线模型拟合后得许氏平鲉对饲料维生素B6的需求量为6.32 mg/kg(图 3)。
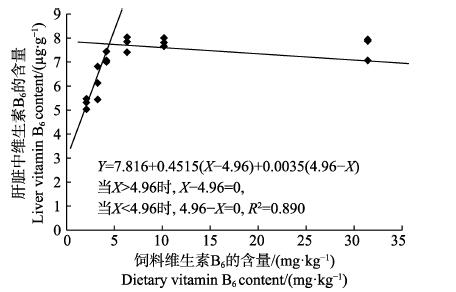
|
图 2 许氏平鲉幼鱼肝脏维生素B6含量与饲料中维生素B6含量的折线回归关系 Fig.2 The broken-line regression analysis based on liver vitamin B6 content and dietary vitamin B6 content of juvenile S. schlegeli |
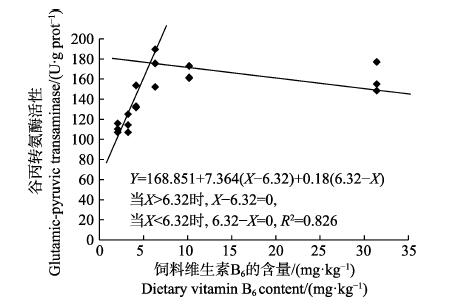
|
图 3 许氏平鲉幼鱼肝脏谷丙转氨酶活性与饲料中维生素B6含量的折线回归关系 Fig.3 The broken-line regression analysis based on liver glutamic-pyruvic transaminase and dietary vitamin B6 content of juvenile S. schlegeli |
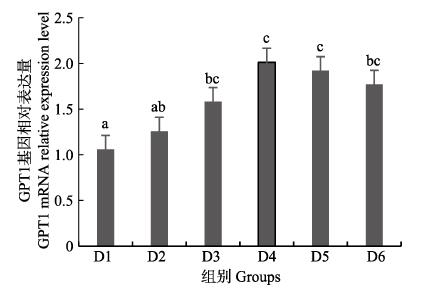
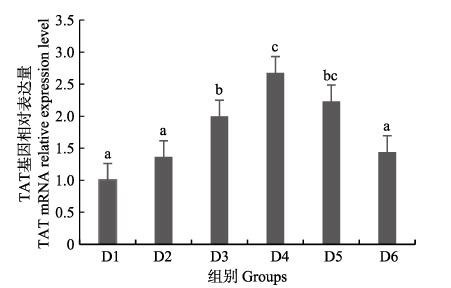
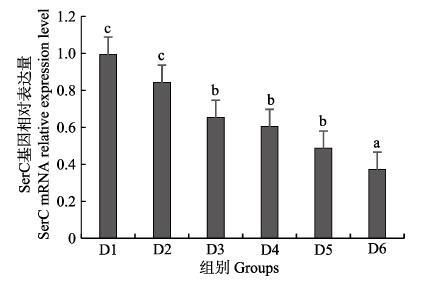
随着维生素B6含量的增加,谷草转氨酶1(GOT1)基因相对表达量呈先上升后下降的趋势,D4组显著高于对照组(P < 0.05),D3~D6组之间无显著差异(P > 0.05)(图 4);D2~D6组谷草转氨酶2(GOT2)基因相对表达量显著高于对照组(P > 0.05),D3组为最大值,D4~D6组间差异不显著(P > 0.05)(图 5);谷丙转氨酶1(GPT1)和谷丙转氨酶2(GPT2)基因相对表达量呈先上升后下降的趋势,均在D4组有最大值,且显著高于对照组和D2组(P < 0.05),D3~D6组差异不显著(P > 0.05)(图 6和图 7);酪氨酸转氨酶(TAT)呈先上升后下降的趋势,D4组有最大值,D3~D5组显著高于其他组(P < 0.05)(图 8);丝氨酸转氨酶(SerC)呈下降趋势,D3~D6组显著低于对照组和D2组(P < 0.05),D6组为最低值(图 9)。
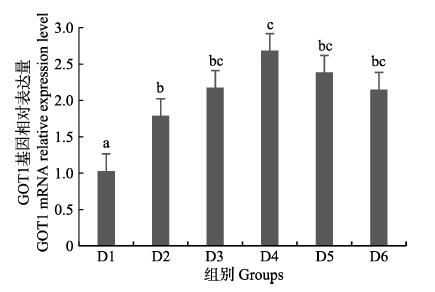
|
图 4 肝脏谷草转氨酶1(GOT1)基因相对表达量 Fig.4 The relative expression level of the glutamic oxalacetic transaminase1(GOT1) mRNA in liver 不同小写字母代表组间差异显著(P < 0.05),下同 Columns with different letters indicate significantly different between groups (P < 0.05), the same as the following |

|
图 5 肝脏谷草转氨酶2 (GOT2)基因相对表达量 Fig.5 The relative expression level of the glutamic oxalacetic transaminase2(GOT2) mRNA in liver |
|
图 6 肝脏谷丙转氨酶1(GPT1)基因相对表达量 Fig.6 The relative expression level of the glutamic-pyruvic transaminase 1(GPT1) mRNA in liver |

|
图 7 肝脏谷丙转氨酶2(GPT2)基因相对表达量 Fig.7 The relative expression level of the glutamic-pyruvic transaminase 2(GPT2) mRNA in liver |
|
图 8 肝脏酪氨酸转氨酶(TAT)基因相对表达量 Fig.8 The relative expression level of the tyrosine aminotransferase (TAT) mRNA in liver |
|
图 9 肝脏丝氨酸转氨酶(SerC)基因相对表达量 Fig.9 The relative expression level of the serine aminotransferase (SerC) mRNA in liver |
实验结束后,对照组的增重率和特定生长率均显著低于其他组,且随着维生素B6含量的增加呈先上升后下降的趋势,说明维生素B6是维持许氏平鲉正常生长发育所必需的营养物质。维生素B6在多种代谢过程中起作用,它的缺乏可导致细胞蛋白质合成和转化反应的错位,在饲料中添加适量的维生素B6会提高蛋白质的利用率(Baker et al, 1995)。本研究中,添加维生素B6组的蛋白质效率显著高于对照组,饲料系数呈先降后升的趋势,饲料利用率有所提高。水产动物缺乏维生素B6会出现相应的症状,如黄尾
本实验以增重率、肝脏维生素B6含量和谷丙转氨酶为评价指标,得出许氏平鲉幼鱼维生素B6的需求量为3.53~6.32 mg/kg,与印度鲶(Heteropneustes fossilis) 3.21 mg/kg(Mohamed, 2001)、红罗非鱼(Oreochromis mossambicus × O. niloticus) 3 mg/kg(Lim et al, 1995)、大黄鱼(Pseudosciaena crocea) 4.49~4.61 mg/kg(张春晓, 2006)、鲈鱼(Lateolabrax japonicus) 4.38~4.53 mg/kg (张春晓, 2006)、团头鲂(Megalobrama amblycephala) 4.17~ 5.02 mg/kg (王莹等, 2013)的需求量类似;高于大菱鲆1~2.5 mg/kg(Adron et al, 1978)、斜带石斑鱼1.75~2.22 mg/kg(Huang et al, 2005)的需求量;低于翠鳢(Channa punctatus) 7.6~10.4 mg/kg(Zehra et al, 2018)、黄尾
鱼体营养状态可以通过形体指标来反映,如脏体比、肝体比和肠体比。研究表明,未添加维生素B6时,吉富罗非鱼和异育银鲫(Carassius auratas gibelio)肝体比显著低于其他组(吴凡等, 2018; 王锦林等, 2011);大西洋鲑(Salmo salar)10 mg/kg组的肝体比显著高于其他组(Albrektsen et al, 1994);建鲤(Cyprinus carpio)对照组的肠体比为最低值(He et al, 2009),本实验的脏体比、肝体比和肠体比均呈先上升后下降的趋势,对照组最低,说明维生素B6不足可能会影响许氏平鲉幼鱼的器官发育能力。
3.2 饲料中维生素B6对许氏平鲉幼鱼鱼体常规成分的影响随维生素B6的增加,许氏平鲉幼鱼全鱼粗蛋白、全鱼和肌肉的粗脂肪呈先上升后下降的趋势,肌肉粗蛋白含量先上升后趋于平稳,对照组肌肉水分显著低于其他各组,这与吉富罗非鱼(吴凡等, 2018)、异育银鲫(王锦林等, 2011)的研究结果类似。维生素B6以5’-磷酸吡哆醛的形式作为转氨酶的辅酶,参与氨基酸分解代谢的第一步去除α-氨基,使氨基酸转化为相应的酮酸。维生素B6含量的增加会提高鱼体蛋白利用率,增加机体蛋白的含量,促进蛋白的合成(Baker et al, 1995; Giri et al, 1997);因此,全鱼和肌肉的粗蛋白含量会随维生素B6含量的增加而有所提高。此外,维生素B6在乙酰辅酶A和脂肪酸利用等方面的脂质代谢中起重要作用。在草鱼(Ctenopharyngodon idellus)和皱纹盘鲍(Haliotis discus hannai)中发现添加维生素B6可以调节和平衡多不饱和脂肪酸的代谢,有助于脂蛋白酯酶等的合成与释放,促进了脂肪的运输和利用,避免了脂质的沉积(冯秀妮, 2005; 黄世蕉等, 1992)。本研究中,对照组全鱼和肌肉的粗脂肪含量显著低于其他各组,随着维生素B6的增加,D5、D6组肌肉的粗脂肪和D6组全鱼的粗脂肪出现了下降,在印度鲮(Cirrhinus mrigala)的研究上也有类似结果(Zehra et al, 2017)。大西洋鲑未添加维生素B6组的全鱼和肝脏脂质含量最低(Albrektsen et al, 1994)。以上结果说明,添加适量的维生素B6,能促进机体蛋白质的合成和脂质代谢反应的正常进行。
3.3 饲料中维生素B6对许氏平鲉幼鱼肝脏维生素B6含量和抗氧化酶的影响维生素B6在氨基酸代谢和含氮化合物的反应中充当氨基转移酶和脱羧酶的辅酶,参与非必需氨基酸的合成(Baker et al, 1995)。鱼类肝脏是维生素代谢和蓄积的重要器官,肠道吸收的水溶性维生素被运送到肝脏,以满足新陈代谢的需要,肝脏中维生素B6的含量常作为特征性的评价指标(Zehra et al, 2017)。因此,测定肝脏中维生素B6的含量能更好的确定维生素B6的需求量。通过折线回归模型,以肝脏维生素B6含量为评价指标,许氏平鲉幼鱼维生素B6需求量为4.96 mg/kg。
维生素B6具有间接的抗氧化作用,可以清除机体超氧化物自由基并进一步预防氧化应激,而缺乏维生素B6会增加自由基的生成、降低抗氧化酶活性(Kumar et al, 2017)。抗氧化物酶作为鱼体抗氧化防御的重要组成部分,其中,SOD是一类抗氧化酶,从细胞环境中清除具有破坏性的活性氧(ROS),具有清除体内自由基的能力,抑制超氧化物的生成,在机体的防御系统和免疫系统中发挥着重要的作用(胡凯, 2008; Cui et al, 2016)。MDA是脂质过氧化的终产物,含量可反映机体细胞受自由基攻击的严重程度(Mccord, 1969)。在斜带石斑鱼、凡纳滨对虾(Litopenaeus vannamei)的研究中发现,维生素B6缺乏组SOD活性显著降低(Huang et al, 2005; 黄晓玲, 2014),与本实验结果相似,随着饲料维生素B6含量的增加,SOD活性呈先上升后下降的趋势,MDA呈先下降后上升的趋势,均在D3组出现极值,这表明添加适当含量的维生素B6可以提高机体的抗氧化能力。
3.4 饲料中维生素B6对许氏平鲉幼鱼肝脏转氨酶活力及其基因表达量的影响维生素B6以5’-磷酸吡哆醛的形式,作为转氨酶参与氨基酸代谢的标志性辅酶(Zehra et al, 2018),肝脏作为氨基酸代谢的主要场所,肝脏的谷草转氨酶和谷丙转氨酶常被用作评价鱼体营养状况的敏感指标,其活力间接反映蛋白质合成效率,同时,也是反映肝功能是否正常的重要指标(陈壮等, 2014; 马俊等, 2016; Smith et al, 1974)。故测定肝脏中谷草转氨酶和谷丙转氨酶的活力可以更准确得出维生素B6的需求量。本研究表明,对照组肝脏维生素B6含量和转氨酶活力均显著低于其他组,随着维生素B6含量的增加,肝脏维生素B6含量呈先上升后平稳的趋势;谷草转氨酶呈上升的趋势,但在D3~D6组无显著差异;谷丙转氨酶呈先上升后下降的趋势。这与吉富罗非鱼、异育银鲫和印度鲶的研究结果类似(Mohamed, 2001; 吴凡等, 2018; 王锦林等, 2011),说明添加维生素B6可以提高转氨酶的活力,保证鱼体蛋白质代谢的正常进行。通过折线回归模型,以谷丙转氨酶为评价指标,许氏平鲉幼鱼维生素B6需求量为6.32 mg/kg。
GOT在真核细胞中存在2种遗传上不同的同工酶,细胞质和线粒体蛋白分别由GOT1和GOT2基因编码(Jiang et al, 2015);GPT基因也常分为2个亚型,即肝细胞质中的谷丙转氨酶1(GPT1)和位于肝线粒体中的谷丙转氨酶2(GPT2)(荆晓丽, 2010)。目前,在水产动物上尚无关于维生素B6对转氨酶基因表达水平影响的报道,但研究发现,维生素B6缺乏的大鼠(Rattus norvegicus)肝脏细胞质的谷草转氨酶mRNA水平比对照组高7倍,施用皮质醇可以诱导肝谷草转氨酶mRNA的表达,而给予维生素B6会抑制由皮质醇诱导的谷草转氨酶的合成;缺乏维生素B6会增强糖皮质激素受体的DNA结合活性,提高谷草转氨酶的基因表达(Kondo et al, 1985;Oka et al, 1995)。研究表明,维生素B6缺乏不但降低了肝脏丙氨酸-乙醛酸转氨酶活性,而且还下调了肝细胞丙氨酸-乙醛酸转氨酶的基因表达(Nishijima et al, 2003)。给大鼠喂食缺乏维生素B6的饲料后,丙氨酸-乙醛酸转氨酶1活性的降低比丙氨酸-乙醛酸转氨酶2活性(在14 d内降低33%相比86%)更快速和显著(Takada et al, 1984)。5’-磷酸吡哆醛(PLP)作为糖皮质激素受体的体内调节剂,PLP水平变化会影响糖皮质激素受体的DNA结合位点,并最终影响酪氨酸转氨酶(TAT)的活性(Disorbo et al, 1981)。丝氨酸转氨酶(SerC)参与氨基酸合成通路的表达,使谷氨酸转氨基生成3-磷酸丝氨酸,SerC基因作为调控和关键酶参与L-丝氨酸的合成(刘浩等, 2015),维生素B6作为所有转氨酶的辅酶,也会影响丝氨酸转氨酶基因的表达水平。
本研究中,随着饲料中维生素B6含量的升高,GOT1的mRNA基因表达呈先上升后下降的趋势,对照组的基因表达量显著低于其他各组,D3~D6组间没有显著差异;GOT2的对照组基因表达水平最低,D3组高表达,以上结果表明,添加维生素B6会提高谷草转氨酶的基因表达。GPT1和GPT2的mRNA基因表达水平呈相似的趋势,均是先升高后降低,且在D4组表达量最高,对照组表达量最低,由此可见,维生素B6缺乏会降低谷丙转氨酶的基因表达,适宜的维生素B6添加会使其高表达。同时,TAT的基因表达水平也是对照组最低,在D3~D5组表达量显著高于对照组、D2和D6组。SerC基因表达水平呈下降趋势,对照组和D2组表达量显著高于D3~D6组。本研究结果与以上结论有差异的原因可能是物种、实验条件和方法、实验形式等所致。
随着维生素B6的添加,谷草转氨酶活力呈上升趋势,谷丙转氨酶活力先升后降,这与mRNA表达水平趋势类似,说明适宜含量的维生素B6能促进谷草转氨酶和谷丙转氨酶基因的转录,提高谷草转氨酶和谷丙转氨酶的活力,促进鱼体蛋白质合成效率和利用率,更好的调控许氏平鲉幼鱼的蛋白质代谢。此外,添加维生素B6会上调酪氨酸转氨酶基因的表达量,下调丝氨酸转氨酶基因的表达量,具体作用机制需要进一步的实验来证实。
4 结论综上,维生素B6是许氏平鲉幼鱼生长发育和维持正常生理功能的必需营养物质。适宜含量的维生素B6可以提高许氏平鲉幼鱼抗氧化能力和代谢酶活性,提高谷草转氨酶、谷丙转氨酶和酪氨酸的基因表达水平,降低丝氨酸转氨酶的基因表达水平。以增重率、肝脏维生素B6含量和谷丙转氨酶为评价指标,36 g的许氏平鲉幼鱼维生素B6的需求量为3.53~6.32 mg/kg饲料。
Adron JW, Knox D, Cowey CB, et al. Studies on the nutrition of marine flatfish. The pyridoxine requirement of turbot (Scophthalmus maximus). British Journal of Nutrition, 1978, 40(2): 261-268 |
Akhtar MS, Pal AK, Sahu NP, et al. Stress mitigating and immunomodulatory effect of dietary pyridoxine in Labeo rohita (Hamilton) fingerlings. Aquaculture Research, 2010, 41(7): 991-1002 |
Albrektsen S, Hagve TA, Lie Ø. The effect of dietary on vitamin B6 on tissue fat contents and lipid composition in livers and gills of Atlantic salmon (Salmo salar). Comparative Biochemistry and Physiology, Part A: Physiology, 1994, 109(2): 403-411 DOI:10.1016/0300-9629(94)90144-9 |
Bai SC, Lee KJ. Different levels of dietary DL-α-tocopheryl acetate affect the vitamin E status of juvenile Korean rockfish, Sebastes schlegeli. Aquaculture, 1998, 161(1): 405-414 |
Baker RTM, Davies SJ. The effect of pyridoxine supplementation on dietary protein utilization in gilthead seabream fry. Animal Science, 1995, 60(1): 157-162 |
Chen Z, Liang MQ, Zheng KK, et al. Impact of dietary protein level on growth performance, body composition and protease activity of juvenile Lateolabrax japonicus. Progress in Fishery Sciences, 2014, 35(2): 51-59 |
陈壮, 梁萌青, 郑珂珂, 等. 饲料蛋白水平对鲈鱼生长、体组成及蛋白酶活力的影响. 渔业科学进展, 2014, 35(2): 51-59 |
Cho SH, Kim HS, Myung SH, et al. Optimum dietary protein and lipid levels for juvenile rockfish (Sebastes schlegeli, Hilgendorf 1880). Aquaculture Research, 2015, 46(12): 2954-2961 DOI:10.1111/are.12450 |
Cui P, Zhou QC, Huang XL, et al. Effect of dietary vitamin B6 on growth, feed utilization, health and non-specific immune of juvenile Pacific white shrimp, Litopenaeus vannamei. Aquaculture Nutrition, 2016, 22(5): 1143-1151 DOI:10.1111/anu.12365 |
Disorbo DM, Litwack G. Changes in the intracellular levels of pyridoxal 5'-phosphate affect the induction of tyrosine aminotransferase by glucocorticoids. Biochemical and Biophysical Research Communications, 1981, 99(4): 1203-1208 DOI:10.1016/0006-291X(81)90747-6 |
Feng XN. Effects of dietary vitamin C and vitamin B6 on the metaboloam responses and shell biomineralization of juvenile abalone Haliotis discus hannai Ino. Master′s Thesis of Ocean University of China, 2005
|
冯秀妮.维生素C和B6对皱纹盘鲍(Haliotis discus hannai Ino)代谢反应和贝壳生物矿化影响的研究.中国海洋大学硕士研究生学位论文, 2005
|
Giri INA, Teshima SI, Kanazawa A, et al. Effects of dietary pyridoxine and protein levels on growth, vitamin B6 content, and free amino acid profile of juvenile Penaeus japonicus. Aquaculture, 1997, 157(3-4): 263-275 DOI:10.1016/S0044-8486(97)00157-9 |
Halsted CH. Absorption of water-soluble vitamins. Current Opinion in Gastroenterology, 2003, 19(2): 113-117 DOI:10.1097/00001574-200303000-00003 |
Hang SJ, Shen Z. The effect of vitamin B6 on the lipid metabolism of grass carp (Ctenopharyngodon idellus). Acta Hydrobiologica Sinica, 1992, 16(4): 313-321 |
黄世蕉, 沈竑. 维生素B6对草鱼脂肪代谢的影响. 水生生物学报, 1992, 16(4): 313-321 |
He W, Zhou XQ, Feng L, et al. Dietary pyridoxine requirement of juvenile Jian carp (Cyprinus carpio var. Jian). Aquaculture Nutrition, 2009, 15: 402-408 DOI:10.1111/j.1365-2095.2008.00604.x |
Hosokawa H, Teraoka R, Saito Y, et al. Dietary pyridoxine requirement of fingerling yellowtail. Aquaculture Science, 1992, 40(2): 215-220 |
Hu K. Effeets of pyridoxine on the mechanism of antioxidative in Jian carp (Cyprinus carpio var. Jian), and pathology of the pyridoxine deficiency syndrome in juvenile Jian carp. Master′s Thesis of Sichuan Agricultural University, 2008
|
胡凯.吡哆醇对幼建鲤抗氧化能力的影响及其缺乏症研究.四川农业大学硕士研究生学位论文, 2008
|
Huang JW, Tian LX, Du ZY, et al. Pyridoxine deficiency of grouper, Epinephelus coioides: Physiological and biochemical alteration. Fish Physiology and Biochemistry, 2005, 31(4): 331-337 DOI:10.1007/s10695-005-2832-2 |
Huang XL. Study on the requirements of thiamin, pantothenic acid, vitamin B6 and inositol for juvenile Pacific white shrimp, Litopenaeus vannamei. Master′s Thesis of Ningbo University, 2014
|
黄晓玲.凡纳滨对虾幼虾对硫胺素、泛酸、维生素B6和肌醇需要量的研究.宁波大学硕士研究生学位论文, 2014
|
Ishibashi Y, Kato K, Ikeda S, et al. Dietary pyridoxine requirement of juvenile Japanese parrot fish, Oplegnathus fasciatus.. Suisanzoshoku, 2002, 50(3): 347-353 |
Jiang XP, Chang HY, Zhou Y. Expression, purification and preliminary crystallographic studies of human glutamate oxaloacetate transaminase 1 (GOT1). Protein Expression and Purification, 2015, 113: 102-106 DOI:10.1016/j.pep.2015.05.010 |
Jing XL. Cloning, expression and functional analysis of amphialt in amphioxus Branchiostoma japonicus. Master′s Thesis of Ocean University of China, 2010
|
荆晓丽.青岛文昌鱼谷丙转氨酶基因克隆、表达和功能研究.中国海洋大学硕士研究生学位论文, 2010
|
Katya K, Lee SH, Bharadwaj AS, et al. Effects of inorganic and chelated trace mineral (Cu, Zn, Mn and Fe) premixes in marine rockfish, Sebastes schlegeli (Hilgendorf), fed diets containing phytic acid. Aquaculture Research, 2017, 48: 4165-4173 DOI:10.1111/are.13236 |
Kissil GW, Cowey CB, Adron JW, et al. Pyridoxine requirements of the gilthead bream, Sparus aurata. Aquaculture, 1981, 23(1-4): 243-255 DOI:10.1016/0044-8486(81)90018-1 |
Kondo T, Okada M. Effect of pyridoxine administration on the induction of cytosolic aspartate aminotransferase in the liver of rats treated with hydrocortisone. Journal of Nutritional Science and Vitaminology, 1985, 31(5): 509-517 DOI:10.3177/jnsv.31.509 |
Kumar N, Ambasankar K, Krishnani KK, et al. Dietary pyridoxine promotes growth and cellular metabolic plasticity of Chanos chanos fingerlings exposed to endosulfan induced stress. Aquaculture Research, 2017, 48(5): 2074-2087 DOI:10.1111/are.13042 |
Lee KJ, Kim KW, Bai SC. Effects of different dietary levels of L-ascorbic acid on growth and tissue vitamin C concentration in juvenile Korean rockfish,Sebastes schlegeli (Hilgendorf). Aquaculture Research, 1998, 29(4): 237-244 |
Lee SM, Jeon IG, Lee JY. Effects of digestible protein and lipid levels in practical diets on growth, protein utilization and body composition of juvenile rockfish (Sebastes schlegeli). Aquaculture, 2002, 211(1-4): 227-239 |
Lee SM, Kim KD. Effects of dietary carbohydrate to lipid ratios on growth and body composition of juvenile and grower rockfish, Sebastes schlegeli. Aquaculture Research, 2009, 40(16): 1830-1837 DOI:10.1111/j.1365-2109.2009.02288.x |
Lim C, Leamaster BR, Brock JA. Pyridoxine requirement of fingerling red hybrid tilapia grown in seawater. Journal of Applied Aquaculture, 1995, 5(2): 49-60 DOI:10.1300/J028v05n02_05 |
Liu CX. Artificial breeding of Sebastes schlegeli. Aquatic Science, 1988, 17(1): 22-23 |
刘蝉馨. 黑鲪的人工育苗. 水产科学, 1988, 17(1): 22-23 |
Liu H, Huang W. Identification and characterization of a phosphoserine aminotransferase 1 cDNA in Pseudosciaena crocea. Journal of Zhejiang Ocean University (Natural Science), 2015, 34(3): 209-215 |
刘浩, 黄伟. 大黄鱼SerC基因的克隆、鉴定以及信息学分析. 浙江海洋学院学报(自然科学版), 2015, 34(3): 209-215 |
Ma J, Wei ZH, Xing SJ, et al. Effects of dietary oligo- methionine on the growth performance, feed utilization and protein metabolism responses of juvenile large yellow croaker (Larimichthys crocea). Progress in Fishery Sciences, 2016, 37(3): 126-133 |
马俊, 魏泽宏, 邢淑娟, 等. 饲料中添加蛋氨酸寡肽对大黄鱼((Larimichthys crocea)生长、饲料利用和蛋白质代谢反应的影响. 渔业科学进展, 2016, 37(3): 126-133 |
Ma LM, Wang WJ, Liu CH, et al. Selection of reference genes for reverse transcription quantitative real-time PCR normalization in black rockfish (Sebastes schlegeli). Marine Genomics, 2013, 11: 67-73 DOI:10.1016/j.margen.2013.08.002 |
Mao SQ, Zou MY, Wang CS, et al. Optimal feeding frequency for Sebastes schlegeli juveniles. Chinese Journal of Animal Nutrition, 2014, 26(8): 2379-2385 |
冒树泉, 邹明妤, 王春生, 等. 许氏平鲉幼鱼适宜投喂频率的研究. 动物营养学报, 2014, 26(8): 2379-2385 |
Mccord JM. Superoxide dismutase: An enzymatic function for erythrocuprein (Hemocuprein). Journal of Biological Chemistry, 1969, 244(22): 6049-6055 |
Mohamed JS. Dietary pyridoxine requirement of the Indian catfish, Heteropneustes fossilis. Aquaculture, 2001, 194(3-4): 327-335 DOI:10.1016/S0044-8486(00)00510-X |
Natori Y, Oka T. Vitamin B6 modulation of gene expression. Nutrition Research, 1997, 17(7): 1199-1207 DOI:10.1016/S0271-5317(97)00089-4 |
Nishijima S, Sugaya K, Morozumi M, et al. Hepatic alanine- glyoxylate aminotransferase activity and oxalate metabolism in vitamin B6 deficient rats. Journal of Urology, 2003, 169(2): 683-686 |
Oka T, Komori N, Kuwahata M, et al. Pyridoxal 5'-phosphate modulates expression of cytosolic aspartate aminotransferase gene by inactivation of glucocorticoid receptor. Journal of Nutritional Science and Vitaminology, 1995, 41(3): 363-375 DOI:10.3177/jnsv.41.363 |
Shiau SY, Wu MH. Dietary vitamin B6 requirement of grass shrimp, Penaeus monodon. Aquaculture, 2003, 225(1-4): 397-404 DOI:10.1016/S0044-8486(03)00304-1 |
Smith CE, Brin M, Halver JE. Biochemical, physiological, and pathological changes in pyridoxine-deficient rainbow trout (Salmo gairdneri). Journal of the Fisheries Research Board of Canada, 1974, 31(12): 1893-1898 DOI:10.1139/f74-247 |
Takada Y, Mori T, Noguchi T. The effect of vitamin B6 deficiency on alanine: Glyoxylate aminotransferase isoenzymes in rat liver. Archives of Biochemistry and Biophysics, 1984, 229(1): 1-6 DOI:10.1016/0003-9861(84)90123-1 |
Wang JL, Zhu XM, Lei W, et al. Dietary vitamin B6 requirement of juvenile gibel carp, Carassius auratas gibelio. Acta Hydrobiologica Sinica, 2011, 35(1): 98-104 DOI:10.3724/SP.J.1035.2011.00098 |
王锦林, 朱晓鸣, 雷武, 等. 异育银鲫幼鱼对饲料中维生素B6需求量的研究. 水生生物学报, 2011, 35(1): 98-104 |
Wang Y, Li XF, Zhang WW, et al. Optimal dietary pyridoxine requirement of juvenil blunt snout brea, Megalobrama amblycephala. Acta Hydrobiologica Sinica, 2013, 37(4): 632-639 |
王莹, 李向飞, 张微微, 等. 团头鲂幼鱼吡哆醇适宜需求量的研究. 水生生物学报, 2013, 37(4): 632-639 |
Wu F, Ren C, Wen H, et al. Dietary vitamin B6 requirement of genetically improved farmed tilapia (Oreochromis niloticus). Chinese Journal of Animal Nutrition, 2018, 30(5): 1781-1788 |
吴凡, 任春, 文华, 等. 吉富罗非鱼对饲料中维生素B6的需要量. 动物营养学报, 2018, 30(5): 1781-1788 |
Zehra S, Khan MA. Dietary pyridoxine requirement of fingerling Channa punctatus (Bloch) based on growth performance, liver pyridoxine concentration, and carcass composition. Journal of Applied Aquaculture, 2018, 30(3): 238-255 DOI:10.1080/10454438.2018.1456999 |
Zehra S, Khan MA. Dietary thiamin and pyridoxine requirements of fingerling Indian major carp, Cirrhinus mrigala (Hamilton). Aquaculture Research, 2017, 1–13
|
Zhang CX. Studies on nutritional physiology of major B vitamins and mineral-phosphorus for large yellow croaker, Pseudosciaena crocea R. and Japanese seabass, Lateolabrax japonicus. Doctoral Dissertation of Ocean University of China, 2006
|
张春晓.大黄鱼、鲈鱼主要B族维生素和矿物质–磷的营养生理研究.中国海洋大学博士研究生学位论文, 2006
|
Zhu L, Sui FM. Biology and artificial culture of Sebastes schlegeli Hilgendorf. Modern Fisheries Information, 1999, 14(4): 21-25 |
朱龙, 隋风美. 许氏平鲉的生物学特征及其人工养殖. 现代渔业信息, 1999, 14(4): 21-25 |



