2. 烟台市海洋与渔业监督监察支队 烟台 264005
2. Yantai Marine and Fishery Supervision Detachment, Yantai 264005
口虾蛄(Oratosquilla oratoria)一般生活在浅海海域,是目前我国分布最广且产量最大的口足类动物。国内学者对口虾蛄的生物学、形态、性腺、组织、繁殖习性等开展了研究(张代臻等, 2013; 张年国等, 2018; 薛梅等, 2016)。形态学测量作为一种了解口虾蛄生长规律的手段已应用到部分海区的研究中。近10年来,有学者将形态学测量方法应用到口虾蛄地理种群的鉴别(杜欣蔚, 2016; 林月娇等, 2008)。形态学方法作为鱼类种群鉴别和物种分类的重要方法,在个体发育和系统发生学中极其重要(Cadrin, 2000; Mitteroecker et al, 2009; 陈新军等, 2013),并已将其应用于虾蛄研究(Patek et al, 2007、2013; Claverie et al, 2011、2013; Anderson et al, 2014)。
口虾蛄是山东近岸小型底拖网、定置网和流刺网等作业方式的主要捕捞对象(金显仕等, 2006),传统经济鱼类资源的严重衰退,导致口虾蛄经济价值增加,对其开发利用程度逐年升高(黄梓荣等, 2009),黄渤海口虾蛄群体面临严峻的生存压力,已出现性成熟提前的现象(盛福利等, 2009)。本研究选取分别位于山东半岛北部黄海北部海域和山东半岛南部黄海中部海域的烟台和海阳口虾蛄群体为研究对象,通过形态测量探明两地群体的形态学特征,比较群体间的形态差异,为口虾蛄的种群划分、资源管理、保护利用及口虾蛄的环境适应性研究提供基础资料和依据。
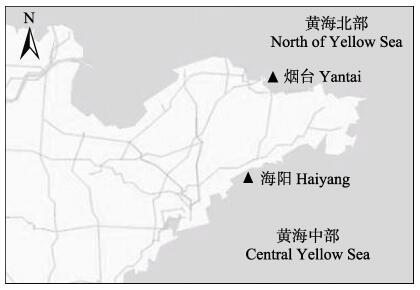
1 材料与方法 1.1 实验材料本研究所用口虾蛄样本均为流刺网渔获物,分别采集于黄海北部的烟台近岸和黄海中部的海阳近岸海域(图 1)。烟台近岸海域的样本采集于2017年4月,每10 d采集1次,共采集3次,样本总数为223尾(♀101尾、♂122尾)。海阳近岸海域的样本采集于2018年4月,每10 d采集1次,共采集3次,样本总数为290尾(♀119尾、♂171尾)。海阳样本的平均体长[(133.64±12.02) mm]比烟台群体[(130.76±13.22) mm)]高2.11%。海阳群体的平均体重[(35.28±7.95) g]比烟台群体[(30.92±8.64) g]高14.21%。
|
图 1 口虾蛄样本采集位置 Fig.1 Location of O. oratoria sample collection |
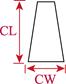
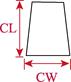
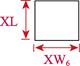
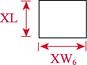
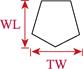
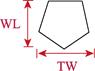
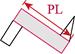
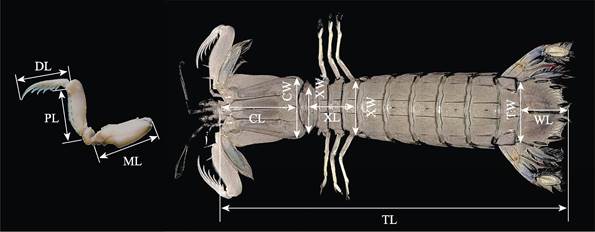
对采集的口虾蛄样本进行性别鉴定、称重和形态学测量。雄性在第3步足内有1对透明线状交接器,雌性无。样品体重(W)用电子天平测量,精确到0.1 g。形态学性状参数用游标卡尺测量,包括体长、头胸甲长、头胸甲宽、胸节长、第5胸节宽、第8胸节宽、尾节长、尾节宽、掠足长节长、掠足掌节长、掠足指节长共11个参数(图 2),精确到0.01 mm。
|
图 2 口虾蛄形态测量示意 Fig.2 Morphometric diagram of O. oratoria TL:体长; CL:头胸甲长; CW:头胸甲宽; XL:胸节长; XW5:第5胸节宽; XW8:第8胸节宽; WL:尾节长; TW:尾节宽; ML:掠足长节长; PL:掠足掌节长; DL:掠足指节长。下同 TL: Body length; CL: Carapace length; CW: Carapace width; XL: Thoracic somites length; XW5: 5th thoracic somite width; XW8: 8th thoracic somite width; WL: Telson length; TW: Telson width; ML: Merus length; PL: Propodus length; DL: Dactylus length. The same as below |
为了消除口虾蛄规格大小对形态特征的影响,采用形态学性状指标与体长的比值作为分析不同海域群体形态差异的形态学指标。同时,为反映口虾蛄各部位的几何形态差异,将头胸甲宽/头胸甲长、第5胸节宽/胸节长、第8胸节宽/胸节长、尾节宽/尾节长4项的比值作为分析形态差异的另一组形态学指标。
1.4 统计分析 1.4.1 独立样本t检验对口虾蛄样本的形态学参数进行K-S检验,样本数据均近似服从正态分布。对15项形态学指标分别进行独立样本t检验,比较海阳和烟台的口虾蛄在形态上是否有显著性差异。
1.4.2 差异系数检验判断口虾蛄海阳群体和烟台群体是否为统一种群,根据Mary等(1953)的方法计算群体形态多样性的差异系数(CD),若CD>1.28,则可视两群体为亚种以上水平的多样性差异,反之,则认为差异未达到亚种水平,属于种间差异。计算公式如下:
| $\mathrm{CD}=\left(M_{1}-M_{2}\right) /\left(S_{1}+S_{2}\right)$ |
式中,M1和M2分别表示2个群体的15项形态比例性状的平均值;S1和S2为对应的标准差。
1.4.3 主成分分析利用SPSS 23.0软件对口虾蛄的15项形态学指标进行主成分分析(Principal component analysis, PCA),得到各主成分的特征值和贡献率,根据各主成分的得分绘制主成分散布图,分析其形态差异的主要来源。
1.4.4 判别分析根据对口虾蛄形态差异贡献较大的形态学指标,建立烟台和海阳群体的判别公式。判别准确率计算公式如下:
| $判别准确率 \;P_{1}=(判断正确的口虾虾尾数/实际判别的该群体尾数)\times 100 \%$ |
| $判别准确率 \;P_{2}=(判别正确的口虾虾尾数/判入该群体尾数) \times 100 \%$ |
| $综合判别率 \;K=\sum\limits_{i=1}^{k} A_{i} / \sum\limits_{i=1}^{k} B_{i}$ |
式中,Ai为i种群判别正确的尾数;Bi为i种群的实际尾数;k为群体数。
2 结果 2.1 海阳和烟台海域口虾蛄群体结构比较雌雄异体的动物,其外部表现的性状随性别而异,称为雌雄差异或性别二态性。根据调查统计结果,海阳和烟台的口虾蛄群体中,雄性个体体型均明显大于雌性,为消除两性差异的影响,将口虾蛄分雌、雄群体分别进行统计分析。
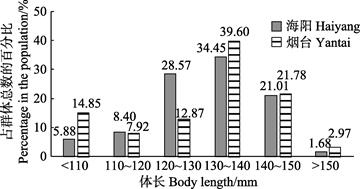
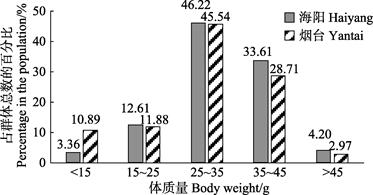
海阳和烟台雌虾的体长分别为97.68~159.32和79.21~164.28 mm,平均体长分别为(131.27±11.18)和(128.81±16.58) mm,海阳雌虾群体平均体长比烟台群体高1.91%,优势体长组均为130~140 mm,分别占总体的34.45%和39.60%(图 3)。2个海域间的雌性口虾蛄群体的体长结构相近。海阳和烟台雌虾的体重分别为11.4~51.7和7.89~69.0 g,平均体重分别为(32.59±7.88)和(30.09±9.80) g。海阳雌虾群体的平均体重略高于烟台群体,且2个海域雌虾的体重均集中分布在25~35 g区间,分别占总体的46.22%和45.54% (图 4)。从百分组成看,2个群体体重分布都较集中,且各体长区间的分布趋势极相似,说明2个海域间雌性口虾蛄群体体重结构相近。
|
图 3 口虾蛄雌虾体长分布 Fig.3 Body length distribution of female O. oratoria |
|
图 4 口虾蛄雌虾体重分布 Fig.4 Body weight distribution of female O. oratoria |
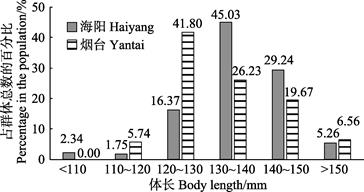
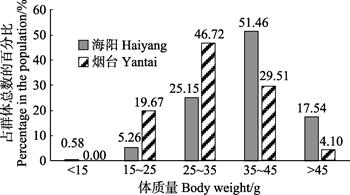
海阳和烟台雄虾的体长分别为96.48~157.92和117.85~155.37 mm,平均体长分别为(136.00±12.85)和(132.70±9.86) mm。海阳雄虾的平均体长略高于烟台群体。海阳群体雄虾的优势体长为130~140 mm,占总体的45.03%;烟台群体雄虾的优势体长为120~130 mm,占总体的41.80%(图 5)。海阳和烟台群体雄虾的体重分别为12.3~60.5和21.13~51.65 g,平均体重分别为(38.06±8.02)和(31.75±7.47) g。海阳雄虾群体的平均体重比烟台群体高19.87%。海阳地区雄虾群体的优势体重为35~45 g,占总体的51.46%;烟台群体雄虾的优势体重为25~35 g,占总体的46.72%(图 6)。对比体长和体重分布情况可知,海阳的雄性口虾蛄生长发育情况要优于烟台。
|
图 5 口虾蛄雄虾体长分布 Fig.5 Body length distribution of male O. oratoria |
|
图 6 口虾蛄雄虾体重分布 Fig.6 Body weight distribution of male O. oratoria |
2个海域中的雌性群体在W/TL、CL/TL、CW/TL、XW5/TL、XW8/TL、WL/TL、TW/TL、PL/TL、CW/CL、TW/WL共10个指标上具有极显著性差异(P < 0.01),在XW5/XL指标上差异显著(P < 0.05)(表 1)。其中,烟台雌性的W/TL、CL/TL、CW/TL、XW5/TL、XW8/TL、WL/TL、TW/TL、CW/CL、TW/WL这7个指标比海阳的平均高4.33%~24.16%,海阳雌性的PL/TL比烟台的高13.80%。雄性群体在W/TL、CL/TL、CW/TL、XW5/TL、TW/TL、PL/TL、XW5/XL、XW8/XL、TW/WL这9个性状上具有极显著性差异(P < 0.01),在XW8/TL、WL/TL、CW/CL这3个性状上差异显著(P < 0.05)。其中,烟台雄性的CL/TL、CW/TL、XW5/TL、WL/TL、XW5//XL、XW8/XL、TW/WL、XW8/TL、WL/TL、CW/CL这10个指标比海阳的平均高4.24%~ 16.58%,海阳雄性的PL/TL比烟台的高13.53%。雄性与雌性的t检验结果基本一致,两地口虾蛄具有形态差异的性状主要集中在口虾蛄的头胸甲部、胸部、尾部和第2颚足的掌节4个部位(表 2)。在15个形态指标中,关于形体宽度的指标有4个,烟台的雌、雄群体的平均值均高于海阳群体,说明烟台群体比海阳群体体型更为矮胖。烟台群体的头胸甲和尾部在整体体型中占比较大,且较为宽阔,而海阳群体的腹部在整体体型中占比较大,且较为细长。
|
|
表 1 口虾蛄独立样本检验和CD检验结果 Tab.1 Independent sample test and CD test results of O. oratoria |
|
|
表 2 海阳和烟台口虾蛄群体的形态差异 Tab.2 Morphological differences between Haiyang and Yantai O. oratoria stocks |
虽然两地的雌、雄口虾蛄形态上具有一定差异,但将其作为一个整体进行头胸甲部、尾部等各个主要性状的CD检验,其差异系数(CD)均小于1.28(表 1),这表明2个海域口虾蛄群体间的形态差异属于种内不同地理群体的差异,尚未达到亚种水平。
2.2.2 主成分分析在主成分分析前,进行KMO和Bartlett球形度检验,KMO值分别为0.732和0.767,均>0.700;Bartlett球形度检验中,P=0.000 < 0.001,综合2个检验指标,说明各变量参数之间存在相关性,所得结果具有统计分析意义,适用于主成分分析。
对雌性口虾蛄群体进行主成分因子分析,提取出3个特征值>1的形态指标,选用方差贡献率较大的3个主成分,其贡献率分别为65.698%、17.673%和7.200%,累计贡献率为87.571%。3个主成分的累计贡献率达到较高水平,包含了群体中总变异的绝大部分,因此,可以用这3个相互独立的因子来概括雌性口虾蛄群体间的形态差异。其中,主成分1的贡献率相对较大,说明2个不同海域的雌性口虾蛄群体在CL/TL、CW/TL、XL/TL、XW5/TL、XW8/TL、WL/TL、TW/TL、ML/TL、PL/TL(负荷值>0.100)这9个变量性状上存在的形态变化较大(表 3)。
|
|
表 3 口虾蛄雌雄群体形态特征因子负荷矩阵及主成分贡献率 Tab.3 Component matrix and contributive proportions of principal components on morphological characters of female and male O. oratoria |
对雄性口虾蛄群体进行主成分因子分析,提取出3个特征值>1的形态指标,选用方差贡献率较大的3个主成分,其贡献率分别为60.645%、14.034%和8.477%,累计贡献率为83.156%。3个主成分的累计贡献率达到较高水平,包含了群体中总变异的绝大部分,因此,可以用这3个相互独立的因子来概括雌性口虾蛄群体间的形态差异。其中,主成分1的贡献率相对较大,说明2个不同海域的雄性口虾蛄群体在CL/TL、XL/TL、XW5/TL、WL/TL、TW/TL、ML/TL、PL/TL(负荷值>0.100)这7个变量性状上存在的形态变化较大(表 3)。
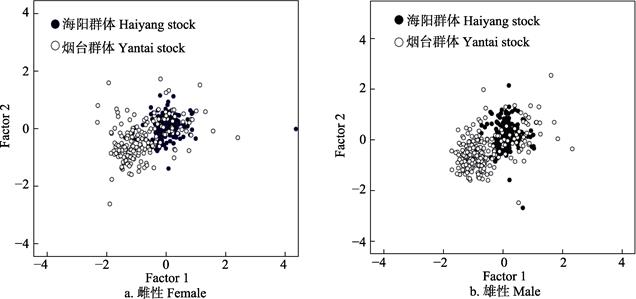
对雌性和雄性口虾蛄群体分别绘制贡献率较大的主成分1和2的散布图(图 7)。主成分1主要集中反映了口虾蛄的头胸甲部、胸部、尾部和第2颚足(掠足)等整体体型指标,主成分2主要反映了胸部指标。综合比较可知,烟台和海阳近岸的雌性和雄性群体的主成分性状主要集中在头胸甲部、胸部、尾部和第2颚足部位,雌性和雄性口虾蛄群体的主成分散布分布类似,差异较小。海阳群体和烟台群体在主成分1轴和主成分2轴上均具有较多重叠,烟台群体的主成分散布分布相对于海阳群体分散,说明烟台群体在头胸甲部、胸部、尾部和第2颚足体型指标上变化幅度要高于海阳群体,也从侧面印证海阳口虾蛄比烟台口虾蛄体型上更为细长。从整体上看,烟台群体的体型较宽阔,主要表现在头胸甲、胸部的宽度上。烟台雌性群体的CW/TL和XW5/TL平均值(0.1729和0.1403)均高于海阳雌性群体(0.1446和0.1130),烟台雄性群体的CW/TL和XW5/TL平均值(0.1851和0.1423)均高于海阳雄性群体(0.1598和0.1196),说明在同一体长时,烟台雌性和雄性口虾蛄群体的头胸甲部和胸部都比海阳群体宽。
|
图 7 口虾蛄雌雄群体的主成分散布分布 Fig.7 Distribution of principal components of female and male O. oratoria |
采用逐步筛选变量的方法,从15个形态学指标中筛选出9个具有显著贡献的变量(P < 0.01),依次为X1-W/TL、X3-CW/TL、X4-XL/TL、X5-XW5/TL、X7- WL/TL、X8-TW/TL、X9-ML/TL、X10-PL/TL和X15- TW/TL。基于这9个变量的特征值建立4个判别函数,分别表示海阳和烟台近岸口虾蛄的雌、雄群体:
海阳雌性群体:
| $Y=51.276 X_{1}+161.157 X_{3}+172.252 X_{4}-165.467 X_{5}+ \\ 678.578 X_{7}-718.087 X_{8}-204.126 X_{9}+215.718 X_{10}+ \\ \quad 375.595 X_{15}-216.282$ |
海阳雄性群体:
| $Y=66.682 X_{1}+185.168 X_{3}+143.268 X_{4}-190.776 X_{5}+ \\ 667.502 X_{7}-706.964 X_{8}-177.233 X_{9}+198.774 X_{10}+ \\ 371.529 X_{15}-214.753$ |
烟台雌性群体:
| $Y=55.855 X_{1}+199.767 X_{3}+127.306 X_{4}-125.299 X_{5}+ \\ \quad 721.610 X_{7}-588.051 X_{8}-114.523 X_{9}-23.964 X_{10}+ \\ 381.347 X_{15}-229.820$ |
烟台雄性群体:
| $Y=59.501 X_{1}+231.005 X_{3}+116.551 X_{4}-130.284 X_{5}+ \\ 647.771 X_{7}-561.957 X_{8}-97.071 X_{9}-19.577 X_{10}+ \\ 371.165 X_{15}-219.495$ |
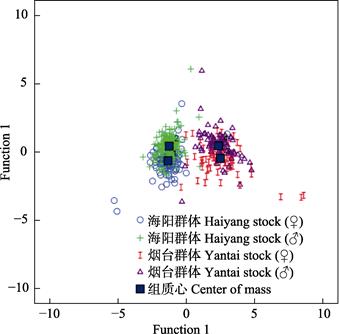
判断某口虾蛄的群体归属时,将其9个性状的特征值分别代入上述4个判别方程式,得到4个函数值,得到最大函数值的判别函数对应的群体即为该口虾蛄的群体类别(李勇等, 2001)。为了验证上述判别方程式的准确性,对所测样本进行预测分类。判别准确率P1为61.8%~84.0%,P2为62.2%~87.2%,综合判别率为74.0%。交互检验后P1为61.5%~83.2%,P2为60.0%~86.6%,综合判别率为72.5%,说明建立的判别公式对相应群体的判别是可行的,适合对样品的初判(表 4)。海阳地区口虾蛄群体的判别准确率较高,其雌性群体和雄性群体间的形态差异相对于烟台地区更为显著。4组群体中,不同地区口虾蛄群体间的形态差异明显,而同一地区雌、雄群体间的形态差异相对较小(图 8),说明地理位置和栖息环境是影响口虾蛄群体形态差异的重要因素。
|
|
表 4 口虾蛄4个群体的判别结果 Tab.4 Discriminant results of four O. oratoria stocks |
|
图 8 口虾蛄4组群体的散点图 Fig.8 Scatter plot of four O. oratoria stocks |
雌雄异体的动物,其外部表现性状随性别而异,称为雌雄差异或性别二态性,可能成因包括天择、性择和生殖选择。两性体型差异是两性异形的一个常见例子。口虾蛄是典型的群居生物,雄性口虾蛄体型的强壮无疑会使其在寻找配偶时更有竞争力。本研究采集的海阳和烟台口虾蛄样本中,雄性的体型明显比雌性大,雄性的平均体长和体重分别比雌性高3.31%和11.38%。大部分雌、雄个体的生长情况已具有明显差异,说明口虾蛄是典型的性别二态性物种。蒋霞敏等(2000)在研究黑斑口虾蛄(Oratosquilla kempi)时也发现,雌、雄个体身体各部分的生长发育速度在不同阶段有所差异。其中,头胸甲长随体长的增加呈匀速增长,雌雄略有差异,雄性头胸甲比雌性生长略快。而尾扇长随体长增加呈匀速增加,体长小于111.52 mm时,雌性尾扇长于雄性,而当体长达111.52 mm以后,雌性尾扇短于雄性。
3.2 烟台和海阳群体的形态差异本研究结果显示,2个海域口虾蛄群体间存在显著的形态差异,主要体现在头胸甲部、胸部、尾部和第2颚足,主成分分析发现,2个群体在横向体型因子上差异最明显。虽然2个口虾蛄群体的形态存在显著差异,但仍属于同一个种的不同地理种群,还没有进化到种间或亚种的程度。同一物种不同群体间的形态差异,与群体间的地理距离有相关性,若地理位置距离较近,则群体间的亲缘关系也相对较近(徐敬明等, 2015)。本研究中,2个口虾蛄群体分别位于山东半岛的南北两侧海域,生活环境存在明显的差异,北侧黄海北部表层水温低于南侧黄海中部水温,而盐度则呈南高北低的分布趋势(金显仕等, 2005)。此外,山东近海属于大陆架浅海,黄海北部底质多泥沙,而黄海中部砂质较多(许鹏, 2005),可能是形成2个群体间形态差异的重要因素。董志国等(2010)研究中国海三疣梭子蟹(Portunus trituberculatus)时发现,造成群体形态分类差异的原因是不同地理位置和不同栖息环境共同影响的结果。在克氏原螯虾(Procambarus clarkii)群体的分析中也得到同样结论(邹桂伟等, 2009)。此外,栖息地扰动和生存环境的影响,或组成饵料的营养成分不同,对一些物种的形态特征和进化方向造成一定影响(沈伟良等, 2017; Hassani et al, 2019)。人为干扰因素(如养殖废水、工业污水、生活污水等环境污染物的任意排放)也会对群体间的形态差异产生严重影响。海阳群体总体形态上较烟台群体要更细长。烟台群体的头胸甲和尾部在整体体型中占比较大,且较为宽阔,而海阳群体的腹部在整体体型中占比较大,且较为细长。口虾蛄的头胸甲部是主要的感觉和摄食中心,第2颚足和尾部是主要的捕食、挖、掘穴和防卫器官,胸、腹部为主要的游泳和呼吸器官(王春琳等, 1996a)。因此,2个群体形态上的差异很可能与栖息环境中的水流环境和底质差异有关。
4月,海阳口虾蛄群体的体型比烟台群体更健壮,其平均体长和平均体重分别比烟台群体高2.1%和14.21%。形态特征指标中,海阳的雄性口虾蛄PL/TL、ML/TL和DL/TL和雌性口虾蛄PL/TL和DL/TL平均值以及CL/TL平均值均明显高于烟台群体。因此,推测口虾蛄第2颚足和头胸甲的形态、比例与其捕食能力有密切联系。第2颚足是鉴别虾蛄种类的重要依据(Caldwell et al, 1976),其形态特征反映了虾蛄的捕食方式和捕食能力(Patek et al, 2005、2004)。王春琳等(1996b)对口虾蛄进行生物学观察后认为,掠足长度限制了口虾蛄对饵料生物的攻击范围。而李铭五(1988)在研究虾蛄对日本对虾的捕食行为时也发现,日本对虾甲壳长等于虾蛄头胸甲长的1/2或者等于虾蛄身体长的1/2或1/3大小时,最适于虾蛄捕食。
3.3 形态比较样本采集方式的选择甲壳动物的个体发育需要通过蜕皮来实现,即蜕去旧的外骨骼并长出新的外骨骼的过程。虽然已经有幼体期口虾蛄蜕皮周期的研究报道(王波等, 1998),但目前还没有对自然海域的口虾蛄蜕皮进行深入研究,对成体蜕皮的具体时间更未有报道。王春琳等(1996b)通过对浙江近岸海区调查结合实验室活体培养观察与实验,认为8~11月是口虾蛄的蜕皮与生长阶段,但未明确蜕皮的具体时间和过程。邓景耀等(1992)对渤海口虾蛄调查研究时发现,1~3月为其越冬期,5~7月为产卵期,5月为产卵盛期。因此,本研究筛选4月作为本实验的采样期,同时,选择流刺网渔获物为样本采集源,以排除幼体在群体形态特征比较时的影响。根据李显森等(2016)在渤海进行的口虾蛄三重刺网、单层刺网和底拖网渔获组成的比较发现,网目尺寸在50~60 mm的三重刺网和单层刺网捕获的口虾蛄体长范围为78~166 mm,优势体长组为120~130 mm,而底拖网捕获的口虾蛄体长范围为64~130 mm,优势体长组为80~90 mm。根据统计,本研究采集的口虾蛄样本90%以上为110 mm以上个体。因此,可判断实验期间所捕获的是率先进入渔场的口虾蛄群体中发育较早的产卵群体。根据王波等(1998)的研究可判断基本上为2龄以上的成体。
甲壳动物蜕皮周期一般分为蜕皮后期、蜕皮间期、蜕皮前期和蜕皮期,发生形态变化的时刻发生在蜕皮期,只占了整个蜕皮周期的相对较短的时间,且根据种类的不同而有长短差异。甲壳动物在蜕去旧的外骨骼后,摄入水分,柔软的新皮膨胀,这种身体的增大严格讲并非“生长”(罗荣生, 1989)。为排除4月采样时,口虾蛄群体中处于不同蜕皮周期的个体对形态差异分析时的影响,本研究在30 d内采集3次,每次间隔时间约为10 d左右。实验中采集的所有口虾蛄样本的外壳都很坚硬,并未发现蜕皮现象,基本可排除同一批群体中处于不同蜕皮周期的幼体对形态差异分析的影响。因此,判断口虾蛄产卵前不进行蜕皮,以4月的口虾蛄样本进行群体间形态差异的比较研究是十分适宜的。
Anderson PS, Claverie T, Patek SN. Lever and linkages mechanical trade-offs in a power-amplified system. Evolution, 2014, 68(7): 1919-1933 DOI:10.1111/evo.12407 |
Cadrin SX. Advances in morphometric identification of fishery stocks. Reviews in Fish Biology and Fisheries, 2000, 10(1): 91-112 DOI:10.1023/A:1008939104413 |
Caldwell RL, Dingle H. Stomatopods. Scientific American, 1976, 81-89 |
Chen XJ, Fang Z, Su H, et al. Review and application of geometric morphometrics in aquatic animals. Journal of Fisheries of China, 2013, 37(12): 1873-1885 [陈新军, 方舟, 苏杭, 等. 几何形态测量学在水生动物中的应用及其进展. 水产学报, 2013, 37(12): 1873-1885] |
Claverie T, Chan E, Patek SN. Modularity and scaling in fast movements:Power amplification in mantis shrimp. Evolution, 2011, 65(2): 443-461 |
Claverie T, Patek SN. Modularity and rates of evolutionary change in a power-amplified prey capture system. Evolution, 2013, 67(11): 3191-3207 DOI:10.1111/evo.12185 |
Deng JY, Cheng JS. Biological study on mantis shrimps fishery in Bohai Bay. Qingdao:Qingdao Ocean University Press, 1992, 36-44 [邓景耀, 程济生. 渤海口虾蛄渔业生物学研究. 青岛:青岛海洋大学出版社, 1992, 36-44] |
Dong ZG, Li XY, Yan BL, et al. Morphological variation analysis among five populations of the swimming crab Portunus trituberculatus from China Sea areas. Marine Science Bulletin, 2010, 29(4): 421-426 [董志国, 李晓英, 阎斌伦, 等. 中国海五种群三疣梭子蟹的形态差异分析. 海洋通报, 2010, 29(4): 421-426 DOI:10.3969/j.issn.1001-6392.2010.04.012] |
Du XW. Genetic diversity of Oratosquilla oratoria stocks in east China. Masterxs Thesis of Zhejiang Ocean University, 2016 [杜欣蔚. 中国东部近海口虾蛄群体遗传多样性研究. 浙江海洋大学硕士研究生学位论文, 2016] |
Hassani MSE, Hassan EME, Slimani T, et al. Morphological and physiological assessments reveal that freshwater turtle (Mauremys leprosa) can flourish under extremely degraded-polluted conditions. Chemosphere, 2019, 220: 432-441 DOI:10.1016/j.chemosphere.2018.12.142 |
Huang XR, Zhang HH. Composition and distribution of Squilla in the continental shelf waters of northern South China Sea. Progress in Fishery Sciences, 2009, 30(6): 125-130 [黄梓荣, 张汉华. 南海北部陆架区虾蛄类的种类组成和数量分布. 渔业科学进展, 2009, 30(6): 125-130 DOI:10.3969/j.issn.1000-7075.2009.06.017] |
Jiang XM, Zhao QS, Wang CL. Analysis on morphological parameters of Oratosquilla kempi. Journal of Sun Yat-Sen University (Natural Science), 2000(z1): 268-270 [蒋霞敏, 赵青松, 王春琳. 黑斑口虾蛄的形态参数关系的分析. 中山大学学报(自然科学版), 2000(z1): 268-270 DOI:10.3321/j.issn:0529-6579.2000.z1.057] |
Jin XS, Cheng JS, Qiu SY, et al. Comprehensive study and evaluation of fishery resources in Huang-Bohai Sea. Beijing:China Ocean Press, 2006 [金显仕, 程济生, 邱盛尧, 等. 黄、渤海渔业资源综合研究与评价. 北京:海洋出版社, 2006] |
Jin XS, Zhao XY, Meng TX, et al. Biological resources and habitat environment in Huang-Bohai Sea. Beijing:China Science Press, 2005 [金显仕, 赵宪勇, 孟田湘, 等. 黄、渤海生物资源与栖息环境. 北京:科学出版社, 2005] |
Li MW. Feeding study of Oratosquilla oratoria. Marine Fisheries, 1988(6): 288 [李铭五. 虾蛄食性研究. 海洋渔业, 1988(6): 288] |
Li XS, Wu YF, You ZB, et al. Analysis on the catch composition by trammel net and its fishing performance for Oratosquilla oratoria in the Bohai Sea. Marine Fisheries, 2016, 38(5): 516-524 [李显森, 吴亚飞, 尤宗博, 等. 渤海口虾蛄三重刺网渔获组成及其捕捞性能分析. 海洋渔业, 2016, 38(5): 516-524 DOI:10.3969/j.issn.1004-2490.2016.05.008] |
Li Y, Li SF, Wang CH, et al. Establishment and application of morphological discrimination model for juveniles Eriocheir sinensis from Liaohe, Yangtze and Oujiang rivers. Journal of Fisheries of China, 2001, 25(2): 120-126 [李勇, 李思发, 王成辉, 等. 三水系中华绒螯蟹形态判别程序的建立和使用. 水产学报, 2001, 25(2): 120-126] |
Lin YJ, Liu HY, Xu HL, et al. Morphometry of mantis shrimp Oratosquilla oratoria in Dalian coast. Journal of Dalian Ocean University, 2008, 23(3): 215-217 [林月娇, 刘海映, 徐海龙, 等. 大连近海口虾蛄形态参数关系的研究. 大连海洋大学学报, 2008, 23(3): 215-217 DOI:10.3969/j.issn.1000-9957.2008.03.011] |
Luo RS. The molting of Crustaceans. Fishery Science and Technology Information, 1989(6): 186-188 [罗荣生. 甲壳纲动物的蜕皮. 水产科技情报, 1989(6): 186-188] |
Mayr E, Linsley EG, Usinger RL. Methods and principles of systematic zoology. New York; McGraw Hill Book Company, 1953 |
Mitteroecker P, Gunz P. Advances in geometric morphometrics. Evolutionary Biology, 2009, 36(2): 235-247 |
Patek SN, Caldwell RL. Extreme impact and cavitation forces of a biological hammer:Strike forces of the peacock mantis shrimp (Odontodactylus scyllarus). Journal of Experimental Biology, 2005, 208: 3655-3664 DOI:10.1242/jeb.01831 |
Patek SN, Korff WL, Caldwell RL. Deadly strike mechanism of a mantis shrimp. Nature, 2004, 428(6985): 819-820 DOI:10.1038/428819a |
Patek SN, Nowroozi BN, Baio JE, et al. Linkage mechanics and power amplification of the mantis shrimpxs strike. Journal of Experimental Biology, 2007, 210: 3677-3688 DOI:10.1242/jeb.006486 |
Patek SN, Rosario MV, Taylor JR. Comparative spring mechanics in mantis shrimp. Journal of Experimental Biology, 2013, 216(7): 1317-1329 DOI:10.1242/jeb.078998 |
Shen WL, Wu XF, Shen TJK, et al. The effects of different diets and culture environments on the morphological variations in the large yellow croaker (Larimichthys crocea). Progress in Fishery Sciences, 2017, 38(6): 72-79 [沈伟良, 吴雄飞, 申屠基康, 等. 不同饵料及养殖环境对大黄鱼(Larimichthys crocea)形态差异的影响. 渔业科学进展, 2017, 38(6): 72-79] |
Sheng FL, Zeng XQ, Xue Y. Breeding and feeding habits of Oratosquilla oratoria in the off-shore area of Qingdao. Journal of Ocean University of China (Natural Science), 2009, 39(S1): 326-332 [盛福利, 曾晓起, 薛莹. 青岛近海口虾蛄的繁殖及摄食习性研究. 中国海洋大学学报(自然科学版), 2009, 39(S1): 326-332] |
Wang B, Zhang XL, Sun PX. On biological characters and artificial seedling-rearing techniques of mantis shrimp (Oratosquilla oratoria). Journal of Oceanography of Huanghai and Bohai Seas, 1998, 16(2): 64-73 [王波, 张锡烈, 孙丕喜. 口虾蛄的生物学特征及其人工苗种生产技术. 黄渤海海洋, 1998, 16(2): 64-73] |
Wang CL, Xu SL, Mei WX, et al. Preliminary observations on appendage morphology and living behaviors of Oratosquilla oratoria. Journal of Zhejiang Ocean University (Natural Science), 1996b(1): 9-14 [王春琳, 徐善良, 梅文骧, 等. 口虾蛄的附肢形态及生活习性的初步观察. 浙江海洋学院学报(自然科学版), 1996b(1): 9-14] |
Wang CL, Xu SL, Mei WZ, et al. A biological basic character of Oratosquilla oratoria. Journal of Zhejiang Ocean University, 1996a, 15(1): 60-62 [王春琳, 徐善良, 梅文骤, 等. 口虾姑的生物学基本特征. 浙江水产学院学报, 1996a, 15(1): 60-62] |
Xu JM, Yang ML, Wu B, et al. Morphological variation analysis among nine populations of Perisesarma bidens from coasts of China. Sichuan Journal of Zoology, 2015, 34(4): 481-488 [徐敬明, 杨明柳, 吴斌, 等. 中国沿海双齿近相手蟹9个群体形态差异分析. 四川动物, 2015, 34(4): 481-488] |
Xu P.Effects of intertidal culture on biodiversity in the Yellow-Bohai intertidal zone.Beijing: China Science and Technology Paper Online, 2005-11-18 [许鹏.滩涂养殖对黄渤海潮间带生物种群多样性的影响.北京: 中国科技论文在线, 2005-11-18]
|
Xue M, Yan HW, Liu HY, et al. Reproductive biology of mantis shrimp Oratosquilla oratoria in Pikou Bay in coastal Dalian. Journal of Dalian Ocean University, 2016, 31(3): 237-245 [薛梅, 闫红伟, 刘海映, 等. 大连市皮口海域口虾蛄群体繁殖生物学特征初步研究. 大连海洋大学学报, 2016, 31(3): 237-245] |
Zhang DZ, Ding G, Zhou TT, et al. Genetic diversity of Oratosquilla oratoria populations in Yellow Sea. Chinese Journal of Zoology, 2013, 48(2): 232-240 [张代臻, 丁鸽, 周婷婷, 等. 黄海海域口虾蛄种群的遗传多样性. 动物学杂志, 2013, 48(2): 232-240] |
Zhang NG, Pan GP, Zhou WY. A preliminary study on first feeding and early growth of larval Oratosquilla oratoria. Journal of Guangdong Ocean University, 2018, 38(5): 79-85 [张年国, 潘桂平, 周文玉, 等. 口虾蛄幼体开口饵料及早期生长的初步研究. 广东海洋大学学报, 2018, 38(5): 79-85] |
Zou GW, Lou XZ, Wang CZ, et al. Genetic diversity in four Procambarus clarkii populations in the lower reaches of the Yangtze River. Biodiversity Science, 2009, 17(5): 518-523 [邹桂伟, 罗相忠, 王长忠, 等. 长江下游地区4个克氏原螯虾群体的遗传多样性分析. 生物多样性, 2009, 17(5): 518-523] |