2. 湖南生物机电职业技术学院 长沙 410127
2. Hunan Biological and Electromechanical Polytechnic, Changsha 410127
中华鳖(Trionyx sinensis)是我国重要的名特优水产养殖动物之一,具有较高的营养价值和药用价值(Zhang et al, 2018)。近年来,养殖过程中抗生素的使用与日俱增,抗生素虽然能有效防治动物疾病,但也会导致病原菌耐药性以及药物残留等问题,对养殖环境和人类健康造成一定的影响。在此背景下,寻求绿色、健康、无污染的抗生素替代物已经成为当前养殖业可持续发展的必然趋势(胡贵丽等, 2018)。
植物提取物中富含多种活性成分,并且具有天然、绿色、无污染等特点,这使得植物提取物成为最具潜力的抗生素替代物(陶新等, 2018)。血根碱是从博落回(Macleaya cordata)中分离出来的一种苯菲啶异喹啉类生物碱,在2011年被批准为国家二类新兽药(2011新兽药证字34号),作为绿色、安全、高效的抗生素替代物已经被广泛应用。研究表明,从博落回中提取的血根碱能促使小肠细胞更新,改善肠道健康和提高肠道免疫机能(陈家顺等, 2018),调控肠道中微生物菌群的稳定(Chen et al, 2018)。肠道微生物的稳定在营养物质消化吸收(李桂英等, 2013)、提高抵抗力和免疫机制中起着不可替代的作用(汤菊芬等, 2016)。肠道微生物群的失调与许多慢性病症息息相关(Khachatryan et al, 2008),在影响健康肠道菌群构成和功能的因素中,遗传(Turnbaugh et al, 2009)、食物(Hildebrandt et al, 2009)和药物摄入(Russell et al, 2012)等似乎都发挥了作用。
本研究以中华鳖为实验动物,投喂血根碱添加量不同的饲料进行养殖实验。饲养实验结束后,利用高通量测序对中华鳖肠道样品进行16S rRNA V3-4区测序分析,旨在研究血根碱对中华鳖肠道微生物多样性及物种丰度的影响。本研究从微生物角度来评价血根碱添加剂的作用,为血根碱在中华鳖饲料中的科学利用提供理论依据。
1 材料与方法 1.1 实验材料实验中华鳖购于湖南常德市河州甲鱼合作社,挑选480只体重为(31.75±7.20) g的健康活泼的中华鳖。暂养于水泥养殖池中1周后,按照不同添加浓度进行分组(RS1:0;RS2:50 mg/kg; RS3:100 mg/kg; RS4:150 mg/kg),每组设3个重复,每个重复组放养40只中华鳖。血根碱(博落回散)购于湖南美可达生物资源有限公司,其有效成分为血根碱(≥98%)。根据实验组的设定向饲料中添加血根碱,并混匀,现配现用。投喂量约为中华鳖体重的3%,每天投喂2次,饲养75 d。
饲养结束后,禁食24 h,从每个重复组中随机选取5只中华鳖,将其转移至实验室内,使用丁香油将其麻醉后放置于解剖盘中,用75%的酒精进行体表消毒,再用0.85%的无菌生理盐水冲洗2~3次。按照实验动物福利的基本要求在无菌操作环境下进行解剖,取中肠组织,用生理盐水冲洗掉内容物后,立即放入液氮,速冻后移至–80℃储存备用。
1.2 基因组DNA的提取和测序高通量测序部分均委托北京诺禾致源科技股份有限公司(NOVOGENE)完成,具体操作方法如下:
(1) 基因组DNA的提取和PCR扩增:样品基因组DNA采用SDS法提取,并通过琼脂糖凝胶电泳检测DNA的浓度和纯度。在离心管中,用无菌水将样品稀释至1 ng/μl。以稀释的基因组DNA为模板,根据测序区域(16S V3-V4区)的选择,使用带Barcode的特异引物,Phusion High-Fidelity PCR Master Mix with GC Buffer (New England Biolabs)和高效高保真酶进行PCR,确保扩增准确性和效率。
(2) PCR产物的混样和纯化:PCR产物使用2%的琼脂糖凝胶电泳检测; 根据PCR产物浓度进行等质量混样,充分混匀后,使用2%琼脂糖胶电泳纯化PCR产物,切割回收目标条带。使用GeneJET胶回收试剂盒(Thermo Scientific)回收产物。
(3) 上机测序与数据统计:使用TruSeq DNA PCR- Free Sample Preparation Kit试剂盒构建文库,构建好的文库经过Q-PCR和Qubit定量,确定合格后,使用Ion Plus Fragment Library Kit 48 rxns (Thermofisher)构建文库。对文库进行Qubit定量和文库测试,然后,使用Life Ion S5TM或Ion S5TMXL (Thermofisher)测序。使用Cutadapt先对Reads低质量部分剪切,再根据Barcode从得到的Reads中拆分出各样品数据,截去Barcode和引物序列初步质控,得到原始数据(Raw reads),经过以上处理,得到的Reads需要去除嵌合体序列。嵌合体是多个亲本序列之间的杂交产物,可能会被错误地解释为新的生物体,序列通过UCHIME algorithm与数据库(Gold database)检测2个或多个片段的嵌合序列,比对检测嵌合体序列,并去除其中的嵌合体序列,得到最终的有效数据(Clean reads)。
1.3 数据分析拼接测序得到的原始数据,筛选有效数据,基于有效数据进行操作分类单元(Operational taxonomic units, OTUs)聚类分析。通过Alpha多样性分析中华鳖肠道微生物菌群丰度和多样性,根据Beta多样性分析得到的距离矩阵进行UPGMA聚类分析,得到可视化差异程度。结合属分类水平的Heatmap进行分析,从聚类结果可知,样品在属分类水平上的肠道菌群的相似性和差异性。
2 结果与分析 2.1 16S rRNA测序结果分析对4个组的20个样品的原始数据进行处理,获得的总读数(Total reads)为1478897,均值为73945(图 1)。根据97%相似度分类获得OTU序列,RS1~RS4组总OTUs分别为258、412、977和1004(表 1)。由此可以看出,实验组的OTU数目显著高于对照组(P < 0.05),尤其是RS3和RS4组。
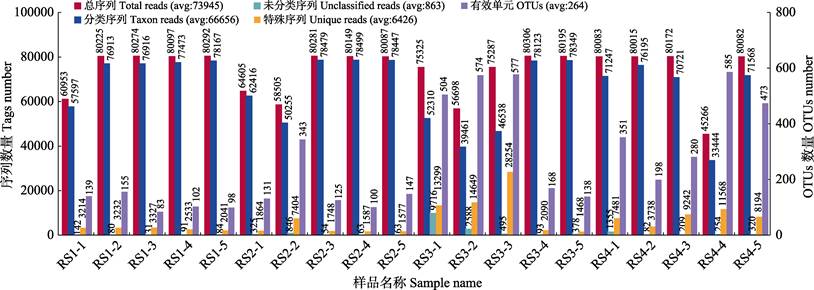
|
图 1 不同样品间OTU统计结果 Fig.1 The OTUs statistical results of different samples |
|
|
表 1 各样品中高通量测序数据统计 Tab.1 Summary of high throughput sequencing results of each sample |
将相似度较高的序列聚在一起称为OTUs聚类,不同OTU代表不同微生物种类,统计不同的OTU对应的微生物门类和相对丰度(表 2)。结果显示,RS1组中检测到的物种门类为变形菌门(Proteobacteria)、衣原体门(Chlamydiae)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)和梭杆菌门(Fusobacteria),除了变形菌门、衣原体门和厚壁菌门,其他门类占比均不足1%。RS2组中主要检测到变形菌门、厚壁菌门和拟杆菌门。RS3组中主要有变形菌门、衣原体门、放线菌门、厚壁菌门、拟杆菌门和蓝细菌门。RS4组中主要有变形菌门、拟杆菌门、厚壁菌门、衣原体门、柔膜菌门(Tenericutes)和放线菌门。由此可知,中华鳖肠道菌群的组成结构发生了明显变化,其中,变形菌门呈显著下降趋势(P < 0.05);衣原体门、放线菌门、拟杆菌门呈不规律变化; 厚壁菌门呈显著上升趋势(P < 0.05)。整体来看,实验组肠道菌群组成结构较对照组复杂,物种多样性更高。
|
|
表 2 各样品优势细菌门类及相对丰度(%) Tab.2 Dominant bacterial phyla and the relative abundance of each sample (%) |
筛选每组样品中相对丰度最高的前10种OTU对应的菌类,在属分类水平上进行统计分析(图 2)。结果显示,在RS1组中,主要优势菌种为螺杆菌属(Helicobacter)(90.80%),其次是衣原体属(Chlamydia) (3.92%)。RS2组中,优势菌种为螺杆菌属(87.15%)、拟杆菌属(Bacteroides)(2.04%)和伊丽莎白菌属(Elizabethkingia)(1.49%)。RS3组中,优势菌种为螺杆菌属(40.59%)、衣原体属(15.21%)、双歧杆菌属(Bifidobacterium)(6.31%)、劳森菌属(Lawsonia)(3.74%)和杀雄菌属(Arsenophonus)(1.51%)。RS4组中,优势菌种为螺杆菌属(41.19%)、不动杆菌属(Acinetobacter) (11.54%)、衣原体属(8.87%)、伊丽莎白菌属(4.70%)、脲原体属(Ureaplasma)(2.31%)、乳杆菌属(Lactobacillus) (2.78%)和拟杆菌属(2.45%)。

|
图 2 属分类水平上的物种相对丰度 Fig.2 Relative abundance of species at the genus level |
根据样品在属分类水平上的注释和丰度信息,选取丰度前35的属分级聚类,并绘制Heatmap (图 3)。在属分类水平上可看到,螺杆菌属的丰度在实验组中呈下降趋势。随着添加量的增加,优势菌属的数量增多。
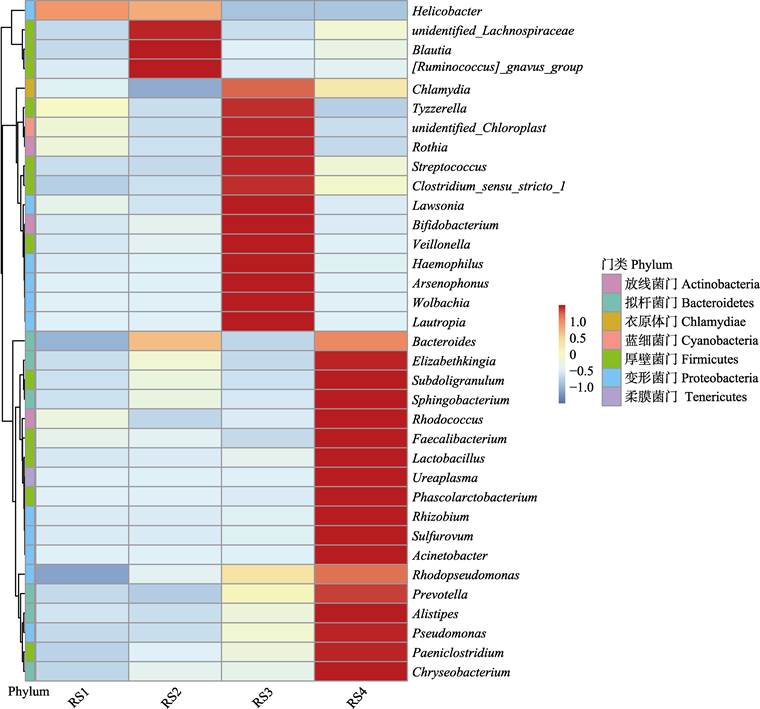
|
图 3 肠道微生物属分类水平的热图 Fig.3 Heatmap of the classification level of gut microbes |
覆盖率(Goods coverage)指数可以反映测序的深度。本研究中各样品的覆盖指数均在0.99以上(图 4a),表明测序的深度基本覆盖到样品中的所有微生物菌群。Shannon指数主要用于评估样本中微生物的多样性,Shannon值越大,表明群落多样性越高。Shannon指数箱型图(图 4b)显示,实验组多样性均高于对照组,其中,RS4组显著高于RS1组(P < 0.05),RS3组和RS4组显著高于RS2组(P < 0.05),而RS1组和RS2组则无显著差异(P>0.05)。Chao1指数和Ace指数可以评估菌群物种的丰度,指数越大表明菌群的丰度越高。Ace和Chao1指数箱型图(图 4c、图 4d)显示,实验组较对照组呈上升趋势,其中,RS3、RS4组显著高于RS1、RS2组(P < 0.05),RS1和RS2组间无显著差异(P> 0.05)。表明,适量添加血根碱能有效提高肠道微生物菌群的多样性及物种丰度。

|
图 4 Alpha多样性组间比较 Fig.4 Comparison of Alpha diversity between groups |
进一步分析各分组中样品菌群间多样性的相互关系,并构建Venn图(图 5)。结果显示,RS1组具有的OTU总数为258;实验组中,RS2~RS4组的OTU总数分别为412、977和1004。其中,RS1~RS4组特有OTUs分别为10、37、302和347。4个组共享OTU为160,占总OTU数的6.04%。从样本间菌群相似性来看,对照组与实验组间的相似性较低,说明,血根碱的添加对肠道菌群组成结构有明显影响,总体来说提高了肠道微生物菌群的复杂度及丰度。
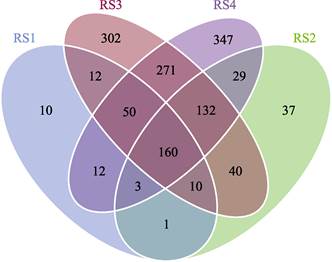
|
图 5 不同实验组的OTU分析 Fig.5 OTU analysis of different experimental groups |
RS1与RS2组肠道内菌群组成在PC1上相差较小(图 6a),而RS3和RS4组与RS1组距离较远。表明,RS1与RS2组的菌群构成差异较小,与RS3、RS4组差异较大。基于Weighted UniFrac距离的PCoA分析结果显示(图 6b),RS1与RS2组菌群构成相似,与RS3、RS4组相差较远。基于以上方法得到的距离矩阵用于UPGMA聚类分析(图 7),并将聚类结果整合到门分类水平上菌群的相对丰度,结果显示,RS1与RS2组间相似性较高,与RS3、RS4组相似性较低。由此可知,血根碱对肠道菌群的结构组成有明显影响,当浓度达到100 mg/kg时,肠道内菌群结构发生显著变化,菌群结构相对复杂,种类较多。
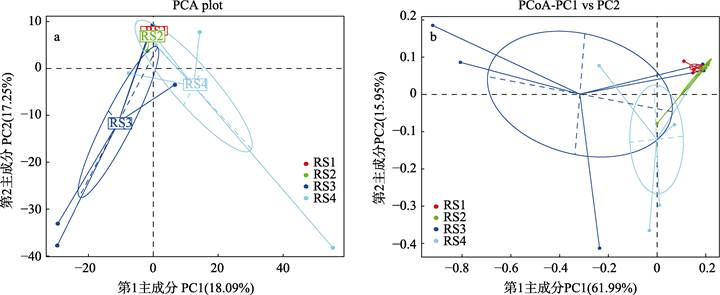
|
图 6 组间PCA和PCoA分析 Fig.6 PCA and PCoA analysis between groups |
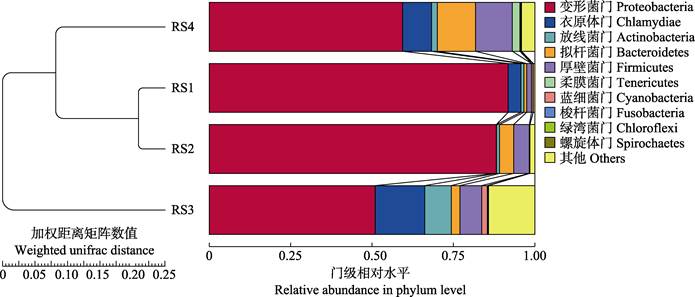
|
图 7 基于Weighted Unifrac距离的UPGMA聚类树 Fig.7 UPGMA clustering tree based on Weighted Unifrac distance |
肠道微生物菌群是肠道黏膜上的一个复杂多样的生态系统,肠道微生态的相对稳定对于动物机体消化和吸收营养物质、调节宿主免疫功能、抵御有害微生物侵害等具有重要意义(Huang et al, 2018; Pérez et al, 2010; De Schryver et al, 2014)。肠道菌群结构的失衡可能会导致机体的免疫系统遭到破坏、细菌性疾病暴发(朱文根等, 2019)。本研究利用16S rRNA高通量测序,分析不同浓度血根碱对中华鳖肠道黏膜上皮菌群结构的影响,以期为探究血根碱的微观作用机制及中华鳖饲料开发提供理论依据。
通过Alpha多样性分析可知,实验组的Shannon指数均大于对照组,且呈上升趋势,说明添加血根碱在一定程度上可以提高肠道菌群的多样性。从Ace和Chao1分析可知,血根碱可提高肠道中微生物菌群的丰度。但值得注意的是,RS1对照组和RS2组之间并无显著差异(P>0.05)。主成分分析PCA可反映样品间的关系,PCA图中的距离反映了样品间的差异,样品中菌群的组成结构越相似,它们在PCA图中分布的距离就越近。Beta多样性分析表明,RS1与RS2组间的肠道菌群组成结构差异较小,而与RS3、RS4的肠道菌群组成结构差异较大。总体来说,不同浓度的血根碱添加组中,肠道黏膜上皮菌群的相对丰度和优势菌群发生了较为明显的变化,说明添加血根碱可提高肠道黏膜上皮菌群的多样性。当添加量达到100 mg/kg时,其肠道菌群多样性显著提高(P < 0.05)。
物种注释结果显示,对照组中肠道菌群构成前5的门类有变形菌门、衣原体门、厚壁菌门、放线菌门和拟杆菌门,其中,变形菌门是优势菌群,占绝对优势,次优势菌群是衣原体门,与何娇娇等(2018)对鱼类肠道微生物菌群研究结果相似。可以推测变形菌门和衣原体门为中华鳖肠道黏膜上皮的固有菌群。在属分类水平上,螺杆菌属和衣原体属为优势菌属,其中,螺杆菌属占据绝对优势。在实验组中,变形菌门均呈下降趋势,在RS3组中为最低,而衣原体门则呈不规律变化。在属分类水平上,肠道菌群中优势菌群的数量与血根碱添加量呈正相关,其中,不动杆菌属、乳杆菌属和双歧杆菌属丰度显著提高(P < 0.05),而螺杆菌属丰度明显降低。通过韦恩图分析肠道菌群相似性发现,随着血根碱添加量的增加,肠道菌群相似性越低。可见,在饲料中添加血根碱能有效降低肠道中螺杆菌属的含量,并提高不动杆菌属、乳杆菌属和双歧杆菌属的含量。
据报道,螺杆菌属与人、动物的疾病有关,例如,螺杆菌(Helicobacter)与薄饼龟(Malacochersus tornieri)败血症有关(Stacy et al, 2010)。幽门螺杆菌(Helicobacter pylori)是一种主要的水传播病原体,能够危害养殖和野生的罗非鱼(Oreochromis mossambicus) (Abdel-Moein et al, 2015)。而乳杆菌和双歧杆菌对幽门螺杆菌具有很好的抑制作用(Wang et al, 2013、2014)。在本研究中,螺杆菌属含量在实验组均呈下降趋势,且在RS3、RS4中显著下降(P < 0.05);而乳杆菌属和双歧杆菌属含量在实验组中均明显上升。推测血根碱在肠道菌群变化中起到重要的作用,可有效提高乳杆菌属和双歧杆菌属的含量,并抑制螺杆菌属的增殖(Mahady et al, 2003),降低螺杆菌属的致病性(胡守奎等, 2014),但其作用机制有待进一步验证和研究。此外,还发现不动杆菌属的丰度在实验组中呈规律性上升,而不动杆菌属的生长与繁殖需要大量的O2,导致肠道中形成厌氧环境,给厌氧菌(乳酸杆菌、双歧杆菌)的生长繁殖创造了有利的环境条件(汤菊芬等, 2016)。本研究中,不动杆菌属、乳杆菌属和双歧杆菌属的丰度在实验组均呈上升趋势,与前人的研究结果相似,推测可能与内环境的改变有关,具体机制有待进一步验证。乳杆菌属是常见的有益菌属,其中,乳酸菌作为饲料添加剂已经得到广泛的应用,被公认为对宿主有益,已经在凡纳滨对虾(Litopenaeus vannamei) (Wang, 2007)和大黄鱼(Larimichthys crocea) (何娇娇等, 2018)中得到很好的应用。双歧杆菌可在肠道形成生物学屏障,以阻止致病菌入侵(吴淑清等, 2007),其代谢能产生甘氨酰水解酶,使结合的胆酸游离,从而达到抑制病原菌生长的作用。整体来看,血根碱对螺杆菌属的生长繁殖起到有效的抑制作用,而对不动杆菌属、乳杆菌属和双歧杆菌属增值起到一定的促进作用。这种现象在RS3、RS4组中较为明显。推测当饲料中的血根碱添加量达到(100~150) mg/kg时,能有效改善中华鳖的肠道菌群,对于维护肠道健康具有重要意义。
4 结论综上所述,在饲料中添加(100~150) mg/kg的血根碱能有效提高中华鳖肠道黏膜上皮菌群的复杂度及菌群的丰度,改善肠道黏膜上皮的菌群结构。本研究获得了血根碱对中华鳖肠道黏膜上皮菌群影响的重要信息,主要表现在血根碱能有效抑制螺杆菌属增殖,同时,提高不动杆菌属、乳杆菌属和双歧杆菌属的丰度。本研究仅检测到属分类水平,种水平暂无分类,其功能机制有待进一步深入研究。
Abdel-Moein KA, Saeed H, Samir A. Novel detection of Helicobacter pylori in fish:A possible public health concern. Acta Tropica, 2015, 152: 141-144 DOI:10.1016/j.actatropica.2015.09.005 |
Chen J, Kang B, Zhao Y, et al. Effects of natural dietary supplementation with Macleaya cordata extract containing sanguinarine on growth performance and gut health of early-weaned piglets. Journal of Animal Physiology and Animal Nutrition, 2018, 102(6): 1666-1674 DOI:10.1111/jpn.12976 |
Chen JS, Kang BJ, Zeng JG, et al. Effects of dietary sanguinarine on growth performance, intestinal mucosal morphology and immune function of small intestinal mucosa of weaned piglets. Chinese Journal of Animal Nutrition, 2018, 30(5): 1845-1853 [陈家顺, 康宝聚, 曾建国, 等. 血根碱对断奶仔猪生长性能、肠道形态结构及小肠黏膜免疫功能的影响. 动物营养学报, 2018, 30(5): 1845-1853 DOI:10.3969/j.issn.1006-267x.2018.05.027] |
De Schryver P, Vadstein O. Ecological theory as a foundation to control pathogenic invasion in aquaculture. The ISME Journal, 2014, 8(12): 2360-2368 DOI:10.1038/ismej.2014.84 |
He JJ, Wang P, Feng J, et al. Effects of fermented soybean meal on the growth and intestinal histology and microbiota of juvenile large yellow croaker Larimichthys crocea. Acta Hydrobiologica Sinica, 2018, 42(5): 919-928 [何娇娇, 王萍, 冯建, 等. 发酵豆粕对大黄鱼生长、肠道结构及肠道微生物菌群的研究. 水生生物学报, 2018, 42(5): 919-928] |
Hildebrandt MA, Hoffmann C, Sherrill-Mix SA, et al. High-fat diet determines the composition of the murine gut microbiome independently of obesity. Gastroenterology, 2009, 137(5): 1716-1724 DOI:10.1053/j.gastro.2009.08.042 |
Hu GL, Liu J, Tian S, et al. Effects of tea seed polysaccharide and Macleaya cordata alkaloids on intestinal flora of yellow-feathered broilers and antimicrobial activity of Macleaya cordata sanguinarine. Chinese Journal of Animal Nutrition, 2018, 30(11): 4619-4625 [胡贵丽, 刘靖, 田莎, 等. 茶籽多糖和博落回生物碱对黄羽肉鸡肠道菌群的影响及博落回血根碱的抑菌活性. 动物营养学报, 2018, 30(11): 4619-4625 DOI:10.3969/j.issn.1006-267x.2018.11.038] |
Hu SK, Xu JG. Research of Helicobacter spp.and its pathogenicity. Disease surveillance, 2014, 29(4): 321-326 [胡守奎, 徐建国. 螺杆菌属及其致病性研究. 疾病监测, 2014, 29(4): 321-326] |
Huang W, Cheng Z, Lei S, et al. Community composition, diversity, and metabolism of intestinal microbiota in cultivated European eel (Anguilla anguilla). Applied Microbiology and Biotechnology, 2018, 102(9): 4143-4157 DOI:10.1007/s00253-018-8885-9 |
Khachatryan ZA, Ktsoyan ZA, Manukyan GP, et al. Predominant role of host genetics in controlling the composition of gut microbiota. PLoS One, 2008, 3(8): e3064 DOI:10.1371/journal.pone.0003064 |
Li GY, Sun Y, Song XL, et al. Potential probiotics supplement may impact intestinal digestive enzyme and bacteria compositin of Litopenaeus vannamei. Progress in Fishery Sciences, 2013, 34(4): 84-90 [李桂英, 孙艳, 宋晓玲, 等. 饲料中添加潜在益生菌对凡纳滨对虾肠道消化酶活性和菌群组成的影响. 渔业科学进展, 2013, 34(4): 84-90 DOI:10.3969/j.issn.1000-7075.2013.04.012] |
Mahady GB, Pendland SL, Stoia A, et al. In vitro susceptibility of Helicobacter pylori to isoquinoline alkaloids from Sanguinaria canadensis and Hydrastis canadensis. Phytotherapy Research, 2003, 17(3): 217-221 DOI:10.1002/ptr.1108 |
Pérez T, Balcázar JL, Ruiz-Zarzuela I, et al. Host-microbiota interactions within the fish intestinal ecosystem. Mucosal Immunology, 2010, 3(4): 355-360 |
Russell SL, Gold MJ, Hartmann M, et al. Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma. EMBO Reports, 2012, 13(5): 440-447 DOI:10.1038/embor.2012.32 |
Stacy BA, Wellehan JF Jr. Fatal septicemia caused by Helicobacter infection in a pancake tortoise (Malacochersus Tornieri). Journal of Veterinary Diagnostic Investigation, 2010, 22(4): 660-662 DOI:10.1177/104063871002200431 |
Tang JF, Huang Y, Cai J, et al. Effects of a compound probiotics combined with Chinese herbal medicine on growth performance, intestinal flora and resistance to diseases of GIFT strain of Nile tilapia (Oreochromis niloticus). Progress in Fishery Sciences, 2016, 37(4): 104-109 [汤菊芬, 黄瑜, 蔡佳, 等. 中草药复合微生态制剂对吉富罗非鱼(Oreochromis niloticus)生长、肠道菌群及抗病力的影响. 渔业科学进展, 2016, 37(4): 104-109] |
Tao X, Sun YQ, Men XM, et al. Effects of composite plant extracts replacing feed antibiotics on growth performance and serum indexes of weaned piglets. Chinese Journal of Animal Nutrition, 2018, 30(1): 163-169 [陶新, 孙雨晴, 门小明, 等. 复合植物提取物替代饲用抗生素对断奶仔猪生长性能和血清指标的影响. 动物营养学报, 2018, 30(1): 163-169 DOI:10.3969/j.issn.1006-267x.2018.01.021] |
Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins. Nature, 2009, 457(7228): 480-484 DOI:10.1038/nature07540 |
Wang YB. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture, 2007, 269(1): 259-264 |
Wang YH, Huang Y. Effect of Lactobacillus acidophilus and Bifidobacterium bifidum supplementation to standard triple therapy on Helicobacter pylori eradication and dynamic changes in intestinal flora. World Journal of Microbiology and Biotechnology, 2014, 30(3): 847-853 DOI:10.1007/s11274-013-1490-2 |
Wang ZH, Gao QY, Fang JY, et al. Meta-analysis of the efficacy and safety of Lactobacillus-containing and Bifidobacterium-containing probiotic compound preparation in Helicobacter pylori eradication therapy. Journal of Clinical Gastroenterology, 2013, 47(1): 25-32 DOI:10.1097/MCG.0b013e318266f6cf |
Wu SQ, Wang SY, Tan K, et al. Studying progress of Bifidobacteri. Journal of Changchun University, 2007, 17(4): 57-61 [吴淑清, 王顺余, 谭克, 等. 双歧杆菌的研究现状. 长春大学学报, 2007, 17(4): 57-61 DOI:10.3969/j.issn.1009-3907-B.2007.04.016] |
Zhang J, Yu P, Zhou Q, et al. Screening and characterisation of sex differentiation-related long non-coding RNAs in Chinese soft-shell turtle (Pelodiscus sinensis). Scientific Reports, 2018, 8(1): 8610-8630 DOI:10.1038/s41598-018-26799-2 |
Zhu WG, Li XH, Rao LY, et al. Effects of reovirus infection on the intestinal microbiota diversity of grass carp (Ctenopharyngodon idella). Acta Hydrobiologica Sinica, 2019, 43(1): 109-116 [朱文根, 李星浩, 饶刘瑜, 等. 感染草鱼呼肠孤病毒对肠道菌群多样性的影响. 水生生物学报, 2019, 43(1): 109-116] |



