2. 中国水产科学研究院黑龙江水产研究所 哈尔滨 150070;
3. 上海海洋大学 农业农村部淡水水产种植资源重点实验室 上海 201306
2. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070;
3. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306
盐度是影响鱼类机体生理生化状态的重要环境因子之一,对鱼类的生存(严银龙等, 2019)、生长发育(El-Leithy et al, 2019)影响显著。研究表明,广盐性鱼类在转入高盐度水体过程中,机体为维持内环境稳态,会消耗大量的能量,同时产生大量的有害代谢产物,如超氧负离子自由基、丙二醛(Malondialdehyde, MDA)等(胡静等, 2015),而机体内的非特异性免疫酶类,如酸性磷酸酶(Acidic phosphatase, ACP)、碱性磷酸酶(Alkaline phosphatase, AKP)和谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)等则在保护机体免受过氧化物二次损伤过程中发挥着重要作用;而皮质醇则在能量代谢和免疫调控方面发挥着重要作用。当鱼类长期处于胁迫环境时,会导致其机体代谢紊乱、免疫机能下降,甚至引起鱼类的死亡(Li et al, 2017; Hoseini et al, 2019; 齐明, 2014)。
大鳞鲃为鲤科(Cyprinidae)、鲃亚科(Barbinae)、鲃属(Barbus)鱼类(Nikoriski, 1958)。目前,关于大鳞鲃的盐度适应性研究主要集中在生存(杨建等, 2014)、生长发育(党云飞等, 2013)、渗透调控(耿龙武等, 2011)等方面。在免疫机能的影响方面,仅初步检测了超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)在肝、肾和鳃组织中的时空变化(杨建, 2014)。为全面揭示盐度胁迫对大鳞鲃机体免疫应激水平的影响,以便为大鳞鲃盐碱水域的养殖提供更加准确、有效的参考,本研究检测分析不同盐度胁迫下,大鳞鲃肝、肾和鳃组织中ACP、AKP、GSH-Px和MDA等氧化应激参数和血清皮质醇水平的变化,以期阐明盐度胁迫对大鳞鲃抗氧化能力和机体应激水平的影响。
1 材料与方法 1.1 实验材料实验鱼取自中国水产科学研究院黑龙江水产研究所呼兰试验站。随机选300尾体长为(25.0±0.5) cm、体重为(95.00±5.56) g的健康、体型正常的个体于室内暂养3 d,暂养用水为曝气2 d的自来水,水温为(24.0±1.5)℃。
根据杨建等(2014)的结果和盐度预实验结果,本实验设置4个NaCl盐度实验组(3、6、9和12 g/L)和1个淡水对照组,每个梯度设置3个平行组。实验溶液采用曝气2 d的自来水和NaCl(国产,分析纯)在体积为200 L的玻璃缸中进行配制,并用盐度测量仪(上海三信仪表厂,SX713-02型)检测校准。溶液配制完成后稳定2 d。各实验组随机挑选20尾大鳞鲃进行为期7 d的耐受实验,实验期间水温为(24.0±1.5)℃。
1.2 实验方法与样品采集各组分别于实验开始后3、6、12、24、48、96 h和7 d进行样品采集,用40 mg/L的MS-222在实验相同盐度梯度下麻醉,每个盐度实验组在每个时间点于3个平行组随机采集1尾实验鱼,共采集3尾。尾部静脉采集血液样本,4℃条件下3000 r/min离心10 min,取上清液,–80℃保存待测;冰上解剖实验鱼,采集其肝、肾和鳃组织,并用4℃预冷的生理盐水润洗,用吸水纸吸干后迅速放入冻存管,液氮保存待测。
1.3 组织氧化应激指标和血清皮质醇测定取0.2 g肝、肾和鳃组织样本,按照质量与体积比1:9加入预冷的0.86%生理盐水,用组织研磨仪(MM400, Retsch) 10000~15000 r/min研磨成10%组织匀浆。将制备好的10%匀浆4℃条件下2500 r/min离心10 min,取上清液,用于测定ACP、AKP、MDA和GSH-PX等氧化应激指标,测试试剂盒购自南京建成生物工程研究所。
采用酶联免疫法ELISA和Synergy HTX多功能检测仪(Bio Tek)测定大鳞鲃血清皮质醇,试剂盒购自上海酶联生物有限公司(Cat.# m1003467-C)。
1.4 数据分析实验结果采用SPSS 20.0与Graphpad prism5进行单因素方差分析(One-way ANOVA),实验结果用平均值±标准差(Mean±SD)表示。同一时间点的不同盐度组进行Duncanxs多重比较,P < 0.05表示差异显著。
2 结果与分析 2.1 盐度胁迫对大鳞鲃肝、肾和鳃ACP活力的影响由图 1可知,在胁迫初期,相同盐度胁迫时间,3种组织中ACP的活力均随着盐度的升高而升高;而在相同盐度条件下,大鳞鲃的肝、肾和鳃中的ACP活力随着时间的延长均呈先上升后下降并趋于平稳的变化趋势。肝、肾和鳃中ACP活力分别在胁迫12、6和24 h达到峰值,之后逐步下降并趋于稳定;而淡水对照组3种组织中ACP活力的变化范围分别为1.27~1.42、1.46~1.62和0.98~1.17 U/g prot,在整个实验过程中酶活力变化不大。此外,肾中ACP活力显著高于肝和鳃,其在肝、肾和鳃组织中的活力范围分别为1.27~1.96、1.42~2.15和0.98~1.96 U/g prot。
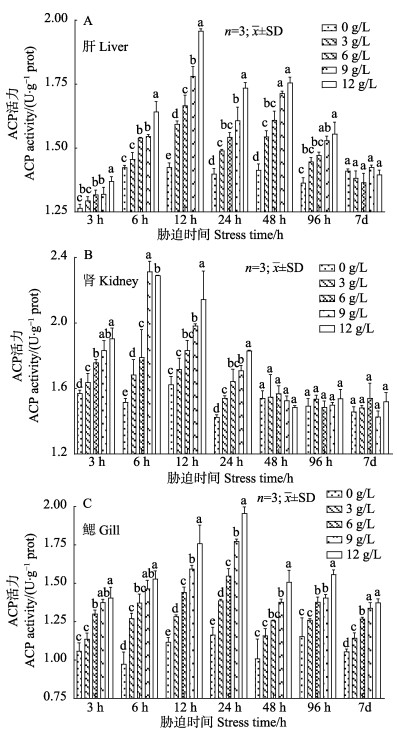
|
图 1 盐度胁迫对大鳞鲃肝、肾和鳃组织的ACP活力的影响 Fig.1 Effects of salinity stress on ACP activity in liver, kidney and gill of L. capito 不同小写字母表示差异显著(P < 0.05).下同 Different small letters indicate significant differences (P < 0.05). The same as below |
由图 2可知,在盐度胁迫初期,在相同胁迫时间下,肝、肾和鳃组织中AKP活力随着盐度的升高显著升高(P < 0.05);而在同一盐度胁迫下,大鳞鲃3种组织中的AKP活力随着时间的延长亦呈先上升后下降并趋于平稳的变化趋势。肝和肾组织中AKP活力在12 h时最大,而鳃组织则在24 h出现峰值;肝和肾组织自24 h开始下降并趋于平稳,而鳃组织在48 h时下降后趋于平稳。淡水对照组3种组织中AKP的活力范围分别为0.32~0.37、1.03~1.23和0.98~1.17金氏单位/g prot,在整个实验过程中AKP活力变化不显著(P > 0.05)。AKP活力在肾组织中显著高于其他2种组织,其在肝、肾和鳃组织中的变化范围分别为0.31~0.86、1.01~1.87和0.13~0.84金氏单位/g prot。
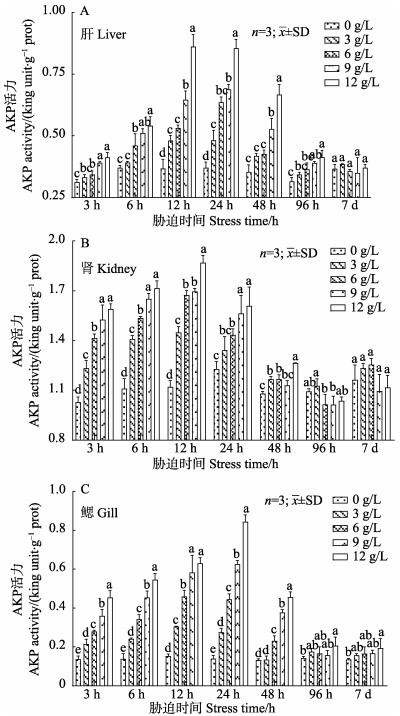
|
图 2 盐度胁迫对大鳞鲃肝、肾和鳃组织的AKP活力影响 Fig.2 Effects of salinity stress on AKP activity in liver, kidney and gill of L. capito |
由图 3可知,初期相同胁迫时间下,肝、肾、鳃组织的GSH-Px活力随盐度的升高而升高;随着胁迫时间的延长,大鳞鲃3种组织中的GSH-Px活力在相同盐度胁迫下呈先上升后下降并趋于平稳的变化趋势。肝和肾组织中GSH-Px的活力在胁迫24 h达到峰值,鳃组织则在胁迫6 h达到顶峰;肾和鳃组织均在96 h时趋于平稳,肝组织则在7 d时趋于稳定;淡水对照组3种组织中GSH-Px活力的变化范围分别为44.41~46.68、17.19~21.59和9.07~13.18活力单位,在整个实验过程中变化差异不大。此外,肝组织的GSH-Px活力显著高于肾和鳃组织,GSH-Px在肝、肾和鳃组织中的活力范围分别为44.41~114.77、16.25~67.59和9.07~48.00活力单位。
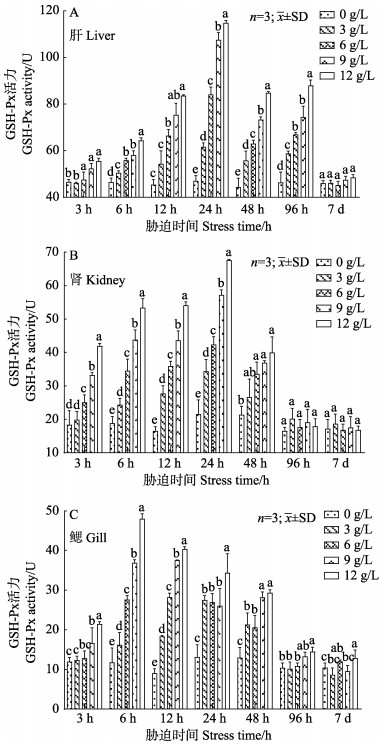
|
图 3 盐度胁迫对大鳞鲃肝、肾和鳃组织GSH-Px活力的影响 Fig.3 Effects of salinity stress on GSH-Px activity in liver, kidney and gill of L. capito |
由图 4可知,胁迫初期相同时间点,大鳞鲃肝、肾和鳃的MDA含量亦随盐度的升高而显著升高(P < 0.05);大鳞鲃的肝、肾和鳃中的MDA含量在相同盐度条件下,随着胁迫时间的延长均呈先上升后下降,并趋于平稳的变化趋势。其中,3种组织中MDA含量均在胁迫24 h时达到峰值,肾组织在96 h时MDA含量趋于稳定,肝组织则在7 d时达到新稳态,鳃组织在7 d内仍未恢复正常水平。淡水对照组3种组织中MDA含量分别为18.63~22.55、13.05~18.89和8.33~11.32 nmol/mg prot,在整个实验过程中变化不大(P > 0.05)。此外,MDA含量在肾组织中略高于肝和鳃组织,其在肝、肾和鳃组织中的变化范围分别为17.02~55.98、13.05~57.27和8.33~53.93 nmol/mg prot。
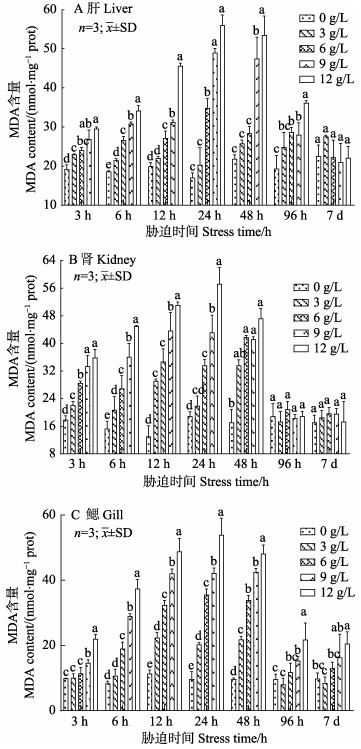
|
图 4 盐度胁迫对大鳞鲃肝、肾和鳃组织MDA含量的影响 Fig.4 Effects of salinity stress on MDA content in liver, kidney and gill of Luciobarbus capito |
由图 5可知,大鳞鲃血清皮质醇浓度在胁迫初期同一胁迫时间下,随盐度的升高呈显著升高的变化趋势(P < 0.05);在同一盐度条件下,随着胁迫时间的延长,大鳞鲃血清皮质醇呈先上升后下降,并趋于平稳的变化趋势。血清中的皮质醇浓度在胁迫24 h时达到峰值,在盐度胁迫48 h时趋于平稳;盐度胁迫组大鳞鲃血清皮质醇浓度为197.00~355.5 ng/L。而淡水对照组血清皮质醇则为197.00~209.00 ng/L,其在整个实验过程中含量变化差异不大。此外,血清皮质醇的浓度变化与盐度呈正相关。
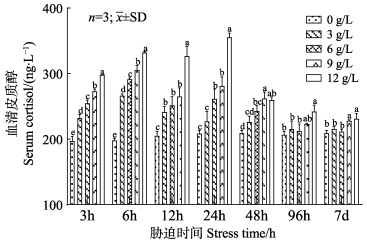
|
图 5 盐度胁迫对大鳞鲃血清皮质醇浓度的影响 Fig.5 Effects of salinity stress on serum cortisol concentration in L. capito |
ACP和AKP的磷酸化和去磷酸化主要作用于机体解毒过程,是衡量机体免疫机能的重要指标(Sarà et al, 2008)。本研究发现,12 g/L高盐胁迫组中大鳞鲃肝、肾和鳃中ACP和AKP活力均高于其他3个低盐度组,表明盐度越高,机体代谢强度越大,参与调控机体相关酶类磷酸化和去磷酸化过程的ACP和AKP活性也越高,徐力文等(2008)对军曹鱼(Rachycentron canadum)在盐度胁迫下的研究也得出相同结论。在相同盐度下,胁迫初期大鳞鲃3种组织中ACP和AKP活力显著上升,并在24 h内达到顶峰,胁迫48 h后逐步下降并趋于平缓;但不同盐度胁迫下,最终恢复平稳的时间不同,高盐度组恢复稳定的时间显著长于低盐组;此外,不同组织ACP和AKP活力恢复稳定的时间也不同,其中,肝组织中ACP和AKP活力分别在7 d和4 d达到新稳态,肾组织中2种酶的活力均在48 h达到平稳状态,而鳃组织AKP活力在胁迫96 h后恢复稳定。肾组织中ACP和AKP活力范围分别为1.42~2.15 U/g prot和1.01~1.87金氏单位/g prot,其在3种组织中活性最高,且恢复时间最短,而肝组织中酶活力恢复稳定的时间则晚于肾组织,这可能与肝组织需要持续为机体提供能量有关。此外,鳃中酶活力范围分别为0.98~1.96 U/g prot和0.13~0.84金氏单位/mg prot,鳃组织ACP和AKP活力恢复所需时间亦较长,这可能与鳃直接接触盐度环境且酶活力较低有关系。
GSH-Px是机体用于清除过氧化物的一种酶,能以GSH为特异性底物降解过氧化氢和有机过氧化物,对维持细胞膜结构和功能的完整性具有重要的保护作用(Arthur, 2000)。本研究结果显示,大鳞鲃肝、肾和鳃3种组织在高盐度胁迫下(12 g/L)的同一时间,GSH-Px活力显著高于低盐度组,且盐度变化与GSH-Px活力呈正相关性;推测在高盐胁迫下,机体代谢调控强度加大,为避免机体产生的过氧化氢和有机过氧化物对机体造成二次损伤,GSH-Px活力也相应增强,这与孙鹏等(2010)的报道一致。在相同盐度条件下,胁迫初期大鳞鲃3种组织中GSH-Px活力显著上升,其肝组织和肾组织在24 h达到顶峰,而鳃组织则在6 h达到峰值,在胁迫48 h后逐步下降并趋于平稳;高盐度组恢复稳定的时间明显长于低盐度组;此外,3种组织中GSH-Px活力最终恢复稳定的时间不同,肝组织中GSH-Px活力在7 d达到新稳态,而肾和鳃均在96 h恢复稳定;此外,肝组织中GSH-Px活力最高,肾和鳃次之。肝是机体代谢供能的主要组织,其在机体盐度适应过程中需要高强度持续供能,产生的过氧化代谢废物多,因此,GSH-Px在活力和恢复稳定所需时间均显著强/长于肾、鳃组织。
MDA是生物体脂质代谢过程中一种重要的脂质过氧化产物,是衡量机体内活性氧的水平和氧化应激程度的重要指标之一(Paust et al, 2011)。本研究发现,盐度胁迫初期,相同时间下高盐度组(12 g/L)大鳞鲃肝、肾和鳃组织中MDA含量明显高于低盐度组,且盐度越高,机体代谢产生的MDA越多,这与杨静雯等(2019)对虹鳟(Oncorhynchus mykiss)在盐度胁迫下的结论一致。相同盐度条件下,胁迫初期大鳞鲃3种组织中MDA含量呈显著上升趋势,并在24 h达到最高,胁迫48 h时逐步下降并基本趋于平稳;此外,肾组织中MDA含量略高于肝和鳃组织。推测在盐度胁迫下,3种组织中脂质物质均参与了分解供能过程,但这一结论仍需进一步的研究证实。
皮质醇是在下丘脑–垂体–肾上腺轴(HPI)分泌的促肾上腺皮质激素作用下,由头肾细胞合成与释放的一种糖皮质类固醇激素,是反应鱼体应激强度的重要指标(Zong et al, 2019)。本结果显示,盐度胁迫下的血清皮质醇在高盐胁迫下(9和12 g/L)显著高于低盐胁迫(3和6 g/L),且皮质醇浓度随盐度的上升而上升,这与胡静等(2016)的报道相一致。在同一盐度下,大鳞鲃血清皮质醇在短期内急速上升,并在24 h时升至峰值,表明在鱼体刚接触盐度环境时,大鳞鲃的肾间组织受到刺激并分泌大量的皮质醇,但随着胁迫时间的延长,到48 h时,大鳞鲃逐渐适应了水体盐度环境,其血清中皮质醇含量亦逐渐恢复至正常水平。
综上所述,本研究中,3种组织中抗氧化酶活力、MDA含量以及血清皮质醇,均在24 h内出现最大值,并在48 h之后逐渐趋于平稳,推测大鳞鲃在刚进入盐度环境时,鱼体对外界环境产生了剧烈反应,在曝露24 h内机体抗氧化能力逐步达到最强,之后随着时间的延长,鱼体逐步适应相应的盐度环境,其抗氧化能力也随之恢复到正常水平,各指标均基本趋于平稳。整个实验过程中未出现大鳞鲃死亡现象,且在12 g/L高盐胁迫下3种组织中各项指标均能恢复稳定水平,表明大鳞鲃对于高盐水体环境具有较强的适应性,且能够在12 g/L高盐环境下中正常生长。
Arthur JR. The glutathione peroxidases. Cellular and Molecular Life Sciences, 2000, 57(13/14): 1825-1835 |
Dang YF, Xu W, Geng LW, et al. Effects of NaCl and NaHCO3 on growth and gill microstructure in juvenile Barbus capito. Journal of Fishery Sciences of China, 2013, 20(3): 577-584 [党云飞, 徐伟, 耿龙武, 等. NaCl盐度和NaHCO3碱度对大鳞鲃幼鱼生长及鳃组织特征的影响. 中国水产科学, 2013, 20(3): 577-584] |
El-Leithy AA, Hemeda SA, Awad ST, et al. Optimum salinity for Nile tilapia (Oreochromis niloticus) growth and mRNA transcripts of ion-regulation, inflammatory, stress-and immune-related genes. Fish Physiology and Biochemistry, 2019, 45(4): 1217-1232 DOI:10.1007/s10695-019-00640-7 |
Geng LW, Xu W, Li CT, et al. Influence of salinity and alkalinity on serum ion concentrations, osmosis and gill Na+/K+-ATPase activity of Barbus capito. Journal of Fishery Sciences of China, 2011, 18(2): 458-465 [耿龙武, 徐伟, 李池陶, 等. 盐碱对大鳞鲃血清渗透压、离子含量及鳃丝Na+/K+-ATP酶活力的影响. 中国水产科学, 2011, 18(2): 458-465] |
Hoseini SM, Yousefi M, Hoseinifar SH. Cytokines' gene expression, humoral immune and biochemical responses of common carp (Cyprinus carpio, Linnaeus, 1758) to transportation density and recovery in brackish water. Aquaculture, 2019, 504(7): 13-21 |
Hu J, Wu KC, Ye L, et al. Effect of acute salinity stress on catalase of juvenile Amphiprion clarkii. South China Fisheries Science, 2015, 11(6): 73-78 [胡静, 吴开畅, 叶乐, 等. 急性盐度胁迫对克氏双锯鱼幼鱼过氧化氢酶的影响. 南方水产科学, 2015, 11(6): 73-78 DOI:10.3969/j.issn.2095-0780.2015.06.010] |
Hu J, Ye L, Wu KC, et al. Effect of acute salinity stress on serum cortisol and activity of Na+-K+-ATPase of juvenile Amphiprion clarkia. South China Fisheries Science, 2016, 12(2): 116-120 [胡静, 叶乐, 吴开畅, 等. 急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响. 南方水产科学, 2016, 12(2): 116-120 DOI:10.3969/j.issn.2095-0780.2016.02.017] |
Li S, He F, Wen H, et al. Analysis of DNA methylation level by methylation-sensitive amplification polymorphism in half smooth tongue sole (Cynoglossus semilaevis) subjected to salinity stress. Journal of Ocean University of China, 2017, 16(2): 269-278 DOI:10.1007/s11802-017-3156-4 |
Nikoriski. Classification of ichthyology. Liao XZ, Lin FS, Tian MC, trans. Beijing: Higher Education Press, 1958, 11061106: 186-189 [尼科里斯基. 分门鱼类学. 缪学祖, 林福申, 田明诚译.北京:高等教育出版社, 1958, 11061106: 186-189] |
Paust LO, Foss A, Imsland AK. Effects of chronic and periodic exposure to ammonia on growth, food conversion efficiency and blood physiology in juvenile Atlantic halibut (Hippoglossus hippoglossus L. ). Aquaculture, 2011, 315(3): 400-406 |
Qi M. Salinity adaptability study of juvenile Eleutheronema rhadinum. Masterxs Thesis of Zhejiang Ocean University, 2014, 18-32 [齐明. 多鳞四指马鲅幼鱼盐度适应性调节机制. 浙江海洋学院硕士研究生学位论文, 2014, 18-32] |
Sarà G, Romano C, Widdows J, et al. Effect of salinity and temperature on feeding physiology and scope for growth of an invasive species (Brachidontes pharaonis-Mollusca: Bivalvia) within the Mediterranean Sea. Journal of Experimental Marine Biology and Ecology, 2008, 363(1): 130-136 |
Sun P, Yin F, Peng SM, et al. Effects of salinity on the activity of antioxidant enzymes in livers of juvenile Oplegnathus fasciatus. Marine Fisheries, 2010, 32(2): 154-159 [孙鹏, 尹飞, 彭士明, 等. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响. 海洋渔业, 2010, 32(2): 154-159 DOI:10.3969/j.issn.1004-2490.2010.02.007] |
Xu LW, Feng J, Guo ZX, et al. Effect of salinity on hematology and gill Na+-K+ ATPase activity of juvenile cobia, Rachycentron canadum Linnaeus. Marine Environmental Science, 2008, 27(6): 602-606 [徐力文, 冯娟, 郭志勋, 等. 盐度对军曹鱼稚鱼血液生理生化及鳃Na+-K+ ATPase活性的影响. 海洋环境科学, 2008, 27(6): 602-606 DOI:10.3969/j.issn.1007-6336.2008.06.011] |
Yan YL, Yuan XC, Shi YH, et al. Effects of salinity on growth, oxygen consumption rate and ammonia excretion rate of juvenile marbled rockfish Sebastisucus marmoratus. Journal of Dalian Ocean University, 2019, 34(4): 545-551 [严银龙, 袁新程, 施永海, 等. 盐度对褐菖鲉幼鱼生长、耗氧率和排氨率的影响. 大连海洋大学学报, 2019, 34(4): 545-551] |
Yang J, Xu W, Geng LW, et al. Effects of salinity on survival, gill and kidney tissue in juveniles of 5 species. Freshwater Fisheries, 2014, 44(4): 7-12 [杨建, 徐伟, 耿龙武, 等. 盐度对5种幼鱼的生存及鳃、肾组织的影响. 淡水渔业, 2014, 44(4): 7-12 DOI:10.3969/j.issn.1000-6907.2014.04.002] |
Yang J. Tolerance of 5 species of fish and changes of immune related indicators under salinity and immunological stress reaction. Masterxs Thesis of Shanghai Ocean University, 2014, 31-37 [杨建. 盐碱胁迫下5种鱼类的耐受性和免疫应激反应. 上海海洋大学硕士研究生学位论文, 2014, 31-37] |
Yang JW, Zhou YG, Huang M, et al. Comparative studies on digestive and antioxidant enzyme activities between juvenile rainbow (Oncorhynchus mykiss) and steelhead trout (O. mykiss). Periodical of Ocean University of China (Natural Science), 2019, 49(3): 119-128 [杨静雯, 周演根, 黄铭, 等. 盐度对虹鳟和硬头鳟幼鱼消化酶和抗氧化酶活性的比较研究. 中国海洋大学学报(自然科学版), 2019, 49(3): 119-128] |
Zong HZ, Xue HZ, Zhen LL, et al. Effects of different levels of environmental enrichment on the sheltering behaviors, brain development and cortisol levels of black rockfish Sebastes schlegelii. Applied Animal Behaviour Science, 2019, 215: 1-11 |



