2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
针对病原微生物对产量和产品质量的威胁,水产行业中常采用抗菌和抑菌药物进行防控。其中,最常用的抗菌和抑菌药物是移植于人药、兽药的抗生素。由于缺乏科学的用药指导,养殖生产中各种抗生素的用法与用量往往存在盲目性,因而不但成本高(药物浪费)、效果不理想,还会对生态环境健康造成严重的负面影响,特别是对有益菌群的误伤和病原菌抗药性增加(王玉堂, 2014)。此外,人类其他的生产与生活活动排放的抗生素也对水环境及生物体中的微生物种群产生不同程度的影响,如黄伟德等(2018)研究表明,凡纳滨对虾(Litopenaeus vannamei)携带的副溶血弧菌(Vibrio parahaemolyticus, VP)已经表现出了多重耐药性。因此,为了提高病害防治效益和保护生态环境健康,“精准用药”和“适量用药”势在必行。为了实现这个目的,药敏试验(Antimicrobial susceptibility testing, AST)是最好的工具(杨昆明等, 2018)。
AST是指在离体条件下测定药物抑制或杀灭微生物能力的试验,旨在了解微生物对各种抗生素的敏感(或耐受)程度,以指导临床选用抗生素种类及确定剂量,也可用于验证药物质量、研究耐药机理及探索耐药的起源和传播等(van Belkum et al, 2019)。经典的AST全部基于测定目标抗生素对活细胞培养的作用效果(因此成为表现型AST检测),如稀释法(Wiegand et al, 2008; Elmahdi et al, 2018)、K-B纸片法(张昭寰等, 2014; 黄伟德等, 2018)、E-test法(Syal et al, 2017)等。应用这些经典的方法时,对贵重仪器的依赖性较少,费用低,结果可直接通过肉眼观察来判断,且大多能够给出最小抑菌浓度(Minimum inhibitory concentration, MIC)值。但是,它们往往需要繁琐的操作,而且周期较长(Schumacher et al, 2018)。为了提高效率,近年来基于基因分析技术进行药物抗性测定的方法(一般称为基因型AST检测)也得到了较快发展。比如,基于扩增(Schoepp et al, 2016)和测序(Boolchandani et al, 2019)技术来分析抗性基因的方法已经得到了研究,由于免去培养步骤,使整个AST周期可缩短至几个小时甚至几十分钟。然而,由于基因的表达强度受众多因素影响,基因型AST检测结果只能得到微生物对目标抗生素存在抗性的可能性,其阳性结果依然有待采用表现型AST检测方法予以验证(van Belkum et al, 2019),否则不能给出MIC值,无法直接指导生产过程中药物的使用,而且往往费用较高。因此,目前基于培养模式的表现型AST检测方法依然是业界的“金标准”(Schumacher et al, 2018; Avesar et al, 2017)。特别是其中由美国临床和实验室标准协会(CLSI)制定的标准的微量肉汤稀释(Broth microdilution, BMD)法(Wiegand et al, 2008)更是在全球范围内的到了广泛的认可。
为了提高AST的效率和准确性,除了基因分析检测方法之外,更多的研究集中在培养过程的自动化开发(Schumacher et al, 2018; Zhang et al, 2019)。其中,研究成果应用性最好的代表是可以实现在线监测微生物生长动力学过程的光密度(OD值)法(Zhou et al, 2018; Vourli et al, 2017; Hayden et al, 2016)和显微镜法(Fredborg et al, 2015),由于有效避免了主观误差,二者都可以直接给出较精确的MIC值。更重要的是这些基于自动化仪器的AST方法,显著降低了操作者的劳动强度,因而备受欢迎,其中,前者更是已有多款商品化自动仪器面世(Zhou et al, 2018; Hayden et al, 2016)。然而,目前还有3个重要的问题:1)有报道认为,光密度法所得MIC值与CLSI BMD法所得结果吻合性有待进一步验证;2)必需昂贵仪器设备,难以广泛推广;3)不能进行具有光学干扰物质(如共存蛋白、纳米/微米粒子、泥沙等)存在下的AST(Zhang et al, 2019)。为了解决上述问题,研究团队基于电容耦合非接触电导分析创建了一种全新模式的AST方法——微生物生长传感器法(Zhang et al, 2018)。
本研究以渔业环境和水产品领域都非常关注的VP (黄伟德等, 2018; 黄梦诗等, 2019; Bonnin-Jusserand et al, 2019)为模式微生物,以卡那霉素(氨基糖苷类)、四环素(四环素类)、青霉素(β-内酰胺类)和恩诺沙星(喹诺酮类)为代表性抗生素,对比研究了微生物生长传感器AST法和CLSI BMD AST法的性能特征。
1 材料与方法 1.1 生物、化学材料与主要设备实验所用质控VP菌株(ACTT17802)购于北京百欧博伟生物技术有限公司。4株分离VP菌株编号分别为20150709009-1、20140829005-2、20150718005-1和20150705007-2,前二者分离自发病凡纳滨对虾的肝胰腺,后二者来自对虾养殖池水。菌株分离与保存方法参照Silva等(2018),取对虾组织分别放入无菌的玻璃匀浆器内匀浆,然后,取100 μl匀浆液均匀涂布在硫代硫酸盐柠檬酸盐胆盐蔗糖(TCBS)琼脂平板上,或直接取200 μl凡纳滨对虾养殖池水均匀涂布在TCBS琼脂平板上。将涂布后的平板放入30℃培养箱过夜培养。第2天挑取单个蓝色或蓝绿色菌落,再用TCBS平板划线。分离3~4次即可获得纯化的菌株,将纯化菌株进行生化鉴定。使用前分离菌株保存于–80℃冰箱中。
Luria-Bertani(LB)培养基和TCBS培养基为青岛高科海博生物技术有限公司产品。NaCl等其他化学试剂皆为分析纯,皆购自国药集团化学试剂有限公司。卡那霉素、四环素、青霉素和恩诺沙星购自北京索莱宝科技有限公司。
细菌培养采用上海知楚仪器公司生产的ZQZY-BG型振荡培养箱。细菌培养液光密度(OD600 nm)采用TU-1901型紫外可见光分光光度计(北京普析通用仪器有限公司)测定。溶液pH由PHS-3C型pH计(上海精科仪器有限公司产品)测定。为保证不受外来菌的污染,接种等实验在10000级洁净无菌室内完成。一次性无菌96孔平底培养板是康宁生命科学(吴江)有限公司产品。BMD实验结果采用索尼HDR-CX405高清数码摄像机(日本)拍照。微生物生长传感器AST实验采用本研究团队设计、委托澳大利亚eDAQ电子公司加工而成的八通道微生物生长传感器完成。外直径为5 mm、壁厚为0.4 mm的一次性检测管为NORELL公司美国产品。透气隔菌膜为常州创承科技有限公司产品。
1.2 实验方法 1.2.1 细菌培养和定量实验采用黄梦诗等(2019)的方法培养和定量VP。质控和分离菌株从–80℃冰箱中取出后,在TCBS固体培养基上斜面划线进行活化,在培养箱中于30℃下培养24 h。挑取培养菌落接种至LB液体培养基中(含3% NaCl),35℃振荡过夜。通过测定OD600 nm值表征细菌浓度,并用平板计数法进行验证(Zhang et al, 2018)。
1.2.2 微生物生长传感器AST实验以考察质控菌株对卡那霉素为例,采用微生物生长传感器进行AST实验的预备工作包括以下步骤:
1) 配制0.25、0.50、1.00、2.00、4.00和8.00 mg/ml的卡那霉素储备液。
2) 将细菌培养液用灭菌LB液体培养基稀释至5×107 CFU/ml作为储备液。
3) 采用上述2种储备液和灭菌LB液体培养基,配制1.5 ml的VP培养液共7份,其中,细菌的终浓度皆为5×105 CFU/ml,抗生素的终浓度分别为0 (阳性对照)、2.50、5.00、10.00、20.00、40.00和80.00 μg/ml。取1.3 ml该系列培养液分别用无菌进样器装入7个检测管中,然后采用透气隔菌膜封口。
4) 另取1个检测管,装入1.3 ml的LB液体培养基作为阴性对照。
采用微生物生长传感器进行AST实验的工作示意图见图 1。检测管在恒温35℃(Elmahdi et al, 2018)的传感器中生长,系统按照优化过的(Zhang et al, 2018)参数(激励频率为2 MHz,激励电压为16 V),以120 s的时间间隔连续记录检测管中培养液的校准表观电导率(NACV)的变化值,共20 h。系统将NACV对培养时间作图,形成VP的S型生长曲线。当未发现VP的生长时,即表明该菌被完全抑制,该浓度的抗生素就是MIC值(Elmahdi et al, 2018)。
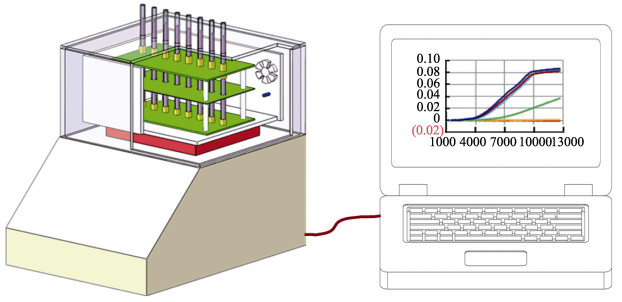
|
图 1 微生物生长传感器法进行AST测定的工作示意 Fig.1 Diagram of microbial growth sensor-based AST assay |
使用相同步骤测定VP对四环素、青霉素和恩诺沙星的敏感性,其中,四环素在培养液中的终浓度为0.50、1.00、2.00、4.00、8.00和16.00 μg/ml;青霉素在培养液中的终浓度为0.04、0.08、0.16、0.32、0.64和1.28 mg/ml;恩诺沙星在培养液中的终浓度为31.25、62.50、125.00、250.00、500.00和1000.00 ng/ml。如非特殊说明,实验为3个平行;阳性对照和阴性对照用于表征细菌增殖的正常与否及培养体系是否被细菌污染。
1.2.3 BMD AST实验BMD AST实验按照CLSI (2010)推荐的方法进行。在无菌96孔板A1中加入180 μl待测菌液(5×105 CFU/ml),在A2~A11共10个孔中分别加入100 μl同浓度待测菌液;向A1孔中加入20 μl浓度为6400.00 μg/ml的卡那霉素溶液,混匀,然后从该孔中取100 μl混合液加入A2孔,照此操作逐次倍比稀释抗生素浓度至A10 (弃掉A10孔中取出的100 μl混合液);不含卡那霉素的A11孔作为阳性对照,另取100 μl无菌LB液体培养基放入A12孔作为阴性对照。如非特殊说明,实验为3个平行。将准备好的该96孔板放置于培养箱,于35℃下温育20 h。取出后,肉眼根据浊度判断生长结果并拍照。使用相同方法研究VP对四环素、青霉素和恩诺沙星的耐药情况,其中,四环素、青霉素和恩诺沙星的最高浓度分别为128.00、1280.00和8.00 μg/ml。

|
图 2 BMD法进行AST测定的工作示意图 Fig.2 Diagram of BMD-based AST assay |
微生物生长传感器和BMD实验所获MIC值相同或相差±1个稀释度的视为基本一致(Essential agreement, EA);相差±2和±3个稀释度的视为微小错误(minor Error, mE);相差±3个稀释度以上的视为重大错误(Major Error, ME)。
2 结果与分析 2.1 质控菌株ATCC 17802药敏实验结果VP的新陈代谢作用将LB液体培养基中导电能力较差的大分子营养物质分解转化为电活性较好的氨基酸、醛、酮、无机盐等,因而使之导电性增强。采用电容耦合非接触式电导检测器在线记录这种导电性能的变化,并将之对培养时间作图,即可得到生长动力学曲线。液体培养基中存在的抗生素通过抑制细胞的增殖/生长而影响生长曲线的动力学参数(如调整时间、最大生长速率、最大生长量等)。对应的是,生长曲线上动力学参数的变化亦可反过来指示抗生素对微生物的抑制作用效果,是为微生物生长传感器AST法的工作原理(Zhang et al, 2018)。如图 3所示,当LB液体培养基中没有抗生素存在的情况下(阳性对照),微生物生长传感器通过实时监测VP的生长而形成的S型曲线(图 3A1、图 3B1、图 3C1和图 3D1)。和传统的OD值曲线(Qiu et al, 2017)、接触式电导曲线(Yang et al, 2005)一样,从该S型曲线上可以方便地得知调整期、加速期、指数期、减缓期和稳定期等细菌生长参数。值得注意的是,该曲线的时间分辨率为120 s,显著高于OD值曲线(20 min)(Qiu et al, 2017)和接触式电导曲线(5 min)(Yang et al, 2005)。与阳性对照对应的阴性对照测定结果表明,即使没有抗生素的存在,无接种VP ATCC 17802的LB液体培养基也不会发生电导率的变化(培养过程的传感器响应为平滑直线,见图 3A8、图 3B8、图 3C8和图 3D8)。
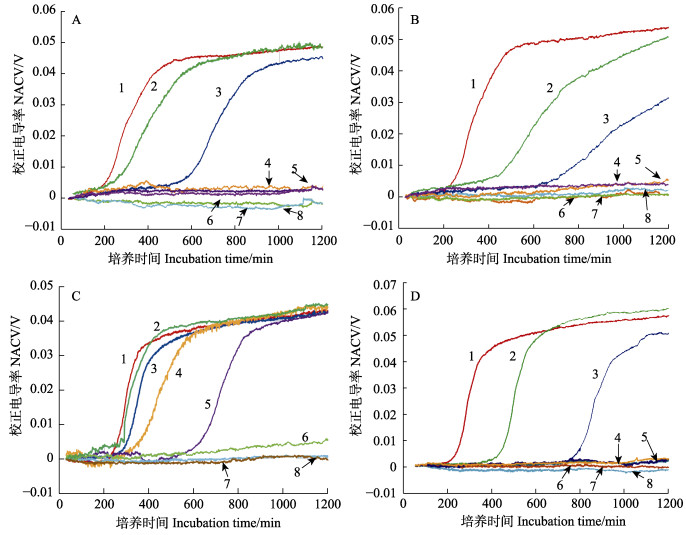
|
图 3 微生物生长传感器法测定质控菌株ATCC 17802对卡那霉素(A)、四环素(B)、青霉素(C)和恩诺沙星(D)的敏感性
Fig.3 Antibiotic susceptibility testing of VP against kanamycin (A), tetracycline (B), penicillin V (C) and enrofloxacin (D) with the microbial growth sensor
A:曲线1~8对应卡那霉素浓度分别为0(阳性对照)、2.50、5.00、10.00、20.00、40.00、80.00和0 μg/ml(阴性对照); B:曲线1~8对应四环素浓度分别为0(阳性对照)、0.50、1.00、2.00、4.00、8.00、16.00和0 μg/ml(阴性对照); C:曲线1~8对应青霉素浓度分别为0(阳性对照)、0.04、0.08、0.16、0.32、0.64、1.28和0 mg/ml(阴性对照); D:曲线1~8对应恩诺沙星浓度分别为0(阳性对照)、31.25、62.50、125.00、250.00、500.00、1000.00和0 ng/ml(阴性对照) VP growth curves, from 1 to 8 in the presence of (A) kanamycin at concentrations of 0 (positive control), 2.50, 5.00, 10.00, 20.00, 40.00, 80.00 and 0 μg/ml (negative control); (B) tetracycline at concentrations of 0 (positive control), 0.50, 1.00, 2.00, 4.00, 8.00, 16.00 and 0 μg/ml (negative control); (C) penicillin V at concentrations of 0 (positive control), 0.04, 0.08, 0.16, 0.32, 0.64, 1.28 and 0 mg/ml (negative control); (D) enrofloxacin at concentrations of 0 (positive control), 31.25, 62.50, 125.00, 250.00, 500.00, 1000.00 and 0 ng/ml (negative control) |
当培养基中有2.50和5.00 μg/ml卡那霉素时,抗生素抑制VP ATCC 17802生长的能力随着浓度的增加而增强,但只是增大调整期,几乎不能影响最大增殖量(图 3A2和图 3A3)。在卡那霉素浓度为10.00、20.00、40.00和80.00μg/ml时,传感器检测结果与阴性对照结果一致(图 3A4、图 3A5、图 3A6和图 3A7),表明细菌的生长被完全抑制,因而,卡那霉素对VP ATCC 17802的MIC为10.00 μg/ml。
当培养基中有0.50和1.00 μg/ml的四环素时,抗生素抑制VP ATCC 17802生长的能力随着浓度的增加而增强,不但持续增加调整期时长,而且显著抑制最大生长率(图 3B2和图 3B3)。在四环素浓度为2.00、4.00、8.00和16.00 μg/ml时,传感器检测结果与阴性对照结果一样(图 3B4、图 3B5、图 3B6和图 3B7),表明细菌的生长被完全抑制,因而,四环素对VP ATCC 17802的MIC为2.00 μg/ml。
当培养基中有0.04、0.08、0.16和0.32 mg/ml青霉素时,抗生素抑制VP ATCC 17802生长的能力随着浓度的增加而增强,但只是增大调整期,几乎不影响最大增殖量(图 3C2、图 3C3、图 3C4和图 3C5)。在青霉素浓度为0.64 mg/ml时,传感器检测结果表明,20 h内虽未形成S型曲线,然而具有细菌生长现象(图 3C6)。在青霉素浓度为1.28 mg/ml时,传感器检测结果与阴性对照结果一样(图 3C7),表明细菌的生长被完全抑制,因而,卡那霉素对VP ATCC 17802的MIC为1.28 mg/ml。
当培养基中有31.25和62.50 ng/ml恩诺沙星时,抗生素抑制VP ATCC 17802生长的能力随浓度的增加而增强,但只是增大调整期,几乎不影响最大增殖量(图 3D2和图 3D3)。在卡那霉素浓度为125.00、250.00、500.00和1000.00 ng/ml时,传感器检测结果与阴性对照结果相同(图 3D4、图 3D5、图 3D6和图 3D7),表明细菌的生长被完全抑制,因而,恩诺沙星对VP ATCC 17802的MIC为125.00 ng/ml。
采用BMD进行AST实验的典型结果见图 4。为了避免因培养时间不同造成MIC的差异(Tang et al, 2013; Tsukatani et al, 2012),BMD AST实验结果判读时间与微生物生长传感器测定时长保持完全一致(20 h)。由图 4可以看出,卡那霉素、四环素、青霉素和恩诺沙星对VP ATCC 17802的MIC分别为10.00 μg/ml、2.00 μg/ml、1.28 mg/ml和62.50 ng/ml。BMD法测定所得到的MIC值是微生物生长传感器法测定值的1/2浓度;2种方法测定所得其他3种抗生素的MIC值完全吻合。因此,这2种AST测定结果的EA为100%;mE和ME皆为0%。

|
图 4 BMD法测定质控菌株ATCC 17802对卡那霉素(A)、四环素(B)、青霉素(C)和恩诺沙星(D)的敏感性 Fig.4 Antibiotic susceptibility testing of VP against kanamycin (A), tetracyclines (B), penicillin V (C) and enrofloxacin (D) with the BMD assay 3个平行实验中,96孔板上第11列为阳性对照,第12列为阴性对照。自第1列起至第10列:卡那霉素浓度依次为640.00、320.00、160.00、80.00、40.00、20.00、10.00、5.00、2.50和1.25 μg/ml;四环素浓度依次为128.00、64.00、32.00、16.00、8.00、4.00、2.00、1.00、0.50和0.25 μg/ml;青霉素浓度依次为1280.00、640.00、320.00、160.00、80.00、40.00、20.00、10.00、5.00和2.50 μg/ml;恩诺沙星浓度依次为8.00、4.00、2.00和1.00 μg/ml,500.00、250.00、125.00、62.50、31.25和15.63 ng/ml Testing is conducted in triplicate. In 96-well plates, samples loaded in line 11 and line 12 are positive and negative controls, respectively. From line 1 to line 10: the concentration of kanamycin is 640.00, 320.00, 160.00, 80.00, 40.00, 20.00, 10.00, 5.00, 2.50 and 1.25 μg/ml; the concentration of tetracycline is 128.00, 64.00, 32.00, 16.00, 8.00, 4.00, 2.00, 1.00, 0.50 and 0.25 μg/ml; the concentration of penicillin V is 1280.00, 640.00, 320.00, 160.00, 80.00, 40.00, 20.00, 10.00, 5.00 and 2.50 μg/ml; the concentration of enrofloxacin is 8.00, 4.00, 2.00 and 1.00 μg/ml, 500.00, 250.00, 125.00, 62.50, 31.25 and 15.63 ng/ml |
以分离自养殖环境的2株VP和分离自生物体中的2株VP为模式微生物,采用和上述实验完全相同的步骤测定它们对4种抗生素的敏感性。微生物生长传感器法测定结果表明,卡那霉素对分离VP菌株的MIC值范围为2.50~10.00 μg/ml,基本上等同于从血液中分离的菌株(1.00~8.00 μg/ml)(Hollis et al, 1976);四环素对分离VP菌株的MIC值范围为1.00~32.00 μg/ml,其中,3株菌(20150709009-1,20150718005-1和20150705007-2)的MIC值与文献报道基本一致(1.00~2.00 μg/ml)(Hollis et al, 1976; Lopatek et al, 2015),来自于凡纳滨对虾的20140829005-2号菌株MIC值高出一个数量级;青霉素对3个分离VP菌株的MIC值都是160.00 μg/ml,该值与Hollis等(1976)的发现(> 128.00 μg/ml)吻合性较好,但对环境分离菌株20150718005-1的MIC值为40.00 μg/ml;恩诺沙星对分离VP菌株的MIC值范围为62.50~125.00 ng/ml,远低于Roque等(2001)的报道(0.45 μg/ml)。BMD AST测定MIC值基本上与微生物生长传感器法测定结果吻合或低1倍。但也有2个例外,对20150718005-1号分离菌株,BMD AST测定四环素的MIC值是微生物生长传感器法测定结果的2倍;对20150705007-2号分离菌株,BMD AST测定青霉素的MIC值是微生物生长传感器法测定结果的2倍。
|
|
表 1 微生物生长传感器法和BMD法所测定VP分离菌株对卡那霉素、四环素、青霉素和恩诺沙星的敏感性结果 Tab.1 In vitro susceptibilities of VP isolates to kanamycin, tetracycline, penicillin and enrofloxacin as determined by the microbial growth sensor based AST assay and BMD assay |
细菌生长/增殖时,新陈代谢作用将培养基中导电能力较差的大分子营养物质(如酵母提取物、蛋白胨、糖等)转化分解为电活性较好的小分子物质(如氨基酸、醛、酮、无机盐等),因而使混合液的导电性增强(Varshney et al, 2008)。通过采用电容耦合非接触式电导检测器在线记录这种导电性能的变化即可绘制出微生物的生长曲线,进而用于研究微生物被目标抗生素抑制的程度(Zhang et al, 2018),即微生物生长传感器AST法。该方法可以直接给出MIC值,同时,还解决了上述光密度法存在的3个问题。但迄今为止,微生物生长传感器AST法与作为金标准的CLSI BMD AST法之间对比验证尚未见报道。
每种抗生素都有其抗菌范围和抗菌活性,而且,相应范围和活性还会随着时空的变化而改变,比如菌群抗药性的产生将对治疗和预防效果产生巨大影响(黄伟德等, 2018; van Belkum et al, 2019)。因此,农业生产、食品加工、生态环境保护等各个领域都急需正确的用药指导,从而合理选用抗生素、提高疗效、防止抗生素的滥用和误用(Avesar et al, 2017; van Belkum et al, 2019)。由于正确的用药指导必需建立在准确的AST数据之上,因此,近年来AST相关方法和技术得到了广泛的研究。其中,基于液体培养的方法常常能比对应的琼脂培养法更快地给出检测结果,因而获得越来越多的探讨与应用(Avesar et al, 2017)。本世纪以来,绝大多数自动、半自动药敏实验技术(如OD值法、流式细胞仪法等)的发展基本上都基于液体培养法(Zhang et al, 2019)。本研究团队为解决现有基于光学和电化学原理的自动化技术存在的问题,构建了一种微生物生长传感器AST方法(Zhang et al, 2018)。将该方法与标准BMD AST方法进行比较验证,归纳出以下特点:无论是以质控菌株还是以分离菌株为研究对象,微生物生长传感器AST测定结果和BMD AST测定结果的MIC值吻合性都很好,实验没有发现超出2个倍比浓度的差异数据(EA=100%),说明微生物生长传感器AST方法具有良好的准确性。如果不考虑由操作者造成的主观和客观误差,本特点表明这种基于传感器的自动化方法优于通常流行的OD值自动化方法(Zhou et al, 2018)。此外,微生物生长传感器AST测定的MIC值往往大于或者等于BMD AST测定的结果,这个现象与Vourli等(2017)的发现一致,其原因在于自动化仪器的灵敏度高于肉眼观察。图 3C6曲线和其对应的图 4C第2列浊度情况直白地表明了这一点。因此,无论是从原理还是实践来讲,传感器方法的AST结论比基于肉眼判断的结果都具有更高的可靠性。
众所周知,培养时间是影响MIC读出值的重要影响因素(Tang et al, 2013; Tsukatani et al, 2012)。采用BMD AST测定时,必需严格要求操作者在特定的时间节点判断MIC值。如果由于客观的原因造成读取的延迟将有可能获得偏小的虚假数据,从而造成实验的失败。当采用微生物生长传感器AST测定时,由于任何时刻微生物的生长状态都存在永久记录,所以可以在完成培养后的任何合适的时刻获得目标时间节点处的MIC值。因此,从用户友好性来讲,微生物生长传感器AST法具有明显的优势。
BMD AST能直接给出MIC值是依据在培养时间终点(20 h)时观察96孔板上培养液的浊度,肉眼判断透明视为该浓度抗生素抑制了VP的生长,最低浓度即为MIC值(CLSI, 2010)。然而,该终点观察所得结果仅能提供是否抑制细菌生长这个定性信息。相对而言,微生物生长传感器AST测定时给出VP生长的实时动力学曲线(图 3),可以详细报告不同种类、不同浓度抗生素对细菌生长每个阶段的影响,从而给出更多的信息(Tang et al, 2013)。更重要的是同OD值法一样(Veses-Garcia et al, 2018),基于记录细菌生长曲线的该自动化方法提供准确、易读的调整期时长数据。根据这个数据判定特定浓度的抗生素是否会完全抑制细菌生长,较之于终点判定可能会节约几个甚至十几个小时,因而具有更好的AST测定效率。
比较而言,微生物生长传感器AST法比标准BMD AST法的操作相对简便,出现失误的几率更低,而且更易于集成先进的辅助技术,比如目前已经成熟的培养液自动分配技术(Zhou et al, 2018; Smith et al, 2016),进而实现全自动化——不但能够进一步降低操作误差,还能够进一步降低对操作者专业技能的苛刻要求,从而更易于在众多领域推广(Veses-Garcia et al, 2018; Mezger et al, 2015)。虽然,本研究采用VP为模式微生物,对比验证了微生物生长传感器法和BMD法进行AST检测的主要特征,但在成为标准化方法之前,微生物生长传感器AST法的精密度、重现性、再现性等特点需要更多的验证。
Avesar J, Rosenfeld D, Truman-Rosentsvit M, et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(29): E5787-E5795 DOI:10.1073/pnas.1703736114 |
Bonnin-Jusserand M, Copin S, Le Bris C, et al. Vibrio species involved in seafood-borne outbreaks (Vibrio cholerae, V. parahaemolyticus and V. vulnificus): Review of microbiological versus recent molecular detection methods in seafood products. Critical Reviews in Food Science and Nutrition, 2019, 59(4): 597-610 |
Boolchandani M, D'Souza AW, Dantas G. Sequencing-based methods and resources to study antimicrobial resistance. Nature Reviews Genetics, 2019, 20(6): 356-370 |
Clinical and Laboratory Standards Institute (CLSI). Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline, 2nd ed. CLSI document M45-A2. Wayne, PA, 2010 |
Elmahdi S, Parveen S, Ossai S, et al. Vibrio parahaemolyticus and Vibrio vulnificusr recovered from oysters during an oyster relay study. Applied and Environmental Microbiology, 2018, 84(3): e01790-17 |
Fredborg M, Rosenvinge FS, Spillum E, et al. Rapid antimicrobial susceptibility testing of clinical isolates by digital time-lapse microscopy. European Journal of Clinical Microbiology and Infectious Diseases, 2015, 34(12): 2385-2394 DOI:10.1007/s10096-015-2492-9 |
Hayden RT, Clinton LK, Hewitt C, et al. Rapid antimicrobial susceptibility testing using forward laser light scatter technology. Journal of Clinical Microbiology, 2016, 54(11): 2701-2706 DOI:10.1128/JCM.01475-16 |
Hollis DG, Weaver RE, Baker CN, et al. Halophilic Vibrio species isolated from blood cultures. Journal of Clinical Microbiology, 1976, 3(4): 425-431 |
Huang MS, Yang QQ, Zhang Y, et al. Study on the effects of temperature, salinity, pH, phosphate, nitrate, and ammonium on the growth of Vibrio parahaemolyticus using response surface methodology. Progress in Fishery Sciences, 2019, 40(2): 132-140 [黄梦诗, 杨倩倩, 张艳, 等. 响应面法研究温度、盐度、pH及磷酸盐、硝氮、氨氮对副溶血弧菌生长的影响. 渔业科学进展, 2019, 40(2): 132-140] |
Huang WD, Xiao SY, Li SM, et al. Detection of antibiotics resistance and resistance genes in Vibrio parahaemolyticus from Litopenaeus vannamei of Guangxi. Southwest China Journal of Agricultural Sciences, 2018, 31(9): 1979-1988 [黄伟德, 肖双燕, 黎姗梅, 等. 广西凡纳滨对虾源副溶血弧菌耐药性和耐药基因的检测. 西南农业学报, 2018, 31(9): 1979-1988] |
Lopatek M, Wieczorek K, Osek J. Prevalence and antimicrobial resistance of Vibrio parahaemolyticus isolated from raw shellfish in Poland. Journal of Food Protection, 2015, 78(5): 1029-1033 DOI:10.4315/0362-028X.JFP-14-437 |
Mezger A, Gullberg E, Göransson J, et al. A general method for rapid determination of antibiotic susceptibility and species in bacterial infections. Journal of Clinical Microbiology, 2015, 53(2): 425-432 DOI:10.1128/JCM.02434-14 |
Qiu TA, Nguyen TH, Hudson-smith NV, et al. Growth-based bacterial viability assay for interference-free and high- throughput toxicity screening of nanomaterials. Analytical Chemistry, 2017, 89(3): 2057-2064 DOI:10.1021/acs.analchem.6b04652 |
Roque A, Molina-Aja A, Bolán-Mejía C, et al. In vitro susceptibility to 15 antibiotics of vibrios isolated from penaeid shrimps in Northwestern Mexico. International Journal of Antimicrobial Agents, 2001, 17(5): 383-387 DOI:10.1016/S0924-8579(01)00308-9 |
Schoepp NG, Khorosheva EM, Schlappi TS, et al. Digital quantification of DNA replication and chromosome segregation enables determination of antimicrobial susceptibility after only 15 minutes of antibiotic exposure. Angewandte Chemie. International Ed. in English, 2016, 55(33): 9557-9561 DOI:10.1002/anie.201602763 |
Schumacher A, Vranken T, Malhotra A, et al. In vitro antimicrobial susceptibility testing methods: Agar dilution to 3D tissue- engineered models. European Journal of Clinical Microbiology & Infectious Diseases, 2018, 37(2): 187-208 |
Silva IP, Carneiro CDS, Saraiva MAF, et al. Antimicrobial resistance and potential virulence of Vibrio parahaemolyticus isolated from water and bivalve mollusks from Bahia, Brazil. Marine Pollution Bulletin, 2018, 131: 757-762 DOI:10.1016/j.marpolbul.2018.05.007 |
Smith KP, Kirby JE. Verification of an automated, digital dispensing platform for at-will broth microdilution-based antimicrobial susceptibility testing. Journal of Clinical Microbiology, 2016, 54(9): 2288-2293 DOI:10.1128/JCM.00932-16 |
Syal K, Mo M, Yu H, et al. Current and emerging techniques for antibiotic susceptibility tests. Theranostics, 2017, 7(7): 1795-1805 DOI:10.7150/thno.19217 |
Tang YY, Zhen L, Liu JQ, et al. Rapid antibiotic susceptibility testing in a microfluidic pH sensor. Analytical Chemistry, 2013, 85(5): 2787-2794 DOI:10.1021/ac303282j |
Tsukatani T, Suenaga H, Shiga M, et al. Comparison of the WST-8 colorimetric method and the CLSI broth microdilution method for susceptibility testing against drug-resistant bacteria. Journal of Microbiological Methods, 2012, 90(3): 160-166 DOI:10.1016/j.mimet.2012.05.001 |
van Belkum A, Bachmann TT, Lüdke G, et al. Developmental roadmap for antimicrobial susceptibility testing systems. Nature Reviews Microbiology, 2019, 17(1): 51-62 DOI:10.1038/s41579-018-0098-9 |
Varshney M, Li YB. Double interdigitated array microelectrode- based impedance biosensor for detection of viable Escherichia coli O157:H7 in growth medium. Talanta, 2008, 74(4): 518-525 DOI:10.1016/j.talanta.2007.06.027 |
Veses-Garcia M, Antypas H, Löffler S, et al. Rapid phenotypic antibiotic susceptibility testing of uropathogens using optical signal analysis on the nanowell slide. Frontiers in Microbiology, 2018, 9: 1530 DOI:10.3389/fmicb.2018.01530 |
Vourli S, Dafopoulou K, Vrioni G, et al. Evaluation of two automated systems for colistin susceptibility testing of carbapenem-resistant Acinetobacter baumannii clinical isolates. Journal of Antimicrobial Chemotherapy, 2017, 72(9): 2528-2530 DOI:10.1093/jac/dkx186 |
Wang YT. Guidance for prescription in aquaculture based on the results of antibiotic susceptibility testing (Part 1). China Fisheries, 2014, 11061106(4): 53-56 [王玉堂. 基于药敏试验结果的水产养殖用药指导技术(连载一). 中国水产, 2014, 11061106(4): 53-56 DOI:10.3969/j.issn.1002-6681.2014.04.022] |
Wiegand I, Hilpert K, Hancock REW. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols, 2008, 3(2): 163-175 DOI:10.1038/nprot.2007.521 |
Yang KM, Guo AM, Ma JX, et al. Isolation, identification, and antibiotic sensitivity of bacillary enteritis inPerca fluviatilis Linnaeus. Progress in Fishery Sciences, 2018, 39(6): 42-51 [杨昆明, 郭爱民, 马江霞, 等. 河鲈细菌性肠炎致病菌的分离、鉴定及药敏实验. 渔业科学进展, 2018, 39(6): 42-51] |
Yang LJ, Banada PP, Liu YS, et al. Conductivity and pH dual detection of growth prfile of healthy and stressed Listeria monocytogenes. Biotechnology and Bioengineering, 2005, 92(6): 685-694 DOI:10.1002/bit.20642 |
Zhang XZ, Jiang XY, Hao ZH, et al. Advances in online methods for monitoring microbial growth. Biosensors and Bioelectronics, 2019, 126: 433-447 DOI:10.1016/j.bios.2018.10.035 |
Zhang XZ, Jiang XY, Yang QQ, et al. Online monitoring of bacterial growth with an electrical sensor. Analytical Chemistry, 2018, 90(10): 6006-6011 DOI:10.1021/acs.analchem.8b01214 |
Zhang ZH, Guo DF, Wang JJ, et al. An improved Kirby-Bauer disk diffusion method to determine drug resistance against Vibrio parahaemolyticus. Journal of Microbiology, 2014, 34(1): 78-83 [张昭寰, 郭丹凤, 王敬敬, 等. 改良K-B法用于副溶血性弧菌耐药性检测. 微生物学杂志, 2014, 34(1): 78-83 DOI:10.3969/j.issn.1005-7021.2014.01.015] |
Zhou ML, Wang Y, Liu C, et al. Comparison of five commonly used automated susceptibility testing methods for accuracy in the China Antimicrobial Resistance Surveillance System (CARSS) hospitals. Infection and Drug Resistance, 2018, 11: 1347-1358 DOI:10.2147/IDR.S166790 |



