2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071
三疣梭子蟹(Portunus trituberculatus)是我国重要的海水养殖经济蟹(戴爱云等, 1977)。盐度是三疣梭子蟹养殖中的重要环境因子,直接影响其生长、发育和存活(隋延鸣等, 2012)。夏季暴雨多发,养殖水体盐度急剧下降,使得三疣梭子蟹体内渗透压失衡,导致其生长缓慢、成活率较低(孙东方等, 2018)。病害发生也是影响三疣梭子蟹养殖的重要问题,其中,对虾白斑综合征病毒(WSSV)和副溶血弧菌(Vibrio parahaemolyticus)是导致三疣梭子蟹死亡的主要病原(Marques et al, 2011; Sullivan et al, 2017)。耐低盐和抗病性状是三疣梭子蟹重要的育种性状,深入研究其低盐适应和免疫防御的分子机制对培育三疣梭子蟹耐低盐及抗病良种具有重要意义。
14-3-3基因是一种广泛分布于所有真核生物中的高保守基因(Chaudhri et al, 2003),编码一组酸性可溶的多功能蛋白,由Moore等(1967)首次在牛脑细胞中发现。14-3-3基因的功能具有多样性,参与生物细胞应激、免疫、细胞周期调控、细胞信号转导、代谢酶合成、细胞凋亡等多种生理过程的调控(Koskinen et al, 2004; Angrand et al, 2006; Neal et al, 2009; Matta et al, 2012; Rehman et al, 2014; Gómez-Suárez et al, 2016; Lu et al, 2017; Yang et al, 2017)。由于其功能的重要性,该基因在拟穴青蟹(Scylla paramamosain)、凡纳滨对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)等多种经济甲壳类动物中已被克隆,比如在盐度胁迫过程中,斑节对虾中14-3-3基因大量表达(Kaeodee et al, 2011);在病原感染过程中,凡纳滨对虾中14-3-3基因呈显著上调表达(Wang et al, 2007),初步证明了该基因在抗逆、抗病过程中具重要作用。至今尚未见该基因在三疣梭子蟹中的相关研究报道。
本研究以三疣梭子蟹为对象,通过本实验室三疣梭子蟹转录组测序得到三疣梭子蟹14-3-3基因片段,对14-3-3基因在不同组织、低盐和病原胁迫下的表达情况进行研究。本研究利用RACE技术,首次克隆三疣梭子蟹14-3-3基因,通过qRT-PCR分析其在三疣梭子蟹不同组织中的表达水平,并对其在盐度胁迫和病原胁迫下的表达变化规律进行研究,以此探讨Pt14-3-3在三疣梭子蟹盐度适应和免疫反应中的功能,为三疣梭子蟹耐低盐和抗病品种培育提供依据。
1 材料与方法 1.1 实验材料本实验所需三疣梭子蟹均取自中国水产科学研究院黄海水产研究所实验基地潍坊昌邑海丰水产有限公司,体重为(5.78±1.11) g。暂养于4 m×5 m×1.5 m的室内水泥池中,每池90只,共10池,暂养7 d。养殖水温为(25±1)℃,盐度为33,pH 8.7,持续充氧,每天换水1/3,于18:00定时投喂蓝蛤(Potamocorbula laevis)。随机选取9只暂养后健康有活力的三疣梭子蟹,分别取其血细胞、心脏、肝胰腺、鳃、肌肉和眼柄,存于液氮,设3个平行,每个平行3只,用于组织表达分布分析。
1.2 实验方法 1.2.1 盐度胁迫实验随机挑取暂养7 d的三疣梭子蟹,分为2组,对照组(33)和低盐组(11)(72 h半致死盐度)(Han et al, 2014;隋延鸣等, 2012),每个处理组设3个平行,每个平行60只。使用自然海水和淡水配制低盐度实验用水,使用YSI盐度仪进行盐度校准,具体方法见隋延鸣等(2012)。各组分别于胁迫后0、3、6、12、24、48和72 h取鳃和肝胰腺组织,液氮速冻保存,用于RNA的提取,每个时间点取3只。
1.2.2 病原胁迫实验随机挑取暂养7 d后体表完整、活力旺的三疣梭子蟹,分成副溶血弧菌注射组和WSSV注射组,每组50只,设3个平行。分别于梭子蟹的游泳足第一关节基膜处注射浓度为3.8×108 CFU/ml副溶血弧菌和7.6×107 CFU/ml WSSV(谢建军等, 2011; Ren et al, 2017)。在人工感染后的0、3、6、12、24、48和72 h取血细胞和肝胰腺组织,于液氮中速冻保存,用于RNA提取,每个时间点取3只。
1.3 Pt14-3-3基因全长cDNA的克隆及测序取三疣梭子蟹鳃、肝胰腺、肌肉等组织样品,采用TRIzol® Reagent(Invitrogen公司)方法进行总RNA提取,经1%琼脂糖凝胶电泳和紫外分光光度计(NanoDrop 2000, Thermo)对所提RNA检测质量和浓度,将各组织的高质量RNA均匀混合,使用SmartTM RACE Amplification Kit (TaKaRa公司)进行3'和5' RACE cDNA模板的合成。根据从三疣梭子蟹cDNA文库中获得的Pt14-3-3基因的EST序列,利用Primer Premier 5.0软件设计3'RACE和5'RACE特异性引物及RACE通用引物UPM(表 1-1)。使用Advantage 2 PCR Kit(Clontech公司)进行3'和5'末端的扩增。将获得的PCR产物回收纯化、连接转化,挑取阳性单克隆,利用M13-47/48引物进行菌落PCR鉴定,筛选目的菌液进行测序。
|
|
表 1 本研究中所用引物序列 Tab.1 The sequence of primers used in this study |
利用Vector NTI 11.0软件对测序后的序列进行冗余序列去除和再拼接,通过DNAStar的EditSeq程序进行开放阅读框(ORF)的预测和氨基酸的翻译。三疣梭子蟹Pt14-3-3基因的核苷酸序列和推导氨基酸序列使用BLAST(http://www.blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对。利用ProtParam tool软件进行蛋白质理化性质预测,使用InterproScan软件进行蛋白质功能结构域分析,TMHMM 2.0软件进行蛋白质跨膜区分析。使用ClustalX软件对三疣梭子蟹Pt14-3-3基因的氨基酸序列与其他物种的14-3-3氨基酸序列进行多序列比对,在此基础上采用MEGA 4.0软件,以邻接法构建系统进化树。
1.5 Pt14-3-3的组织表达及各实验组的表达特征利用Trizol试剂提取不同实验组三疣梭子蟹鳃和肝胰腺组织的总RNA,使用PrimeScript RT reagent Kit反转录合成cDNA。根据已获得的三疣梭子蟹内参基因β-actin和Pt14-3-3基因全长序列,利用Primer Premier 5.0软件设计2对正反引物(β-actin-F和β-actin-R;Q14-3-3-F和Q14-3-3-R)(表 1),使用SYBR Premix Ex Taq Ⅱ试剂在ABI 7500 Real Time PCR仪上对不同处理组获得的Pt14-3-3基因进行实时荧光定量检测。荧光定量PCR反应体系为20 μl:10 μl SYBR Premix Ex TaqTM Ⅱ (2×),0.8 μl 10 μmol/L的引物Q14-3-3-F,0.8 μl 10 μmol/L的引物Q14-3-3-R,0.4 μl ROX Reference Dye Ⅱ(50×),2.0 μl cDNA模板,6.0 μl无菌ddH2O。反应程序:95℃ 30 s,95℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。采用2-∆∆Ct计算Pt14-3-3基因的相对表达量,使用SPSS 17.0软件进行单因素方差(One-way ANOVA)分析。
2 结果与分析 2.1 Pt14-3-3基因cDNA全长克隆及序列分析获得的三疣梭子蟹基因全长为2510 bp,包括93 bp的5'端非编码区,1676 bp的3'非编码区和744 bp的开放阅读框(ORF)(图 1)。3'端含有PolyA尾,具有AATAAA多聚腺苷酸加尾信号。氨基酸序列分析可知,Pt14-3-3基因编码一个由247个氨基酸组成,理论等电点为4.65,分子量为27.98 kDa的蛋白。由于其较高的不稳定系数(41.28)和较低的GRAVY(Grand average of hydropathicity) (–0.657),推断其为不稳定的亲水蛋白。

|
图 1 三疣梭子蟹14-3-3基因核苷酸序列及其推导的氨基酸序列 Fig.1 Nucleotide sequence and deduced amino acids sequence of P. trituberculatus 14-3-3 gene |

|
图 2 三疣梭子蟹Pt14-3-3氨基酸序列与其他物种14-3-3氨基酸序列比对 Fig.2 Amino-acid sequences alignment of P. trituberculatus with different animalsx 14-3-3 genes |
利用MEGA 4.0软件进行系统进化分析显示,所有物种的14-3-3共聚为两大类群:脊椎动物和无脊椎动物;在无脊椎动物中,三疣梭子蟹与中华绒螯蟹(Eriocheir sinensis)紧密聚为一支,同源性为94%,之后的聚类顺序依次为与脊尾白虾(Palaemon carinicauda)、日本对虾(Marsupenaeus japonicus)、拟穴青蟹、斑节对虾、墨吉明对虾(Fenneropenaeus merguiensis)。在脊椎动物和无脊椎动物中,14-3-3基因在氨基酸序列上都具有高度的保守性,表明该基因在物种间非常保守。
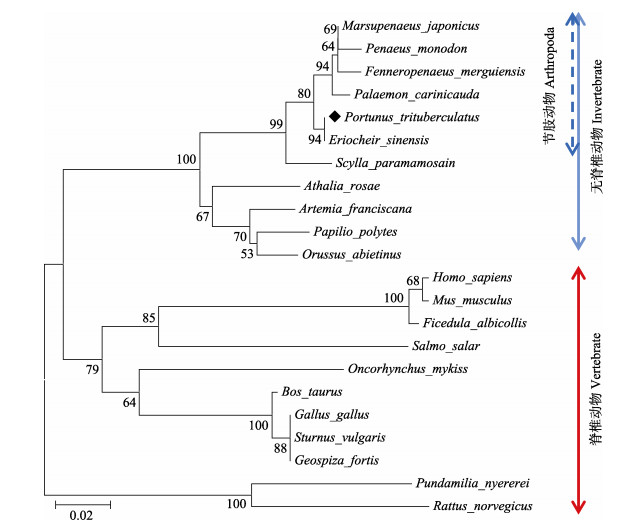
|
图 3 利用MEGA 4.0软件构建的基于14-3-3氨基酸序列的NJ系统进化树 Fig.3 NJ tree based on 14-3-3 gene amino acid sequences using MEGA 4.0 |
利用实时荧光定量PCR分析了三疣梭子蟹Pt14-3-3基因在不同组织中的表达分布特征,结果显示,Pt14-3-3基因在鳃、肝胰腺、肌肉、眼柄、血细胞和心脏中均有表达。其中,在肝胰腺中的表达量最高,其次为肌肉、鳃、心脏和眼柄,而在血淋巴中的表达量最低(图 4)。
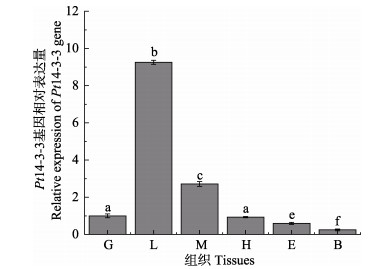
|
图 4 三疣梭子蟹Pt14-3-3基因在各组织中的表达 Fig.4 Distribution of Pt14-3-3 gene expression in different tissues of P. trituberculatus G:鳃;L:肝胰腺;M:肌肉;H:心脏;E:眼柄;B:血细胞不同字母代表差异显著(P < 0.05)。下同 G: Gill; L: Liver; M: Muscle; H: Heart; E: Eyestalk; B: Blood cell. Different letters on the column represent significant differences (P < 0.05). The same as below |
Real-time PCR检测了三疣梭子蟹在低盐胁迫后不同时间点的鳃和肝胰腺中Pt14-3-3基因的相对表达情况(图 5)。低盐胁迫后,Pt14-3-3基因在鳃中的相对表达量与对照组相比,于3~24 h呈现显著下调表达,48~72 h为显著上调表达,分别于6 h和48 h达到最小值和最大值,为对照组的0.24倍(P < 0.05)和1.34倍(P < 0.05)。低盐胁迫后,Pt14-3-3基因在肝胰腺中的相对表达量与对照组相比,除6 h外,整体呈上调表达,表达趋势为先上升、下降后再上升、下降,于12 h达到最大值,为对照组的7.54倍(P < 0.05)。
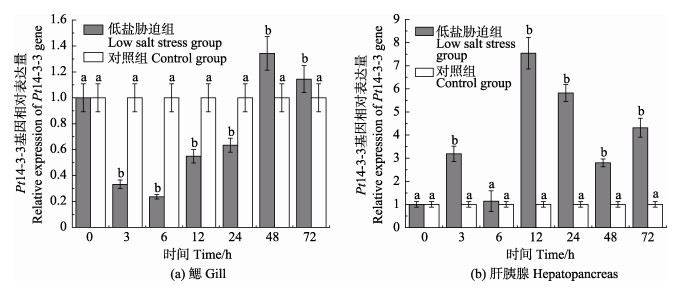
|
图 5 Pt14-3-3基因在低盐胁迫下鳃和肝胰腺中的表达情况 Fig.5 Expression of Pt14-3-3 gene in gill and hepatopancreas under low salt stress |
实时荧光定量PCR检测了三疣梭子蟹在病原胁迫后不同时间点的肝胰腺和血细胞中Pt14-3-3基因的相对表达情况(图 6)。感染副溶血弧菌后,Pt14-3-3基因在肝胰腺中相对表达量与对照组相比,整体呈显著上调表达,分别于12 h和48 h达到最大值和最小值,为对照组的17.52倍(P < 0.05)和1.77倍(P < 0.05);在血细胞中的相对表达量与对照组相比,除6 h外,整体呈下调表达,分别于6 h和12 h达到最大值和最小值,为对照组的1.68倍(P < 0.05)和0.04(P < 0.05)倍。感染WSSV后,Pt14-3-3基因在肝胰腺和血细胞中的相对表达量与对照组相比,除24 h外,整体均呈上调表达,分别于72 h和3 h达到最大值,为对照组的13.35倍(P < 0.05)和3.25倍(P < 0.05),均于24 h降至最小值,分别为对照组的0.52倍(P < 0.05)和0.42倍(P < 0.05)。
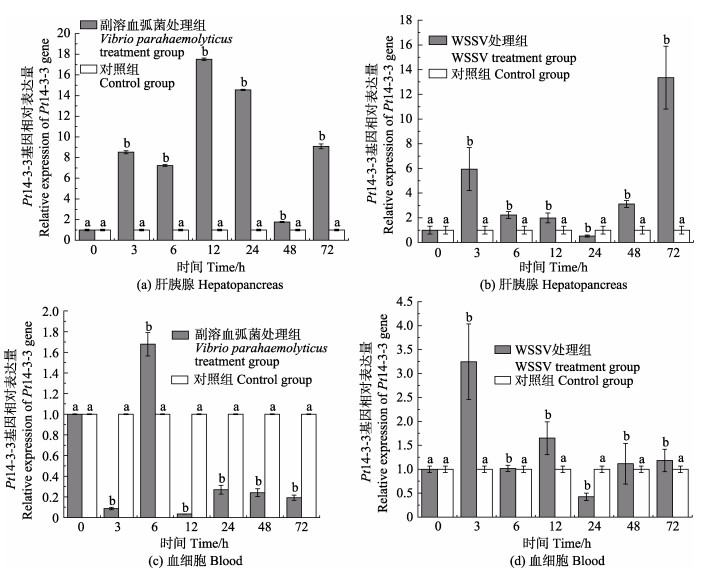
|
图 6 Pt14-3-3基因在病原胁迫下肝胰腺以及血细胞中的表达 Fig.6 Expression of Pt14-3-3 gene in hepatopancreas and blood cells under pathogen stress |
本研究克隆得到三疣梭子蟹14-3-3cDNA全长序列,编码由247个氨基酸组成的蛋白质。14-3-3基因具有高度的保守性,将本研究克隆得到的三疣梭子蟹14-3-3基因与其他进行比对,Pt14-3-3基因与中华绒螯蟹14-3-3基因同源性最高,达到100%;聚类分析显示,三疣梭子蟹14-3-3基因氨基酸序列与中华绒螯蟹紧密聚为一支,之后依次与脊尾白虾、日本对虾、拟穴青蟹、斑节对虾、墨吉明对虾聚在一起,同源性均在95%以上。研究发现,14-3-3基因在哺乳动物中存在β、γ、ε、η、σ、ζ和θ 7种亚型(Hermeking, 2003)。根据NJ系统进化树和氨基酸比对结果,对Pt14-3-3基因进行分析,推测该基因属于ζ亚型,三疣梭子蟹是否存在14-3-3基因的其他亚型有待进一步研究。
本研究采用荧光定量RT-PCR方法对三疣梭子蟹14-3-3基因mRNA组织表达进行分析。显示14-3-3基因在多种组织中都有表达,暗示该基因功能的多样性。在肝胰腺中的表达量最高,推测肝胰腺为三疣梭子蟹14-3-3基因发挥作用的重要器官,而肝胰腺是机体参与免疫防御的重要组织,暗示了该基因具有免疫功能。该结果与拟穴青蟹14-3-3基因表达的研究结果基本一致(舒妙安等, 2012)。血细胞是三疣梭子蟹重要的免疫细胞,Pt14-3-3基因在血细胞中有少量表达,同样说明其具有免疫功能(Kaimin et al, 2017)。例如,Chongsatja(2010)等研究发现,凡纳滨对虾病原感染后14-3-3基因在血细胞中大量表达,证明了该基因的免疫功能。另外,在鳃中也有较多表达,鳃组织与渗透压调节密切相关(Lü et al, 2013; Genovese et al, 2004),暗示其可能的在盐度适应中发挥一定的功能。例如,Kaeodee等(2011)发现,斑节对虾从高渗到低渗的适应中14-3-3基因大量表达,证明该基因参与机体渗透压的调节。
为了探究Pt14-3-3基因在三疣梭子蟹盐度适应中是否具有一定功能,本研究分析了该基因在低盐胁迫下鳃和肝胰腺中的表达规律。发现低盐胁迫后,Pt14-3-3基因在鳃组织中0~24 h呈显著下调表达,推测原因可能是低盐胁迫导致鳃组织产生应激损伤,最终间接干扰或抑制了Pt14-3-3基因的表达;48 h后基因表达上调,暗示了三疣梭子蟹通过显著上调鳃组织中Pt14-3-3基因的表达量来应对低盐胁迫。Kammerer等(2009)研究认为,盐度胁迫下罗非鱼鳃上皮细胞凋亡数量随时间的延长而增加。Pt14-3-3基因属于ζ亚型,具有凋亡抑制的功能(陈惠华等, 2005)。以上研究表明,三疣梭子蟹可能通过上调Pt14-3-3基因的表达来抑制鳃组织中细胞凋亡的过程。低盐胁迫后,Pt14-3-3基因在肝胰腺中于3 h后呈上调表达,暗示三疣梭子蟹通过上调肝胰腺中Pt14-3-3基因的表达量来抑制肝胰腺中的细胞凋亡进程,来参与环境的适应性调节。
注射副溶血弧菌和WSSV病毒后,肝胰腺中Pt14-3-3基因的表达量整体上调,基本呈先上升后下降再上升的表达趋势,上升趋势表明Pt14-3-3基因可能参与了三疣梭子蟹的免疫应答反应,通过增加Pt14-3-3基因的表达协助清除受损细胞,来维持其正常生理功能(Chang et al, 2008)。下降趋势表明,机体可能处于感染后的恢复期,而再次的上升趋势则可能是三疣梭子蟹恢复期后继续清除残留的副溶血弧菌和WSSV病毒的表现。2种致病病原导致的Pt14-3-3基因在肝胰腺中的表达到达最大值的时间不同,可能是由于三疣梭子蟹对于2种病原的敏感程度和耐受程度不同。感染副溶血弧菌后,三疣梭子蟹14-3-3基因在血细胞中的表达量呈先下降再上升再下降的趋势,该趋势与脊尾白虾感染WSSV病毒后14-3-3基因(王有昆等, 2016)在血细胞中的变化趋势及凡纳滨对虾感染桃拉病毒后14-3-3蛋白(Chongsatja et al, 2010)的变化趋势相一致,表明三疣梭子蟹可能通过上调14-3-3基因的表达来抑制肝胰腺和血细胞中的细胞凋亡进程,来参与三疣梭子蟹的免疫应答反应。
本研究成功克隆了三疣梭子蟹14-3-3基因cDNA全长,初步探究了该基因在三疣梭子蟹低盐适应中鳃和肝胰腺中的表达模式以及感染副溶血弧菌和WSSV病毒后在肝胰腺和血细胞中的表达模式,证明Pt14-3-3基因在三疣梭子蟹低盐适应和免疫应答反应中发挥了作用,为进一步研究三疣梭子蟹14-3-3基因在低盐适应中的分子机制及其免疫机制研究和病害防治提供了理论依据。
Angrand PO, Segura I, Völkel P, et al. Transgenic mouse proteomics identifies new 14-3-3-associated proteins involved in cytoskeletal rearrangements and cell signaling. Molecular and Cellular Proteomics, 2006, 5(12): 2211-2227 DOI:10.1074/mcp.M600147-MCP200 |
Chang CC, Yeh MS, Lin HK, et al. The effect of Vibrio alginolyticus infection on caspase-3 expression and activity in white shrimp Litopenaeus vannamei. Fish and Shellfish Immunology, 2008, 25(5): 672-678 DOI:10.1016/j.fsi.2008.09.004 |
Chaudhri M, Scarabel M, Aitken A. Mammalian and yeast 14-3-3 isoforms form distinct patterns of dimers in vivo. Biochemical and Biophysical Research Communications, 2003, 300(3): 679-685 DOI:10.1016/S0006-291X(02)02902-9 |
Chen HH, Lu YL. 14-3-3ζ and cell apoptosis. Bulletin of the Academy of Military Medical Sciences, 2005(2): 185-187 [陈惠华, 陆应麟. 14-3-3ζ与细胞凋亡. 军事医学科学院院刊, 2005(2): 185-187 DOI:10.3969/j.issn.1674-9960.2005.02.025] |
Chongsatja PO, Bourchookarn A, Lo CF, et al. Proteomic analysis of differentially expressed proteins in Penaeus vannamei hemocytes upon Taura syndrome virus infection. Proteomics, 2010, 7(19): 3592-3601 |
Czirjak G, Vuity D, Enyedi P. Phosphorylation-dependent binding of 14-3-3 proteins controls TRESK regulation. Journal of Biological Chemistry, 2008, 283(23): 15672-15680 DOI:10.1074/jbc.M800712200 |
Dai AY, Feng ZQ, Song YZ, et al. Preliminary investigation on fishery biology of Portunus trituberculatus. Journal of Zoology, 1977(2): 36-39 [戴爱云, 冯钟琪, 宋玉枝, 等. 三疣梭子蟹渔业生物学的初步调查. 动物学杂志, 1977(2): 36-39] |
Genovese G, Luchetti CG, Luquet CM. Na+/K+-ATPase activity and gill ultrastructure in the hyper-hypo-regulating crab Chasmagnathus granulatus acclimated to dilute, normal, and concentrated seawater. Marine Biology, 2004, 144(1): 111-118 DOI:10.1007/s00227-003-1169-6 |
Gómezsuárez M, Gutiérrezmartínez IZ, Hernándeztrejo JA, et al. 14-3-3 Proteins regulate Akt Thr308 phosphorylation in intestinal epithelial cells. Cell Death and Differentiation, 2016, 23(6): 1060-1072 DOI:10.1038/cdd.2015.163 |
Han XL, Gao BQ, Wang HF, et al. Effects of low salt stress on gill and hepatopancreas microstructures and family survival of Portunus trituberculatus. Progress in Fishery Sciences, 2014, 35(1): 104-110 [韩晓琳, 高保全, 王好锋, 等. 低盐胁迫对三疣梭子蟹鳃和肝胰腺显微结构及家系存活的影响. 渔业科学进展, 2014, 35(1): 104-110 DOI:10.3969/j.issn.1000-7075.2014.01.015] |
Hermeking H. The 14-3-3 cancer connection. Nature Reviews Cancer, 2003, 3(12): 931-943 DOI:10.1038/nrc1230 |
Kaeodee M, Pongsomboon S, Tassanakajon A. Expression analysis and response of Penaeus monodon 14-3-3 genes to salinity stress. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2011, 159(4): 244-251 DOI:10.1016/j.cbpb.2011.05.004 |
Koskinen H. The 14-3-3 proteins in the teleost fish rainbow trout (Oncorhynchus mykiss). Journal of Experimental Biology, 2004, 207(19): 3361-3368 DOI:10.1242/jeb.01165 |
Liu Y. Effect of Cordyceps sinensis powder on immune function of Macrobrachium japonicum. Hebei Fisheries, 2007(1): 11-13 [刘勇. 虫草菌粉对日本沼虾免疫功能的影响. 河北渔业, 2007(1): 11-13] |
Lu Q, Wu S, Zhen H, et al. 14-3-3 α and 14-3-3 ζ contribute to immune responses in planarian Dugesia japonica. Gene, 2017, 615: 25-34 DOI:10.1016/j.gene.2017.03.017 |
Lü JJ, Liu P, Wang Y, et al. Transcriptome analysis of Portunus trituberculatus in response to salinity stress provides insights into the molecular basis of osmo-regulation. PLoS One, 2013, 8(12): e82155 DOI:10.1371/journal.pone.0082155 |
Marie A, Fran Oise LB, Ronald W, et al. 14-3-3 is a regulator of the cardiac voltage-gated sodium channel Nav1.5. Circulation Research, 2006, 98(12): 1538-1546 DOI:10.1161/01.RES.0000229244.97497.2c |
Marques JS, Müller IC, Moser JR, et al. Wild captured crab, Chasmagnathus granulata (Dana, 1851), a new host for white spot syndrome virus (WSSV). Aquaculture, 2011, 318(1-2): 24 |
Matta A, Michael S, Ralhan R. 14-3-3 zeta as novel molecular target for cancer therapy. Expert Opinion on Therapeutic Targets, 2012, 16(5): 515-523 DOI:10.1517/14728222.2012.668185 |
Moore BW, Perez VJ. Specific acidic proteins of the nervous system. Physiological and Biochemical Aspects of Nervous Integration, 1967: 343-359
|
Neal CL, Yao J, Yang WT, et al. 14-3-3 zeta overexpression defines high risk for breast cancer recurrence and promotes cancer cell survival. Cancer Research, 2009, 69(8): 3425-3432 DOI:10.1158/0008-5472.CAN-08-2765 |
Rehman SK, Li SH, Wyszomierski SL, et al. 14-3-3ζ orchestrates mammary tumor onset and progression via miR-221- mediated cell proliferation. Cancer Research, 2014, 74(1): 363-373 DOI:10.1158/0008-5472.CAN-13-2016 |
Ren X, Lü JJ, Gao BQ, et al. Immune response and antioxidant status of Portunus trituberculatus inoculated with pathogens. Fish and Shellfish Immunology, 2017, 63: 322-333 DOI:10.1016/j.fsi.2017.02.034 |
Roberts MR. 14-3-3 Proteins find new partners in plant cell signaling. Trends in Plant Science, 2003, 8(5): 218-223 DOI:10.1016/S1360-1385(03)00056-6 |
Shu MA, Zhang LT, Xu BP, et al. The full length cDNA cloning and expression profile of 14-3-3bgene from the mudcrab (Scylla paramamosain). Journal of Fisheries of China, 2012, 36(8): 1193 [舒妙安, 张龙韬, 徐宾朋, 等. 拟穴青蟹14-3-3基因全长cDNA的克隆及组织表达分析. 水产学报, 2012, 36(8): 1193-1200] |
Sui YM, Gao BQ, Liu P, et al. Salinity tolerance analysis of Portunus trituberculatus "Huangxuan No.1". Progress in Fishery Sciences, 2012, 33(2): 63-68 [隋延鸣, 高保全, 刘萍, 等. 三疣梭子蟹"黄选1号"盐度耐受性分析. 渔业科学进展, 2012, 33(2): 63-68] |
Sullivan TJ, Neigel JE. Effects of temperature and salinity on prevalence and intensity of infection of blue crabs, Callinectes sapidus, by Vibrio cholerae, V.parahaemolyticus, and V. vulnificus in Louisiana.. Journal of Invertebrate Pathology, 2017, 151: S0022201117302343 |
Sun DF, Lü JJ, Huan PP, et al. Expression analysis of neuroparsin gene under low salinity stress in swimming crab (Portunus trituberculatus). Journal of Fishery Sciences of China, 2018, 25(5): 967-975 [孙东方, 吕建建, 环朋朋, 等. 低盐胁迫下三疣梭子蟹蝗抗利尿肽基因的表达. 中国水产科学, 2018, 25(5): 967-975] |
Wang YK, Liu P, Li JT, et al. Cloning and expression analysis of 14-3-3 gene from Exopalaemon carinicauda. Journal of Fishery Sciences of China, 2016, 23(1): 44-52 [王有昆, 刘萍, 李吉涛, 等. 脊尾白虾14-3-3基因cDNA全长的克隆和表达分析. 中国水产科学, 2016, 23(1): 44-52] |
Wang HC, Wang HC, Leu JH, et al. Protein expression profiling of the shrimp cellular response to white spot syndrome virus infection. Developmental and Comparative Immunology, 2007, 31(7): 672-686 |
Xie JJ, Xu WJ, Shi H, et al. Effects of Vibrio alginolyticus induction on non-specific immunity of haemolymph of Portunus trituberculatus. Journal of Fisheries, 2011, 35(9): 1392-1398 [谢建军, 许文军, 施慧, 等. 溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响. 水产学报, 2011, 35(9): 1392-1398] |
Yang J, Joshi S, Wang Q, et al. 14-3-3ζ loss leads to neonatal lethality by microRNA-126 down regulation-mediated developmental defects in lung vasculature. Cell and Bioscience, 2017, 7(1): 58 |
Zhou KM, Zhou FL, Huang JH, et al. Characterization and expression analysis of a chitinase gene (PmChi-4) from black tiger shrimp (Penaeus monodon) under pathogen infection and ambient ammonia nitrogen stress. Fish and Shellfish Immunology, 2017, 62: 31-40 |



