2. 中国水产科学研究院南海水产研究所 广东省渔业生态环境重点实验室 广州 510300
2. Guangdong Provincial Key Laboratory of Fishery Ecology and Environment; South China Sea Fisheries Research Institute, Chinese Academy of Fisheries Sciences, Guangzhou 510300
溶解氧是对虾养殖环境中重要的环境因子,直接影响对虾的存活、生长、代谢、消化和免疫能力。养殖环境中溶解氧受诸多因素的影响,环境中浮游植物优势种群的突然改变或死亡、阴天暴雨及过量投饵造成的池塘水质污染等都会导致溶解氧急剧下降(郑慧等, 2014; 李根瑞等, 2016)。此时,凡纳滨对虾(Litopenaeus vannamei)、日本沼虾(Macrobrachium nipponense)、细角滨对虾(Litopenaeus stylirostris)和罗氏沼虾(Macrobrachium rosenbergii)等抗氧化活性和免疫力发生显著变化(Han et al, 2018)。低氧胁迫时,日本沼虾有氧代谢减弱,无氧酵解和抗氧化能力增强,糖原和磷酸精氨酸大量消耗,以维持机体能量需要(Sun et al, 2018)。其中,低氧诱导因子1 (HIF1)是虾体维持氧稳态的关键异二聚体转录因子,由受氧调节的α亚基和组成型表达的β亚基组成,最先由Semenza(1992)在缺氧诱导的细胞核抽提物中发现,参与许多重要的生物学反应。例如,HIF1α和HIF1β亚基均参与虾类缺氧适应性反应(Terova et al, 2010; 连春盎, 2016)。缺氧时,凡纳滨对虾鳃HIF1α、甘油醛-3-磷酸脱氢酶和肝胰脏磷酸果糖激酶、果糖-1, 6-二磷酸酶表达量显著增高,而HIF1α或HIF1α亚基的沉默阻断了鳃中己糖激酶表达和酶活性诱导(Camacho-Jiménez et al, 2018)。通常情况下,HIF1的稳定性和活性由HIF1α决定,HIF1α的调节受多种因素影响,且HIF1α为专一受O2调控的亚基。HIF1α的N末端用来介导α和β两亚基二聚化及与靶基因特异DNA序列结合,HIF1α的C末端用来介导降解和反式激活,含有2个独立的反式激活结构域,2个结构域序列间为负调控反式激活结构域,而中部是氧依赖降解结构域(Oxygen dependent degradation domain, ODDD),ODDD决定HIF1α的稳定性。在常氧条件下,位于HIF1α ODDD内的脯氨酸残基的羟基化可促进HIF1α的泛素化和蛋白酶的降解,这种羟基化作用由多聚羟化酶介导。其中,脯氨酸羟化酶(PHDs)被认为在细胞质中广泛表达,且在羟基化中作用最大。另一种羟基化酶是HIF1抑制剂,主要进行天门冬氨酰残基的羟基化,进而抑制HIF1α的激活(李国青等, 2005)。转录组学可用于分析不同组织或生理状态下某些基因表达水平的差异,发掘与特定生理功能相关的未知基因。本研究通过高通量测序,分析低氧胁迫下脊尾白虾(Palaemon carincauda)某些基因的差异表达,可为进一步揭示虾体响应低氧胁迫的分子机制提供参考。
1 材料与方法 1.1 实验设计 1.1.1 低氧胁迫实验实验前,脊尾白虾暂养1周,以适应实验室环境。暂养期间,海水温度为22℃~ 24℃、盐度为29、pH为8.1,人工增氧。随机挑选湿重为(3.15±0.26) g的脊尾白虾60只,分为2组,每组3个重复,每个水族箱(水体约50 L)放养10只脊尾白虾,人工增氧适应24 h,哈希(HACH) DR900测定实验水体溶解氧浓度为7.6 mg/L。实验开始时,停止低氧胁迫组的人工增氧,水族箱用2 mm厚液体石蜡封闭。胁迫约3.5 h后,脊尾白虾虾体从尾部开始变白;约4 h后,开始侧卧游动,猜测其处于昏厥状态,此时,水体溶解氧浓度为(1.13±0.26) mg/L,脊尾白虾整体取样,速冻于液氮中备用。预实验表明,低氧胁迫条件下,白虾侧卧后约10~20 min死亡。为确保取到新鲜的样品,白虾侧卧游动时马上取样。对照组保持人工增氧,白虾游动正常,溶解氧浓度为(7.59±0.66) mg/L,同样取样冻存。
1.1.2 基因表达验证实验实验前,脊尾白虾暂养1周,暂养条件同1.1.1。随机挑选湿重为(2.77±0.34) g的脊尾白虾120只,分为2组,每组设3个重复,每个水族箱(水体约为100 L)放养20只白虾,人工增氧适应24 h,哈希(HACH) DR900测得水体溶解氧浓度为7.6 mg/L。实验开始时,低氧胁迫组停止人工增氧,水族箱用2 mm厚液体石蜡封闭,在0、10、20、40、120、240和480 min,从每个箱中取2只虾,解剖取出肌肉、鳃和肝胰脏,液氮速冻,取样时间点水体溶解氧浓度分别为(8.05±0.40)、(7.21±0.23)、(6.71± 0.18)、(6.10±0.22)、(5.81±0.25)、(4.08±0.47)和(2.03± 0.15) mg/L;对照组保持人工增氧,白虾游动正常,溶解氧浓度为(8.11±0.42) mg/L,同样取样冻存。
1.2 转录组测序将1.1.1中冻存的低氧胁迫组和对照组样品分别在液氮中全虾研磨混合,常规方法提取总RNA。采用带有Oligo (dT)的磁珠富集真核生物mRNA,加入破碎液,将mRNA进行随机打断,以mRNA为模板,反转合成双链cDNA链。利用AMPure XP beads纯化cDNA,对纯化的双链cDNA进行末端修复、加尾并连接测序接头,然后,采用AMPure XP beads进行片段大小选择。最后,通过PCR富集得到cDNA文库。送北京百迈客生物科技有限公司进行HiSeq2500高通量测序,测序读长为PE125。
1.3 生物信息学分析对原始数据进行过滤,去除其中的接头及低质量Reads,获得高质量的测序数据。将高质量测序数据通过Trinity软件进行序列组装,获得该物种的Unigene库。将低氧胁迫组和对照组高质量的测序数据与组装得到的Unigene库进行序列比对和基因表达量分析,筛选差异表达的基因。使用BLAST软件将Unigene序列与NR、Swiss-Prot、GO、COG、KOG和KEGG数据库比对,获得Unigene及差异表达基因的功能注释信息。使用TransDecoder软件进行Unigene基因结构预测。
1.4 实时定量测定常规方法提取1.1.2中的样品RNA,反转录成cDNA。同时,设计引物进行实时定量PCR,引物序列见表 1;利用软件SPSS 11进行统计分析,以P < 0.05作为差异显著水平。
|
|
表 1 脊尾白虾实时定量所用引物序列 Tab.1 Sequences of P. carincauda qRT-PCR primers |
完成对照和低氧胁迫组脊尾白虾样品的转录组测序,获得10.62 Gb高质量测序数据,各样品高质量测序数据均达到5.27 Gb,质量值≥30的碱基所占的百分比(Q30)≥90.21%(表 2)。
|
|
表 2 高质量测序数据评估统计 Tab.2 Statistics for evaluation of clean sequencing data |
应用Trinity对高质量测序数据进行组装,得到155113条转录本和118953条Unigene,转录本与Unigene的N50分别为1940和928 (表 2)。序列长度为200~300 nt的Unigene最多,占总数的42.76%;300~500 nt的有33316条,占28.01%;500~1000 nt有19088条,占16.05%;1000~2000 nt有9112条,占7.66%;2000 nt以上的Unigene有6569条,占5.52%。
2.2 Unigene功能注释对脊尾白虾Unigene进行功能注释,选择BLAST参数E≤10–5和HMMER参数E≤10–10,获得37580条有注释信息的Unigene (表 3)。其中,COG得到注释的Unigene 12527条,GO 13878条,KEGG 11275条。
|
|
表 3 组装结果统计 Tab.3 Statistics of assembly results |
|
|
表 4 Unigene注释统计 Tab.4 Statistics of Unigene annotated |
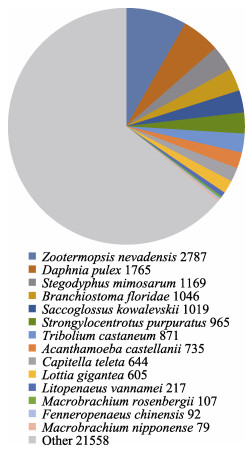
与Nr蛋白数据库进行同源性比对,有33659条白虾Unigene与已知基因同源,在Nr蛋白数据库中,与虾类相关的注释信息较少(图 1)。相似序列比例最高为内华达古白蚁(Zootermopsis nevadensis) (2787条,8%),随后依次是蚤状蚤(Daphnia pulex, 1765)、隆头蛛(Stegodyphus mimosarum, 1169)、文昌鱼(Branchiostoma floridae, 1046)、囊舌虫(Saccoglossuskowalevskii, 1019)、紫海胆(Strongylocentrotus purpuratus, 965)、赤拟谷盗(Tribolium castaneum, 871)、卡氏棘阿米巴(Acanthamoeba castellanii, 735)、海蠕虫(Capitella teleta, 644)、霸王莲花青螺(Lottia gigantea, 605)、凡纳滨对虾(217)、罗氏沼虾(107)、中国对虾(Fenneropenaeus chinensis, 92)和日本沼虾(M. nipponense, 79)。
|
图 1 Nr同源物种分布
Fig.1 Homologous species distribution of Nr
|
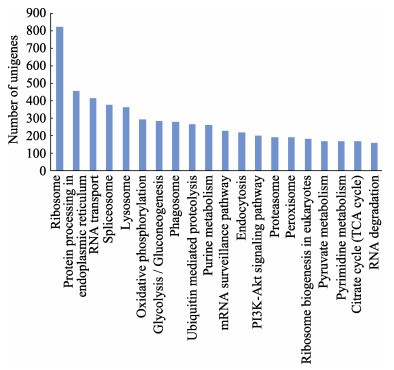
11275条脊尾白虾Unigene注释到KEGG,归类为223个代谢通路,其中,基因数量排名前20的通路如图 2所示,包括核糖体、内质网中蛋白质加工、RNA转运、剪接体、溶酶体、氧化磷酸化、糖酵解/糖异生、吞噬体、泛素介导的蛋白水解、嘌呤代谢、mRNA监测、内吞、PI3K-AKT信号通路、蛋白酶体、过氧化物酶体、真核生物核糖体生物合成、丙酮酸代谢、嘧啶代谢、柠檬酸循环和RNA降解。另外,在代谢通路中与低氧有关的还包括Wnt信号通路、mTOR信号通路、自噬调节、p53信号通路、癌症通路、HIF-1信号通路和精氨酸与脯氨酸代谢。
|
图 2 Unigene的KEGG分析 Fig.2 KEGG analysis of Unigene 显示基因数量排名前20位的KEGG通路 Top 20 of gene number in KEGG pathway |
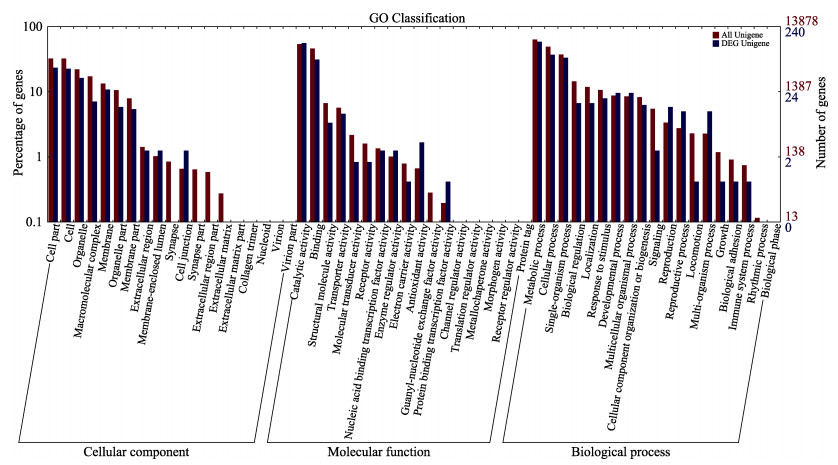
低溶氧胁迫脊尾白虾产生1392条差异表达基因,包括311条上调基因和1081条下调基因。对脊尾白虾差异表达基因进行功能注释,共注释到784条差异基因,其中,COG 232条,GO 240条,KEGG 206条,KOG 460条,Pfam 587条,Swiss-Prot 542条,Nr 742条。图 3展示了白虾差异表达基因和所有基因在GO各二级功能中的注释情况,发现差异基因主要富集到抗氧化活性、细胞连接、蛋白结合转录因子活性、多细胞生物过程、复制和生殖等过程。
|
图 3 差异表达基因GO二级节点注释统计 Fig.3 Annotated statistical map of GO secondary node of differentially expressed genes 横坐标为GO三大分类下的二级节点,纵坐标表示注释到该节点的基因数目及占所有基因数目的百分比,红色柱体表示所有基因的注释情况,蓝色柱体表示差异表达基因的注释情况 The abscissa is the secondary node under the three categories of GO. The ordinates represent the number of genes annotated to the node and the percentage of all genes. The red column represents the annotation of all genes, and the blue column represents the annotation of differentially expressed genes |
利用COG对脊尾白虾差异表达基因产物进行直系同源分类,发现碳水化合物运输和代谢、转录、复制、重组和修复、翻译后修饰、蛋白质周转和分子伴侣等4类富集的差异基因超过20个。其次,无机离子转运与代谢、信号转导机制、氨基酸转运和代谢、细胞周期调控、细胞分裂和染色体分离、能量生产和转换、翻译、核糖体结构和生物合成、次生代谢产物生物合成、运输和代谢等过程富集的差异基因较多(图 4)。

|
图 4 差异表达基因COG注释分类 Fig.4 Classification of COG annotations for differentially expressed genes 横坐标为COG各分类内容,纵坐标为基因数目 The abscissa is the classification content of COG, and the ordinate is the number of genes |
按照KEGG通路类型分类,脊尾白虾差异表达基因分别注释到环境信息处理、人类疾病、遗传信息处理、代谢、细胞过程和有机系统6个分支。其中,遗传信息处理、代谢和细胞过程这3大类通路中脊尾白虾差异基因富集较多。在这些代谢通路中,泛素介导的蛋白水解和溶酶体富集的差异基因最多,分别为11和10条;其次是吞噬(4)、过氧化物酶体(4)和内吞作用(3);另外,还包括糖酵解/葡萄糖生成(6)、精氨酸和脯氨酸代谢(4)、果糖和甘露糖代谢(4)、丙氨酸、天冬氨酸和谷氨酸代谢(4)和丙酮酸代谢(2)(图 5)。

|
图 5 差异表达基因KEGG分类 Fig.5 KEGG classification map of differentially expressed genes 纵坐标为KEGG代谢通路的名称,横坐标为注释到该通路下的基因个数及其个数占被注释上的基因总数的比例 The ordinate is the name of KEGG metabolic pathway. The abscissa is the number of genes annotated to the pathway and the proportion of the number of genes annotated to the total number of genes annotated |
表 5为筛选出的部分脊尾白虾差异表达基因,KOG分类注释包括3条氨基酸的运输和代谢基因(Amino acid transport and metabolism)、5条碳水化合物的运输和新陈代谢基因(Carbohydrate transport and metabolism)、2条防御机制基因(Defense mechanisms)、2条能源生产和转化基因(Energy production and conversion)、7条一般功能预测基因(General function prediction only)、6条无机离子转运和代谢基因(Inorganic ion transport and metabolism)、3条脂质转运和新陈代谢基因(Lipid transport and metabolism)、9条翻译后修饰、蛋白质周转和蛋白质伴侣基因(Posttranslational modification, protein turnover, chaperones)、1条复制、重组和修复基因(Replication, recombination and repair)、2条次生代谢物的生物合成、运输和分解代谢基因(Secondary metabolites biosynthesis, transport and catabolism)、7条信号转导机制基因(Signal transduction mechanisms)、1条转录基因(Transcription)和1条翻译、核糖体结构和生物起源基因(Translation, ribosomal structure and biogenesis)。log2FC数值最大的为丝氨酸苏氨酸蛋白激酶(Serine/threonine protein kinase),为4.98;其次是DNA错配修复蛋白(DNA mismatch repair protein),为3.38。log2FC数值最小的为组织蛋白酶l (Cathepsin l),为–6.89;其次是内切几丁质酶(Endochitinase),–6.58。
|
|
表 5 部分差异表达基因 Tab.5 Part of differentially expressed gene |
本研究中,HIF1密切相关的差异基因有4个,HIF1α和HIF1β缺氧时表达量上调,而HIF1α抑制剂(HIF1αi)和PHDs表达量下调。从转录组测序注释到的缺氧HIF1信号通路看出,HIF1α的表达受PI3K、mTOR和MARK等信号通路关键因子的影响(图 6)。

|
图 6 缺氧HIF1信号通路 Fig.6 Hypoxic HIF1 signaling pathway 红色为转录组测序注释到的Unigene Red is the Unigene annotated by transcriptome sequencing |
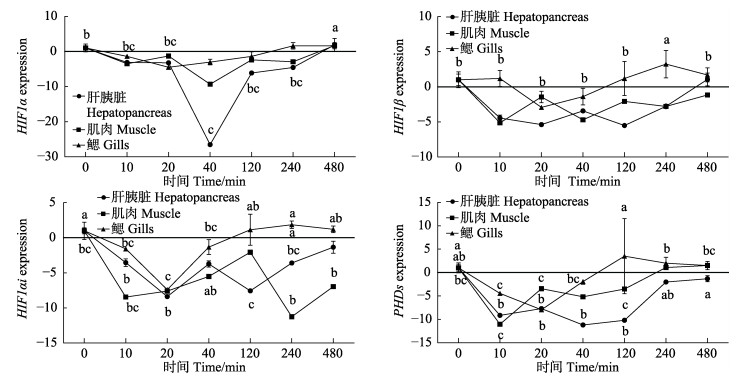
由图 7可以看出,在0~120 min内,随着低氧胁迫时间的延长,脊尾白虾肝胰脏、肌肉和鳃HIF1α基因表达与对照组相比明显下调;而在240 min,脊尾白虾肝胰脏、肌肉和鳃HIF1α基因表达与对照组相比,明显上调;其中,低氧胁迫对脊尾白虾肝胰脏HIF1α基因表达影响显著(P < 0.05)。在10~20 min时间范围内,随着低氧胁迫时间的延长,脊尾白虾肝胰脏、肌肉和鳃HIF1β基因表达与对照组相比明显下调;其中,低氧胁迫对脊尾白虾鳃HIF1β基因表达影响显著(P < 0.05)。在0~20 min时间范围内,随着低氧胁迫时间的延长,脊尾白虾肝胰脏、肌肉和鳃HIF1αi和PHDEs基因表达与对照组相比明显下调;其中,低氧胁迫对脊尾白虾所有组织HIF1αi和PHDEs基因表达影响显著(P < 0.05)。
|
图 7 低氧胁迫对脊尾白虾基因表达的影响 Fig.7 Effects of hypoxic stress on gene expression of P. carincauda 同一线条中具有不同字母的数据间差异显著(P < 0.05) Data with different letters in the same line is significantly different (P < 0.05) |
曾地刚等(2013)通过454技术对凡纳滨对虾肝胰脏转录组测序,获得20225条Unigene。闫允君等(2020)利用RNA-Seq技术对中国对虾对照组和肌肉生长抑制素(Mstn)表达抑制组进行了测序分析,发现Mstn表达被抑制后共筛选到1657个差异表达基因,其中,805个显著上调,852个显著下调,初步筛选出29个Mstn调控的与肌肉生长相关的基因,为阐明对虾的肌肉发育调控机制提供了重要基础。刘欣(2016)获得日本沼虾Unigenes 142560条,其中,43038条获得注释,占总Unigene的30.20%。本研究组装得到155113条转录本和118953条Unigene,获得37580条有注释信息的Unigene,占31.59%,其中,COG注释Unigene 12527条,GO 13878条,KEGG 11275条,Nr 33659条;在223个KEGG代谢通路中,HIF1信号通路、Wnt信号通路、mTOR信号通路、p53信号通路、癌症通路、自噬调节、精氨酸与脯氨酸代谢等通路与低氧胁迫有关。未获得功能注释的Unigene 81373条,占68.41%(表 2、表 3)。未注释的原因可能与组装的序列太短有关,转录组组装的Unigene长度在500 nt以下的占总量的70.77%,增加了功能注释的难度。另外,各类数据库功能注释信息不够全面,使一些基因不能够得到相应的注释,例如,在Nr注释中,白虾Unigene仅与217条凡纳滨对虾、107条罗氏沼虾、92条中国对虾和79条日本沼虾基因同源。
机体为适应缺氧环境会诱导一些与红细胞生成/铁代谢、血管生成、葡萄糖代谢、细胞增殖/生存和凋亡等相关基因的表达(Terova et al, 2010)。本研究中,低氧胁迫产生1392条差异表达基因,784条差异基因得到注释(表 5)。GO和COG注释表明,抗氧化活性、细胞连接、蛋白结合转录因子活性、多细胞生物过程、复制和生殖等过程富集的差异基因较多。与GO和COG注释类似,富集差异基因较多的与免疫有关的KEGG通路包括泛素介导的蛋白水解,含11条差异表达基因,其次是溶酶体10条、吞噬4条、过氧化物酶体4条和内吞作用3条;而富集差异基因较多的与代谢有关的KEGG通路包括糖酵解/葡萄糖生成,含6条差异表达基因,其次是精氨酸和脯氨酸代谢4条、果糖和甘露糖代谢4条、丙氨酸、天冬氨酸和谷氨酸代谢4条和丙酮酸代谢2条(图 5)。这些富集的差异基因表明,低氧胁迫激活了虾体适应缺氧的一系列生理活动,如诱导相关基因转录翻译,参与应激反应,增强白虾各类物质代谢。由表 5可以看出,低氧胁迫条件下脊尾白虾酚氧化酶原激活酶、过氧化物酶l、DNA错配修复蛋白、丝氨酸苏氨酸蛋白激酶和G蛋白信号调节因子等基因显著上调。低氧胁迫对碳水化合物的运输和新陈代谢基、防御机制、能源生产和转化、一般功能预测、无机离子转运和代谢、脂质转运和新陈代谢、次生代谢物的生物合成、运输和分解代谢、转录和翻译、核糖体结构和生物起源等过程产生了抑制效应,表现为富集大量下调的差异表达基因。
转录因子HIF1α是氧传感的核心成分,HIF1α还可作为许多基因的转录调节因子,这些基因在生理学和医学中至关重要(McNamee et al, 2016; Semenza, 2012)。HIF1α抑制剂PHDs需要氧作为羟化作用的辅助因子,在正常条件下,PHDs通过PHD-HIF途径羟基化HIF1α保守的脯氨酰残基,从而靶向HIF1α被泛素蛋白酶体降解失活。然而,在缺氧或炎症条件下,PHD-HIF途径失活,产生稳定的HIF1α、HIF1α和HIF1β组成转录活性二聚体HIF1移位至细胞核,与缺氧调节基因的启动子区域结合调控下游基因表达,这些区域通常是启动子内的“缺氧反应元件”;一方面,通过激活促红细胞生成素(EPO)基因表达促进红细胞生成,激活血清铁传递蛋白(TF)和转铁蛋白受体(TFRC)基因表达促进铁代谢,激活血管内皮生长因子(VEGF)、血管内皮生长因子受体(Flt1)、表皮细胞生长因子(EGF)、血管生成素(ANGPT)和金属肽酶抑制剂(TIMP1)等基因表达促进血管生成,激活血红素加氧酶1(HMOX1)增强血管张力,通过以上调控增强氧的传递;另一方面,通过激活磷酸肌醇依赖的蛋白激酶1(PDK1)抑制三羧酸循环代谢,激活磷酸甘油脱氢酶(GPDH)、己糖激酶(HK)、α烯醇化酶(ENO 1)、6-磷酸果糖激酶2(PFK 2)和磷酸甘油酸激酶1(PGK1)等表达促进厌氧代谢,激活B淋巴细胞瘤2(bcl2)和p21/p27蛋白调节增殖凋亡、降低O2消耗,通过以上调控,缓解机体对缺氧的不适(图 6)。当处于缺氧条件下,草鱼(Ctenopharyngodon idellus)、石首鱼(Sciaenidae)、黑鲈(Micropterus salmoniodes)和河鲈(Perca fluviatilis)一些组织中HIF1α转录水平显著上调(Terova et al, 2010)。任倩妍等(2018)研究发现,大弹涂鱼(Boleophthalmus pectinirostris)在缺氧环境下HIF信号通路被激活,肝中低氧诱导因子表达量上调。Okamura等(2018)研究发现,日本沼虾HIF1α表达水平在缺氧刺激24 h后显著增加,缺氧刺激6 h后Von Hippel-Lindau肿瘤抑制剂基因表达显着下降。与以上研究类似,转录组数据分析发现,HIF1α和HIF1β缺氧时表达量上调;低氧胁迫实时定量测定证实,在胁迫的后期,脊尾白虾肝胰脏和鳃HIF1α和HIF1β明显上调,表明脊尾白虾细胞在低溶氧环境下诱导HIF产生,刺激机体增加血液氧的供应能力。HIF1α还激活葡萄糖转运蛋白、糖酵解酶、血管内皮生长因子等,通过提高糖转运和促进糖酵解以适应缺氧环境(Zhou et al, 2018)。周晓黎等(2018)研究发现,阻断PI3K/AKT信号途径,结肠癌细胞中HIF1α下调,并可导致糖酵解相关蛋白如葡萄糖转运蛋白-1和乳酸脱氢酶A的表达下降,糖酵解代谢产物乳酸含量下降。本研究中,糖酵解/葡萄糖生成通路、精氨酸和脯氨酸代谢和丙酮酸代谢富集大量差异表达基因(图 5),也说明机体缺氧使糖酵解等无氧代谢途径增强,同时促进了部分糖类和氨基酸的代谢。
细胞自噬通过分解代谢和再循环来消除受损或有害成分,以维持营养和能量稳态,涉及细胞质、细胞器或胞质组分的溶酶体降解;该途径可通过多种形式的细胞应激来刺激,包括营养或生长因子剥夺、缺氧、活性氧物质、DNA损伤、蛋白质聚集体、受损细胞器或细胞内病原体(Kroemer et al, 2010; 马骊等, 2018)。在自噬过程中,细胞形成双膜囊泡、自噬体、隔离细胞器,蛋白质或部分细胞等递送至溶酶体细胞质,溶解体中的隔离内容物被降解(He et al, 2009)。自噬构成了一种主要的保护机制,使细胞能够在多种应激源的作用下存活,并有助于保护生物免受退化、炎症、感染和肿瘤疾病的侵害(Levine et al, 2008; Mizushima et al, 2008)。在Snare蛋白及小Rab GTP激酶的作用下,自噬小体与溶酶体融合形成自噬溶酶体,发挥其降解功能(徐倩等, 2017)。缺氧可通过NF-κB途径诱导自噬激活,从而调节细胞增殖和迁移,以诱导肺血管重塑(Jing et al, 2018)。闫广伟等(2018)研究发现,低氧环境可能通过HIF-1α/Bnip3途径诱导滋养细胞自噬水平增强。本研究代谢通路中,溶酶体通路、吞噬通路、过氧化物酶体通路和内吞作用通路富集的差异基因较多(图 5),这些差异基因的表达也证实可能与缺氧引起的自噬有关。推测HIF可通过抑制线粒体生物合成和活化线粒体自噬来降低线粒体氧耗。
综上所述,低氧胁迫可诱导脊尾白虾产生低氧诱导因子调控下游基因表达,进而激活虾体适应缺氧的一系列生理活动,增强脊尾白虾各类物质代谢,促进血管生成,增强血管张力,刺激虾体增加血液氧供应能力;另一方面,低氧胁迫促进厌氧代谢,缓解虾体对缺氧的不适,而低氧诱导因子可通过抑制线粒体生物合成和活化线粒体自噬来降低线粒体氧耗。
Camacho-Jiménez L, Peregrino-Uriarte AB, Martínez-Quintana, J A, et al. The glyceraldehyde-3-phosphate dehydrogenase of the shrimp, Litopenaeus vannamei: Molecular cloning, characterization and expression during hypoxia. Marine Environmental Research, 2018, 138: 65-75 DOI:10.1016/j.marenvres.2018.04.003 |
Han SY, Wang MQ, Liu M, et al. Comparative sensitivity of the hepatopancreas and midgut in the white shrimp Litopenaeus vannamei to oxidative stress under cyclic serious/medium hypoxia. Aquaculture, 2018, 490: 44-52 DOI:10.1016/j.aquaculture.2018.02.021 |
He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy. Annual Review of Genetics, 2009, 43: 67-93 DOI:10.1146/annurev-genet-102808-114910 |
Jing X, Jiang T, Dai L, et al. Hypoxia-induced autophagy activation through NF-κB pathway regulates cell proliferation and migration to induce pulmonary vascular remodeling. Experimental Cell Research, 2018, 368(2): 174-183 DOI:10.1016/j.yexcr.2018.04.026 |
Kroemer G, Guillermo M, Levine B. Autophagy and the integrated stress response. Molecular Cell, 2010, 40(2): 280-293 DOI:10.1016/j.molcel.2010.09.023 |
Levine B, Kroemer G. Autophagy in the pathogenesis of disease. Cell, 2008, 132(1): 27-42 DOI:10.1016/j.cell.2007.12.018 |
Li GQ, Zhang Y. Recent advances in the study of biological characteristics of hypoxia-inducible factor 1. Journal of Practical Medicine, 2005, 22(8): 749-750 [李国青, 张育. 缺氧诱导因子-1生物学特性的研究新进展. 实用医药杂志, 2005, 22(8): 749-750 DOI:10.3969/j.issn.1671-4008.2005.08.064] |
Li GR, Ren LH, Sun GH, et al. Effects of hypoxic stress on oxidative stress indices in Apostichopus japonicus. Progress in Fishery Sciences, 2016, 37(5): 133-139 [李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参(Apostichopus japonicus)氧化应激指标的影响. 渔业科学进展, 2016, 37(5): 133-139] |
Lian CA. Effects of dry exposure on the respiratory metabolism- related enzymes and HIF-1 in Exopalaemon carinicauda. Masterxs Thesis of Shanghai Ocean University, 2016 [连春盎. 干露胁迫对脊尾白虾呼吸代谢相关酶和低氧诱导因子的影响. 上海海洋大学硕士研究生学位论文, 2016]
|
Liu X. High-throughput transcriptome analysis and immune gene discovery of Macrobrachium nipponense. Masterxs Thesis of Hebei University, 2016 [刘欣. 基于日本沼虾转录组的免疫基因发掘. 河北大学硕士研究生学位论文, 2016]
|
Ma L, Ge QQ, Xu Y, et al. Cloning of the translationally controlled tumor protein gene (TCTP) and expression analysis of autophagy regulatory related genes during the development of ovary in Exopalaemon carinicauda. Progress in Fishery Sciences, 2018, 39(4): 101-109 [马骊, 葛倩倩, 许杨, 等. 脊尾白虾翻译控制肿瘤蛋白基因TCTP克隆及自噬调控相关基因在卵巢发育期的表达. 渔业科学进展, 2018, 39(4): 101-109] |
McNamee EN, Vohwinkel C, Eltzschig HK. Hydroxylation- independent HIF-1α stabilization through PKA: A new paradigm for hypoxia signaling. Science Signaling, 2016, 9(430): fs11 DOI:10.1126/scisignal.aaf4630 |
Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion. Nature, 2008, 451(7182): 1069-1075 DOI:10.1038/nature06639 |
Okamura Y, Mekata T, Elshopakey GE, et al. Molecular characterization and gene expression analysis of hypoxia- inducible factor and its inhibitory factors in kuruma shrimp, Marsupenaeus japonicus. Fish and Shellfish Immunology, 2018, 79(8): 168-174 |
Ren QY, Zhang MZ, Li M, et al. Differential induction of gene expressions, protein contents and enzyme activities involved in hypoxic responsive in liver tissues of mudskipper Boleophthalmus pectinirostris exposed to acute hypoxia. Oceanologia et Limnologia Sinica, 2018, 49(4): 187-194 [任倩妍, 张木子, 黎明, 等. 急性缺氧对大弹涂鱼(Boleophthalmus pectinirostris)肝脏中缺氧应答相关基因表达、蛋白含量及酶活性的影响. 海洋与湖沼, 2018, 49(4): 187-194] |
Semenza GL. Hypoxia-inducible factors in physiology and medicine. Cell, 2012, 148(3): 399-408 DOI:10.1016/j.cell.2012.01.021 |
Sun SM, Guo ZB, Fu HT, et al. Based on the metabolomic approach the energy metabolism responses of oriental river prawn Macrobrachium nipponense hepatopancreas to acute hypoxia and reoxygenation. Frontiers in Physiology, 2018, 9: 76 DOI:10.3389/fphys.2018.00076 |
Terova G, Rimoldi S, Ceccuzzi P, et al. Molecular characterization and in vivo expression of hypoxia inducible factor (HIF) 1α in sea bass (Dicentrarchus labrax) exposed to acute and chronic hypoxia. Italian Journal of Animal Science, 2010, 8(2s): 875-877 |
Xu Q, Ha XQ. The protective function of autophagy in hypoxic stress and its regulatory mechanism. Journal of Medical Research, 2017, 46(2): 7-9 [徐倩, 哈小琴. 自噬在缺氧应激中的保护作用及其调控机制. 医学研究杂志, 2017, 46(2): 7-9] |
Yan GW, Ding YZ, Xing JF, et al. Effects of hypoxia on expressions of HIF-1α, BNIP3 and autophagy, invasion ability in trophoblasts. Journal of Zhengzhou University (Medical Sciences), 2018, 227(2): 68-72 [闫广伟, 丁燕子, 邢金芳, 等. 低氧对滋养细胞HIF-1α、BNIP3表达及自噬和侵袭能力的影响. 郑州大学学报(医学版), 2018, 227(2): 68-72] |
Yan YJ, Lu X, Meng XH, et al. Screening of genes related to muscle growth under the Myostatin regulation by RNA-seq in Fenneropenaeus chinensis. Progress in Fishery Sciences, https://doi.org/10.19663/j.issn2095-9869.20200324002 [闫允君, 卢霞, 孟宪红, 等. 基于转录组分析对中国对虾Myostatin基因调控的肌肉生长相关基因的筛选. 渔业科学进展, https://doi.org/10.19663/j.issn2095-9869.20200324002]
|
Zeng DG, Chen XL, Xie DX, et al. Deep sequencing-based transcriptome analysis of Litopenaeus vannamei. Genomics and Applied Biology, 2013, 32(3): 308-313 [曾地刚, 陈秀荔, 谢达祥, 等. 基于高通量测序的凡纳滨对虾的转录组分析. 基因组学与应用生物学, 2013, 32(3): 308-313] |
Zheng H, Li B, Rong XJ, et al. Effects of salinity and dissolved oxygen variation on the non-specific immune response of Apostichopus japonicus. Progress in Fishery Sciences, 2014, 35(1): 118-124 [郑慧, 李彬, 荣小军, 等. 盐度和溶解氧对刺参非特异性免疫酶活性的影响. 渔业科学进展, 2014, 35(1): 118-124 DOI:10.3969/j.issn.1000-7075.2014.01.017] |
Zhou J, Li C, Yao W, et al. Hypoxia-inducible factor-1α- dependent autophagy plays a role in glycolysis switch in mouse graulosa cells. Biology of Reproduction, 2018, 99(2): 308-318 DOI:10.1093/biolre/ioy061 |
Zhou XL, Shu L, Liao Y, et al. Role of PI3K/AKT signal pathway in expression of hypoxia-inducible factor-1α and glycolysis in colon cancer cells under hypoxia. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2018, 47(2): 203-206 [周晓黎, 舒磊, 廖艳, 等. PI3K/AKT通路在低氧环境下对结肠癌细胞HIF-1α及糖酵解的作用. 华中科技大学学报(医学版), 2018, 47(2): 203-206 DOI:10.3870/j.issn.1672-0741.2018.02.015] |



