2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 滨海湿地生态系统教育部重点实验室 厦门 361102;
4. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Key Laboratory of the Ministry of Education for Coastal and Wetland Ecosystems, Xiamen 361102;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
稳定同位素是一种天然的示踪物质,近年来,在海洋生物学及生态学的研究中受到越来越多的重视(蔡德陵等, 2005; 孙明等, 2013; Ohshimo et al, 2019)。生物体内的碳稳定同位素比值(δ13C)受其代谢活动及摄食情况等多方面的影响,在生物体对其饵料进行同化吸收时富集值极低,因此,可用来判断摄食者的食物来源(张波等, 2016)。而氮稳定同位素在生物体内富集系数较大,在消费者和其食物之间以平均3.4‰的差值递减,可以用来确定食物网结构或生物的营养级(徐军等, 2010)。
营养级(Trophic level, TL),是指某一种生物在生态系统的食物链中所处的营养层次(张波等, 2004)。海洋生态系统十分复杂,具有多层次的营养级结构。了解各种海洋生物尤其是鱼类的营养级及其食性是现代海洋生物学的基础目标之一(蔡德陵等, 2005)。计算营养级和食性的传统方法为胃含物分析法,即利用某一种鱼类消化道内未消化的饵料生物的物种组成及数量确定其在食物网中的位置和食性(纪炜炜, 2011)。而稳定同位素能反映生物体一段时间内对食物的吸收代谢情况,具有检测灵敏度高、不受时间和空间限制等特点(王玉堃, 2015)。蔡德陵等(2005)通过对黄、东海生态系统进行长期研究,基于大量渔业资源调查数据,利用氮稳定同位素比值(δ15N),以紫贻贝(Mytilus edulis)作为基准生物,总结出一个适应于黄、东海鱼类的营养级计算公式。纪炜炜等(2011)利用碳稳定同位素比值(δ13C)计算底层饵料贡献比来确定鱼类的食性,将其分为3大类:浮游动物食性、底栖动物食性和混合食性。
在过去几十年里,相关学者对黄海和东海渔业资源的调查和研究从未间断(张波等, 2004; 李忠义等, 2009)。本研究在对2011年后捕获的黄海和东海北部36种海洋鱼类进行碳、氮稳定同位素测定的基础上,分析其营养级及食性,并与以往的研究进行对比,拟解决以下问题:1)黄海和东海北部主要鱼类的营养级在2011年后是否发生改变;2)黄海和东海北部主要鱼类的食性是否发生变化。
1 材料与方法 1.1 鱼类样品的采集和处理实验鱼类为2011~2014年间中国水产科学研究院黄海水产研究所“北斗”号渔业科学调查船于黄海和东海北部(30°~39°N,120.5°~126°E)采集的36种鱼类。采样航次分别为2011年秋季航次(10~11月)和2013、2014年夏季航次(7~8月)。将鱼冷冻带回实验室后,用解剖刀去除鱼鳞及鱼皮等,取适量背部肌肉,置于60℃恒温鼓风干燥箱中烘干48 h,之后使用玛瑙研钵将肌肉组织研磨成细粉末备用。
1.2 稳定同位素检测实验样品的稳定同位素分析在中国农业科学院农业环境与可持续发展研究所农业环境稳定同位素实验室进行,使用Isoprime-100稳定同位素质谱仪(德国Elementar公司)进行测定,碳或氮的稳定同位素比值以国际通用的δ值表示,其定义为:
| $ \delta \left( ‰ \right){\rm{ = }}\left[ {\left( {{R_{样品}} - {R_{标准}}} \right)/{R_{标准}}} \right] \times 1000 $ |
式中,R为所测同位素的比率,为13C/12C或15N/14N,碳、氮同位素比值以国际通用标准物PDB和大气氮(N2)作为标准值。每种鱼取3个个体的样品进行测定。实验中每5个样品加测1个标准品,每10个样品中随机选取1个样品进行2~3次重复测定,δ13C值的分析精度为±0.1‰,δ15N值的分析精度为±0.2‰。
1.3 鱼类营养级计算根据蔡德陵等(2005)的研究结果,将δ15N用于计算黄、东海鱼类的营养级,其公式如下:
| $ {\rm{TL = }}\left({{\delta ^{15}}{{\rm{N}}_{样品}} - {\delta ^{15}}{{\rm{N}}_{基准}}} \right)/\Delta {\delta ^{15}}{\rm{N}} + 1 $ |
式中,δ15N样品为所测样品的氮同位素比值。营养级的氮同位素富集值Δδ15N=2.5及基准值δ15N基准= 6.05‰均采用蔡德陵等(2005)的结果,其研究中的基准生物为紫贻贝。本研究未额外测定基准值。
1.4 鱼类食性测定参考纪炜炜等(2013)的研究,通过计算底层饵料贡献比测定某种鱼类的食性,其公式为:
| $ 底层饵料贡献比\left( {{\rm{Bp}}} \right) = \left( {{\delta ^{13}}{{\rm{C}}_{\rm{C}}} - {\delta ^{13}}{{\rm{C}}_{\rm{P}}}} \right)/\left( {{\delta ^{13}}{{\rm{C}}_{\rm{B}}} - {\delta ^{13}}{{\rm{C}}_{\rm{P}}}} \right) $ |
式中,δ13CC、δ13CP和δ13CB分别代表消费者、浮游生物饵料和底层生物饵料的碳同位素平均值,该公式假设营养级之间碳稳定同位素富集度为0 (Vander Zander et al, 2002)。
根据底层饵料贡献比(Bp)可将水生生物的摄食生态类型划分为3大类:Bp < 0.25,为浮游生物食性;Bp=0.25~0.75,为混合食性;Bp>0.75,为底栖生物食性。此外,当Bp < 0时,为完全意义上的浮游生物食性;Bp>1,则为完全意义上的底栖生物食性(Vander Zander et al, 2002; Sherwood et al, 2005; 李忠义等, 2009; 纪炜炜, 2011)。
通过查阅以往的研究结果,确定黄海和东海北部浮游生物饵料和底层生物饵料的优势类群及其碳同位素平均值。其中,浮游生物饵料定义为粒径大于1000 μm的浮游动物,底层生物饵料定义为凹管鞭虾(Solenocera koelbeli)、哈氏仿对虾(Parapenaeopsis hardwickii)、鹰爪虾(Trachypenaeu scurvirostris)和日本蟳(Charybdis japonica)等底栖无脊椎动物;浮游生物饵料的碳同位素平均值取–22.09‰,底层生物饵料的碳同位素平均值取–17.19‰(薛莹, 2005; 李忠义, 2006)。
1.5 数据处理本研究对鱼类样本的碳、氮稳定同位素进行统计,并计算出营养级和食性结果,与以往研究中黄海及东海北部鱼类的营养级和食性分析结果进行对比,数据处理软件为Excel 2013。
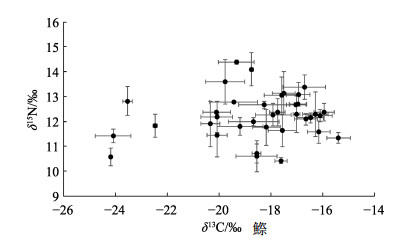
2 结果 2.1 稳定同位素测定结果对于研究中测定的36种鱼类,样品中δ13C的范围为–15.40‰~–24.18‰,总跨度为8.78‰,平均值为(–18.60±2.24)‰;δ15N的范围为10.42‰~14.39‰,总跨度为3.97‰,平均值为(12.23±0.92)‰。稳定同位素测定结果如图 1所示。
|
图 1 36种海洋鱼类的碳、氮稳定同位素比值(平均值±标准差) Fig.1 δ13C and δ15N values of 36 species of marine fishes (Mean±SD) |
根据实验测定的δ15N计算得到本研究中的36种海洋鱼类的营养级,结果如表 1所示,其营养级范围为2.75~4.34,总跨度为1.59,平均值为3.47。其中,(Miichthys miiuy)的营养级最低,黄姑鱼(Nibea albiflora)的营养级最高。
|
|
表 1 黄海及东海北部36种海洋鱼类营养级谱及对比 Tab.1 Trophic levels of 36 marine fishes in Yellow Sea and northern East China Sea |
计算获得的底层饵料贡献比(Bp)值,其范围为–0.43~1.37,总跨度为1.80,其中,斑(Konosirus punctatus)的Bp值最小,黑姑鱼(Atrobucca nibe)的Bp值最大。根据底层饵料贡献比值可判定,本研究分析的36种海洋鱼类中,有4种为完全浮游生物食性,8种为底栖生物食性(非完全意义上的),混合食性为12种,完全底栖生物食性为12种(表 2)。本研究未见其他食性的鱼类。
|
|
表 2 黄海和东海北部36种海洋鱼类的食性测定结果及对比 Tab.2 Feeding characters of 36 marine fishes in Yellow Sea and northern East China Sea |
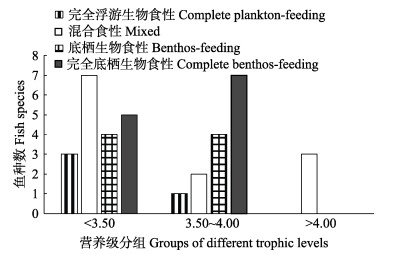
参考张波等(2015)的研究,将本研究中的36种海洋鱼类依据营养级不同分为3组,分别为低营养级组(TL < 3.50)、中营养级组(TL=3.5~4)和高营养级组(TL>4),并对不同食性的鱼种数进行统计(图 2)发现,中、低营养级组的鱼类占绝大多数,高营养级组的鱼类所占比例较少(8.33%),且都是混合食性。中营养级组不同食性的鱼种数呈现明显的梯度变化,其中有一半为完全底栖食性。低营养级组所占比例较大(52.78%),以混合食性和完全底栖食性为主。
|
图 2 本研究中不同营养级分组的鱼类食性种类数 Fig.2 Fish species of feeding character in different trophic levels in this study |
海洋鱼类体内碳、氮稳定同位素含量受其代谢活动等多方面的影响,同时,不同鱼类因其生活史和摄食偏好等的不同,也可能导致它们的δ13C和δ15N含量相差较大(图 1)。在本研究36种海洋鱼类中,共有19种与蔡德陵等(2005)在黄海和东海进行的海洋生物稳定同位素研究的种类相同。整体研究结果与之相比,δ13C的总跨度相差较小(8.78‰ vs 7.04‰),而δ15N的总跨度相差较大(3.97‰ vs 7.17‰)。考虑除个体差异和种群特异性之外,2个研究在采样时不能保证同种鱼处在相同的生长阶段(如幼鱼或成鱼),因此,其稳定同位素的分析结果也会不相同。
此外,研究表明,在同一生态系统中,如果2个物种间的碳稳定同位素差异小于0.60‰或大于1.50‰,便可认为这2个物种间不存在捕食关系。因为对于前一种情况,它们可能处于同一个营养级上;而对于后一种,这2个物种之间至少还存在1个营养级(王玉堃, 2015)。由此,本研究中的36种海洋鱼类,δ13C总跨度为8.78‰,应存在多个营养层次。
对于同一种鱼的稳定同位素比值,其或因在不同类型的海区,饵料种类和丰富度不同而产生差异。张博伦等(2019)研究了天津海域某人工鱼礁区的食物网结构,对于2012年建成的鱼礁区,其许氏平鲉的δ13C (–17.19‰)与本研究(–17.58‰)相差较小,但δ15N (14.30‰)与本研究(13.04‰)相差较大。这或许是因为人工鱼礁区比本研究中的开阔海域饵料更丰富。
本研究中,不同鱼种的碳、氮稳定同位素几乎无相关性(图 1),这或许是由于其营养级跨度较大导致。而对于同一种鱼的稳定同位素分析,Pethybridge等(2015)研究发现,长鳍金枪鱼(Thunnus alalunga)肌肉组织中碳、氮稳定同位素具有很好的相关性。陶雅晋等(2017)利用稳定同位素技术结合胃含物分析法研究南海黄鳍金枪鱼(Thunnus albacores)的摄食习性。他们的研究成果为今后利用稳定同位素分析法深入研究某一种海洋鱼类,尤其是经济鱼种提供了思路。
3.2 海洋鱼类的营养级和食性变动对于水域生态系统生物营养级和食性的分析测定最早采用胃含物分析法。这种方法比较直观、操作性强,但对样品的需求量大,也需要研究者具有娴熟的生物种类识别能力,且容易存在偶然误差(生物偶食性和饵料难消化吸收等情况)。相对而言,稳定同位素分析法需要的样品量较小,高效、准确(王玉堃, 2015)。
本研究查阅以往调查数据,包括邓景耀等(1986)对渤海鱼类的研究,韦晟等(1992)对黄海鱼类的研究以及张波等(2004)对东海和黄海鱼类的研究。通过对比发现,不同年代、不同海域的同种鱼类,其营养级测定结果存在一定的偏差。同时,张波等(2004)研究发现,海洋鱼类的平均营养级随年代变化有下降的趋势。以为例,本研究中其营养级与张波等(2004)和蔡德陵等(2005)的研究相比,分别下降了1.59和0.83个营养级。这可能与本研究中所采集的未生长到成鱼阶段有关。此外,本研究结果与Pauly等(1998)提出的捕捞能降低海洋食物网营养级的观点相吻合,即在高强度的捕捞影响下,海洋生态系统中营养级较高的捕食者(通常是成年个体较大、经济价值较高的种类)会持续减少,从而导致渔获物的整体组成向个体较小、营养级较低、经济价值较低的种类转变(纪炜炜, 2011; 王玉堃, 2015)。
影响鱼类食性的因素有很多,其中饵料生物的类型是主要因素,栖息环境也在一定程度上影响其食性和摄食量(李忠义等, 2009)。本研究通过与以往学者对黄海和东海北部鱼类食性的研究对比发现,少数种类在近10年中,其食性几乎没有变化,如小黄鱼、银鲳等(表 2)。其他种类的食性随年代和海域的不同而略有偏差,如白姑鱼、龙头鱼等,考虑到同一种鱼在不同生长阶段其食性会发生改变(张波等, 2016),而在调查取样时不可能确保所有样本都取到成年个体,从而导致出现这种结果。
营养级分组的食性统计结果(图 2)同以往的研究(张波等, 2004; 李忠义等, 2009)相比,黄海和东海北部的主要鱼类有向较低营养级转变的趋势,同时,中、高营养级组的鱼类以混合食性和完全底栖食性为主,分别占这2组种类总数的29.41%和41.18%。这种情况,一方面可能是由于捕捞压力使海洋中饵料生物的种类和数量减少,迫使某些海洋鱼类改变了食性范围,由单一食性转变为混合食性;另一方面,中、高营养级的部分种类大多以“伏击”的方式捕食其他鱼类,所以会选择较隐蔽的水底生活,促使其食性为完全底栖,例如,Henderson等(2014)对大西洋牙鲆(Paralichthys dentatus)的研究就说明了这一点。
有学者提出“海洋营养级指数”的概念,即海洋渔获物的平均营养级,可反映渔获物及其营养层次的变化趋势。通过近几十年对我国黄海和东海海洋鱼类营养级的研究,杜建国等(2014)发现,海洋营养级指数有下降的趋势,说明我国的海洋渔获物正从高营养级、高经济价值的鱼类向低营养级、低经济价值的鱼类转变。同时,本研究和以往的研究对比发现,部分鱼种的营养级发生了较大改变。除了强大的捕捞压力外,鱼类生境及栖息地的破坏也是导致其营养级变动的一大因素(张波等, 2004)。
Cai DL, Li HY, Tang QS, et al. The establishment of continuous trophic levels in the food web of ecosystem of Yellow Sea and East China Sea: The results from analysis of carbon and nitrogen stable isotopes. Scientia Sinica Vitae, 2005, 35(2): 123-130 [蔡德陵, 李红燕, 唐启升, 等. 黄东海生态系统食物网连续营养谱的建立: 来自碳氮稳定同位素方法的结果. 中国科学C辑: 生命科学, 2005, 35(2): 123-130] |
Deng JY, Meng TX, Ren SM. Food web of fishes in Bohai Sea. Acta Ecologica Sinica, 1986, 6(4): 356-364 [邓景耀, 孟田湘, 任胜民. 渤海鱼类食物关系的初步研究. 生态学报, 1986, 6(4): 356-364] |
Du JG, Ye GQ, Chen B, et al. Changes in the marine trophic index of Chinese marine area. Biodiversity Science, 2014, 22(4): 532-538 [杜建国, 叶观琼, 陈彬, 等. 中国海域海洋生物的营养级指数变化特征. 生物多样性, 2014, 22(4): 532-538] |
Henderson MJ, Fabrizio MC, Lucy JA. Movement patterns of summer flounder near an artificial reef: Effects of fish size and environmental cues. Fisheries Research, 2014, 153: 1-8 DOI:10.1016/j.fishres.2014.01.001 |
Ji WW, Chen XZ, Jiang YZ, et al. Stable isotope analysis of some representative nektonic organisms in the central and northern part of East China Sea. Marine Fisheries, 2011, 33(3): 241-250 [纪炜炜, 陈雪忠, 姜亚洲, 等. 东海中北部游泳动物稳定碳氮同位素研究. 海洋渔业, 2011, 33(3): 241-250 DOI:10.3969/j.issn.1004-2490.2011.03.001] |
Ji WW, Jiang YZ, Ruan W, et al. Stable isotope analysis on the feeding character of representative fishes during spring in central and northern East China Sea and south Yellow Sea. Marine Fisheries, 2013, 35(4): 415-422 [纪炜炜, 姜亚洲, 阮雯, 等. 基于稳定同位素方法分析东海中北部及黄海南部春季主要鱼类的食性特征. 海洋渔业, 2013, 35(4): 415-422 DOI:10.3969/j.issn.1004-2490.2013.04.006] |
Ji WW. Ecological studies on the food web structures and trophic relationships of northern and central East China Sea using stable carbon and nitrogen isotopes. Doctoral Dissertation of Graduate School of Chinese Academy of Sciences (Institute of Oceanology), 2011 [纪炜炜. 东海中北部主要游泳动物食物网结构和营养关系初步研究. 中国科学院研究生院(海洋研究所)博士研究生学位论文, 2011] |
Li ZY, Zuo T, Dai FQ, et al. Study on feeding habits of organisms from Changjiang Estuary and adjacent Southern Yellow Sea in spring with stable isotope technology. Journal of Fisheries of China, 2009, 33(5): 784-789 [李忠义, 左涛, 戴芳群, 等. 长江口及南黄海水域春季生物摄食生态的稳定同位素研究. 水产学报, 2009, 33: 784-789] |
Li ZY. Studies on the feeding ecology of dominant fishes and foodweb structure in the Changjiang Estuary and Southern Yellow Sea with stable isotope. Doctoral Dissertation of Xiamen University, 2006 [李忠义. 应用稳定同位素技术研究长江口及南黄海水域主要鱼类摄食生态和食物网结. 厦门大学博士研究生学位论文, 2006] |
Ohshimo S, Madigan DJ, Kodama T, et al. Isoscapes reveal patterns of δ13C and δ15N of pelagic forage fish and squid in the Northwest Pacific Ocean. Progress in Oceanography, 2019, 175: 124-138 DOI:10.1016/j.pocean.2019.04.003 |
Pauly D, Christensen V, Dalsgaard J, et al. Fishing down marine food webs. Science, 1998, 279(5352): 860-863 DOI:10.1126/science.279.5352.860 |
Pethybridge HR, Young JW, Kuhnert PM, et al. Using stable isotopes of albacore tuna and predictive models to characterize bioregions and examine ecological change in the SW Pacific Ocean. Progress in Oceanography, 2015, 134: 293-303 DOI:10.1016/j.pocean.2015.03.001 |
Sherwood GD, Rose GA. Stable isotope analysis of some representative fish and invertebrates of the Newfoundland and Labrador continental shelf food web. Estuarine Coastal and Shelf Science, 2005, 63(4): 537-549 DOI:10.1016/j.ecss.2004.12.010 |
Sun M, Liu XZ, Li YP, et al. Trophic level analysis of key species in Liaodong Bay using stable nitrogen isotopes. Journal of Fishery Sciences of China, 2013, 20(1): 190-198 [孙明, 刘修泽, 李轶平, 等. 应用氮稳定同位素技术研究辽东湾海域主要渔业生物的营养级. 中国水产科学, 2013, 20(1): 190-198] |
Tao YJ, Mo M, He XB, et al. Feeding habits and ontogenetic diet shifts of yellowfin tuna (Thunnus albacores) in the South China Sea. Progress in Fishery Sciences, 2017, 38(4): 1-10 [陶雅晋, 莫檬, 何雄波, 等. 南海黄鳍金枪鱼(Thunnus albacores)摄食习性及其随生长发育的变化. 渔业科学进展, 2017, 38(4): 1-10] |
Vander Zanden MJ, Vadeboncoeur Y. Fishes as integrators of benthic and pelagic food webs in lakes. Ecology, 2002, 83(8): 2152-2161 DOI:10.1890/0012-9658(2002)083[2152:FAIOBA]2.0.CO;2 |
Wang YK. Preliminary studies on the population ecology based on fish otolith microstructure and microchemistry. Doctoral Dissertation of Ocean University of China, 2015 [王玉堃. 耳石微细结构和微化学示踪技术在鱼类种群生态学研究中的应用. 中国海洋大学博士研究生学位论文, 2015] |
Wei S, Jiang WM. Study on food web of fishes in the Yellow Sea. Oceanologia et Limnologia Sinica, 1992, 23(2): 182-192 [韦晟, 姜卫民. 黄海鱼类食物网的研究. 海洋与湖沼, 1992, 23(2): 182-192] |
Xu J, Zhang M, Xie P. Variability of stable nitrogen isotopic baselines and its consequence for trophic modeling. Journal of Lake Sciences, 2010, 22(1): 8-20 [徐军, 张敏, 谢平. 氮稳定同位素基准的可变性及对营养级评价的影响. 湖泊科学, 2010, 22(1): 8-20] |
Xue Y. Studies on the feeding ecology of dominant fishes and food web of fishes in the central and southern Yellow Sea. Doctoral Dissertation of Ocean University of China, 2005 [薛莹. 黄海中南部主要鱼种摄食生态和鱼类食物网研究. 中国海洋大学博士研究生学位论文, 2005] |
Zhang B, Tang QS. Study on trophic level of important resources species at high trophic levels in the Bohai Sea, Yellow Sea and East China Sea. Advances in Marine Science, 2004, 22(4): 393-404 [张波, 唐启升. 渤、黄、东海高营养层次重要生物资源种类的营养级研究. 海洋科学进展, 2004, 22(4): 393-404] |
Zhang B, Wu Q, Jin XS. Interannual variation in the food web of commercially harvested species in Laizhou Bay from 1959 to 2011. Journal of Fishery Sciences of China, 2015, 22(2): 278-287 [张波, 吴强, 金显仕. 1959-2011年莱州湾渔业资源群落食物网结构的变化. 中国水产科学, 2015, 22(2): 278-287] |
Zhang B, Yuan W, Dai FQ. Study on feeding ecology of fish community in Laoshan Bay during summer using stable carbon and nitrogen isotopes. Journal of Fisheries of China, 2016, 40(4): 585-594 [张波, 袁伟, 戴芳群. 应用稳定同位素技术研究崂山湾夏季鱼类群落的摄食生态. 水产学报, 2016, 40(4): 585-594] |
Zhang BL, Guo B, Yu Y, et al. Study of the food-web structure in the Dashentang artificial reef area in Tianjin using a stable isotope technique. Progress in Fishery Sciences, 2019, 40(6): 25-35 [张博伦, 郭彪, 于莹, 等. 基于稳定同位素技术的天津大神堂海域人工鱼礁区食物网结构研究. 渔业科学进展, 2019, 40(6): 25-35] |



