2. 中国水产科学院黄海水产研究所 青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Laboratory for Marine Drugs and Biological Products, Pilot National Laboratory Marine Science and Technology (Qingdao), Qingdao 266071)
随着社会的发展和科技的进步,塑料在世界范围内大量生产与应用,目前年均产量超过3.11亿t (Gil-Delgado et al, 2017)。塑料通过机械作用、生物降解和太阳辐射等被分解成小颗粒,当其直径小于5 mm时即可定义为微塑料(文天, 2016)。环境中的塑料残体可以通过风力、河流、洋流等外力进行远距离迁移(Cole et al, 2011),从而对全球海洋造成污染。塑料制品的普及和广泛应用,海洋中的塑料逐年增加,海水中微塑料会逐渐转移到海洋生物体内,包括浮游动物(Mao et al, 2018)、双壳类(Abidli et al, 2019)、底栖类(Sussarellu et al, 2016)和鱼类(Espinosa et al, 2018)等。调查研究发现,墨尔本地区19.4%的鱼体内都含有微塑料,且体内的微塑料含量平均高于头部(Su et al, 2019);突尼斯北部湖中软体动物表现出相对较高的微塑料污染水平,总浓度在703.95~109.80个/kg至1482.82~19.20个/kg (Abidli et al, 2019);Zhu等(2019)首次在濒危物种白海豚(Sousa chinensis)的肠道中检测到了微塑料。在海洋环境中,微塑料对海洋生物的危害主要有2个方面:一是海洋生物摄入微塑料,会对生命健康产生直接影响。据已有的研究发现,微塑料可能会导致鱼类(Lu et al, 2016)、甲壳类(Watts et al, 2014)和双壳类(van Cauwenberghe et al, 2014)等消化道阻塞,进食能力受损,甚至导致生殖能力障碍等不良影响。如果微塑料长时间在生物体内,会影响正常的食物摄取,最终导致生物体的饥饿和死亡。二是微塑料易与有毒化学物质结合,从而危害海洋生物。因为微塑料比一般塑料更容易吸附有毒有害物质,已经发现由于微塑料自身的疏水特性,它可以浓缩多氯联苯、多溴联苯和多环芳烃等多种有机污染物、重金属,以及添加剂衍生的化学品(Castillo et al, 2016)。微塑料污染对海洋动物和沿海生态系统造成了影响,并对人类健康产生了威胁。目前,Wu等(2019)研究了不同粒径聚苯乙烯对人结肠腺癌细胞的细胞毒性,发现2种微塑料均对细胞活力、氧化应激、膜完整性和流动性有低毒作用。Schirinzi等(2017)体外研究发现,微塑料可以引起大脑和人类上皮细胞高活性氧产生。Hwang等(2019)研究了聚丙烯微塑料在人源性细胞中的毒性,研究表明,微塑料直接与细胞接触可能通过诱导免疫细胞产生细胞因子而产生健康问题。然而,由于缺乏可靠的数据来量化微塑料在人体的真实情况,因此,很难合理地评估微塑料对人体健康的实际影响。关于微塑料在人体的存在情况以及对人体健康的影响,仍有许多工作要做。
从海洋生物样品中提取微塑料的主要方法是消化法,即使用酸、碱、氧化剂或酶等消化液来进行组织消解。酸性消化液通常使用的是69% HNO3(Dekiff et al, 2014),其他酸性消化液还有65% HNO3和65% HClO4等(Santana et al, 2016)。碱性消化液通常使用的是10% KOH(Dehaut et al, 2016)。氧化剂消化液通常选择30% H2O2(Karami et al, 2016)。酶使用较多的是脂肪酶(Waite et al, 2018)、胰蛋白酶(Courtene-Jones et al, 2017)。然而,在早期的实验研究中存在一些问题。首先,消化液对微塑料的影响不是通过在生物组织中加入微塑料来测试的,而是直接与消化液接触。其次,不适当的消化液或温度等消化条件可能会低估海洋生物中的微塑料含量,或者腐蚀性消化液也可能导致颗粒破碎,从而高估微塑料的含量。因此,本研究旨在通过消化率、回收率、拉曼光谱分析和扫描电镜等多方面的分析,选取最适的消化液,并对其消化工艺进行优化,建立一种高效的消化方法,在保护微塑料聚合物完整性的同时,有效地消化鱼类组织,为海洋生物中微塑料的分离提取提供技术支持。
1 材料与方法 1.1 实验材料斑马鱼(Danio rerio)是一种常见的热带淡水鱼,头小稍尖,略呈纺锤形,具有个体小、易于饲养、繁殖力旺盛、生长周期短和发育快等特点(Talwar et al, 1994)。本实验斑马鱼于2019年4月购自青岛当地水产市场,体长为(2.0±0.6) cm,实验前驯养7 d (驯养期间无斑马鱼死亡),饲养用水为自来水不断曝气24 h,水温为(26.0±0.5)℃,每日投食1次。
KOH、H2O2和HNO3购自国药集团化学试剂有限公司,均为分析纯;胰蛋白酶购自北京索莱宝生物科技有限公司;500 mm聚苯乙烯塑料购自天津市倍思乐色谱技术开发中心;滤纸(No.540)购自美国Whatman公司。
1.2 实验方法 1.2.1 消化率选取常用的4种消化液:10% KOH (Ali et al, 2017)、30% H2O2 (Avio et al, 2015)、69% HNO3 (Vandermeersch et al, 2015)和0.3125%胰蛋白酶(Courtene-Jones et al, 2017)。在相同温度、相同时间下进行组织消化。
在磨碎的0.6 g斑马鱼鱼肉组织(不加聚苯乙烯颗粒)里分别加入6 ml 10% KOH、30% H2O2、69% HNO3和0.3125%胰蛋白酶(Dehaut et al, 2016),一式3份,安瓿瓶密封,放入55℃烘箱中保持48 h。用Whatman No.540滤纸对消化液进行真空过滤。过滤前后,滤膜保持50℃下5 h,称重精度为0.1 mg。计算消化率(Catarino et al, 2016):
| $ 消化率{\rm{\%}}=\frac{{W}_{i}-({W}_{a}-{W}_{b})}{{W}_{i}}$ |
式中,Wi为斑马鱼组织初始重量,Wa为过滤后的滤膜重量,Wb为过滤前的滤膜重量。
1.2.2 回收率收集0.6 g磨碎的斑马鱼鱼肉,将0.06 g聚苯乙烯微塑料加入到磨碎的鱼肉中,搅拌均匀,将混合物转移到装有6 ml 10% KOH、30% H2O2、69% HNO3和0.3125%胰蛋白酶的安瓿瓶中,并在55℃下保持48 h (n=3)。然后,用Whatman No.540滤纸进行过滤,在50℃下干燥5 h,在体视显微镜下将聚苯乙烯颗粒挑出、称量,计算回收率(Catarino et al, 2016):
| $ 回收率{\rm{\%}}=\frac{{W}_{a}}{{W}_{i}}$ |
式中,Wa为消化后聚苯乙烯的重量,Wi为聚苯乙烯的初始重量。
1.2.3 体视显微镜和扫描电镜观察及拉曼光谱分析将未经消化处理的聚苯乙烯颗粒和经过4种消化液消化的聚苯乙烯颗粒在体视显微镜(3×)下观察,检查其形态及其颜色的变化。扫描电镜通过聚焦电子束扫描表面产生微塑料图像,用于表征微塑料的表面形貌。将5种聚苯乙烯颗粒进行扫描电镜观察。用涂布机对样品涂上一层金,以防止电子束对样品充电。观察未经处理(对照)的聚苯乙烯颗粒和消化后的聚苯乙烯颗粒的形貌(Ali et al, 2017; Sun et al, 2019)。
此外,为了评估聚合物的分子完整性,消化后的聚苯乙烯颗粒使用拉曼光谱进行检测,且与自建的数据库进行比较。检测条件:激光波长为785 nm,激光功率为350 mW,扫描范围为200~3000 cm–1 (Araujo et al, 2018; Alexandre et al, 2019)。
1.2.4 单因素实验选择消化温度(25℃、35℃、45℃、55℃和65℃)、消化时间(6、12、24、48和72 h)、消化浓度(3%、5%、10%、20%和30%)进行单因素实验,分别考察这3个因素对斑马鱼消化率的影响。
1.2.5 响应面优化实验根据Box-Behnken实验设计原理进行3因素3水平实验设计,利用Design- Expert 8.0软件进行数据拟合,优化斑马鱼消化率工艺。在单因素的基础上,自变量的实验水平分别以–1、0、1进行编码,共设计15个实验点(3个中心点)。实验因素和水平见表 1。
|
|
表 1 响应面实验水平因素 Tab.1 Factors and their coded levels used in experimental design for response surface methodology |
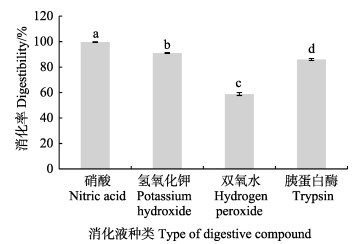
在消化液种类选择中,消化率是非常重要的指标。将斑马鱼肉组织与4种消化液进行反应后得到消化率数据见图 1。从图 1可以看出,消化率最高的是HNO3,达到了100%。Ali等(2017)发现,浓缩HCl和HNO3可以完全消化鱼的组织。KOH和胰蛋白酶的消化率分别达到90.97%和85.89%。消化能力较弱的是H2O2,消化率仅有58.82%。因此,从消化率上来看,H2O2不适合作为斑马鱼的消化液。
|
图 1 不同消化液下斑马鱼的消化率
Fig.1 Digestibility of zebrafish in different digestive compound
a、b、c和d表示各处理间差异显著(P < 0.05)
a, b, c, and d indicate significant difference among treatments at 0.05 level |
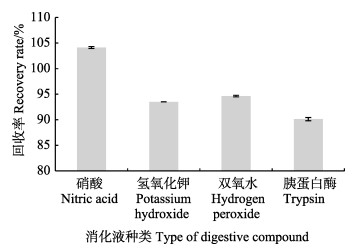
在55℃温度下,斑马鱼肉与聚苯乙烯颗粒混合后分别与4种消化液一起消化,测定其回收率。不同消化液下,聚苯乙烯颗粒的回收率见图 2。从图 2可知,不同消化液之间的差异不显著。HNO3的回收率最高,超过了100%,达到了104.13%。其原因可能是HNO3可以有效地消解有机质,但油脂和组织残渣仍然存在,附着在微塑料上导致重量改变,影响微塑料的最终定量(李陵云等, 2019)。KOH和H2O2的回收率分别为93.50%和94.63%。回收率最低的是胰蛋白酶,仅有90.13%。与本研究不同的是,Catarino等(2016)对NaOH、HNO3和Corolase 7089对贻贝中的微塑料进行回收,蛋白酶的提取回收率均达到了93%以上。可能的原因是,不同消化液对微塑料的种类和消化对象有差异性。因此,从回收率来看,HNO3不适合作为消化液。综合消化率与回收率的结果可以得出,KOH比较适合作为从斑马鱼肉中分离提取聚苯乙烯颗粒的消化液。
|
图 2 不同消化液下聚苯乙烯颗粒的回收率
Fig.2 Recovery rates of polystyrene in different digestive compound
|
通过体式显微镜观察4种消化液消化的聚苯乙烯颗粒,其颜色和状态变化如图 3所示。HNO3作为消化液导致聚苯乙烯颗粒严重变色且颗粒间发生粘连。有研究表明,消化液会导致微塑料变色,从而干扰其进行光学检测(Catarino et al, 2016)。变色的原因可能是由于HNO3可以有效地消解有机质,但油脂仍然存在,附着在微塑料上,导致颜色和状态发生改变(Santana et al, 2016),从而影响微塑料的最终定量,回收率的实验结果也证明了这一点。而KOH、H2O2和胰蛋白酶这3种消化液不会导致微塑料变色,但聚苯乙烯颗粒的表面附着少量消化后的生物组织。其中,KOH消化液消化过的聚苯乙烯颗粒表面附着残留斑马鱼肉组织最少,胰蛋白酶消化液由于消化不彻底,残留组织最多。

|
图 3 正常与不同消化液消化后聚苯乙烯颗粒的形貌(放大倍数3×) Fig.3 Morphology of polystyrene particles in digestion with normal and different digestive compound (magnification 3×) a: 对照;b: 硝酸;c: 氢氧化钾;d: 过氧化氢;e: 胰蛋白酶 a: Control; b: HNO3; c: KOH; d: H2O2; e: Trypsin |
为了进一步了解4种消化液种类对聚苯乙烯颗粒完整性的影响,进行了扫描电镜观察,结果如图 4所示。由图 4可以看出,经过HNO3消化后的聚苯乙烯颗粒表面出现褶皱且球体融化粘连在一起,表明HNO3在消化生物组织的同时,也对聚苯乙烯颗粒产生了严重的破坏,对实验结果有较大的影响。而经过KOH、H2O2和胰蛋白酶消化后的聚苯乙烯颗粒并未发生明显的变化,但球体表面有生物组织残留,其中,胰蛋白酶消化后的聚苯乙烯颗粒上残留的生物组织较多,直接证明了其对斑马鱼肉组织消化不彻底。

|
图 4 正常与不同消化液下的聚苯乙烯扫描电镜照片 Fig.4 Scanning electron microscopy of polystyrene in normal and different digestive compound a: 对照;b: 硝酸;c: 氢氧化钾;d: 过氧化氢;e: 胰蛋白酶 a: Control; b: HNO3; c: KOH; d: H2O2; e: Trypsin |
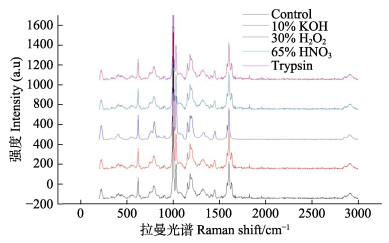
为了有效地分析不同消化液消化后聚苯乙烯颗粒的结构特征,本研究采用拉曼光谱进行分析研究,结果如图 5所示。从图 5可以看出,HNO3、KOH和胰蛋白酶与对照拉曼光谱相比,并无其他明显特征峰值出现,由此可知,HNO3、KOH和胰蛋白酶在消化斑马鱼的同时,不会破坏聚苯乙烯的化学结构。而H2O2的拉曼光谱与对照相比,在波长1130、1375和1630 cm–1左右的峰值的相对强度减弱。波长为1130 cm–1左右处的变化是由苯环与碳原子间非对称伸缩振动引起的,而1375 cm–1左右的变化是由碳氢原子间非对称弯曲振动引起的,1630 cm–1处是由苯环内碳原子间非对称伸缩振动引起的。因此,H2O2不适合作为从斑马鱼肉组织中提取微塑料颗粒的消化液。
|
图 5 正常和不同消化液下的聚苯乙烯颗粒拉曼光谱
Fig.5 Raman spectra of polystyrene particles in normal and different digestive compound
|
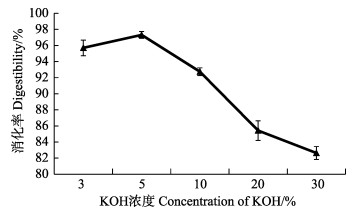
消化液的浓度是影响消化率的重要因素,在45℃、24 h的条件下,不同浓度的KOH消化液对斑马鱼消化率的影响见图 6。从图 6可以看出,随着KOH浓度的增加,斑马鱼消化率呈现上升趋势;当KOH浓度达到5%时,消化率达到峰值,为97.32%。KOH浓度继续增加,消化率开始下降,且下降趋势明显。
|
图 6 不同浓度KOH对斑马鱼消化率的影响
Fig.6 Effects of different concentration of KOH on digestibility of zebrafish
|
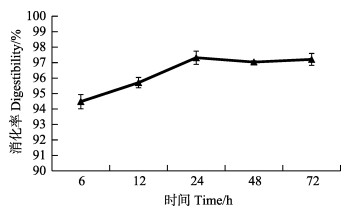
在5% KOH、45℃的条件下,不同消化时间对斑马鱼消化率的影响见图 7。如图 7所示,随着消化时间的增加,斑马鱼消化率也增加。当消化时间增加到24 h时,消化率的变化最明显,达到了97.32%。当消化时间增加到48和72 h时,斑马鱼的消化率趋于稳定。
|
图 7 不同消化时间对斑马鱼消化率的影响
Fig.7 Effect of different digestion time on digestibility of zebrafish
|
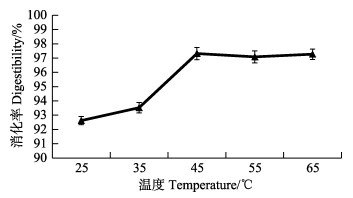
使用5% KOH溶液消化24 h,研究斑马鱼消化率的最佳温度,见图 8。如图 8所示,随着温度的不断升高,斑马鱼的消化率呈现大幅度的上升。当温度达到45℃时,斑马鱼的消化率达到最高。高于45℃,斑马鱼的消化率趋于稳定,基本不变。
|
图 8 不同温度对斑马鱼消化率的影响
Fig.8 Effects of different temperature on digestibility of zebrafish
|
利用Design-Expert 8.0软件进行数据拟合,实验设计与结果见表 2。
|
|
表 2 Box-Behnken实验设计及结果 Tab.2 Design and results for Box-Behnken responses surface methodology |
利用Design-Expert 8.0软件对表 2中的数据进行多元回归拟合,获得斑马鱼消化率(Y)对自变量浓度(A)、时间(B)、温度(C)的二元多项回归方程:Y=97.32–0.21A–0.16B+0.32C +0.37AB+0.077AC–0.42BC–0.67A2–0.32B2–0.87C2。方程中各项系数绝对值的大小直接反映各因素对响应值的影响程度,系数的正、负反映影响方向(冯艳霞等, 2016) (黄梦诗等, 2019)。由于该方程的二次项系数均为负值,可以推断方程代表的抛物面开口向下,因而具有极大值点,可以进行优化分析。由方程的一次项系数可以得出影响斑马鱼消化率的因素的主次顺序为温度 > 浓度 > 时间。对该模型进行方差分析,结果见表 3。
|
|
表 3 回归模型方差分析 Tab.3 Analysis of variance of the regression model |
由表 3可以看出,模型的P=0.0292 (显著),失拟项P=0.7372 (不显著),表明模型充分拟合实验数据,该方程是斑马鱼消化率与消化工艺参数的合适数学模型。
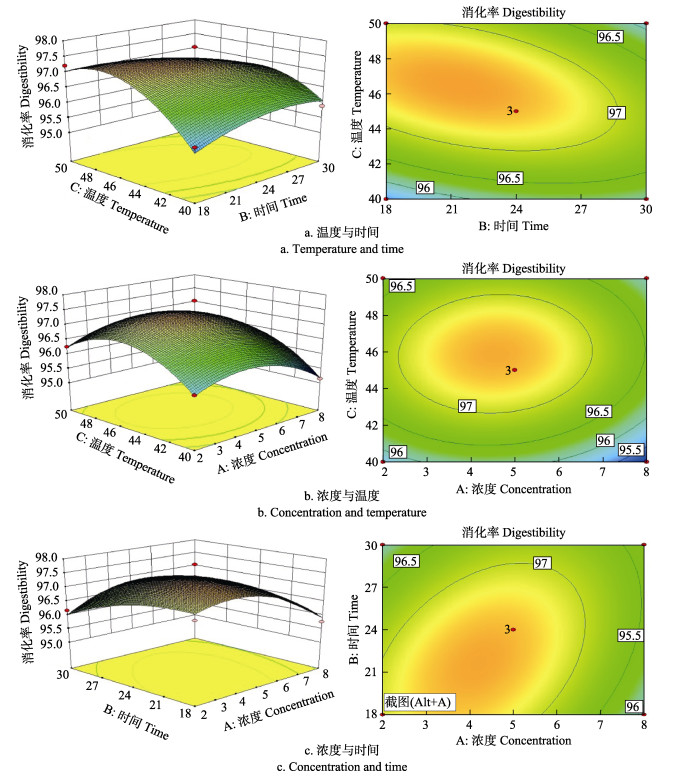
2.7.3 响应面优化分析等高线图可以直观地反映两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形与之相反(吕小京等, 2018)。根据回归方程绘制响应面(图 9)。
|
图 9 各因素交互作用对消化率的等高线和响应面图
Fig.9 Contour and response surface plots for the effects of different factors on the digestibility
|
图 9中响应面的变化及等高线的形状可以直观地反映温度、时间和浓度3个因素对斑马鱼消化率的影响。由图 9a可知,当时间一定时,消化率随着温度的增加而逐渐增大,当温度达到一定值后,消化率基本趋于稳定。由等高线的形状可以看出,温度与时间的交互作用对响应值的作用显著。由图 9b可知,在相同的温度下,消化率随着浓度的增加呈现先增大后减小的趋势。由等高线的形状可以看出,温度和浓度的交互作用对响应值的影响显著。由图 9c可知,当浓度一定时,消化率随着时间的增加而增加,当时间增加到一定值时,继续增大时间,消化率的增加却不明显,稍有下降。时间与浓度的交互作用对响应值影响显著。
2.7.4 最佳条件的确定及验证通过软件分析,得到以消化率为指标的最佳消化条件为浓度4.06%、时间20.15 h、温度46.64℃,此时的消化率预测值为97.45%。结合实际操作,将工艺条件调整为浓度4%、时间20 h、温度47℃,在此条件下进行3次实验,测定消化率为(97.38±0.04)%,相对误差为0.07%,处于误差范围内,所以,实验值与预测值可认为基本一致,说明此消化条件下的回归模型方程可靠。
3 结论化学消解法提取微塑料操作简单,材料费用较低。但是,化学消解中的消解液种类多,不同生物需要的消解液的种类、温度和时间不同。除此之外,使用化学消解法处理样品,花费时间长,并且在消解的过程中可能会有其他物质产生,影响消解效果。因此,从海洋生物中分离提取微塑料消化液的选择和消化条件的设置是至关重要的。本研究首先采用KOH、H2O2、HNO3和胰蛋白酶这4种消化液对斑马鱼进行消化,研究表明,KOH溶液比H2O2、HNO3和胰蛋白酶更适合作为消化液从斑马鱼中提取微塑料。KOH溶液中可以有效的去除生物组织,同时保持被测塑料聚合物结构的完整性。在单因素的基础上,通过响应面优化实验分析表明,KOH溶液作为消化液消化斑马鱼的最佳条件为浓度4%、温度47℃、时间20 h。各因素对斑马鱼消化率的影响依次为温度 > 浓度 > 时间。此消化条件下,实际测得的斑马鱼消化率为97.38%。回归分析和验证实验表明该响应面法合理、可行。
Abidli S, Lahbib Y, Trigui EMN. Microplastics in commercial molluscs from the lagoon of Bizerte (northern Tunisia). Marine Pollution Bulletin, 2019, 142: 243-252 DOI:10.1016/j.marpolbul.2019.03.048 |
Alexandre D, Ludovic H, Guillaume D. Current frontiers and recommendations for the study of microplastics in seafood. Trends in Analytical Chemistry, 2019, 116: 346-359 DOI:10.1016/j.trac.2018.11.011 |
Araujo CF, Nolasco MM, Ribeiro AMP, et al. Identification of microplastics using Raman spectroscopy: Latest developments and future prospects. Water Research, 2018, 142: 426-440 DOI:10.1016/j.watres.2018.05.060 |
Avio CG, Gorbi S, Regoli F. Experimental development of a new protocol for extraction and characterization of microplastics in fish tissues: First observations in commercial species from Adriatic Sea. Marine Environmental Research, 2015, 111: 18-26 DOI:10.1016/j.marenvres.2015.06.014 |
Castillo AB, Al-Maslamani I, Obbard JP. Prevalence of microplastics in the marine waters of Qatar. Marine Pollution Bulletin, 2016, 111(1-2): 260-267 DOI:10.1016/j.marpolbul.2016.06.108 |
Catarino AI, Thompson R, Sanderson W, et al. Development and optimisation of a standard method for extraction of microplastics in mussels by enzyme digestion of soft tissues. Environmental Toxicology and Chemistry, 2016, 36(4): 947-951 |
Cole M, Lindeque P, Halsband C, et al. Microplastics as contaminants in the marine environment: A review. Marine Pollution Bulletin, 2011, 62(12): 2588-2597 DOI:10.1016/j.marpolbul.2011.09.025 |
Courtene-Jones W, Quinn B, Murphy F, et al. Optimisation of enzymatic digestion and validation of specimen preservation methods for the analysis of ingested microplastics. Analytical Methods, 2017, 9(9): 1437-1445 DOI:10.1039/C6AY02343F |
Dehaut A, Cassone AL, Frère L, et al. Microplastics in seafood: Benchmark protocol for their extraction and characterization. Environmental Pollution, 2016, 215: 223-233 DOI:10.1016/j.envpol.2016.05.018 |
Dekiff JH, Remy D, Klasmeier J, et al. Occurrence and spatial distribution of microplastics in sediments from Norderney. Environmental Pollution, 2014, 186: 248-256 DOI:10.1016/j.envpol.2013.11.019 |
Espinosa C, García Beltrán JM, Esteban MA, et al. In vitro effects of virgin microplastics on fish head-kidney leucocyte activities. Environmental Pollution, 2018, 235: 30-38 DOI:10.1016/j.envpol.2017.12.054 |
Feng YX, Jia YF, Gu HH, et al. Optimization of extraction conditions of Chinese chestnut peptides by response surface methodology and its DPPH· scavenging abilities. Science and Technology of Food Industry, 2016, 37(22): 315-319 [冯艳霞, 贾一凡, 顾海华, 等. 响应面法优化板栗多肽制备及其清除DPPH·能力的研究. 食品工业科技, 2016, 37(22): 315-319] |
Gil-Delgado JA, Guijarro D, Gosálvez RU, et al. Presence of plastic particles in waterbirds faeces collected in Spanish lakes. Environmental Pollution, 2017, 220: 732-736 DOI:10.1016/j.envpol.2016.09.054 |
Huang MS, Yang QQ, Zhang Y, et al. Study on the effects of temperature, salinity, pH, phosphate, nitrate, and ammonium on the growth of Vibrio parahaemolyticus using response surface methodology. Progress in Fishery Sciences, 2019, 40(2): 132-140 [黄梦诗, 杨倩倩, 张艳, 等. 响应面法研究温度、盐度、pH及磷酸盐、硝氮、氨氮对副溶血弧菌生长的影响. 渔业科学进展, 2019, 40(2): 132-140] |
Hwang J, Choi D, Han S, et al. An assessment of the toxicity of polypropylene microplastics in human derived cells. Science of the Total Environment, 2019, 684: 657-669 DOI:10.1016/j.scitotenv.2019.05.071 |
Karami A, Golieskardi A, Choo CK, et al. A high-performance protocol for extraction of microplastics in fish. Science of the Total Environment, 2016, 578: 485-494 |
Li LY, Zhu JM, Li JN, et al. Review on methods of extraction and isolation of microplastics in aquatic organisms. Marine Environmental Science, 2019, 38(2): 188-197 [李陵云, 朱静敏, 李佳娜, 等. 水生生物样品中微塑料的提取和分离方法综述. 海洋环境科学, 2019, 38(2): 188-197] |
Lu YF, Zhang Y, Deng YF, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver. Environmental Science and Technology, 2016, 50(7): 40-54 |
Lü XJ, Cao DQ, Xu NJ. Optimization of enzymatic preparation of antioxidant peptides from protein hydrolysate of the marine microalgae Nannochloropsis by response surface methodology. Food Science, 2018, 39(6): 183-188 [吕小京, 操德群, 徐年军. 响应面实验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺. 食品科学, 2018, 39(6): 183-188] |
Mao YF, Ai HN, Chen Y, et al. Phytoplankton response to polystyrene microplastics: Perspective from an entire growth period. Chemosphere, 2018, 208: 59-68 DOI:10.1016/j.chemosphere.2018.05.170 |
Santana MFM, Ascer LG, Custódio MR, et al. Microplastic contamination in natural mussel beds from a Brazilian urbanized coastal region: Rapid evaluation through bioassessment. Marine Pollution Bulletin, 2016, 106(1-2): 183-189 DOI:10.1016/j.marpolbul.2016.02.074 |
Schirinzi GF, Pérez-Pomeda I, Sanchís J, et al. Cytotoxic effects of commonly used nanomaterials and microplastics on cerebral and epithelial human cells. Environmental Research, 2017, 159: 579-587 DOI:10.1016/j.envres.2017.08.043 |
Su L, Nan BX, Hassell KL, et al. Microplastics biomonitoring in Australian urban wetlands using a common noxious fish (Gambusia holbrooki). Chemosphere, 2019, 228: 65-74 DOI:10.1016/j.chemosphere.2019.04.114 |
Sun J, Dai XH, Wang QL, et al. Microplastics in wastewater treatment plants: Detection, occurrence and removal. Water Research, 2019, 152(1): 21-37 |
Sussarellu R, Suquet M, Thomas Y, et al. Oyster reproduction is affected by exposure to polystyrene microplastics. Proceedings of the National Academy of Sciences, 2016, 113(9): 2430-2435 DOI:10.1073/pnas.1519019113 |
Talwar PK, Jhingran AG. Inland fishes of India and adjacent countries. Reviews in Fish Biology and Fisheries, 1994, 4(1): 135-136 DOI:10.1007/BF00043269 |
van Cauwenberghe L, Janssen CR. Microplastics in bivalves cultured for human consumption. Environmental Pollution, 2014, 193: 65-70 DOI:10.1016/j.envpol.2014.06.010 |
Vandermeersch G, van Cauwenberghe L, Janssen CR, et al. A critical view on microplastic quantification in aquatic organisms. Environmental Research, 2015, 193(Part B): 46-55 |
Waite HR, Donnelly MJ, Walters LJ. Quantity and types of microplastics in the organic tissues of the eastern oyster, Crassostrea virginica and Atlantic mud crab Panopeus herbstii from a Florida estuary. Marine Pollution Bulletin, 2018, 129(1): 179-185 DOI:10.1016/j.marpolbul.2018.02.026 |
Watts AJR, Lewis C, Goodhead RM, et al. Uptake and retention of microplastics by the shore crab, Carcinus maenas. Environmental Science and Technology, 2014, 48(15): 8823-8830 DOI:10.1021/es501090e |
Wen T. Plastic particles threaten chemical degradation of marine fish species. Science Garden, 2016(15): 30-31 [文天. 研究发现塑料颗粒威胁海洋鱼类物种化学品降解. 科学大观园, 2016(15): 30-31 DOI:10.3969/j.issn.1003-1871.2016.15.025] |
Wu B, Wu XM, Liu S, et al. Size-dependent effects of polystyrene microplastics on cytotoxicity and efflux pump inhibition in human Caco-2 cells. Chemosphere, 2019, 221: 333-341 DOI:10.1016/j.chemosphere.2019.01.056 |
Zhu JM, Yu XY, Zhang Q, et al. Cetaceans and microplastics: First report of microplastic ingestion by a coastal delphinid, Sousa chinensis. Science of the Total Environment, 2019, 659: 649-654 DOI:10.1016/j.scitotenv.2018.12.389 |



