2. 设施渔业教育部重点实验室 大连 116023
2. Key Laboratory of Environment Controlled Aquaculture, Ministry of Education, Dalian 116023
鱼类行为研究涉及多个方面,包括游泳行为(Cai et al, 2013)、摄食行为(周朝伟等, 2019; 张鹏飞等, 2020)和繁殖行为(刘丽丽等, 2010)等,而对鱼类认知的研究较少。认知(包括感知、学习、记忆和决策等)在动物行为中起着重要作用(Shettleworth, 2001)。在脊椎动物的认知研究中,鱼类是一个特别值得研究的群体(Bshary et al, 2014)。经验和学习是鱼类认知过程中非常重要的部分(Hsu et al, 2006; Kozak et al, 2008; Manassa et al, 2012; Alcazar et al, 2014; Vega-Trejo et al, 2014)。目前,关于鱼类认知的研究多集中在鱼类感觉器官的功能研究方面(Giaquinto et al, 1997; Lucon-Xiccato et al, 2019; Frommen, 2020)。但越来越多的研究表明,鱼类认知不仅限于自身的感觉器官,还会根据相邻个体的行为调整自身运动(Berdahl et al, 2013),通过与周围有经验个体进行社会互动来提高自身行为的效率。Reebs(2000)研究表明,少数经过训练的美鳊(Notemigonus crysoleucas)能引导未经训练的鱼来到食物区,提高集体的觅食效率。Webster等(2017)研究表明,经过训练的刺鱼(Gasterosteus aculeatus)能显著提高混合群体中未经训练的个体的觅食效率。
欧洲舌齿鲈(Dicentrarchus labrax),又名欧鲈,是目前地中海区域最主要的商业养殖鱼类之一,具有较强的学习能力和行为可塑性(Covès et al, 2006; Benhaïm et al, 2011)。关于鱼类经验和学习行为的研究现多集中在孔雀鱼(Poecilia reticulata) (Goodey et al, 1986; Shohet et al, 2009)、虹鳟(Salmo gairdneri) (Ware, 1971)、大西洋鲑(Salmo salar) (Reiriz et al, 1998)、雀鲷(Acanthochromis polyacanthus) (Ramasamy et al, 2015)等鱼类,对欧洲舌齿鲈学习和信息传递的相关研究较少。本研究通过设定在特定环境背景条件下,分析欧洲舌齿鲈幼鱼在有/无有经验个体条件下完成任务的时间及相关行为指标的关联性,为今后深入研究欧洲舌齿鲈及其他鱼类的学习和信息传递行为提供参考。
1 材料与方法 1.1 实验对象及条件实验用欧洲舌齿鲈幼鱼取自大连海洋大学设施渔业教育部重点实验室,共45尾,平均全长为(20.69± 0.21) cm。所有实验用鱼性腺发育均未成熟,故不考虑性行为。
实验共使用9个蓝色水箱,每个水箱5尾幼鱼。实验正式开始前,实验幼鱼在水箱中暂养20 d,水温控制在18℃±1℃,溶解氧(DO)保持在6 mg/L以上,光照周期为12 L∶12 D,每日08:00和17:00投喂饲料颗粒,实验期间停止投喂。
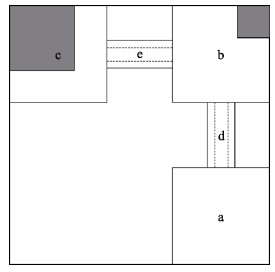
1.2 实验装置实验装置放置于240 cm × 240 cm × 50 cm的玻璃缸中,共2套,水深为10 cm。装置呈“L”型,采用白色PVC板搭建,共分为3个60 cm × 60 cm的象限,相邻象限之间由内径为12 cm的透明亚克力材质圆柱体连通(图 1)。其中,象限1与通道的连接处插有20 cm × 20 cm的白色PVC隔板;象限2右上角底面和侧面分别贴有20 cm×20 cm的红色防水贴纸;象限3左上角底面和侧面分别贴有40 cm × 40 cm和40 cm × 20 cm的红色防水贴纸。红色防水贴纸一是为了模拟陌生的背景环境;二是从鱼的感官角度来识别各象限的差异。
|
图 1 实验装置的俯视图 Fig.1 Top view of experimental setup a:象限1;b:象限2;c:象限3;d:通道1;e:通道2。灰色区域表示红色贴纸区域 a is the first quadrant, b is the second quadrant, c is the third quadrant, d is the first channel, e is the second channel. Gray areas are red sticker |
为尽可能减少实验过程中对鱼的干扰,每个60 cm × 20 cm的板面底侧都均匀分布3个4 cm×0.5 cm的小孔,方便换水和清理粪便。实验为静水环境,以减少鱼类之间信息交流的可能性。每套实验装置的正上方各布设1盏LED灯和1台高清摄像机。
1.3 实验设计实验分为2个部分:实验1用于测试首次进入陌生环境后,单独1尾幼鱼的行为表现;实验2用于测试陌生环境中已有有经验鱼存在时,幼鱼首次进入后的行为表现以及2尾鱼的运动状态。随机挑选3个水箱用于实验1 (共15尾鱼),剩余6个水箱用于实验2(共30尾鱼)。各水箱设定为不熟悉组,因为熟悉度已被证明会影响个体的学习效率(Swaney et al, 2001)。
1.3.1 单独1尾欧洲舌齿鲈幼鱼的行为表现将1尾欧洲舌齿鲈幼鱼放入象限1,记为Alone Fish (AF),适应30 min后轻轻地取走隔板,记为实验开始;欧洲舌齿鲈幼鱼首次进入象限3 10 min后,记为实验结束。将鱼捞出放入新的暂养水箱中,对整个装置进行清理和换水,重复以上过程,共13组。
利用全事件观测法,记录每尾鱼实验开始至整个鱼体完全通过通道1的时间间隔(T1)和鱼体第1次完全通过通道1至完全通过通道2的时间间隔(T2)。
1.3.2 有经验鱼存在时欧洲舌齿鲈幼鱼的行为表现从2个水箱中随机各捞出1尾鱼,作为1组实验对象,每组随机挑选1尾欧洲舌齿鲈幼鱼记为First Fish (FF, 有经验鱼),第2尾记为Second Fish (SF, 无经验鱼)。用于实验2的幼鱼在实验前24 h麻醉,并快速在背鳍前端固定直径为8 mm的不同颜色轻型圆形卡片,并通过卡片颜色实现个体识别。
首先,将FF放进插有隔板的象限1,适应30 min后轻轻地取走隔板,FF在实验装置中活动24 h,使鱼适应并熟悉整个实验环境;其次,当FF在象限3时,重新插回隔板,并立即放入SF,为了减少FF对SF存在的感知,放入过程用黑色塑料遮住SF;然后,当SF在象限1适应30 min后,轻轻拿走隔板,记为实验开始,2 h后记为实验结束(当FF进入象限1发现SF,且此时SF仍然在象限1时,则为有效实验;反之,实验无效);最后,捞出FF和SF放入新的暂养水箱中,对整个装置进行清理和换水,重复以上过程,共15组。
利用全事件观测法,记录FF和SF第1次相遇至SF整个鱼体完全通过通道1的时间间隔(t1)和SF第1次完全通过通道1至完全通过通道2的时间间隔(t2)。利用行为学软件分析FF和SF在第1次相遇10 min内的行为参数。
1.4 行为参数获取及分析使用Noldus EthoVision XT (版本12.0; Noldus信息技术, 荷兰)对欧洲舌齿鲈幼鱼的行为进行分析。采用25帧/s (即每秒采集25个样本)的频率追踪实验鱼的实时坐标X和Y,计算相关行为学参数,各参数的计算方法如下:
移动距离(cm)、速度(cm/s)和加速度(最小值和最大值) (cm/s2)计算公式:
| ${\rm{D}}{{\rm{M}}_n} = \mathop \sum \limits_{n = 1}^{15000} \sqrt {{{({X_n} - {X_{n - 1}})}^2} + {{({Y_n} - {Y_{n - 1}})}^2}} $ |
| ${V_n} = \frac{{\sqrt {{{({X_n} - {X_{n - 1}})}^2} + {{({Y_n} - {Y_{n - 1}})}^2}} }}{{{t_n} - {t_{n - 1}}}}$ |
| ${A_n} = \frac{{{V_n} - {V_{n - 1}}}}{{{t_n} - {t_{n - 1}}}}$ |
式中,
转角(度)计算公式:
| ${\rm{RT}}{{\rm{A}}_n} = {\rm{Headin}}{{\rm{g}}_n} - {\rm{Headin}}{{\rm{g}}_{n - 1}}$ |
式中,
活跃度计算方法:拾取对象的每个像素,并在当前图像与上一图像之间逐一对比各像素。活跃度(频次)计算公式:
| ${\rm{C}}{{\rm{A}}_n} = ({A_n} - {A_{n - 1}}) + ({A_{n - 1}} - {A_n})$ |
| ${\rm{Activity}} = \frac{{{\rm{C}}{{\rm{A}}_n}}}{{{A_{n - 1}} + {A_n}}} \times 100$ |
式中,

|
图 2 |
活跃度具有3种可能状态:狂躁、活跃和静止,并根据活跃度与2个自定义阈值之间的关系,确定每个样本的活跃状态。本研究设定活跃度阈值为60%和20%。当身体面积的变化百分比高于60%时,为狂躁状态;当身体面积的变化百分比低于20%时,为静止状态;当身体面积的变化百分比介于二者之间时,为活跃状态。
对象间的距离(cm)计算公式:
| ${\rm{D}}{{\rm{S}}_n} = \sqrt {{{({X_{a, n}} - {X_{r, n}})}^2} + {{({Y_{a, n}} - {Y_{r, n}})}^2}} $ |
式中,
实验数据用SPSS 24.0软件进行独立样本t检验。采用重复测量多变量方差分析(MANOVA),以FF和SF为独立变量,检验2尾鱼在不同行为指标上的差异。对实验2中2尾幼鱼的行为参数进行Pearson相关性检验。处理结果均以P < 0.05为显著性水平。
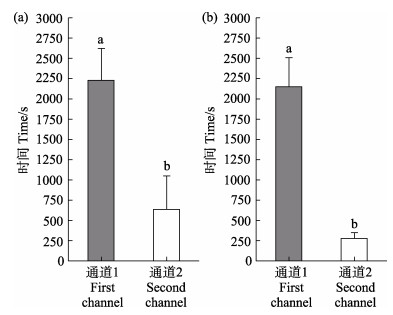
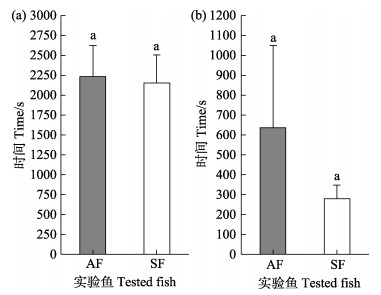
2 结果在整个实验过程中,实验2有2组无效数据被剔除。AF通过通道1的时间(T1)显著高于通过通道2的时间(T2) (P < 0.05),T1约为T2的4倍(图 3a)。由图 3b可知,SF通过通道1的时间(t1)也显著高于通过通道2的时间(t2) (P < 0.05),t1约为t2的8倍。分别对AF和SF通过通道1或通过通道2的时间进行比较,结果无显著差异(P > 0.05),但AF通过通道2的时间(T2)近乎是SF通过通道2的时间(t2)的2倍(图 4)。
|
图 3 实验鱼通过通道1和通道2的时间
Fig.3 Time for the tested fish to pass through the first and second channel
(a):单独的鱼;(b):无经验鱼 字母不同表示差异显著(P < 0.05) (a): AF; (b): SF Different letters mean significant differences (P < 0.05) |
|
图 4 AF和SF通过通道的时间
Fig.4 Time for AF and SF to pass through the channels
(a):通过通道1;(b):通过通道2; AF:单独的鱼;SF:无经验鱼。 相同字母表示差异不显著(P > 0.05) (a): Pass through the first channel; (b): Pass through the second channel; AF: Alone fish; SF: Second fish. Same letters mean no significant difference (P > 0.05) |
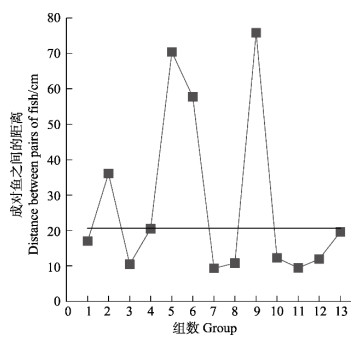
图 5表示实验2中2尾鱼首次相遇10 min内成对鱼间的平均距离。结果显示,若以鱼的平均全长为基线,13组实验中共有9组成对鱼的距离小于1倍平均全长(图 5)。除此之外,13组成对鱼之间的平均距离与鱼平均全长之间无显著差异(P > 0.05)。
|
图 5 首次相遇10 min内每对实验鱼之间的平均距离基于鱼的平均全长的分布情况 Fig.5 Distribution of the average distance between pairs of fish based on the mean total length of fish within 10 min after the first met 直线为鱼平均全长;正方形为每对实验鱼之间的平均距离 Straight line is the average total length of fish; square is the average distance between each pair of experimental fish |
对实验2中2尾鱼的行为参数进行重复测量多变量方差分析(MANOVA)可知,首次相遇10 min内2尾鱼之间的移动距离、速度、加速度、转角和活跃度均无显著差异(P > 0.05)。此外,对实验2的成对鱼首次相遇10 min内的行为参数进行Pearson相关性分析,结果如表 1所示,除成对鱼的加速度(最小值)为显著相关(P < 0.05)外,其他行为学参数,如移动距离、速度、加速度(最大值)、转角和活跃度均为极显著相关(P < 0.01)。
|
|
表 1 首次相遇10 min内成对鱼之间行为学参数相关性分析 Tab.1 Correlation analysis of behavioral parameters between pairs of fish within 10 min after the first met |
对实验2的成对鱼首次相遇10 min内的状态进行跟踪,结果如图 6所示。整体来讲,成对鱼的运动变化具有相似的趋势(图 6)。在FF和SF相遇6 min时,成对鱼的移动距离、速度和加速度(最大值)逐渐趋近相同值(图 6a、图 6b和图 6d)。成对鱼的加速度(最小值)和转角变化趋势无明显规律(图 6c和图 6e),除最后1 min内成对鱼的转角存在显著差异外(P < 0.05) (图 6e),其余成对鱼的转角结果均无显著差异。当有FF存在时,SF活跃度的变化趋势与FF相似(图 6f、图 6g和图 6h),特别是狂躁状态的结果,相遇3~7 min变化趋势基本一致(图 6f)。
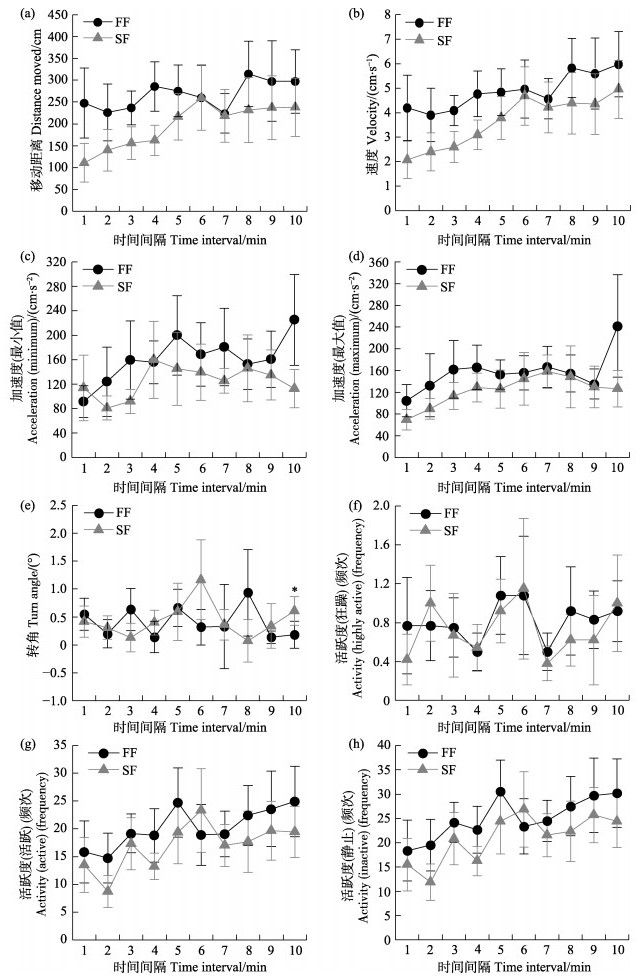
|
图 6 首次相遇10 min内成对鱼运动状态随时间间隔的变化 Fig.6 The changes of fish motion state within 10 min after the first met 加速度最小值取绝对值,*表示差异显著(P < 0.05) Acceleration minimum values takes absolute value; * represents significant difference (P < 0.05) |
鱼类和其他脊椎动物一样,具有复杂的认知行为,其中学习在这一过程中起着非常重要的作用(Brown et al, 2003; Laland et al, 2003)。鱼类通过学习获得经验,以适应周围的环境变化(Kieffer et al, 1992),改善自身的摄食性能(Warburton, 2003)以及提高性选择机率(Rystrom et al, 2019)等。在本研究中,无论是否存在有经验的鱼,AF和SF通过通道的时间T1(t1)都显著高于T2(t2),表明在特定环境背景下,AF和SF的学习能力表现出相似性,即经验的积累会显著提高完成任务的效率,对环境的适应性也会随时间的推移逐渐增强。在整个实验过程中,AF和SF通过通道1的时间较长,观察到AF和SF在通过通道2之前,在象限1和通道1之间多次徘徊,原因可能是鱼暴露在新环境中时,需要承担一定的风险(Huntingford et al, 2010),个体通过反复探索来了解周围环境(Braithwaite, 2006)。
已有研究结果显示,有经验的个体可以“领导”无经验的个体(Reebs, 2000),无经验个体发生跟随行为的原因可能是向有经验的个体学习,也可能是依赖其寻找食物或躲避敌害(Bshary et al, 2014)。在本研究中,分别对2个实验中AF和SF通过通道1或通道2的时间进行比较,结果均无显著差异(图 4),但SF通过通道的时间t2约为AF通过通道时间T2的1/2,表明有经验个体的存在能够在一定程度上提高欧洲舌齿鲈幼鱼的学习能力,即经验丰富个体的存在能够提高无经验个体完成任务的效率(Webster et al, 2017)。除此之外,鱼类的个性、对环境的感知能力或自身学习能力等因素对鱼类行为表现有很大的影响(Sneddon, 2003; Millot et al, 2014)。大胆的个体愿意为了获得食物或配偶承担一定的风险,而害羞的个体则选择避免风险(Chapman et al, 2010)。Mamuneas等(2015)研究也表明,与害羞的刺鱼(Gasterosteus aculeatus)相比,大胆的刺鱼探索新环境和获取信息的速度更快。这也可能是实验1中各重复组AF完成任务时间差异较大的原因(通过通道2的时间最快只需十几秒,而最慢的则超过1 h)。
图 5、图 6和表 1分析结果显示,成对鱼首次相遇10 min内的平均距离较近,同时,其游泳行为具有较强的同步性(例如,相似的变化趋势等),推测成对鱼之间可能存在信息传递,进而影响SF的学习效率。对于领地行为较强的鱼类来说,当2尾鱼相遇时,领地行为的胁迫也会导致2尾鱼的行为表现发生变化,例如,胁迫鱼的驱赶和被胁迫鱼的逃避等。但Pérez-Ruzafa等(2014)在对欧洲舌齿鲈行为生态学进行研究时发现,欧洲舌齿鲈不具有领地意识。因此,推测SF通过通道时间变短的原因,对于领地行为的胁迫来说,更多可能是由于学习行为导致。另外,已有研究表明,鱼类可通过视觉线索来获得重要信息(Strandburg-Peshkin et al, 2013; Lemasson et al, 2018),从而影响自身的行为决策。全事件观测法的结果显示,在多组实验中,FF首次与SF相遇后会多次往返于象限1和象限3之间。这一行为可能通过SF视觉感官对其调整自身行为起到刺激和示范作用(Rosenthal et al, 2015)。对成对鱼的行为表现进行观察时还发现,成对鱼在首次相遇时,FF会保持“警惕状态”,随后缓慢地靠近SF的泄殖孔部位或尾部,根据相关研究表明,鱼类可通过视觉信号、听觉信号、嗅觉信号或化学信号,如尿液(Keller-Costa et al, 2016)、胆盐(Buchinger et al, 2014)等进行信息传递,但这一过程的发生途径尚不清楚,还需继续开展相关实验加以验证。
本研究表明,有经验的个体能影响无经验个体的行为表现,但无经验个体在探索环境的过程中,自身可能会获得更复杂的信息。若要确切阐明成对鱼之间信息传递的方式及其机制,还需开展进一步研究,更系统地提供鱼类认知方面的理论基础,这些探索性工作将为进一步揭示鱼类的认知提供参考。
Alcazar RM, Hilliard AT, Becker L, et al. Brains over brawn: Experience overcomes a size disadvantage in fish social hierarchies. Journal of Experimental Biology, 2014, 217(9): 1462-1468 DOI:10.1242/jeb.097527 |
Benhaïm D, Péan S, Brisset B, et al. Effect of size grading on sea bass (Dicentrarchus labrax) juvenile self-feeding behaviour, social structure and culture performance. Aquatic Living Resources, 2011, 24(4): 391-402 DOI:10.1051/alr/2011140 |
Berdahl A, Torney CJ, Ioannou CC, et al. Emergent sensing of complex environments by mobile animal groups. Science, 2013, 339(6119): 574-576 DOI:10.1126/science.1225883 |
Braithwaite VA. Cognitive ability in fish. Fish Physiology, 2006, 24(5): 1-37 |
Brown C, Laland KN. Social learning in fishes: A review. Fish and Fisheries, 2003, 4(3): 280-288 DOI:10.1046/j.1467-2979.2003.00122.x |
Bshary R, Brown C. Fish cognition. Current Biology, 2014, 24(19): R947-R950 DOI:10.1016/j.cub.2014.08.043 |
Buchinger TJ, Li W, Johnson NS. Bile salts as semiochemicals in fish. Chemical Senses, 2014, 39(8): 647-654 DOI:10.1093/chemse/bju039 |
Cai L, Taupier R, Johnson D, et al. Swimming capability and swimming behavior of juvenile Acipenser schrenckii. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2013, 319(3): 149-155 DOI:10.1002/jez.1780 |
Chapman BB, Morrell LJ, Krause J. Unpredictability in food supply during early life influences boldness in fish. Behavioral Ecology, 2010, 21(3): 501-506 DOI:10.1093/beheco/arq003 |
Covès D, Beauchaud M, Attia J, et al. Long-term monitoring of individual fish triggering activity on a self-feeding system: An example using European sea bass (Dicentrarchus labrax). Aquaculture, 2006, 253(1-4): 385-392 DOI:10.1016/j.aquaculture.2005.08.015 |
Frommen JG. Aggressive communication in aquatic environments. Functional Ecology, 2020, 34(2): 364-380 DOI:10.1111/1365-2435.13482 |
Giaquinto PC, Volpato GL. Chemical communication, aggression, and conspecific recognition in the fish Nile tilapia. Physiology and Behavior, 1997, 62(6): 1333-1338 DOI:10.1016/S0031-9384(97)00347-8 |
Goodey W, Liley NR. The influence of early experience on escape behaviour in the guppy (Poecilia reticulata). Canadian Journal of Zoology, 1986, 64(4): 885-888 DOI:10.1139/z86-132 |
Hsu Y, Earley RL, Wolf LL. Modulating aggression through experience. In: Brown C, Laland K, Krause J. Fish cognition and behaviour. John Wiley and Sons, 2006, 96–113
|
Huntingford FA, Andrew G, Mackenzie S, et al. Coping strategies in a strongly schooling fish, the common carp Cyprinus carpio. Journal of Fish Biology, 2010, 76(7): 1576-1591 DOI:10.1111/j.1095-8649.2010.02582.x |
Keller-Costa T, Saraiva JL, Hubbard PC, et al. A multi-component pheromone in the urine of dominant male tilapia (Oreochromis mossambicus) reduces aggression in rivals. Journal of Chemical Ecology, 2016, 42(2): 173-182 DOI:10.1007/s10886-016-0668-0 |
Kieffer JD, Colgan PW. The role of learning in fish behaviour. Reviews in Fish Biology and Fisheries, 1992, 2(2): 125-143 DOI:10.1007/BF00042881 |
Kozak GM, Boughman JW. Experience influences shoal member preference in a species pair of sticklebacks. Behavioral Ecology, 2008, 19(3): 667-676 DOI:10.1093/beheco/arn022 |
Laland KN, Brown C, Krause J. Learning in fishes: From three-second memory to culture. Fish and Fisheries, 2003, 4(3): 199-202 DOI:10.1046/j.1467-2979.2003.00124.x |
Lemasson B, Tanner C, Woodley C, et al. Motion cues tune social influence in shoaling fish. Scientific Reports, 2018, 8(1): 9785 DOI:10.1038/s41598-018-27807-1 |
Liu LL, Zheng XX, You YL, et al. Experiment on the artificial propagation of Acrossocheilius hemispinus. Freshwater Fisheries, 2010, 40(2): 57-61 [刘丽丽, 郑欣欣, 尤永隆, 等. 半刺厚唇鱼的人工繁殖试验. 淡水渔业, 2010, 40(2): 57-61 DOI:10.3969/j.issn.1000-6907.2010.02.011] |
Lucon-Xiccato T, Santacà M, Petrazzini MEM, et al. Guppies, Poecilia reticulata, perceive a reversed Delboeuf illusion. Animal Cognition, 2019, 22(3): 291-303 DOI:10.1007/s10071-019-01237-6 |
Mamuneas D, Spence AJ, Manica A, et al. Bolder stickleback fish make faster decisions, but they are not less accurate. Behavioral Ecology, 2015, 26(1): 91-96 DOI:10.1093/beheco/aru160 |
Manassa RP, McCormick MI. Social learning and acquired recognition of a predator by a marine fish. Animal Cognition, 2012, 15(4): 559-565 DOI:10.1007/s10071-012-0484-z |
Millot S, Cerqueira M, Castanheira MF, et al. Behavioural stress responses predict environmental perception in European sea bass (Dicentrarchus labrax). PLoS One, 2014, 9(9): e108800 DOI:10.1371/journal.pone.0108800 |
Pérez-Ruzafa A, Marcos C. Ecology and distribution of Dicentrarchus labrax (Linnaeus 1758). Biology of European Sea Bass, 2014, 3-33 |
Ramasamy RA, Allan BJM, McCormick MI. Plasticity of escape responses: Prior predator experience enhances escape performance in a coral reef fish. PLoS One, 2015, 10(8): e0132790 DOI:10.1371/journal.pone.0132790 |
Reebs SG. Can a minority of informed leaders determine the foraging movements of a fish shoal?. Animal Behaviour, 2000, 59(2): 403-409 DOI:10.1006/anbe.1999.1314 |
Reiriz L, Nicieza AG, Brañta F. Prey selection by experienced and naive juvenile Atlantic salmon. Journal of Fish Biology, 1998, 53(1): 100-114 DOI:10.1111/j.1095-8649.1998.tb00113.x |
Rosenthal SB, Twomey CR, Hartnett AT, et al. Revealing the hidden networks of interaction in mobile animal groups allows prediction of complex behavioral contagion. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(15): 4690-4695 DOI:10.1073/pnas.1420068112 |
Rystrom TL, Bakker TCM, Rick IP. Mate assessment behavior is correlated to learning ability in female threespine sticklebacks. Current Zoology, 2019, 65(3): 295-304 DOI:10.1093/cz/zoz010 |
Shettleworth SJ. Animal cognition and animal behaviour. Animal Behaviour, 2001, 61(2): 277-286 DOI:10.1006/anbe.2000.1606 |
Shohet AJ, Watt PJ. Female guppies Poecilia reticulata prefer males that can learn fast. Journal of Fish Biology, 2009, 75(6): 1323-1330 DOI:10.1111/j.1095-8649.2009.02366.x |
Sneddon LU. The bold and the shy: Individual differences in rainbow trout. Journal of Fish Biology, 2003, 62(4): 971-975 DOI:10.1046/j.1095-8649.2003.00084.x |
Strandburg-Peshkin A, Twomey CR, Bode NWF, et al. Visual sensory networks and effective information transfer in animal groups. Current Biology, 2013, 23(17): R709-R711 DOI:10.1016/j.cub.2013.07.059 |
Swaney W, Kendal J, Capon H, et al. Familiarity facilitates social learning of foraging behaviour in the guppy. Animal Behaviour, 2001, 62(3): 591-598 DOI:10.1006/anbe.2001.1788 |
Vega-Trejo R, O'Dea RE, Jennions MD, et al. The effects of familiarity and mating experience on mate choice in mosquitofish, Gambusia holbrooki. Behavioral Ecology, 2014, 25(5): 1205-1211 DOI:10.1093/beheco/aru113 |
Warburton K. Learning of foraging skills by fish. Fish and Fisheries, 2003, 4(3): 203-215 DOI:10.1046/j.1467-2979.2003.00125.x |
Ware DM. Predation by rainbow trout (Salmo gairdneri): The effect of experience. Journal of the Fisheries Board of Canada, 1971, 28(12): 1847-1852 DOI:10.1139/f71-279 |
Webster MM, Whalen A, Laland KN. Fish pool their experience to solve problems collectively. Nature Ecology and Evolution, 2017, 1(5): 0135 DOI:10.1038/s41559-017-0135 |
Zhang PF, Chang Q, Chen SQ, et al. Diet feeding rhythm and analysis of gastric evacuation associated mathematical models in juvenile Thamnaconus septentrionalis. Progress in Fishery Sciences, 2020, 41(1): 104-111 [张鹏飞, 常青, 陈四清, 等. 绿鳍马面鲀幼鱼昼夜摄食节律及胃排空模型研究. 渔业科学进展, 2020, 41(1): 104-111] |
Zhou CW, Lei L, Deng XX, et al. Cloning, tissue expression profiling, functional characterization of corticotropin-releasing hormone (crh) on feeding in gibel carp (Carassius auratus gibelio). Progress in Fishery Sciences, 2019, 40(3): 69-79 [周朝伟, 雷骆, 邓星星, 等. 银鲫crh基因的克隆、组织表达谱及其对摄食的影响. 渔业科学进展, 2019, 40(3): 69-79] |



