2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071;
3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Qingdao 266071;
3. Laboratory of Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071
牡蛎礁被誉为温带地区的"珊瑚礁",在净化水体、提供鱼类生境及维持生物多样性等方面均具有重要的生态功能。近几十年来,过度捕捞、环境污染、围海造地和病害浸染使世界温带河口和滨海区野生牡蛎资源量急剧下降,牡蛎礁生境遭到破坏,面积减小或丧失(Beck et al, 2016; Jackson et al, 2001),牡蛎礁生态修复已经成为海洋生态系统保护和恢复的研究热点。除此之外,地表径流激增引发的河口区海水盐度骤降,严重威胁区域内牡蛎等贝类的养殖及牡蛎礁修复。2018~2019年,降雨和地表径流对山东省潍坊小清河口区牡蛎产生重要影响,在降水密集、盐度降低幅度大的月份,长牡蛎(Crassostrea gigas)的死亡率高于近江牡蛎(Crassostrea ariakensis)。
长牡蛎俗称太平洋牡蛎,是一种广温、广盐性双壳贝类,是我国沿海地区的重要养殖经济贝类。近江牡蛎广泛分布于我国沿海(北自中朝边界的蜊子江,南至海南岛),是我国河口区牡蛎礁的核心种,曾一度认为在我国北方濒临功能性灭绝。牡蛎具有超强的过滤功能,被称为海洋工程师,在沿岸带生态保护和修复中具有重要功能。贝类的生物能量学与其呼吸、代谢、滤食和摄食等生命活动密切相关,滤水、摄食和呼吸代谢受水温、饵料浓度等多种环境因子的影响,是反映滤食性贝类生理状况的重要指标,也是评估贝类养殖容量的必要参数(包杰等, 2013; Mao et al, 2006)。盐度是影响滤食性贝类摄食和代谢的一个重要环境因子,低盐会影响牡蛎的正常生理代谢包括摄食、免疫活性及生长,甚至引起大规模死亡(宫建文等, 2019)。本研究从能量代谢角度,探讨了近江牡蛎和长牡蛎对盐度骤变的响应机制,旨在为牡蛎礁修复和养殖生产过程中的品种选择提供参考。
1 材料与方法 1.1 实验材料实验所用牡蛎为2龄贝,生物学参数见表 1。长牡蛎取自桑沟湾牡蛎养殖区,近江牡蛎于2018年在山东省莱州湾海域人工育苗养殖获得。2019年6月采集2种牡蛎,经分离、清洁壳表面污物和附着物后,放置在桑沟湾楮岛实验基地所属养殖区暂养。实验前7 d,取回2种牡蛎,置于室内水族箱中微流水暂养,暂养水温为(21.5±0.3)℃,海水盐度为29.0±0.1。
|
|
表 1 2种牡蛎的生物学数据 Tab.1 Biological parameters of two species of oyster |
2018~2019年,在莱州湾小清河河口区,牡蛎礁恢复工作中监测到降雨和上游河水注入,使该区域盐度骤降到10甚至更低,致使长牡蛎大量死亡。本研究根据盐度的降低情况,设计了2个低盐度梯度,分别为10和20,自然海水作为对照组(盐度约为29),利用淡水和自然海水不同配比调至所需盐度,使用流水装置开展实验,随机挑选不同规格的近江牡蛎和长牡蛎若干。
1.3 耗氧率和排氨率测定随机选取状态良好的3只牡蛎放入400 ml的呼吸瓶中,流水保持水体中溶解氧(DO)充足,待牡蛎壳张开时即盖上呼吸瓶的盖子,实验持续2 h。每组实验中呼吸瓶的水环境与上述盐度设置的水环境相同,以不加牡蛎的呼吸瓶作为对照,每个盐度处理组设3个平行,3个对照。测定实验前后呼吸瓶中溶解氧和氨氮(NH4+-N)的浓度,DO使用溶氧仪(德国, PreSens, OXY-4mini)测定,NH4+-N采用次溴酸盐氧化法测定。根据始末DO和NH4+-N浓度的变化计算耗氧率(Oxygen consumption rate, OR, mg/h)和排氨率(Ammonia excretion rate, NR, μmol/h)。实验结束后,用游标卡尺测量牡蛎的规格(壳长、壳高和壳宽),称量湿重,后用解剖刀将软组织与壳分开,测其软体部湿重,并在60℃烘箱烘干48 h后称软组织干重。按以下方法计算耗氧率和排氨率:
| $ {\rm{OR}} = \left({{\rm{D}}{{\rm{O}}_0} - {\rm{D}}{{\rm{O}}_t}} \right) \times V/t $ |
式中,OR为归一化后(20 g)的耗氧率,DO0和DOt分别为实验开始和结束时实验水中DO的含量(mg/L),V为呼吸瓶容积(L),t为实验持续时间(h)。
| $ {\rm{NR}} = \left({{N_0} - {N_t}} \right) \times V/t $ |
式中,NR为归一化后(20 g)排氨率,N0和Nt分为空白组与实验组的NH4+-N浓度(μmol/L)。
氧氮比(O∶N)指呼吸消耗氧原子数与排出氨态氮原子数之比,按下式计算:
| $ {\rm{O}}:{\rm{N}} = \left({{\rm{OR}}/16 \times 1000} \right)/{\rm{NR}} $ |
采用流水装置进行滤水实验(王晓芹等, 2019)。根据生物沉积法测定滤食性动物滤水率(周毅等, 2002),每种牡蛎每个盐度处理设置3个平行,每个平行放入3只牡蛎,自然海水作为对照(3个平行),实验在50 L流水槽中进行,实验时间为24 h,实验结束后,收集粪便,分离假粪。测定实验前后水体和粪便中的总颗粒物浓度(PIM)和颗粒有机物(POM)浓度,计算无机颗粒物浓度:
| $ {\rm{PIM}} = {\rm{TPM}}--{\rm{POM}} $ |
POM和TPM采用GF/C膜过滤,采用灼烧法测定,详见海洋监测规范(GB 17378-2007)。
| $ {\rm{IFR}} = {\rm{IBD}} $ | (1) |
| $ {\rm{CR}} = {\rm{IFR}}/{\rm{PIM}} = {\rm{IBD}}/{\rm{PIM}} $ | (2) |
| $ \begin{array}{*{20}{l}} {{\rm{FR}} = {\rm{CR}} \times {\rm{TPM}} = {\rm{IBD}} \times {\rm{TPM}}/{\rm{PIM}}} \end{array} $ | (3) |
式中,IFR和IBD为贝类对海水中无机物的过滤速率和生物沉积速率,CR (Clearance rate)和FR (Filtration rate)分别为滤水率和滤食率。当颗粒物浓度很高以致引起假粪产生时,摄食率需减去假粪的排出速率。
1.5 能量代谢测定贝类能量收支方程:
式中,C为摄食能,G为生长能,R为呼吸能,U为排泄能,F为排粪能。C、R、U和F分别通过食物中POM、呼吸率、排泄率和粪便中POM计算,采用的能量转换因子为1 mg POM=20.78 J、1 mg O2= 14.24 J、1 μmol氨氮=0.34 J,生长能通过上式计算。
1.6 代谢率的归一化处理由于近江牡蛎和长牡蛎成体个体差异较大,为比较2种牡蛎对盐度骤降胁迫的差异响应,对2种牡蛎的代谢率进行归一化处理。测定不同盐度梯度下,不同规格的长牡蛎和近江牡蛎单位个体代谢指标(耗氧率、排氨率、排粪率和摄食率),建立各代谢指标与牡蛎总湿重的相关方程,方程符合幂指数函数:
| $ Y = {\rm{a}}{W^{\rm{b}}} $ |
式中,Y为代谢速率;W为湿重;a和b为系数。
对2种牡蛎的规格实验进行统计比较,选择湿重为20 g时进行归一化处理,计算2种牡蛎在湿重为20 g时的代谢率指标,并通过能量转换因子和贝类能量收支方程计算呼吸能、排泄能、排粪能和生长能(见1.5),建立不同盐度的能量收支方程。
1.7 数据分析使用Excel 2013和SPSS 18.0软件进行数据分析和作图,实验结果采用平均值±标准差(Mean±SD)表示,采用单因素方差(One-way ANOVA)进行数据分析,以P < 0.05为不同处理组间差异显著。
2 结果 2.1 代谢率与体重(湿重)的相关方程2种牡蛎的摄食率、耗氧率、排氨率、排粪率与总湿重相关,且符合幂指数关系:Y=aWb,相关系数见表 2。从表 2可以看出,2种牡蛎的系数b都小于1,近江牡蛎的系数b范围为0.3669~0.9369,长牡蛎的系数b范围为0.1954~0.9641。
|
|
表 2 不同盐度下2种牡蛎代谢率与湿重关系 Tab.2 Allometric relationships of metabolic rate to wet weight of two oysters under different salinity |
根据湿重和耗氧率的相关方程对2种牡蛎的耗氧率进行归一化处理,计算湿重为20 g时,2种牡蛎的耗氧率(图 1)。从图 1可以看出,盐度对近江牡蛎和长牡蛎的耗氧率均有显著影响(P < 0.05)。长牡蛎的耗氧率在盐度为10时最低,为0.008 mg/h,对照组的耗氧率最高,为0.13 mg/h。而近江牡蛎的耗氧率在盐度为20时最高,为0.25 mg/h。
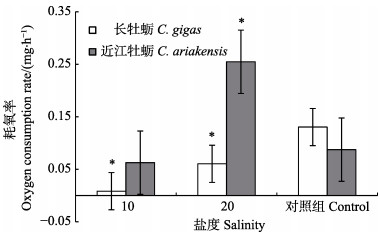
|
图 1 不同盐度对牡蛎耗氧率的影响 Fig.1 Effects of salinity on oxygen consumption rate of oysters *为同一种牡蛎不同盐度处理组与对照组之间差异显著(P < 0.05),下同 * represents significant difference between treatment groups and control group (P < 0.05), the same as below |
盐度对近江牡蛎和长牡蛎排氨率的影响差异显著(P < 0.05),在盐度为10和20时,长牡蛎排氨率较低,在对照组中,排氨率达到最大值,为4.19 μmol/h。而近江牡蛎的排氨率在盐度为20时最高,为3.98 μmol/h (图 2)。

|
图 2 不同盐度对牡蛎排氨率的影响 Fig.2 Effects of salinity on ammonia excretion rates of oysters |
长牡蛎呼吸排泄的O∶N值波动范围为5.5~9.4 (图 3),O∶N值在盐度为10和20时相近且低于对照组;而近江牡蛎不同盐度之间的O∶N值均有显著差异(P < 0.05),在盐度为20时,近江牡蛎的O∶N值最大,为24.2。
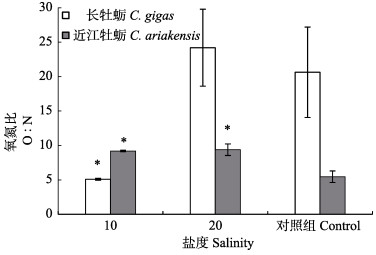
|
图 3 不同盐度对牡蛎O∶N的影响 Fig.3 Effects of salinity on O: N of oysters |
盐度对长牡蛎的摄食率和排粪率均具有显著影响(P < 0.05),近江牡蛎在盐度为10和20时,摄食率无显著差异(P > 0.05)。长牡蛎在盐度为10和20时,摄食率和排粪率均低于对照组,而近江牡蛎的摄食率和排粪率在盐度为20时最高,分别为1.90和0.73 mg/h (图 4和图 5)。
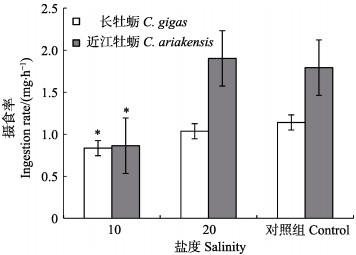
|
图 4 不同盐度对牡蛎摄食率的影响 Fig.4 Effects of salinity on ingestion rates of oysters |

|
图 5 不同盐度对牡蛎排粪率的影响 Fig.5 Effects of salinity on feces production rate of oysters |
长牡蛎在盐度为10时摄食能最低,为0.37 J/(g·h),而近江牡蛎在盐度为20时摄食能最高,为1.97 J/(g·h),且近江牡蛎在盐度为20时,呼吸能、排泄能、排粪能及生长余能均达到最大。长牡蛎和近江牡蛎在响应盐度骤降胁迫时,二者的能量收支差异明显(表 3)。
|
|
表 3 不同盐度下长牡蛎和近江牡蛎的能量收支方程 Tab.3 Energy budget equation of two species of oyster under different salinities |
贝类的摄食和代谢受多种环境因子的影响,盐度是决定海洋贝类分布并影响其生理代谢的重要环境因子之一(陈丽梅等, 2007)。这是因为贝类属于变渗透压动物,当盐度发生变化时,需要消耗大量能量用于维持渗透压平衡,能量分配也发生变化(杜美荣等, 2007)。盐度主要通过影响海洋贝类的胞内等渗调节、新陈代谢、消化吸收效率、免疫能力等控制个体的生长、发育、数量消长和分布等(许岚等, 2017)。
3.1 不同盐度下近江牡蛎和长牡蛎归一化处理系数的变化动物的体型关系通常符合异速生长模型,一般符合幂指数方程:Y=aWb,其中,系数a和b是由方程两边分别取对数,再进行线性回归计算,系数b被称为功能常数,系数a指单位体重的代谢速率,与种类有关。最重要的体型关系是呼吸作用,即耗氧量或CO2产量,其中,单细胞生物的系数b约为0.66,恒温动物约为0.88,变温动物约为0.69(Kooijman, 1986)。本研究中,2种牡蛎的摄食率、耗氧率、排氨率、排粪率与总湿重的关系均可用幂函数式Y=aWb表示,与Bayne等(1976、1973)的研究结果相一致,系数b的范围一般为0.40~0.75。本研究中,近江牡蛎在不同盐度下,b值的变化在0.3669~0.9369之间,长牡蛎在不同盐度下b值的变化在0.1954~0.9641之间。长牡蛎在盐度为10时,摄食率b值最低,可能与长牡蛎在低盐条件下贝壳出现部分或全部关闭现象有关(Djangmah et al, 1979),导致单位体重摄食率较低。
3.2 盐度对近江牡蛎和长牡蛎能量代谢的影响盐度是影响贝类生理代谢及其分布规律的环境因子之一。研究表明,盐度通过影响贝类鳃纤毛运动(Berger et al, 1997)、心脏跳动、附着力等生理代谢,进而导致贝类选择性分布。不同贝类对盐度的变化具有一定的适应范围,过高或过低的盐度都将影响贝类的正常代谢(吕昊泽等, 2016)。
本研究中,长牡蛎与近江牡蛎对盐度的适应范围不同,长牡蛎在自然海水中(盐度约为29)的代谢率相对较高,而近江牡蛎在盐度为20时的代谢率相对较高,研究结果与姚托等(2015)对2种牡蛎稚贝生长的研究结果一致。以耗氧率为例,在自然海水中,长牡蛎耗氧率最大,在盐度为10时最低,与王芳等(2003)对长牡蛎的研究结果一致。在盐度为15~35范围内,长牡蛎耗氧率随盐度的升高而增大,其原因可能是因为在低盐度条件下,贝壳会出现部分或全部关闭现象(Djangmah et al, 1979)。本研究也观察到长牡蛎在盐度为10时,出现闭壳和个别个体死亡现象,可能无法迅速适应骤降的低盐环境,导致代谢紊乱,甚至死亡,其主要原因是盐度骤变引起海水渗透压的改变超出了贝类自身调节能力所致(刘志刚等, 2006)。
O∶N值的大小反映了动物特定状态下机体脂肪和糖类与蛋白质分解代谢的比率,可作为机体适应环境压力的指标(焦海峰等, 2017)。当机体以蛋白质代谢为主要供能方式时,其代谢产物以氨的形式释放,O∶N值较低;如果由脂肪和碳水化合物供能,O∶N值约为24。本研究中,盐度为20时,对照组中长牡蛎O∶N值较高,盐度降低时,O∶N值下降,这表明在低盐环境下,长牡蛎蛋白质代谢比例增大。近江牡蛎在各盐度处理组的O∶N值都低于长牡蛎,可能是归一化引起的个体差异,但相对于低盐度,其在高盐度下O∶N值更低。
盐度骤降对近江牡蛎影响的研究相对较少,主要涉及到个体免疫(Xu et al, 2012)、敌害生物、生态毒理和倍性等,也有少数研究涉及到其生理特性(Audemard et al, 2008)。本研究中,近江牡蛎的代谢率在盐度为20时较高,说明该盐度是近江牡蛎较适宜的盐度,这与姚托等(2015)的研究结果相一致,表明近江牡蛎的最适盐度范围为10~25。
本研究在模拟现场条件下,建立了2种牡蛎在不同盐度下的能量收支方程可以看出,2种牡蛎在不同盐度下的能量分配不同,长牡蛎在低盐下呼吸能非常低,说明受到盐度骤降的胁迫较大,而近江牡蛎在低盐下的生长能相对较高。本研究采用生物沉积物法建立能量方程中的生长能相对于自然环境中较高,可能由于自然海水中饵料浓度相对较低,产生一定误差。但从能量代谢的角度分析,长牡蛎在自然海水中代谢速率较高,而近江牡蛎更能适应低盐环境。
Audemard C, Carnegie RB, Bishop MJ, et al. Interacting effects of temperature and salinity on Bonamia sp. parasitism in the Asian oyster Crassostrea ariakensis. Journal of Invertebrate Pathology, 2008, 98(3): 344-350 |
Bao J, Jiang HB, Dong SL, et al. Comparison of oxygen consumption rate and ammonia-N excretion rate between green type and red type Apostichopus japonicus. Journal of Fisheries of China, 2013, 37(11): 1689-1696 [包杰, 姜宏波, 董双林, 等. 红刺参和青刺参耗氧率与排氨率的比较研究. 水产学报, 2013, 37(11): 1689-1696] |
Bayne BL. Physiological changes in Mytilus edulis L. induced by temperature and nutritive stress. Journal of the Marine Biological Association of the United Kingdom, 1973, 53(1): 39-58 DOI:10.1017/S0025315400056629 |
Bayne BL, Bayne CJ, Carefoot T, et al. The physiological ecology of Mytilus californianus Conrad. 2. Adaptations to low oxygen tension and air exposure. Oecologia, 1976, 22(3): 229-250 DOI:10.1007/BF00344793 |
Beck MW, Brumbaugh RD, Airoldi L, et al. Oyster reefs at risk and recommendations for conservation, restoration, and management. Biology Science, 2011, 61(2): 107-116 |
Berger VJ, Kharazova AD. Mechanisms of salinity adaptations in marine mollusc. Hydrobiologia, 1997, 355(1-3): 115-126 |
Brett JR, Groves TD. Physiological energetics in fish physiology. New York: Academic Press, 1979, 279-352 |
Chen LM, Ren YP, Xu BD. Effects of environmental factors on the clearance rate of the transplant enhanced Manila clam (Ruditapes philippinarum) in the Jiaozhou Bay. South China Fisheries Science, 2007, 3(2): 30-35 [陈丽梅, 任一平, 徐宾铎. 环境因子对胶州湾移植底播菲律宾蛤仔滤水率的影响. 南方水产, 2007, 3(2): 30-35 DOI:10.3969/j.issn.2095-0780.2007.02.006] |
Djangmah JS, Shumway SE, Davenport J. Effects of fluctuating salinity on the behaviour of the West African blood clam Anadara senilis and on the osmotic pressure and ionic concentrations of the haemolymph. Marine Biology, 1979, 50(3): 209-213 DOI:10.1007/BF00394202 |
Du MR, Fang JG, Ge CZ, et al. Effects of salinities and microalgae densities on filtration rates of scallop Chlamys farreri spats. Progress in Fishery Sciences, 2009, 30(3): 74-78 [杜美荣, 方建光, 葛长字, 等. 盐度和饵料密度对栉孔扇贝稚贝滤水率的影响. 渔业科学进展, 2009, 30(3): 74-78 DOI:10.3969/j.issn.1000-7075.2009.03.013] |
Gong JW, Li Q, Yu H, et al. Screening and validation of internal reference genes by quantitative PCR under normal and low salt stress in rock oyster. Chinese Journal of Fisheries, 2019, 26(4): 657-663 [宫建文, 李琪, 于红, 等. 岩牡蛎正常和低盐胁迫下定量PCR内参基因的筛选与验证. 中国水产科学, 2019, 26(4): 657-663] |
Ikeda T. Nutritional ecology of marine zooplankton. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 1-97 |
Jackson JBC, Kirby MX, Berger WH, et al. Historical overfishing and the recent collapse of coastal ecosystems. Science, 2001, 293(5530): 629-637 DOI:10.1126/science.1059199 |
Jiao HF, Zheng D, Yan QN, et al. Effects of water temperature and salinity on oxygen consumption rate and ammonia excretion rate of Saccostrea cucullata. Acta Ecologica Sinica, 2017, 37(2): 692-699 [焦海峰, 郑丹, 严巧娜, 等. 温度、盐度及交互作用对僧帽牡蛎(Saccostrea cucullata)呼吸排泄的影响. 生态学报, 2017, 37(2): 692-699] |
Kooijman SALM. Energy budgets can explain body size relations. Journal of Theoretical Biology, 1986, 121(3): 269-282 DOI:10.1016/S0022-5193(86)80107-2 |
Liu JY, Yu DH, Li JB. Effects of salinity and pH on oxygen consumption and ammonia excretion rates in Pinctada fucata. Oceanologia et Limnologia Sinica, 2011, 42(4): 603-607 [刘建业, 喻达辉, 李金碧. 盐度和pH对合浦珠母贝(Pinctada fucata)耗氧率和排氨率的影响. 海洋与湖沼, 2011, 42(4): 603-607] |
Liu Y, Shi KT, Zhang SH, et al. Advancement of respiratory metabolism study in bivalve molluscs. South China Fisheries Science, 2007, 3(4): 65-69 [刘勇, 施坤涛, 张少华, 等. 贝类呼吸代谢的研究进展. 南方水产, 2007, 3(4): 65-69 DOI:10.3969/j.issn.2095-0780.2007.04.011] |
Lü HZ, Liu J, Chen JH, et al. Effects of salinity on the filtration rate, feeding rate and assimilation rate of three filter feeding shellfish in the Changjiang estuary. Marine Sciences, 2016, 40(8): 10-17 [吕昊泽, 刘健, 陈锦辉, 等. 盐度对长江口3种滤食性贝类滤水率、摄食率、同化率的影响. 海洋科学, 2016, 40(8): 10-17] |
Liu ZG, Liu JY, Wang H, et al. Study on salinity adaptability of juvenile scallops in Gulf of Mexico. Journal of Zhanjiang Ocean University (Natural Science), 2006, 26(6): 12-16 [刘志刚, 刘建勇, 王辉, 等. 墨西哥湾扇贝稚贝盐度适应性的研究. 湛江海洋大学学报(自然科学版), 2006, 26(6): 12-16] |
Mao YZ, Zhou Y, Yang HS, et al. Seasonal variation in metabolism of cultured Pacific oyster, Crassostrea gigas, in Sanggou Bay, China. Aquaculture, 2006, 253(1-4): 322-333 DOI:10.1016/j.aquaculture.2005.05.033 |
Mayzaud P. Respiration and nitrogen excretion of zooplankton. Ⅳ. The influence of starvation on the metabolism and the biochemical composition of some species. Marine Biology, 1976, 37(1): 47-58 |
Wang F, Dong SL, Zhang S, et al. Experimental studies on feeding selectivity and the filter-feeding rate of Argopecten irradians and Crassostrea gigas. Oceanologia et Limnologia Sinica, 2000, 31(2): 139-144 [王芳, 董双林, 张硕, 等. 海湾扇贝和太平洋牡蛎的食物选择性及滤除率的实验研究. 海洋与湖沼, 2000, 31(2): 139-144 DOI:10.3321/j.issn:0029-814X.2000.02.005] |
Wang F, Wang ZP, Dong SL, et al. Marine sciences effects of salinity on respiration and excretion of diploid and triploid oysters Crassostrea gigas. Marine Science, 2003, 27(6): 73-76 [王芳, 王昭萍, 董双林, 等. 盐度对二倍体和三倍体长牡蛎呼吸和排泄的影响. 海洋科学, 2003, 27(6): 73-76 DOI:10.3969/j.issn.1000-3096.2003.06.018] |
Wang XQ, Wu YL, Fang JH, et al. Effects of acidification stress on the energy distribution of Mytilus galloprovincialis. Progress in Fishery Sciences, 2019, 40(3): 21-30 [王晓芹, 吴亚林, 房景辉, 等. 海水酸化胁迫对紫贻贝能量分配的影响. 渔业科学进展, 2019, 40(3): 21-30] |
Yao T, Wang ZP, Yan XW, et al. Effect of salinity on growth and survival of Crassostrea gigas, C.ariakensis and juvenile hybrids.. Acta Ecologica Sinica, 2015, 35(5): 1581-1586 [姚托, 王昭萍, 闫喜武, 等. 盐度对长牡蛎和近江牡蛎及其杂交稚贝生长和存活的影响. 生态学报, 2015, 35(5): 1581-1586] |
Xu L, Li Q, Kong LF, et al. Effects of temperature and salinity on the growth and survival of larva of Crassostrea gigas. Journal of Ocean University of China (Natural Science), 2017, 47(8): 44-50 [许岚, 李琪, 孔令锋, 等. 温度和盐度对壳黑长牡蛎幼虫生长和存活的影响. 中国海洋大学学报(自然科学版), 2017, 47(8): 44-50] |
Xu T, Xie J, Li J, et al. Identification of expressed genes in cDNA library of hemocytes from the RLO-challenged oyster, Crassostrea ariakensis Gould with special functional implication of three complement-related fragments (CaC1q1, CaC1q2 and CaC3). Fish and Shellfish Immunology, 2012, 32: 1106-1116 DOI:10.1016/j.fsi.2012.03.012 |
Yang XX, Lin XT, Ji XL, et al. Influences of temperature, salinity and illumination on clearance rate of Perna viridis (Linnaeus). Marine Sciences, 2000, 24(6): 36-38 [杨晓新, 林小涛, 计新丽, 等. 温度、盐度和光照条件对翡翠贻贝清滤率的影响. 海洋科学, 2000, 24(6): 36-38 DOI:10.3969/j.issn.1000-3096.2000.06.011] |
Zhou Y, Mao YZ, Yang HS, et al. Biodeposition method used in bivalval physio-ecological studies. Chinese Journal of Ecology, 2002, 21(6): 74-76 [周毅, 毛玉泽, 杨红生, 等. 应用于贝类生理生态学研究的生物沉积法. 生态学杂志, 2002, 21(6): 74-76 DOI:10.3321/j.issn:1000-4890.2002.06.018] |



