2. 中国科学院大学 北京 100049;
3. 中国科学院南海生态环境工程创新研究院 广州 510301
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Institution of South China Sea Ecology and Environmental Engineering, Chinese Academy of Sciences, Guangzhou 510301
糙海参(Holothuria scabra)是一种具有较高营养价值、药用价值及经济价值的棘皮动物(廖玉麟, 1997)。20世纪80年代以来,随着沿海经济快速发展,糙海参的近海栖息生境遭到严重破环,海洋环境条件不断恶化。目前,广西和广东沿海的野生糙海参种群已基本绝迹,华南沿海仅海南东部有少量的野生资源(杨学明等, 2015)。糙海参已被世界自然保护联盟濒危物种红色名录(IUCN红色名录)列为濒危物种(Lovatelli et al, 2004)。因此,人工繁育和养殖糙海参对于恢复糙海参资源显得尤为重要。在人工繁育过程中,糙海参的雌、雄辨别能在很大程度上优化人工繁育过程,但糙海参在外表上无法分辨雌雄(Conand, 1998)。关于海参雌雄差异的研究只在仿刺参(Apostichopus japonicus)上有少数相关报道,有研究构建了仿刺参性别特异性图谱,展示了染色体重组率的性别差异(Tian et al, 2015; Yan et al, 2013);Jiang等(2019)根据检测产卵前后雌雄仿刺参体腔细胞转录组的免疫特征,描述了仿刺参性别特异性免疫差异,并发现脂肪酸组成可能是导致雌雄免疫差异的原因之一,然后通过蛋白组学揭示了仿刺参繁殖期间体液免疫和生理特性的性别差异,并表示雄性在产卵后可能会具有更强的恢复能力(Jiang et al, 2020)。但关于糙海参性别差异的研究尚属空白。因此,对于糙海参性别差异的研究有助于改良糙海参的人工繁育过程,并为糙海参性别决定机制的研究奠定基础。
代谢组学是一门研究生物体内各种生物化学过程的新兴学科,它主要聚焦于生物体内发生的生物化学过程所产生的代谢物,能够帮助研究者了解在某种生物体内已经发生的过程和变化,如代谢通路、能量传递和细胞通信等(Nicholson et al, 2002)。影响代谢物产生的因素有很多,如环境因素、生物体内部因素和饮食因素等,性别差异属生物体内部因素,不同性别的同种生物,其体内代谢物和性激素水平有很大差异。在不了解海参性别决定机制的情况下,对海参雌、雄亲参的代谢物差异进行研究,可以帮助了解雌、雄海参性别特异性化学过程和变化(Schock et al, 2010)。迄今已有很多关于水产动物代谢物具有性别特异的相关报道。Kleps等(2007)发现,性别特异性代谢物AEP (2-Aminoethyl phosphonate)仅存在于雄性蓝蟹(Callinectes sapidus)的鳃中,该代谢物可能发挥交配信息素的功能。一些研究发现,贻贝的外套膜脂质含量随繁殖周期的变化具有雌雄差异(Hines et al, 2007; Jabbar et al, 1987; Lubet et al, 1986);Aru等(2017)使用1H-NMR技术探究了欧洲蛤仔(Ruditapes decussatus)受季节影响的代谢变化,发现了一些性别特异性候选分子标记,发现雄性蛤仔代谢物中的丙氨酸和甘氨酸含量显著高于雌性蛤仔,而乙酰乙酸、胆碱和磷酸胆碱在雌性蛤仔代谢物中的含量较高;克氏螯虾(Cherax tenuimanus)的血淋巴代谢组研究表明,由于生殖活动或生活史的差异,雌、雄克氏螯虾的代谢物具有显著差异(Lette et al, 2020)。然而,关于海参性别差异代谢物研究目前尚属空白。海参体腔液浸泡着海参所有内脏(Conand, 1998),可能发挥物质运输和细胞信号传递(Laires, 2012)、性腺发育营养物和催产信息素贮存(Mercier et al, 2002)的功能,因此,海参体腔液可能参与性腺的分化和发育。
本研究以热带糙海参为研究对象,针对雌、雄亲参的体腔液进行代谢组学研究,对性别差异代谢物进行分析,推测可能存在的性别间差异代谢通路,以期为糙海参性别决定机制以及性别鉴定提供有用的基础数据。
1 材料与方法 1.1 体腔液样本采集糙海参亲参来源于湛江市美珍种苗有限公司。通过组织学切片鉴定糙海参性别后,选取雌、雄亲参各6头,进行体腔液样本采集。将采集的体腔液先用100 μm细胞筛过滤以除去组织碎屑,随后在4℃、12000 r/min条件下离心10 min,以确保体腔细胞及其他微小杂质被完全清除,最后将上清液转移至50 ml离心管中,在–80℃冰箱中冷冻保存备用。
1.2 体腔液样本处理将体腔液样本置于4℃下融化,每个样本各取10 ml,冻干成粉末。向每个冻干样本中分别加入5 ml乙腈溶液,震荡混匀1 min。在4℃、12000 r/min条件下离心10 min后,吸取450 μl上清液转移至新的1.5 ml离心管中,真空浓缩干燥。加入150 μl含有2-氯苯丙氨酸(4 mg/L)的50%乙腈溶液重新溶解上述已浓缩干燥的上清液,通过0.22 μm膜过滤,获得待测样本。从每个待测样本中各取20 μl溶液混合成质量控制(QC)样本,用于校正分析结果的偏差及由于分析仪器原因所造成的失误。其余样品用于LC-MS检测。
1.3 LC-MS检测进样顺序:加入混标溶液用于检测仪器状态,仪器状态良好后,加入QC样品用于稳定仪器,然后再依次加入空白溶剂(阴性对照)和待测样品,每10个样本加入1针QC样本。
色谱条件:仪器采用Thermo Ultimate 3000,使用ACQUITY UPLC® HSS T3 1.8 µm (2.1×150 mm)色谱柱,自动进样器温度设为8℃,以0.25 ml/min的流速、40℃的柱温以及进样2 μl进行梯度洗脱,流动相为正离子0.1%甲酸水(D)–0.1%甲酸乙腈(C)和负离子5 mmol/L甲酸铵水(B)–乙腈(A)。梯度洗脱程序:0~1 min,2% A/C;1~9 min,2%~50% A/C;9~12 min,50%~98% A/C;12~13.5 min,98% A/C;13.5~14 min,98%~2% A/C;14~20 min,2% C-正模式;14~17 min,2% A-负模式。
质谱条件:仪器使用Thermo Q Exactive Focus,为电喷雾离子源(ESI),正负离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气10 arb。毛细管温度325℃,以分辨率70000进行全扫描,扫描范围81~1000,并采用HCD进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息。
1.4 数据处理 1.4.1 样本数据预处理及代谢物鉴定和筛选通过Proteowizard软件(v3.0.8789),将获得的原始数据转换成mzXML格式(xcms输入文件格式),利用R(v3.3.2)的XCMS程序包进行峰识别、峰过滤和峰对齐。主要参数有bw=5、ppm=15、peak 0.015、mzdiff=0.01及method="centWave"。得到包括质核比(m/z)、保留时间和峰面积等信息的数据矩阵。为使不同量级的数据能够进行比较,对数据进行峰面积的批次归一化。代谢物的鉴定首先需确认代谢物的精确分子量(分子量误差 < 20 ppm),然后根据MS/MS模式所得的碎片信息,在Metlin(http://metlin.scripps.edu)、LipidMaps(http://www.lipidmaps.org)、mzclound (https://www.mzcloud.org)和帕诺米克自建标准品数据库中进一步匹配和注释所获得代谢物的准确信息。
1.4.2 多元统计分析在多元统计分析前,对数据采用UV换算以进行标准化处理,采用主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)和正交–偏最小二乘判别分析(OPLS-DA)的多元统计方法对采集的多维数据进行降维和归类分析,观察样品的聚集和离散程度。
1.4.3 差异代谢物统计分析及通路分析差异代谢物的筛选指标为P≤0.05+VIP≥1。采用R(v3.3.2)中的cor函数计算相关系数,同时采用R(v3.3.2)中的cor.test函数对代谢物进行关联分析和统计检验,将P≤0.05作为差异显著的判断标准。采用凝聚层次聚类分析各组样本的聚类情况,通过R(v3.3.2)中pheatmap程序包对数据集进行缩放,得到代谢物相对定量值层次聚类图,用来推测已知或未知代谢物的生物学功能。应用KEGG进行代谢网络的预测,并采用MetPA数据库分析2组差异代谢物的相关代谢通路,通过降维算法获得代谢通路中代谢物的相对响应值,并以此计算代谢通路间的相关系数,进而绘制代谢通路关联网络图。
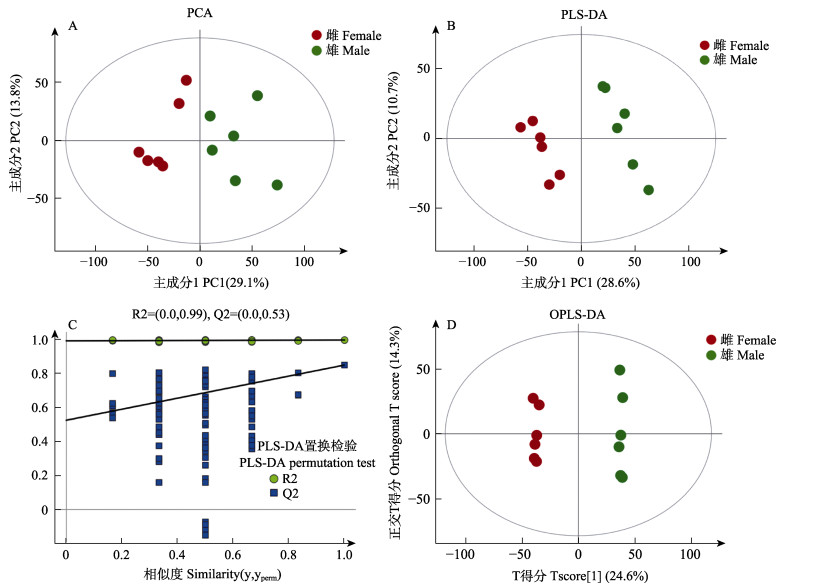
2 结果 2.1 性别差异代谢物的鉴定在本研究中,采用PCA、PLS-DA和OPLS-DA等多元统计的分析方法对数据进行处理。如PCA主成分分析得分图(图 1A)所示,雌性糙海参(F)组和雄性糙海参(M)组样本表现为组内聚类以及组间离散,可以看出F组和M组样本具有差异;进一步通过PLS-DA得分图(图 1B)分析,结果显示,F组和M组, 之间表现明显的离散趋势,可以很好地区分,表明雌性和雄性样本的代谢物具有显著差异。PLS-DA置换检验图可以作为评估PLS-DA模型可靠有效的标准,解决模型存在过拟合的问题,其可靠性标准为(满足其中一个即可):所有蓝色的Q2点从左到右均低于最右的原始蓝色Q2点或点的回归线与横坐标交叉或者小于0,从图 1C可以看出,PLS-DA模型得到的结果是可靠有效的;图 1D表示OPLS-DA主成分分析得分图,可以看出,F组和M组能很好地区分,组内关联性很高,组间差异很大,再一次表明雌、雄糙海参体腔液中的代谢物具有显著差异。
|
图 1 糙海参体腔液代谢物的多元统计分析及PLS-DA置换检验
Fig.1 The multivariate analysis and PLS-DA permutation test of coelomic fluid in H. scabra
A:PCA得分图;B:PLS-DA得分图;C:PLAS-DA置换检验得分图;D:OPLS-DA得分图 R2和Q2是模型验证参数,分别表示模型可解释度和模型可预测度 A: PCA score plot; B: PLS-DA score plot; C: PLAS-DA permutation test plot; D: OPLS-DA score plot R2 and Q2, two parameters of permutation test, represent model interpretability and model predictability respectively |
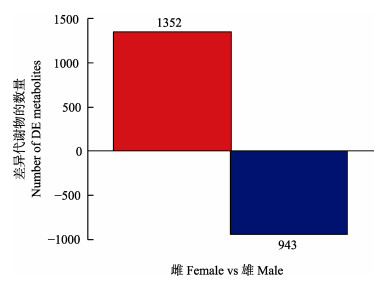
本研究采用P≤0.05及VIP≥1作为相关差异代谢物的筛选指标,与M组相比,F组的体腔液中共筛选出1352个上调代谢物和943个下调代谢物(图 2)。
|
图 2 性别差异代谢物统计柱状图 Fig.2 The statistical histogram of sex-specific metabolites |
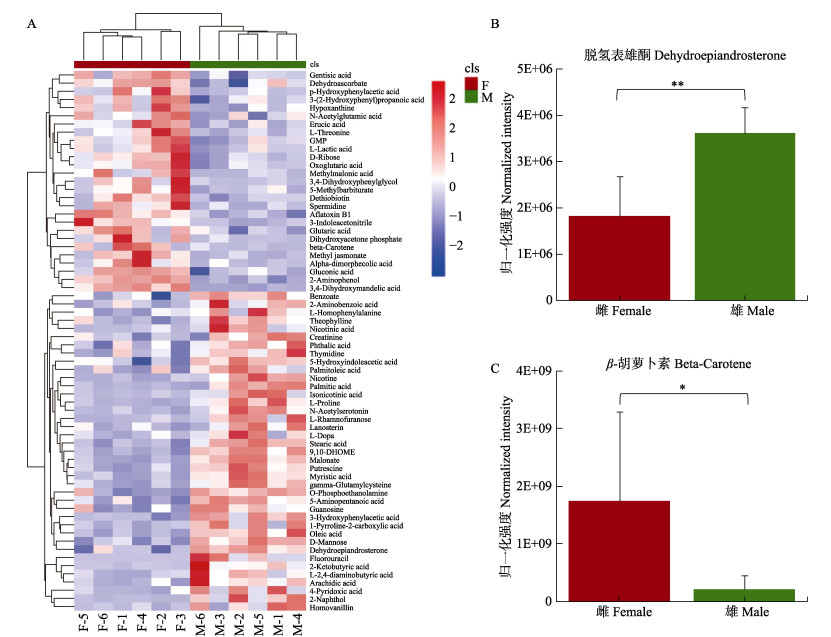
根据精确分子量及数据库比对,最终确认66个具有显著差异和明确注释的代谢物(表 1)。本研究还对糙海参体腔液中的性别差异代谢物进行凝聚层次聚类分析(图 3A),显示有27个代谢物在雌性体腔液中上调,39个代谢物在雄性体腔液中上调,并且雌性组内以及雄性组内的数据重复性较好。
|
|
表 1 差异显著的性别差异代谢物(P≤0.05+VIP≥1)[按照log2(FC_F/M)大小排序] Tab.1 Significantly different sex-specific metabolites (P≤0.05+VIP≥1) [The order according to the score of log2(FC_F/M)] |
|
图 3 A:性别差异代谢物的凝聚层次聚类热图;B:体腔液脱氢表雄酮柱状图;C:体腔液中的β-胡萝卜素柱状图 Fig.3 A: The agglomerate hierarchical clustering heatmap of sex-specific metabolites; B: Histogram of dehydroepiandrosterone in coelomic fluid; C: Histogram of beta-carotene in coelomic fluid *代表差异显著,0.05 < P < 0.1;**代表差异极显著,0.01 < P < 0.05 *represents significant difference, 0.05 < P < 0.1; **represents highly significant difference, 0.01 < P < 0.05 |
由表 1看出,大多数性别差异代谢产物属于脂类和氨基酸;与脂肪酸生物合成相关的代谢物,如硬脂酸(Fold Change_F/M=0.448)、肉豆蔻酸(Fold Change_ F/M=0.428)、丙二酸(Fold Change_F/M=0.247)、棕榈酸(Fold Change_F/M=0.238)和油酸(Fold Change_ F/M=0.233)等在雄性体腔液中的含量显著高于雌性;与性激素相关的脱氢表雄酮(Fold Change_F/M=0.506)在雄性中的含量也显著高于雌性(图 3B);同时,外源物质2-萘酚(Fold Change_F/M=0.050)、异烟酸(Fold Change_F/M=0.134)、尼古丁(Fold Change_F/M=0.307)、3-羟基苯乙酸(Fold Change_F/M=0.414)和茶碱(Fold Change_F/M=0.433)等在雄性体腔液中的的含量也远高于雌性,可能预示着雌、雄糙海参对于外源物质的积累具有一定的差异性。而氨基酸代谢物,如3, 4-二羟基苯乙二醇(DOPEG) (Fold Change_ F/M=6.894)、3-吲哚乙腈(Fold Change_F/M=4.768)、甲基丙二酸(Fold Change_F/M=4.715)、亚精胺(Fold Change_F/M=4.602)、p-羟基苯乙酸(4-HPA)(Fold Change_F/M=2.715)和3, 4-二羟基扁桃酸(DOMA) (Fold Change_F/M=2.075)等在雌性体腔液中的含量显著高于雄性;另外,雌性体腔液中的β-胡萝卜素(Fold Change_F/M=8.517)含量远高于雄性(图 3C),由于β-胡萝卜素涉及卵子的色素沉积,具有可作为性别差异代谢标志物的潜力。
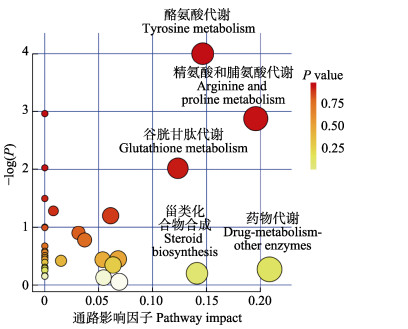
2.3 性别差异代谢物相关代谢通路分析将不同的代谢产物数据导入KEGG数据库及MetPA数据库进行分析,共获得38条性别差异代谢物的相关代谢通路。其中,雄性差异代谢物多富集于不饱和脂肪酸合成代谢、精氨酸与脯氨酸代谢、谷胱甘肽代谢、色氨酸代谢和脂肪酸生物合成代谢;而雌性差异代谢物主要富集于酪氨酸代谢、糖酵解或糖异生和嘌呤代谢。根据富集和影响因子分析得到代谢通路影响因子气泡图(图 4),其中,5个为具有显著性功能的代谢通路(Pathway impact > 0.1),分别为酪氨酸代谢、精氨酸和脯氨酸代谢、谷胱甘肽代谢、甾类化合物生物合成和药物代谢通路。
|
图 4 代谢通路影响因子气泡图 Fig.4 Bubble chart of pathway impact X轴代表通路富集,y轴代表通路影响;点的大小和颜色深浅代表主要通路的富集程度和影响程度 The x-axis represents pathway enrichment, and the y-axis represents pathway impact. Circle sizes and colors represent pathway enrichment and pathway impact values, respectively |
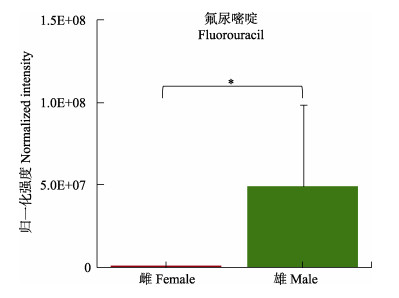
结合表 1可知,雌性糙海参体腔液中含量较高的DOPEG (Fold Change_F/M=6.894)、DOMA (Fold Change_F/M=2.075)、4-HPA(Fold Change_F/M=2.715)和龙胆酸(Fold Change_F/M=1.084)以及雄性体腔液中的高香草醛(Fold Change_F/M=0.511)和L-多巴(L-DOPA) (Fold Change_F/M=0.379)均参与酪氨酸代谢;甾类化合物合成则由雄性差异代谢物羊毛甾醇(Fold Change_F/M=0.538)参与。药物代谢在本代谢组研究中具有较高的影响因子(Pathway impact= 0.20833),参与其中的代谢物只有氟尿嘧啶,如图 5所示,氟尿嘧啶只富集于雄性糙海参体腔液中。对体腔液外源物质进行统计后发现,与雌性相比,雄性糙海参体腔液更具有积累外源物质的倾向(表 2)。
|
图 5 体腔液中氟尿嘧啶柱状图 Fig.5 Histogram of fluorouracil in coelomic fluid |
|
|
表 2 体腔液外源物质统计 Tab.2 Statistical list of xenobiotics in coelomic fluid |
精氨酸和脯氨酸代谢和谷胱甘肽代谢均与精子的发生和成熟相关,腐胺(Fold Change_F/M=0.341)和亚精胺(Fold Change_F/M=4.602)是关键的中间代谢物,腐胺可以生成亚精胺;表 1的结果显示,腐胺富集在雄性中,而亚精胺则富集在雌性中,表明体腔液对这2个代谢物的利用情况具有明显的性别差异。
3 讨论 3.1 β-胡萝卜素具有作为标志性雌、雄差异代谢物的潜力海洋生物体内存在着多种类胡萝卜素,但一般来说,动物体内不能直接合成类胡萝卜素,所以这种代谢物的积累可能与生物体的摄食偏好或某些代谢反应修饰有关(Matsuno, 2001; Liaaen-Jensen, 1991; Maoka, 2009)。棘皮动物由于生殖需要,在性成熟时期,其体内会积累类胡萝卜素。β-胡萝卜素在海参中十分常见,它能保护卵子免受光氧化和氧中毒的损害(Matsuno et al, 1995),Maoka等(2011)在海参性腺中发现了β-胡萝卜素的氧化代谢产物角黄素和虾青素,它们是海参性腺的主要成分。之前也有研究结果表明,雌性海胆(Strongylocentrotus droebachiensis)在产卵期间,其体内类胡萝卜素含量呈现大幅度下降的趋势,而在性腺恢复过程中,类胡萝卜素又具有补充的趋势,而雄性海胆中的类胡萝卜素含量在生殖周期基本保持稳定,这说明海胆对类胡萝卜素的吸收和利用存在性别差异(Hagen et al, 2008)。在本研究中,雌性糙海参体腔液中的β-胡萝卜素水平显著高于雄性(P < 0.05)(图 3C),由于在性腺成熟期,体腔液是十分重要的运输介质(John, 1964),因此,我们认为海参对β-胡萝卜素的吸收和利用也存在性别差异:在性腺发育过程中,雌性海参往往需要吸收大量的β-胡萝卜素来补偿卵子成熟的需求,β-胡萝卜素可能通过体腔液从肠道输送到性腺,从而发挥保护作用或进行氧化代谢为卵子提供必需物质(Allen, 1974)。由于雄性海参体内β-胡萝卜素含量远远低于雌性,因此,可将β-胡萝卜素作为雌、雄差异的标志性代谢物,用来鉴定性腺成熟期糙海参的性别。
3.2 雌、雄糙海参体腔液中的差异代谢物脱氢表雄酮(Fold Change_F/M=0.506)是性激素的来源,可以转变为睾酮和雌二醇(Henderson, 2007),在水产养殖中,其可以作为饲料添加剂诱导杂交罗非鱼(Oreochromis niloticus × O.mossambicus)幼体雄性化,同时还能提高饲料转化率及增加体重(Mohamed et al, 2012),其在雄性糙海参中的含量显著高于雌性(P < 0.05)(图 3C),推测在海参体腔液中存在脱氢表雄酮转化过程的雌雄差异。
亚精胺(Fold Change_F/M=4.602)同腐胺(Fold Change_F/M=0.341)和精胺一样属于多胺,是最初从人类精液里提取出来的精液蛋白,在人类体内具有抗氧化作用(Madeo et al, 2018),亚精胺和腐胺通过参与精氨酸和脯氨酸代谢通路生成精胺(精氨酸→腐胺→亚精胺→精胺),亚精胺和精胺是形成精子的必要物质,因此,一般来说,雄亲参会更需要亚精胺和腐胺,而本研究的数据却显示,在雌性体腔液中,亚精胺含量显著高于雄性,腐胺则富集在雄性中;推测这可能是由于在糙海参亲参生殖活动旺盛时期,其精氨酸和脯氨酸代谢旺盛,合成的腐胺首先在体腔液中积累,随后由亚精胺合成酶(Spermidine synthase)将腐胺转化成亚精胺,由于精巢的需要,雄性的亚精胺可以转运到精巢中以满足精子的发育需求,所以雄性体腔液中的亚精胺含量降低而腐胺不断合成以继续生成亚精胺满足精巢的需求;而卵巢并不需要亚精胺,所以它累积在了雌性体腔液中,并且抑制了腐胺的合成,造成了亚精胺含量较高而腐胺较低的结果。
同样的,雄性体腔液中也富集了较多的卵巢需求较大的脂肪酸合成代谢相关代谢物(表 1)。有研究表明,野生雌性大西洋鲑(Salmo salar)在性腺指数上升时,其血浆中的游离脂肪酸含量大幅度下降,这些营养物质在很大程度上被分配到性腺中(Booth et al, 1999)。Gianasi等(2017)也发现,喂食鱼卵的雌性叶瓜参(Cucumaria frondosa)的卵母细胞较大,性腺所富含的必需脂肪酸的比例较多,说明卵子的成熟需要大量脂肪酸的积累,脂肪酸可能从体腔液中转运到性腺,因而雌性体腔液中的脂肪酸含量明显低于雄性。
综上所述,糙海参亲参性腺发育相关通路有一部分会在体腔液中发生,产生的雌、雄性腺发育所必需的代谢产物先积累在体腔液中,根据性腺发育需求,代谢产物被转运到性腺中以满足下一步代谢的需求,造成剩余的代谢产物的种类和数量具有明显的雌雄差异,但不排除它们在体腔液中另有作用的可能性,其功能有待进一步研究。
3.3 雌雄亲参的性别差异代谢通路通过代谢物富集分析发现,雄性体腔液中的代谢物多参与谷胱甘肽代谢以及精氨酸脯氨酸代谢,这2条代谢通路均在精子的发生和成熟过程中起重要作用(Sies, 1999),其中,亚精胺、腐胺和γ-谷氨酰半胱氨酸(γ-Glutamylcysteine, 3GC)参与谷胱甘肽代谢,而亚精胺和腐胺也同时参与精氨酸脯氨酸代谢。腐胺(Fold Change_F/M=0.341)和3GC(Fold Change_F/M = 0.468)在雄性体腔液中含量较高,腐胺的代谢流向是精胺和亚精胺,而3GC和精胺可进行下一步反应,从而在精子发生和成熟过程中发挥作用。因此,雄性体腔液中上述2种通路流向精胺的代谢过程较为活跃,从而能为精子发生与成熟提供需要的营养和能量。本研究的结果显示,亚精胺在雌性体腔液中含量显著较高(Fold Change_F/M=4.602),由于雌性不需要参与精子发生和成熟过程,因而在雌性中亚精胺不继续进行下一步代谢而滞留在体腔液中。此外,雄性差异代谢物羊毛甾醇(Fold Change_ F/M=0.538)是甾类化合物生物合成的中间代谢产物,羊毛甾醇可经过一系列生物化学转化,形成胆甾醇和性激素等甾族物质,表明在糙海参雄性体腔液中性激素的合成通路较为活跃。氟尿嘧啶是参与药物代谢的唯一代谢物,它只在雄性体腔液中富集(图 5)。氟尿嘧啶是广泛应用于人体治疗的抗肿瘤药物(Jamieson et al, 2014),由于工业、医药和环境污染等问题,使得一些化学物质流入土壤和水体,对生态环境和生物多样性造成了一定程度的损害(Gavrilescu et al, 2015),为此,吴海燕等(2012)建立了海参等体内药物残留液相色谱–荧光检测方法。有研究表明,氟尿嘧啶在水体中浓度低时也会触发蝌蚪的恶性细胞转化过程,从而导致突变(Araújo et al, 2019),其对糙海参的具体影响尚未明确。这种氟尿嘧啶浓度的差异预示了糙海参对于化学药物等外源物质的摄取趋向具有显著的性别差异,表 2的数据也说明,无论从种类还是含量上来看,雄性体腔液比雌性更容易积累外源物质。
酪氨酸代谢可以产生许多重要激素和神经递质,包括甲状腺素、三碘甲状腺氨酸、肾上腺素、多巴胺和黑色素等(Li et al, 2009),其中,多巴胺在鱼类性腺发育期具有激素调控作用(Peter et al, 1988),并且海胆也具有多巴胺能神经系统(汝少国等, 2015)。雌性体腔液中的DOMA和DOPEG以及雄性体腔液中的高香草醛(HMPAL)(Fold Change_F/M=0.511)和多巴胺前体L-DOPA (Fold Change_F/M=0.379 (Calvo et al, 2011)均为酪氨酸代谢产物,这些代谢物的富集表明在海参体腔液中流向多巴胺前体L-DOPA的代谢活动十分活跃,但由于雌、雄体腔液中多巴胺代谢相关酶的表达具有差异,导致产生的代谢产物种类具有差异,这一结果与金钱鱼(Scatophagus argus)性腺成熟时多巴胺系统具有性别表达差异一致(苏冒亮, 2017),而这一代谢通路的作用推测与性激素调节有关。
综上所述,雄性体腔液中的代谢物多富集于谷胱甘肽代谢、精氨酸脯氨酸代谢、甾类化合物生物合成和药物代谢,涉及精子发生及成熟、性激素合成以及外源物质积累等过程;同时,雌、雄体腔液代谢物多参与酪氨酸代谢过程,该过程涉及激素合成及多巴胺调节激素过程,表明糙海参雌、雄性腺的发育可能受到多巴胺的影响,并且这种影响具有性别代谢差异。
4 结论本研究表明,体腔液可以积累性腺发育所需要的代谢物,其中,β-胡萝卜素在糙海参雌性体腔液中大量积累,可作为雌、雄差异标志代谢物;体腔液还能够积累性腺发育不需要的代谢物,如雌性积累亚精胺,而雄性积累脂肪酸合成通路代谢物,推测这是由于雌、雄性腺发育所需要的代谢过程有部分在体腔液中发生,产生的代谢物一部分转运到性腺中为性腺发育提供能量或营养,其余的代谢物则滞留在体腔液中,可能具有其他生理作用;同时发现,糙海参雌、雄性腺发育过程有性激素的参与,性激素调节可能受到多巴胺的影响,并且这种影响具有性别代谢差异;通过对比外源代谢物的数量和种类,发现雄性糙海参体腔液相比雌性更容易积累外源物质特征,其中,氟尿嘧啶属于环境污染物,它的积累对雄性糙海参的影响需要进一步的研究。总之,糙海参雌、雄体腔液代谢物具有明显的性别差异。
Allen WV. Interorgan transport of lipids in the purple sea urchin, Strongylocentrotus purpuratus. Comparative Biochemistry and Physiology Part A Physiology, 1974, 47(4): 1297-1311 DOI:10.1016/0300-9629(74)90104-2 |
Araújo A, Mesak C, Montalvão MF, et al. Anti-cancer drugs in aquatic environment can cause cancer: Insight about mutagenicity in tadpoles. Science of the Total Environment, 2019, 650(2): 2284-2293 |
Aru V, Søren BE, Savorani F, et al. The effect of season on the metabolic profile of the European clam Ruditapes decussatus as studied by 1H-NMR spectroscopy. Metabolites, 2017, 7(3): 36 DOI:10.3390/metabo7030036 |
Booth RK, McKinley RS, Ballantyne JS. Plasma non-esterified fatty acid profiles in wild Atlantic salmon during their freshwater migration and spawning. Journal of Fish Biology, 1999, 55(2): 260-273 DOI:10.1111/j.1095-8649.1999.tb00677.x |
Calvo AC, Pey AL, Miranda-Vizuete A, et al. Divergence in enzyme regulation between Caenorhabditis elegans and human tyrosine hydroxylase, the key enzyme in the synthesis of dopamine. Biochemical Journal, 2011, 434(1): 133-141 DOI:10.1042/BJ20101561 |
Conand C. Holothurians (Sea cucumbers, Class Holothuroidea). 1998, 1157-1190
|
Gavrilescu M, Demnerová K, Aamand J, et al. Emerging pollutants in the environment: Present and future challenges in biomonitoring, ecological risks and bioremediation. New Biotechnology, 2015, 32(1): 147-156 DOI:10.1016/j.nbt.2014.01.001 |
Gianasi BL, Parrish CC, Hamel JF, et al. Influence of diet on growth, reproduction and lipid and fatty acid composition in the sea cucumber Cucumaria frondosa. Aquaculture Research, 2017, 48(7): 3413-3432 DOI:10.1111/are.13168 |
Hagen NT, Jørgensen I, Egeland ES. Sex-specific seasonal variation in the carotenoid content of sea urchin gonads. Aquatic Biology, 2008, 3(3): 227-235 |
Henderson VW. Chapter 23-The role of sex steroids in Alzheimer's disease: Prevention and treatment. Lobo RA, Treatment of the postmenopausal woman (Third Edition). Academic Press; St. Louis, 2007, 295-306
|
Hines A, Yeung WH, Craft J, et al. Comparison of histological, genetic, metabolomics, and lipid-based methods for sex determination in marine mussels. Analytical Biochemistry, 2007, 369(2): 175-186 DOI:10.1016/j.ab.2007.06.008 |
Jabbar A, Davies JL. A simple and convenient biochemical method for sex identification in the marine mussel, Mytilus edulis L. Journal of Experimental Marine Biology and Ecology, 1987, 107(1): 39-44 DOI:10.1016/0022-0981(87)90121-3 |
Jamieson D, Lee J, Cresti N, et al. Pharmacogenetics of adjuvant breast cancer treatment with cyclophosphamide, epirubicin and 5-fluorouracil. Cancer Chemotherapy and Pharmacology, 2014, 74(4): 667-674 DOI:10.1007/s00280-014-2541-6 |
Jiang JW, Zhao ZL, Pan YJ, et al. Proteomics reveals the gender differences in humoral immunity and physiological characteristics associated with reproduction in the sea cucumber Apostichopus japonicus. Journal of Proteomics, 2020, 217: 103687 DOI:10.1016/j.jprot.2020.103687 |
Jiang JW, Zhao ZL, Pan YJ, et al. Gender specific differences of immune competence in the sea cucumber Apostichopus japonicus before and after spawning. Fish and Shellfish Immunology, 2019, 90: 73-79 DOI:10.1016/j.fsi.2019.04.051 |
John CF. Nutrient transport in starfish I. Properties of the coelomic fluid. Biological Bulletin, 1964, 126(1): 33-53 |
Kleps RA, Myers TC, Lipcius RN, et al. A sex-specific metabolite identified in a marine invertebrate utilizing phosphorus-31 nuclear magnetic resonance. PLoS One, 2007, 2(8): 780 DOI:10.1371/journal.pone.0000780 |
Laires R. Characterization of the coelomic fluid of the starfish Marthasterias glacialis in a wound-healing phase. Instituto Superior Tecnico, 2012, November: 1-86
|
Lette E, Lawler N, Burnham Q, et al. Metabolomic profiling of crayfish haemolymph distinguishes sister species and sex: Implications for conservation, aquaculture and physiological studies. Freshwater Crayfish, 2020, 25(1): 89-101 DOI:10.5869/fc.2020.v25-1.089 |
Li P, Mai K, Trushenski J, et al. New developments in fish amino acid nutrition: Towards functional and environmentally oriented aquafeeds. Amino Acids, 2009, 37(1): 43-53 DOI:10.1007/s00726-008-0171-1 |
Liaaen-Jensen S. ChemInform Abstract: Marine Carotenoids- Selected topics. ChemInform, 1991, 22(4): 747-759 |
Liao YL. Echinoderma, Holothuria. Zoology of China. Beijing: Science Press, 1997: 1-334 [廖玉麟. 棘皮动物门海参纲. 中国动物志. 北京: 科学出版社, 1997: 1-334]
|
Lovatelli A, Conand C, Purcell P, et al. Advances in sea cucumber aquaculture and management. FAO Fisheries Technical Paper, 2004, 463: 425 |
Lubet P, Brichon G, Besnard JY, et al. Sexual differences in the composition and metabolism of lipids in the mantle of the mussel Mytilus galloprovincialis LMK (Mollusca: Bivalvia). Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1986, 84(3): 279-285 DOI:10.1016/0305-0491(86)90077-5 |
Madeo F, Eisenberg T, Pietrocola F, et al. Spermidine in health and disease. Science, 2018, 359(6374): 410-410 |
Maoka T. Carotenoids in marine animals. Marine Drugs, 2011, 9(2): 278-293 DOI:10.3390/md9020278 |
Maoka T. Recent progress in structural studies of carotenoids in animals and plants. Archives of Biochemistry and Biophysics, 2009, 483(2): 191-195 DOI:10.1016/j.abb.2008.10.019 |
Matsuno T. Aquatic animal carotenoids. Fisheries Science, 2001, 67(5): 771-783 DOI:10.1046/j.1444-2906.2001.00323.x |
Matsuno T, Tsushima M. Comparative biochemical studies of carotenoids in sea cucumbers. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1995, 111(4): 597-605 DOI:10.1016/0305-0491(95)00028-7 |
Mercier A, Hamel JF. Perivisceral coelomic fluid as a mediator of spawning induction in tropical holothurians. Invertebrate Reproduction and Development, 2002, 41(1-3): 223-234 DOI:10.1080/07924259.2002.9652755 |
Mohamed A, Traifalgar R, Traifalgar F, et al. Dietary administration of dehydroepiandrosterone hormone influences sex differentiation of hybrid red tilapia (O. niloticus ×O. mossambicus) Larvae. Journal of Fisheries and Aquatic Science, 2012, 744(7): 447-453 |
Nicholson JK, Connelly J, Lindon JC, et al. Metabonomics: A platform for studying drug toxicity and gene function. Nature Reviews Drug Discovery, 2002, 1(2): 153-161 DOI:10.1038/nrd728 |
Peter RE, Lin HR, Kraak GVD. Induced ovulation and spawning of cultured freshwater fish in China: Advances in application of GnRH analogues and dopamine antagonists. Aquaculture, 1988, 74(1-2): 1-10 DOI:10.1016/0044-8486(88)90080-4 |
Ru SG, Wang CC. Progress on the research of the development and function of the dopaminergic nervous system of sea urchin in the early developmental stage. Progress in Fishery Sciences, 2015, 36(1): 132-138 [汝少国, 王翠翠. 海胆早期多巴胺能神经系统的发育及功能研究进展. 渔业科学进展, 2015, 36(1): 132-138] |
Schock TB, Stancyk DA, Thibodeaux L, et al. Metabolomic analysis of Atlantic blue crab, Callinectes sapidus, hemolymph following oxidative stress. Metabolomics, 2010, 6(2): 250-262 DOI:10.1007/s11306-009-0194-y |
Sies H. Glutathione and its cellular functions. Free Radical Biology & Medicine, 1999, 27(9-10): 916-921 |
Su ML. Dopaminergic system in response to the environmental salinity change and influence on the gonadogenesis in the spotted scat (Scatophagus argus). Doctoral Dissertation of Shanghai Ocean University, 2017 [苏冒亮. 多巴胺系统在金钱鱼环境盐度适应及性腺发育中的调节机制. 上海海洋大学博士研究生学位论文, 2017]
|
Tian ML, Li YP, Jing J, et al. Construction of a high-density genetic map and quantitative trait locus mapping in the sea cucumber Apostichopus japonicus. Scientific Reports, 2015, 5: 14852 DOI:10.1038/srep14852 |
Wu HY, Guo MM, Li ZX, et al. Determination of tetracyclines residue in aquatic products by HPLC with fluorescence detector. Progress in Fishery Sciences, 2012, 33(5): 102-108 [吴海燕, 郭萌萌, 李兆新, 等. 高效液相色谱-荧光法测定水产品中多种四环素残留. 渔业科学进展, 2012, 33(5): 102-108 DOI:10.3969/j.issn.1000-7075.2012.05.016] |
Yan JJ, Jing J, Mu XY, et al. A genetic linkage map of the sea cucumber (Apostichopus japonicus) based on microsatellites and SNPs. Aquaculture, 2013, 404-405: 1-7 DOI:10.1016/j.aquaculture.2013.04.011 |
Yang XM, Wu MC, Zhang L, et al. Annual change of gonadal development in Holothuria scabra from Hainan Island. Journal of Southern Agriculture, 2015, 46(6): 1117-1122 [杨学明, 吴明灿, 张立, 等. 海南糙海参性腺发育的周年变化. 南方农业学报, 2015, 46(6): 1117-1122 DOI:10.3969/j.issn.2095-1191.2015.6.1117] |



