2. 山东海跃水产科技有限公司 东营 257500
2. Shandong Haiyue Aquatic Science and Technology Co. Ltd, Dongying 257500
仿刺参(Apostichopus japonicus)又称刺参,是池塘或浅海中增养殖的重要海洋经济动物。近年来,随着养殖环境的恶化和养殖产业规模的迅速扩D大,病害频发问题已成为产业可持续发展的瓶颈因子之一。对刺参病害的研究显示,腐皮综合征是刺参育苗和养殖过程中的最主要病害。病原学研究表明,细菌性病原如灿烂弧菌(Vibrio splendidus)(张春云等, 2006)、假交替单胞菌(Pseudoalteromonas nigrifaciens)(王印庚等, 2006)是该疾病的重要致病原。池塘养殖是刺参养殖的最主要养殖模式,由于刺参养殖池塘面积较大,使用药物进行病害防控的可操作性受限制,利用微生态制剂进行池塘水环境和刺参生理状态调控是防控池塘养殖刺参腐皮综合征的重要途径。
乳酸菌制剂是一类不运动、无芽孢、产生大量乳酸的天然活性微生态制剂,能粘附于肠黏膜、改善肠道菌群、增强免疫,并抑制病原菌在肠道的定殖,降解水体中的氨氮(NH4+-N)、亚硝酸盐(NO2–-N)等有害物质,具有作为益生菌的巨大潜力,是近年来养殖动物疾病生态防控应用热点(Cavalcante et al, 2020; Wang et al, 2015; Zhao et al, 2016; Peng et al, 2020)。乳酸菌在畜牧生产中应用较为成熟,但在水产养殖中的应用尚处在探索阶段。目前,相关研究初步揭示了乳酸菌对养殖动物的增重率、免疫力以及水质的影响。Li等(2018)将植物乳杆菌(Lactobacillus plantarum)及粪肠球菌(Enterococcus faecalis)添加到刺参饲料中,对刺参生长及免疫均具有良好的促进作用,林艾影等(2020)研究表明,乳酸菌能显著提高军曹鱼(Rachycentron canadum)幼鱼增重率、特定生长率以及淀粉酶、胰蛋白酶、脂肪酶的活性;王国霞等(2010)在凡纳滨对虾(Litopenaeus vannamei)饲料中添加乳酸菌,可提高溶菌酶和血清过氧化氢酶的活性,然而,关于乳酸菌对刺参病害防控的研究鲜有报道。目前,市场上的乳杆菌产品多为从其他区域或物种分离获得,从微生态制剂生态安全性的角度来看,自养殖动物本身或生长环境中筛选土著菌,开发土著菌的应用潜能,具有更好的环境适用性和更高的使用安全性。鉴于此,本研究从山东东营地区刺参池塘环境中筛选对刺参安全的土著乳酸菌并开展其生长特性评价,以期为刺参池塘病害生态防控提供应用参考。
1 材料与方法 1.1 材料 1.1.1 养殖池塘选择选取位于山东省东营市海跃水产科技有限公司池塘培育的大规格刺参苗种,池塘面积约为4 hm2,水深为1.5~2 m,池塘附着基由遮阴网搭建而成,该池塘为使用1.5年的池塘,投苗规格为1~2 g/头,苗种投放密度为2万头/亩,春、秋季苗种摄食旺盛期投饵,饵料成分为鼠尾藻(Sargassum thunbergii)、海带(Laminaria japonica)等藻粉。
1.1.2 样品的采集2018年10月采集底泥样本。采样时,养殖池水温度为20℃,盐度为29;采集地点选择在养殖池中央池底,使用采集器采集池底沉积物,选取表层为5 cm的上层底泥为测试样本,样本采集后于4℃保存,低温运回实验室。
1.1.3 培养基LB培养基:蛋白胨5.0 g,酵母提取物2.5 g,氯化钠5.0 g,加蒸馏水定容至1000 ml。
MRS固体培养基:蛋白胨10.0 g,牛肉浸粉5.0 g,酵母浸粉4.0 g,葡萄糖20.0 g,磷酸氢二钾2.0 g,柠檬酸三铵2.0 g,醋酸钠5.0 g,磷酸镁0.2 g,硫酸锰0.05 g,琼脂15.0 g,吐温80 1.0 g,加蒸馏水定容至1000 ml。
MRS液体培养基:配方同MRS固体培养基,不加琼脂。
1.1.4 拮抗指示用病原菌刺参腐皮综合征的2株重要的细菌性致病原——灿烂弧菌和假交替单胞菌为本实验室保存的分离自患病刺参的病原菌。
1.1.5 安全性评价用刺参苗种安全性评价实验所用健康刺参购自东营市海跃水产科技有限公司,苗种平均规格为(22.67±2.56) g/头。运抵实验室后暂养7 d,用于后续实验。暂养条件:水温为16℃,盐度为28,pH为7.9。
1.2 方法 1.2.1 乳酸菌的培养与分离将采集的底泥样本加入50 ml 1.5%的灭菌NaCl溶液进行充分稀释溶解,静置20 min后,吸取上清液,利用1.5%的灭菌NaCl溶液进行10倍梯度稀释后,在MRS平板上进行涂布,恒温培养箱进行细菌培养,培养条件为37℃,倒置培养24~48 h,选取适宜稀释度的平板进行菌落计数,单菌落分离、纯化和保种,并对保种的菌落于–80℃保存。
1.2.2 拮抗菌的筛选将活化的灿烂弧菌和假交替单胞菌涂布于牛津杯打孔的LB平板上,向牛津杯小孔添加150 μl浓度为1×108 CFU/ml培养的相应乳酸菌菌液,37℃培养24~36 h,测定牛津杯小孔的抑菌圈直径。选取对2株致病菌具有最佳抑菌效果的乳酸菌作为候选益生菌,用于下一步实验。
1.2.3 所筛选乳酸菌产生的胞内产物及胞外产物抑菌效果(1) 胞内产物及胞外产物的制备对以MRS液体培养基扩大培养获得的候选益生菌培养液进行离心,4500 r/min离心15 min,采用直径为0.22 μm的滤膜过滤上清液,得到的过滤液即供试菌胞外产物;离心获得的菌泥使用灭菌的PBS冲洗3次,再用超声波方法进行破碎,制备胞内产物。
(2) 胞内产物及胞外产物抑菌效果比较将活化的灿烂弧菌和假交替单胞菌涂布于牛津杯打孔的LB平板上,向牛津杯小孔添加150 μl制备的胞内产物和胞外产物,37℃培养24~36 h,测定牛津杯小孔的抑菌圈直径。根据抑菌圈直径确定胞内产物及胞外产物对致病原的抑菌效果。
1.2.4 候选益生菌对刺参的安全性评价将暂养稳定后的刺参苗种随机分到容积为20 L的12个实验水槽中,每个水槽放置20头苗种,实验分为4组,即1个对照组和3个实验组,每个组设3个平行。安全性实验采用浸浴的方式进行,候选益生菌的浸浴浓度分别设定为1×107、1×108和1×109 CFU/ml,以不添加候选益生菌的3个水槽作为对照组。安全性实验周期为30 d,日投饵量为刺参体重的1%,每天投喂1次,水温为16℃~18℃、盐度为29,每天换水量为20%,换水后及时补充新培养的益生菌以维持相应的浸浴浓度。实验期间,每天记录刺参活动、摄食、吐脏及死亡情况。
1.2.5 菌株的生理生化鉴定采用细菌微量生化鉴定管(青岛海博生物)对所筛选的菌株进行生理生化指标的测试。测试结果与《常见细菌系统鉴定手册》(东秀珠等, 2001)和《乳酸细菌分类鉴定及实验方法》(凌代文等, 1999)进行对比归类后判定菌株类型。
1.2.6 菌株的16S rDNA序列分析利用细菌基因组DNA提取试剂盒(北京天根生物)提取菌株基因组DNA。采用细菌16S rDNA通用引物扩增基因组DNA,引物序列为27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-TACGGTTACCTTGTTACGACTT-3′),扩增产物经1% 琼脂糖凝胶电泳检验后,送青岛擎科梓熙生物技术有限公司测序。测序结果通过Blast检索程序与NCBI基因库中相关序列进行比对,并利用MEGA 6.0软件构建该菌株的系统发育树。
1.2.7 菌株生长特性研究(1) 温度对菌株生长的影响分别设定温度为9℃、16℃、23℃、30℃、37℃、44℃、51℃和58℃,将所筛选的菌株接种于300 ml MRS液体培养基中,置于设置了相应温度条件的细菌振荡培养箱中,180 r/min恒温培养24 h,对菌液中的培养细菌计数(刘宇等, 2017),确定菌株的最适温度。
(2) pH对菌株生长的影响分别设定pH为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,用1 mol/L的NaOH和HCl溶液将MRS液体培养基分别调至相应pH条件,所筛选的菌株接种于300 ml相应的MRS液体培养基中,180 r/min恒温培养24 h,对菌液中的培养细菌计数(周映华等, 2015),确定菌株最适pH。
(3) 菌株生长曲线的绘制依据上述实验确定菌株最适生长pH值和生长温度,将筛选的菌株接种于300 ml相应的pH条件的MRS液体培养基中,设定培养箱温度为最适生长温度,按照180 r/min的转速进行振荡培养52 h。培养期间,每隔4 h取样1次,测定相应节点的细菌浓度并绘制该菌株的生长曲线。
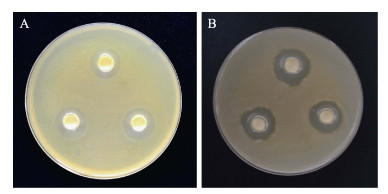
2 结果 2.1 拮抗菌的筛选本研究从山东东营刺参养殖池塘环境中分离获得56株乳酸菌,分别编号为CSND-1、CSND-2、CSND-3、…CSND-56。通过对指示菌的拮抗实验,筛选出1株对灿烂弧菌和假交替单胞菌的生长具有良好抑制作用的乳酸菌CSND-6(图 1)。该菌株的菌落表面光滑、边缘清晰、中央隆起,呈乳白色。革兰氏染色阳性,透射电镜观察表明,该菌呈短杆状,为1.5~2.0 μm,两端钝圆,无鞭毛,无芽孢(图 2)。
|
图 1 菌株CSND-6对刺参重要病原菌的抑制作用 Fig.1 The antagonistic activities of strain CSND-6 to main pathogens of sea cucumber A和B指示菌分别为灿烂弧菌和假交替单胞菌 A and B are V. splendidus and P. nigrifaciens, respectively |

|
图 2 菌株CSND-6的革兰氏染色和透射电镜观察 Fig.2 Gram's staining and TEM photograph of the strain CSND-6 |
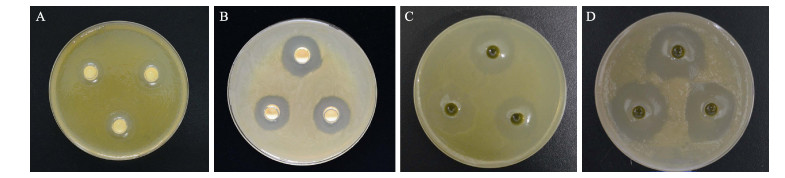
利用所筛选的CSND-6制备该菌株的胞内产物和胞外产物,测定该菌株对灿烂弧菌和假交替单胞菌的抑菌圈大小见图 3和表 1。从图 3和表 1可以看出,胞内产物对灿烂弧菌、假交替单胞菌的抑菌圈分别为17、22 mm,胞外产物的抑菌圈分别为25、31 mm,说明候选菌株CSND-6的胞内、胞外产物对指示菌的生长均具有较强的抑制作用。
|
图 3 菌株CSND-6胞内及胞外产物对刺参重要病原菌的抑制作用
Fig.3 The antagonistic activities of intracellular products and extracellular products of strain CSND-6 to main pathogens of sea cucumber
A、B分别为菌株CSND-6胞内产物对灿烂弧菌、假交替单胞菌的抑制作用 C、D分别为菌株CSND-6胞外产物对灿烂弧菌、假交替单胞菌的抑制作用 A and B: Effects of antibacterial activity of intracellular products of CSND-6 to V. splendidus and P. nasnigrifaciens, respectively C and D: Effects of antibacterial activity of extracellular products of CSND-6 to V. splendidus and P. nasnigrifaciens, respectively |
|
|
表 1 菌株CSND-6胞内及胞外产物对刺参重要病原菌的抑制作用 Tab.1 The antagonistic activities of intracellular products and extracellular products of strain CSND-6 to main pathogens of sea cucumber |
采用不同浓度的CSND-6菌液对刺参苗种的浸浴胁迫实验的安全性结果见表 2。从表 2可以看出,浸浴浓度分别为1.0×107、1.0×108、1.0× 109 CFU/ml的高浓度胁迫实验组,在整个实验过程中,刺参苗种活力良好,摄食正常,均未发现排脏、发病和死亡的现象,表明该CSND-6菌株对刺参苗种是安全的。
|
|
表 2 菌株CSND-6的刺参的安全性实验 Tab.2 Safety testing of strain CSND-6 to sea cucumber A. japonicus |
对筛选的乳酸菌CSND-6进行生理生化检测,该菌在3% NaCl尿素酶、3% NaCl ONPG、苦杏仁苷、丙二酸盐条件下呈阳性,能利用葡萄糖、甘露醇、蔗糖、山梨醇;氧化酶反应呈阴性,该菌株不液化明胶,不产生H2S气体。参照《常见细菌系统鉴定手册》(东秀珠等, 2011)和《乳酸细菌分类鉴定及实验方法》(凌代文等, 1999),该菌株属乳杆菌科(Lactobacillaceae)(表 3)。
|
|
表 3 菌株CSND-6的生理生化特征 Tab.3 Physiological and biochemical characteristics of strain CSND-6 |
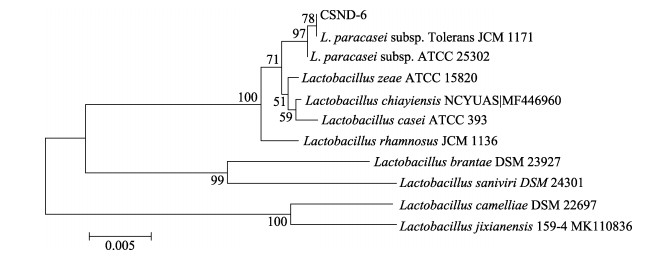
对菌株CSND-6 16S rDNA的相应序列进行扩增、测序获得该菌株的16S rDNA序列为1414 bp。通过Blast检索程序与NCBI基因库中序列进行比对分析,并使用MEGA 6.0软件构建系统发育树,结果见图 4。从图 4可以看出,本研究分离获得的菌株CSND-6与副干酪乳杆菌(Lactobacillus paracasei JCM1171)的相似性最高,为99.83%。
|
图 4 基于16S rDNA序列的菌株CSND-6系统发育树 Fig.4 The phylogenetic tree of strain CSND-6 based on 16S rDNA sequence |
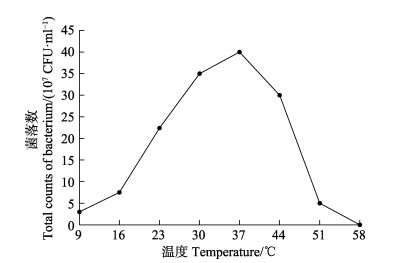
测定不同温度对菌株生长的影响见图 5。从图 5可以看出,在9℃~58℃的实验范围内,菌株的生长速度随培养温度的升高呈先增高再降低的趋势,该菌株在9℃~51℃范围内均可生长,58℃时不生长;30℃~44℃温度范围内生长较快,最适宜的生长温度为37℃。
|
图 5 不同温度下菌株CSND-6的生长情况 Fig.5 Growth of strain CSND-6 in different temperature |
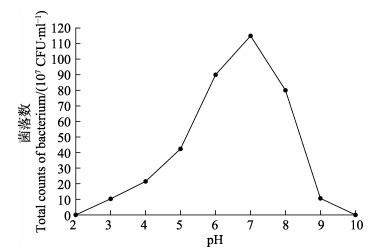
不同pH的MRS培养基中菌株CSND-6的培养结果见图 6。从图 6可以看出,菌株CSND-6在pH为2.0和10.0时不生长;在pH为3.0~9.0范围内均可以生长;在pH为6.0~8.0范围内,菌落数量明显高于其他组,pH为7.0时生长速度最快。
|
图 6 不同pH对菌株CSND-6生长的影响 Fig.6 Effect of different pH on the growth of strain CSND-6 |
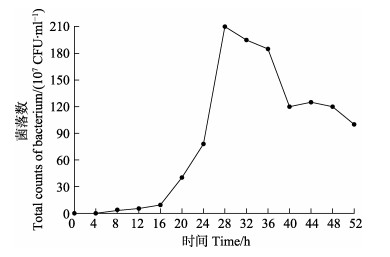
以上述实验结果为基础,确定该菌株的最适培养温度为37℃,最适菌株生长的pH为7.0。按照这一条件配制pH为7.0的MRS培养基,绘制其在37℃培养的生长曲线见图 7。根据CSND-6的生长曲线可以看出,CSND-6在16 h之前生长速度较慢,16 h后快速生长并进入对数生长期,28~32 h期间处于生长高峰期,其中,28 h时菌落数达到峰值,菌落数为2.10×109 CFU/ml,32 h后CSND-6生长速度下降,36 h后开始进入平台期。
|
图 7 菌株CSND-6在不同时间的生长曲线 Fig.7 Growth curve of strain CSND-6 in different time |
乳酸菌广泛分布于动物肠道中,能阻碍肠道内特定致病菌的粘附和定殖,从而起到调节肠道微生态平衡及抑制病原菌的作用(Guo et al, 2020)。目前,乳酸菌已经应用于畜牧和水产养殖的病害防治过程并对其抑菌机理进行了研究。Atanassova等(2003)研究表明,副干酪乳杆菌(L.paracasei subsp M3)能分泌1种抗菌素,抑制细菌、真菌生长;Ashokkumar等(2011)研究表明,副干酪乳杆菌产生的细菌素粗提物对鼠伤寒沙门氏菌(Salmonella typhimurium)具有较强的抑制作用。本研究从山东东营刺参养殖池塘底泥样品中分离获得1株具有显著抑菌活性的副干酪乳杆菌,该菌胞内产物和胞外产物对刺参腐皮综合征重要的致病原假交替单胞菌和灿烂弧菌均具有较好的抑菌活性,表明筛选的副干酪乳杆菌在池塘养殖的病害防控中具有良好的应用潜力。
掌握乳酸菌发酵条件及生长规律可对后期开发利用提供重要参考。本研究通过对筛选菌株——副干酪乳杆菌发酵条件和生长曲线的研究,确定了副干酪乳杆菌CSND-6最适生长条件,温度为37℃,pH为7.0,且在16 h后进入对数生长期,28~32 h达到生长高峰期,28 h时活菌数量达到高峰,为2.10×109 CFU/ml。数据与刘宇等(2017)从新鲜的驴粪中获得1株驴源干酪乳杆菌LV1所测定的生物学特性相似。唐素婷等(2019)对1株分离自酱油渣的副干酪乳杆菌的生物学特性研究发现,相应菌株进入对数生长期的时间(12 h)比本研究筛选的菌株时间短,但进入生长高峰期的时间(30 h)较长。通过以上研究可以看出,本研究筛选出的副干酪乳杆菌CSND-6生长的温度、酸碱度的范围较广,并且进入高峰期的活菌数量大,适宜于产品的开发和池塘养殖环境的推广应用。
益生菌能调节养殖水体的微环境、改善水质条件、抑制病原菌生长,在水产养殖动物的疾病防控过程中已初见成效,但养殖水域使用大量益生菌并释放到公共环境中对生态环境的安全不容忽视。Wang等(2000)研究表明,在养殖的斑节对虾(Penaeus monodon)中发现1种新的细菌性白斑病,该病是由大量使用枯草芽孢杆菌(Bacillus subtilis)而引发;骆艺文等(2009)研究发现,大量使用益生菌——蜡样芽孢杆菌(Bacillus cereus)可引起刺参化皮。因此,养殖过程中益生菌来源的选取及益生菌制剂的科学实用对安全生产也十分重要。
本研究筛选的抑制刺参重要病原菌的副干酪乳杆菌CSND-6在高浓度浸浴胁迫刺参时,实验刺参均健康、活力好,无吐脏、化皮和死亡现象,表明该菌对刺参是安全的。关于副干酪乳杆菌在水产养殖动物的应用方面,夏雨等(2020)研究发现,在凡纳滨对虾饲料中添加副干酪乳杆菌,能提升对虾肌肉持水性及EPA、DHA含量,降低肌肉中饱和脂肪酸含量;Cazorla等(2015)研究表明,副干酪乳杆菌坚韧亚种(L. paracasei subsp. Tolerans)能提高虹鳟(Oncorhynchus mykiss)幼鱼的生长性能并改善其肠道菌群;桂琳等(2015)在草鱼(Ctenopharyngodon idella)饲料中加入干酪乳杆菌等益生菌的实验结果表明,相应菌株可以显著提高草鱼的生长速度,并提高消化酶和抗氧化酶活性。张永刚等(2019)自刺参池塘中筛选到1株对刺参安全且具有良好抑菌效果的植物乳杆菌(Lactobacillus plantarum)。本研究所分离的副干酪乳杆菌CSND-6对养殖刺参的生长、消化酶活性以及对养殖环境的调控作用还需进一步的研究探讨。
综上所述,本研究从山东东营地区刺参池塘养殖环境中筛选土著益生菌——副干酪乳杆菌CSND-6,该菌具有生长温度范围广、抑菌能力强的特点,在刺参池塘养殖环境中快速繁殖形成优势菌并发挥作用的潜能。相关研究对池塘养殖的病害防控具有重要意义,为水产动物乳酸菌类微生态制剂的产业化应用奠定基础。
Ashokkumar S, Krishna RS, Pavithra V, et al. Production and antibacterial activity of bacteriocin by Lactobacillus paracasei isolated from donkey milk. International Journal of Current Science Research, 2011, 1: 109-115 |
Atanassova M, Choiset Y, Dalgalarrondo M, et al. Isolation and partial biochemical characterization of a proteinaceous anti-bacteria and anti-yeast compound produced by Lactobacillus paracasei subsp. paracasei strain M3. International Journal of Food Microbiology, 2003, 87(1-2): 63-73 DOI:10.1016/S0168-1605(03)00054-0 |
Cavalcante RB, Telli GS, Tachibana L, et al. Probiotics, prebiotics and synbiotics for nile tilapia: Growth performance and protection against Aeromonas hydrophila infection. Aquaculture Reports, 2020, 17: 100343 DOI:10.1016/j.aqrep.2020.100343 |
Cazorla AL, Sica MG, Brugnoni LI, et al. Evaluation of Lactobacillus paracasei subsp. Tolerans isolated from Jenyn's sprat (Ramnogaster arcuata) as probiotic for juvenile rainbow trout Oncorhynchus mykiss (Walbaum, 1792). Journal of Applied Ichthyology, 2015, 31(1): 88-94 DOI:10.1111/jai.12496 |
Dong XZ, Cai MY. Common bacteria system identification manual. Beijing: Science Press, 2001: 45-65 [东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001: 45-65]
|
Guo GX, Li C, Xia B, et al. The efficacy of lactic acid bacteria usage in turbot Scophthalmus maximus on intestinal microbiota and expression of the immune related genes. Fish and Shellfish Immunology, 2020, 100: 90-97 DOI:10.1016/j.fsi.2020.03.003 |
Gui L, Wang XQ, Kang Y, et al. Effects of one compound probiotics on growth and antioxidant function of Ctenopharyngodon idellus. Freshwater Fisheries, 2015, 45(5): 83-87 [桂琳, 王晓清, 康银, 等. 一种复合益生菌对草鱼生长和抗氧化功能的影响. 淡水渔业, 2015, 45(5): 83-87 DOI:10.3969/j.issn.1000-6907.2015.05.014] |
Li C, Ren YC, Jiang SH, et al. Effects of dietary supplementation of four strains of lactic acid bacteria on growth, immune- related response and genes expression of the juvenile sea cucumber Apostichopus japonicus Selenka. Fish and Shellfish Immunology, 2018, 74: 69-75 DOI:10.1016/j.fsi.2017.12.037 |
Lin AY, Wang WZ, Chen G, et al. Effects of two lactic acid bacteria on growth performance and activities of digestive and non-specific immune enzymes of juvenile cobia (Rachycentron canadum). Journal of Guangdong Ocean University, 2020, 40(5): 105-110 [林艾影, 王维政, 陈刚, 等. 2种乳酸菌对军曹鱼幼鱼生长及消化酶、免疫酶活性的影响. 广东海洋大学学报, 2020, 40(5): 105-110 DOI:10.3969/j.issn.1673-9159.2020.05.013] |
Ling DW, Dong XZ. Classification and identification of lactic acid bacteria and experimental methods. Beijing: China Light Industry Press, 1999: 130-137 [凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法. 北京: 中国轻工业出版社, 1999: 130-137]
|
Liu Y, Yin JY, Jiang BT, et al. Isolation, identification and biological characterizatics study of a strain of Lactobacillus casei from Donkeys. Journal of Heilongjiang Bayi Agricultural University, 2017, 29(6): 16-19 [刘宇, 尹珺伊, 江波涛, 等. 一株驴源干酪乳杆菌分离、鉴定及生物学特性研究. 黑龙江八一农垦大学学报, 2017, 29(6): 16-19 DOI:10.3969/j.issn.1002-2090.2017.06.005] |
Luo YW, Hao ZK, Wang YG, et al. A Bacillus cereus causing "skin ulcer syndrome" of sea cucumber. Fisheries Science and Technology Information, 2009, 36(2): 60-63 [骆艺文, 郝志凯, 王印庚, 等. 一株引起刺参"腐皮综合征"的蜡样芽胞杆菌. 水产科技情报, 2009, 36(2): 60-63 DOI:10.3969/j.issn.1001-1994.2009.02.011] |
Peng KD, Koubaa M, Bals O, et al. Recent insights in the impact of emerging technologies on lactic acid bacteria: A review. Food Research International, 2020, 137: 109544 DOI:10.1016/j.foodres.2020.109544 |
Tang ST, Qu XM, Huang GD, et al. Isolation, identification and antioxidant properties of Lactobacillus paracasei from soy sauce residue. Food and Machinery, 2019, 35(10): 11-17 [唐素婷, 区锡敏, 黄桂东, 等. 酱油渣中副干酪乳杆菌的分离鉴定及抗氧化特性研究. 食品与机械, 2019, 35(10): 11-17] |
Wang GX, Huang YH, Zhou Y, et al. Effects of lactobacillus on growth performance, digestive enzyme activities and non-specific immunity of Litopenaeus vannamei. Chinese Journal of Animal Nutrition, 2010, 22(1): 228-234 [王国霞, 黄燕华, 周晔, 等. 乳酸菌对凡纳滨对虾幼虾生长性能、消化酶活性和非特异性免疫的影响. 动物营养学报, 2010, 22(1): 228-234 DOI:10.3969/j.issn.1006-267x.2010.01.035] |
Wang JH, Zhao LQ, Liu JF, et al. Effect of potential probiotic Rhodotorula benthica D30 on the growth performance, digestive enzyme activity and immunity in juvenile sea cucumber Apostichopus japonicus. Fish and Shellfish Immunology, 2015, 43(5): 330-336 |
Wang YG, Fang B, Zhang CY, et al. Etiology of skin ulcer syndrome in cultured juveniles of Apostichopus japonicus and analysis of reservoir of the pathogens. Journal of Fishery Sciences of China, 2006, 13(4): 610-616 [王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病"腐皮综合征"病原及其感染源分析. 中国水产科学, 2006, 13(4): 610-616 DOI:10.3321/j.issn:1005-8737.2006.04.016] |
Wang YG, Lee KL, Najiah M, et al. A new bacterial white spot syndrome (BWSS) in cultured tiger shrimp Penaeus monodon and its comparison with white spot syndrome (WSS) caused by virus. Diseases of Aquatic Organisms, 2000, 41(1): 9-18 |
Xia Y, Yi HX, Fan RB, et al. Effects of dietary lactic acid bacteria on the meat quality of juvenile Litopenaeus vannamei. Journal of Fishery Sciences of China, 2020, 27(1): 74-82 [夏雨, 易华西, 范荣波, 等. 饲喂乳酸菌对凡纳滨对虾幼虾肉质的影响. 中国水产科学, 2020, 27(1): 74-82] |
Zhang CY, Wang YG, Rong XJ. Isolation and identification of causative pathogen for skin ulcerative syndrome in Apostichopus japonicus. Journal of Fisheries of China, 2006, 30(1): 118-123 [张春云, 王印庚, 荣小军. 养殖刺参腐皮综合征病原菌的分离与鉴定. 水产学报, 2006, 30(1): 118-123] |
Zhang YG, Li B, Wang YG, et al. Screening and characteristic analysis of Lactobacillus plantarum from ponds for sea cucumber farming. Progress in Fishery Sciences, 2019, 40(6): 154-162 [张永刚, 李彬, 王印庚, 等. 刺参养殖池塘中一株植物乳杆菌的分离及其生物学特性. 渔业科学进展, 2019, 40(6): 154-162] |
Zhao YC, Yuan L, Wan JL, et al. Effects of potential probiotic Bacillus cereus EN25 on growth, immunity and disease resistance of juvenile sea cucumber Apostichopus japonicus. Fish and Shellfish Immunology, 2016, 49: 237-242 DOI:10.1016/j.fsi.2015.12.035 |
Zhou YH, Liu HZ, Hu XX, et al. Biological characteristics and stress resistance of a Lactobacillus paracasei strain from pickles. Feed Research, 2015(1): 5-8 [周映华, 刘惠知, 胡新旭, 等. 一株泡菜来源副干酪乳杆菌生物学特性及抗逆性研究. 饲料研究, 2015(1): 5-8] |



