2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;
3. 青岛瑞滋集团有限公司 青岛 266408
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071;
3. Qingdao Ruizi Company, Qingdao 266408
刺参(Apostichopus japonicus)自然分布于太平洋西部的中国、俄罗斯、韩国与日本沿海(廖玉麟, 1997)。20世纪80年代,刺参人工育苗技术突破后,刺参养殖业迅猛发展,目前已成为引领我国第五次海水养殖浪潮的主要品种。然而,近年来随着产业规模的急剧扩大,养殖过程中出现的种质退化、疾病频发、产品质量安全等问题日益突出,对刺参养殖的可持续发展构成巨大威胁(王印庚等, 2014)。刺参良种选育和规模化推广是解决上述问题的重要手段之一。中国水产科学研究院黄海水产研究所采用群体选育方法,以抗病力和生长速度为选育目标,经过累代选育,培育出生长速度快、抗病力强、成活率高的刺参“参优1号”新品种(GS-01-016- 2017),为刺参养殖种质提升提供了种质基础。然而,生物的性状表现是环境和基因共同作用的结果,我国海参养殖区域跨度大、养殖模式多样、水域环境复杂,要充分发挥良种的种质潜力,需要对其生态适应性进行科学评价,相应结果也将有助于良种最适养殖区和养殖模式的确定,进而为获得最佳的良种增产贡献率提供科学指导。
pH是水体环境的关键指标,研究表明,pH的升高或降低会对鱼、虾、贝、参等水生动物的存活、生长和免疫酶活性产生直接影响(王双耀等, 2013; 王芸等, 2013; 文春根等, 2009; 韩莎等, 2018a)。在池塘养殖过程中,因天气、浮游藻类繁殖、池底大型藻类生长、底质老化、人工投饵或微生态制剂使用等因素的影响,养殖水体的pH值常会发生波动或剧烈变化,监测结果表明,池塘养殖水体的pH值在4.0~10.0范围内大幅度波动(韩莎等, 2018b)。近年来,在外海海域,受海洋酸化、赤潮、绿潮等影响,外海的pH值也会发生大幅波动。随着刺参养殖产业的发展,尤其是“东参西养”和“北参南养”模式的快速发展,刺参养殖区从最初的自然分布区逐步拓展到黄河三角洲地区和闽浙沿海,刺参的养殖模式涉及外海底播增殖、滩涂的围堰养殖、池塘养殖以及陆基的工厂化养殖等多种模式,养殖用水的pH受相应因素的影响波动较大,pH值变化会对良种的生理、生长及优良性状的表现产生影响。本研究测定了不同pH条件下刺参“参优1号”的生长、存活、呼吸代谢以及非特异性免疫酶活性变化,旨在探明“参优1号”对pH的适应性,分析不同pH条件下“参优1号”苗种的生长、呼吸代谢和免疫等特征变化,进而确定其最适pH条件及其耐受机制,为该良种的推广提供理论依据和参考。
1 材料与方法 1.1 实验材料本实验所用刺参苗种为2019年中国水产科学研究院黄海水产研究所在青岛瑞滋集团有限公司培育的“参优1号”苗种,平均规格为(5.00±0.75) g/头。选取活力良好的个体,在水槽中暂养7 d后进行实验。
1.2 实验方法根据刺参对pH的耐受特点和各养殖模式下海水的pH变化范围,本研究设8个pH梯度:6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0。实验所用海水以砂滤洁净海水为基础,利用NaOH或HCl调节至相应pH,采用pH测定仪测定相应pH,配制好的海水分别储备在单独的1 m3的聚丙烯水槽中。各pH实验组所用养殖水槽为塑料水槽,水槽容积为30 L。以自然海水pH值为基础,按照每天降低或升高0.5个pH对实验用海水进行酸碱度的梯度降低或升高。每个pH实验设置4个平行,每个平行放置30头刺参,其中3个平行用于测定相应实验条件下苗种的生长和存活,另外1个平行用于呼吸代谢和酶活性测定样品的获取。实验期间的养殖管理:每天投喂配合饲料1次,按照刺参体重的2%投喂,每天定时吸底、清污并补充相同pH的储存海水,换水量为50%。实验期间,每天观察并记录各实验组刺参的摄食、运动状况,及时挑出化皮死亡个体并绘制存活率曲线。根据实验前后刺参存活的个体数和平均体重计算各组存活率(Survival rate, SR)和特定生长率(Specific growth rate, SGR),设置相同的实验条件,在第7天测定各组刺参的呼吸代谢,在0、10、20和30 d自各实验组中随机抽取刺参苗种,测定其非特异性免疫酶活性。
1.2.1 不同pH条件下刺参“参优1号”苗种的特定生长率和存活率实验开始时,测定并计算苗种的初始平均体重。实验过程中,每天观察并记录苗种的存活数量,绘制存活率曲线图。实验结束时,测定并计算终末平均体重,采用以下公式计算苗种的存活率和特定生长率:
| $ \begin{array}{*{20}{c}} {存活率\left({{\rm{SR}}} \right) = {N_t}/{N_0} \times 100\% }\\ {特定生长率\left({{\rm{SGR}}} \right) = (ln{W_t}--\ln {W_0}) \times 100/t} \end{array} $ |
式中,N0和Nt分别为刺参初始苗种数量和终末存活苗种数量,W0和Wt分别为刺参苗种的初始平均体重和苗种的终末平均体重(g),t为养殖天数。
1.2.2 不同pH条件下刺参“参优1号”苗种的呼吸代谢各组到达设定的pH条件的第7天测定各实验组刺参的呼吸代谢,实验在2 L呼吸瓶中进行,每个测试瓶中加入相应pH的海水和刺参,每个pH梯度设3个平行组,每组10头刺参,同时设置3个不添加刺参苗种的呼吸瓶作为空白对照组。所有呼吸瓶放入同一个温度为16℃的水槽中以保持相同的温度环境条件(章龙珍等, 2009)。每个呼吸瓶放入刺参苗种并加满相应pH的储存海水后,立即用橡皮塞封口,封口4 h后用虹吸法收集各呼吸瓶中的水样,用碘量法(GB17378.4-2007)和次溴酸钠氧化法(GB17378.4-2007)测定各样品中的溶解氧(DO)和氨氮(NH3-N)浓度,根据如下公式计算相应pH条件下刺参的耗氧率(RO)和排氨率(RN),并进一步测算其氧氮比(O/N)。
| $ \begin{array}{l} 耗氧率({R_{\rm{O}}}) = [({O_0}-{O_{\rm{t}}})V]/(W \times t)\\ 排氨率({R_{\rm{N}}}) = [({N_{\rm{t}}}-{N_0})V]/(W \times t)\\ 氧氮比({\rm{O/N}}) = ({R_{\rm{O}}}/16)/({R_{\rm{N}}}/14) \end{array} $ |
式中,Ot和O0为实验结束时实验组和对照组水体的溶解氧浓度(mg/L),Nt和N0分别为实验结束时实验组和对照组水体的氨氮浓度(mg/L),t为实验周期(h);W为参与测试的刺参苗种的体重(g),V为实验的水体体积(L)。
1.2.3 不同pH条件下刺参“参优1号”苗种的非特异性免疫酶活性变化本研究实验周期为30 d,分别在0 d、10 d、20 d、30 d自各pH组中随机抽取3头刺参苗种,解剖吸取体腔液,4℃条件下,3000 g离心10 min,吸取上清液,进行酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)和超氧化物歧化酶(SOD)的活性测定,酶指标测定选用南京建成生物公司的试剂盒。
1.3 数据处理利用Graphpad Prism 8.0软件进行图表绘制,用SPSS 18.0软件进行单因素方差分析(One-way ANOVA),多重分析采用Turkey检验,按照P < 0.05对不同pH组相应测定指标的差异进行显著性检测。
2 结果与分析 2.1 pH对刺参“参优1号”苗种存活的影响实验期间,不同pH条件下刺参“参优1号”苗种的存活率统计结果见图 1。由图 1可以看出,pH值对苗种存活影响很大,在pH 6.5~9.5条件下,苗种30 d存活率均为100%,且苗种摄食、运动正常,附着力较强,而pH 10.0实验组,苗种活力下降,附着力降低,逐渐沉到水槽底部,摄食减少,部分个体出现化皮和死亡现象,到第4天苗种全部死亡,死亡率达100%。

|
图 1 不同pH条件对刺参“参优1号”苗种的存活影响 Fig.1 Effect of pH on survival rate of sea cucumber "Shenyou No.1" |
由于pH 10.0条件下测试苗种全部死亡,无法计算实验周期内苗种的SGR,对pH 6.5~9.5各实验组苗种的SGR计算结果见图 2。由图 2可以看出,在pH 6.5~9.5之间,苗种的SGR随pH升高呈先升高后降低的趋势。在pH 6.5~7.0之间,苗种的SGR为负值;在pH 7.5~8.5之间,SGR为正值,在pH 9.0~9.5范围内SGR降为负值。在pH 6.5~ 8.0之间,苗种的SGR显著升高(P < 0.05),在pH 8.0~9.5之间,SGR逐渐降低。其中,在pH 8.0实验组SGR最高,最高值为0.541%/d。
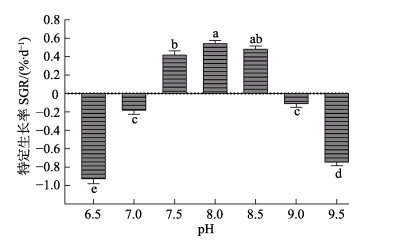
|
图 2 不同pH条件下刺参“参优1号”苗种的特定生长率 Fig.2 Specific growth rate of sea cucumber "Shenyou No.1"under different pH 不同字母表示差异显著(P < 0.05),下同 Different letters indicated significant different (P < 0.05), the same as below |
依据所测得的不同pH条件下的苗种的SGR数据并通过excel数据趋势,推导不同pH条件下生长率曲线公式,在pH 6.5~9.5范围内,pH和苗种SGR的关系可以用以下公式表示:SGR=‒0.6298p2+10.132p‒ 40.195 (R2=0.9892)。据公式推算出刺参“参优1号”在pH条件为8.04时,将获得最大的SGR。
2.3 pH对刺参“参优1号”苗种呼吸代谢的影响不同pH条件下刺参“参优1号”苗种的RO的测定结果见图 3。由图 3可知,在pH 6.5~9.5范围内,随pH的升高RO呈“V”型变化趋势,在pH 6.5~8.0范围内,随着pH的上升RO逐渐降低,并在pH 8.0时达最低[19.07 μg/(g·h)];在pH 8.0~9.5范围内,随pH的升高RO逐渐升高。RO在pH 6.5和pH 9.5组间无显著差异(P > 0.05),均处于较高水平。
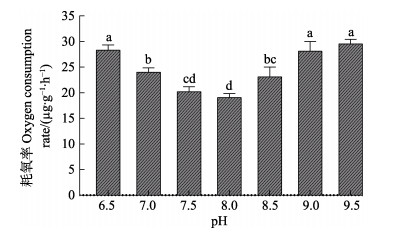
|
图 3 不同pH条件下刺参“参优1号”苗种的耗氧率 Fig.3 Oxygen consumption rate of sea cucumber "Shenyou No.1" under different pH |
不同pH条件下刺参“参优1号”苗种的RN的测定结果见图 4。从图 4可知,不同pH条件下苗种RO变化趋势相似,在pH 6.5~9.5范围内随着pH升高,实验苗种的RN呈“V”型变化趋势,并在pH 8.0时实验组达到最低谷,最低值为1.34 μg/(g·h);并且苗种RN在pH 7.5和pH 8.5之间以及pH 6.5和pH 9.5组间无显著差异(P > 0.05)。
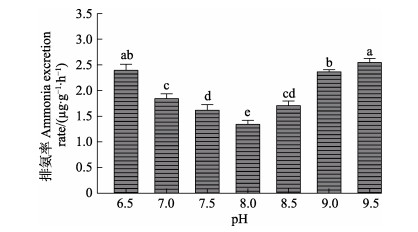
|
图 4 不同pH条件下刺参“参优1号”苗种的排氨率 Fig.4 Ammonia excretion rate of sea cucumber "Shenyou No.1" under different pH |
根据RN和RO计算不同pH条件下刺参苗种的O/N结果见表 1。从表 1可以看出,不同的pH组O/N的值均在11左右,在pH 8.0组苗种的O/N比最高,为12.40±1.17,但不同pH条件下各实验组苗种的O/N无显著差异(P > 0.05)。
|
|
表 1 pH对刺参“参优1号”O/N的影响 Tab.1 Effect of pH on O/N of sea cucumber "Shenyou No.1" |
由于在pH 10.0组实验过程中测试用苗种全部死亡,未对该实验组进行体腔液获取和酶指标的测定。本研究对pH 6.5~9.5条件下苗种的非特异性免疫酶活性(包括ACP、AKP、LZM和SOD)的测定结果见图 5~图 8。
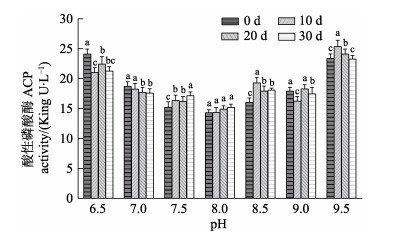
|
图 5 pH对刺参“参优1号”体腔液ACP活性的影响 Fig.5 Effect of pH on ACP activity of coelomic fluid in sea cucumber "Shenyou No.1" |
|
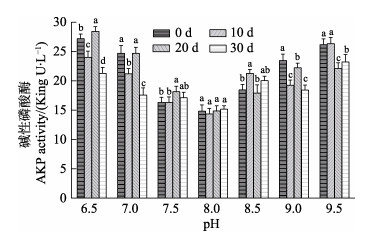
图 6 pH对刺参“参优1号”体腔液AKP活性的影响 Fig.6 Effect of pH on AKP activity of coelomic fluid in sea cucumber "Shenyou No.1" |
|
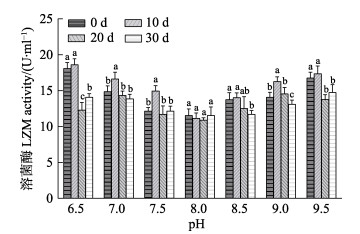
图 7 pH对刺参“参优1号”体腔液LZM活性的影响 Fig.7 Effect of pH on LZM activity of coelomic fluid in sea cucumber "Shenyou No.1" |
|
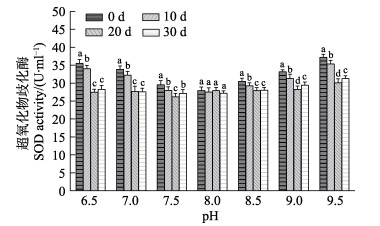
图 8 pH对刺参“参优1号”体腔液SOD活性的影响 Fig.8 Effect of pH on SOD activity of coelomic fluid in sea cucumber "Shenyou No.1" |
对各实验组ACP酶活力的测定结果见图 5,pH为8.0的实验组,在实验周期内的各时间点刺参“参优1号”苗种的ACP活性无显著变化(P > 0.05),其余实验组ACP活性随养殖时间的延长呈波动起伏趋势。对比相同时间节点不同pH条件实验组的酶活力结果可以看出,随着pH的升高ACP活性呈“V”型波动趋势,且在pH 8.0时达到最低值。
对各实验组苗种AKP酶活力的测定结果见图 6,在pH 6.5~9.5范围内,AKP的活性受pH影响变化显著,在pH 6.5~8.0范围内,AKP的活性随pH升高而逐渐降低,并在pH为8.0时达到最低值,且pH 8.0实验组不同时间点刺参“参优1号”苗种的AKP活力没有显著变化(P > 0.05);在pH 8.0~9.5范围内,AKP的活性随pH升高而逐渐升高。
不同pH对刺参“参优1号”体腔液中LZM活性的影响见图 7。从图 7可以看出,在pH 6.5~8.0范围内,LZM的活性随pH升高而逐渐降低,并在pH为8.0时达到最低值,且pH 8.0实验组不同时间点刺参“参优1号”苗种的LZM活力没有显著变化(P > 0.05),pH 8.0~9.5范围内,LZM的活性随pH升高而逐渐升高;除pH 8.0组外,其他实验组LZM的活性随时间均呈先升高再降低的趋势,并在第10天到达到峰值。
不同pH对刺参“参优1号”体腔液中SOD活性的影响见图 8。从图 8可以看出,在pH 6.5~9.5范围内,0 d和10 d时SOD活性随pH的升高呈“V”型变化趋势,最低值在pH 8.0;20 d和30 d时pH的变化对SOD的活性影响相对较小;pH 8.0实验组在实验周期内的不同时间点,刺参“参优1号”苗种的SOD活力变化不显著(P > 0.05);此外,各实验组SOD活性均在0 d时最高,在第10天时活性呈降低趋势,在20 d和30 d时活性较低。
3 讨论 3.1 刺参“参优1号”苗种在不同pH条件下的适应性水体pH值是水产养殖过程中的一个重要的环境因子,pH的高低直接影响水生动物的生长及生理代谢(曹善茂等, 2015; Hu et al, 2015)。刺参在pH不适时会出现棘刺收缩、身体卷曲、粪便变细变短、池底的残饵量增加等现象。在刺参养殖过程中,水体中的pH会因养殖管理、酸雨和水体污染等因素的影响而产生波动,而且不同池塘pH也存在差异,对水产新品种而言,选育目标性状决定了其在养殖业中的应用潜力,而新品种生态适应性则决定了其推广范围和区域。刺参“参优1号”是以抗灿烂弧菌(Vibrio splendidus)能力和生长速度为选育目标培育出的刺参新品种,为获得最大的良种贡献率,需要对该品种的酸碱度适应范围进行评估,以期根据不同区域养殖水域pH范围进行合理推广,从而发挥良种的最大贡献率。
水产动物对pH的适应范围存在物种的差异。相关研究表明,黄颡鱼(Pseudobagrus fuvlidraco)在pH 7.0~8.0范围内生长较好(崔平等, 2018),缢蛏(Sinonovacula constricta)在pH 7.5~9.5可正常存活(叶博等, 2019),中华绒螯蟹(Eriocheir sinensis)在幼蟹时期适宜的pH范围为8.0~9.0 (刘金生等, 2016)。在本研究中,pH 10.0实验组第4天苗种全部死亡,是由于水体碱性过高,刺参出现急性中毒现象;在pH 7.5~8.5之间苗种呈正生长,超出或低于此范围,苗种呈现负增长。研究表明,pH值过高或过低导致海洋生物生长发育缓慢,是因为酸碱度的变化导致生物体内渗透压发生改变,为了维持体内的酸碱平衡,必然会转移部分用于其他生理过程的能量进行反馈补偿性代谢,从而影响了生物其他的正常生理活动,导致生长发育变慢(湛垚垚等, 2013)。刘洋等(2020)研究发现,海湾扇贝(Argopecten irradia)幼虫在pH低于7.6的条件下出现生长停滞现象。Asha等(2005)研究发现,尖塔海参(Holothuria spinifera)幼虫的最适生存pH为7.8,在pH达到9.0的时候实验个体已全部死亡。本研究缓慢调节pH后30 d的养殖实验结果表明,刺参“参优1号”的存活pH为6.5~9.5,最适生长pH为7.5~8.5。韩莎等(2018b)研究表明,青岛国家海洋科研中心选育的刺参苗种适宜生长的pH范围为7.6~8.8,与本研究结果相近。Luo等(2019)调研了大连刺参养殖池塘的pH年变化范围为7.86~8.38,表明该地酸碱度符合“参优1号”苗种的pH适应性,有利于良种优势性状的发挥。
3.2 刺参“参优1号”在不同pH条件下的呼吸代谢特征pH波动会对水生生物产生一定的刺激,从而导致呼吸代谢变化(Stumpp et al, 2011、2012)。曹善茂等(2015)研究表明,中华原钩虾(Eogammarus sinensis)在最适pH范围内的RO和RN均处在较高水平,Savant等(1995)的研究也呈现相同的趋势。而朱爱意等(2007)研究显示,褐菖鲉(Sebastiscus marmoratus)在最适pH范围内的RO和RN相对较低,在pH不适时RO和RN会提高。本研究结果显示,pH 8.0实验组刺参的RO和RN最低,pH偏移会使RO和RN上升,是由于在适宜的pH下,机体的基础代谢较低,耗能较少;在pH胁迫下,机体需要消耗更多的能量去维持体内的内环境平衡,此趋势与章龙珍等(2009)对长鳍篮子鱼(Siganus canaliculatus)幼鱼的研究结果类似。
氧氮比(O/N)是反映生物对环境适应情况和营养物质供能情况的指标(Ikeda, 1974),不同的生物之间O/N受pH影响的变化趋势存在差异。O/N表示生物体内蛋白质、脂肪和碳水化合物分解代谢之间的关系(曹善茂等, 2015)。Mayzalld(1976)提出,O/N约为7时,生物体能量完全由蛋白质氧化提供;Ikeda (1974)认为,O/N约为24时,生物体所需能量由蛋白质和脂肪氧化提供;如果主要由脂肪或碳水化合物提供,O/N将变为无穷大(Conover et al, 1968)。相关研究表明,中华小长臂虾(Palaemonetes sinensis)在pH 4.0~9.0之间O/N呈波动趋势,pH的升高会使长肋日月贝(Amusium pleuronectes)的O/N升高,在pH 7.7和pH 8.7的水体中文蛤(Meretrix meretrix)O/N显著高于pH 6.7和pH 9.7(姜宏波等, 2017; 严俊贤等, 2018; 杨杰青等, 2016)。本研究表明,pH的变化对刺参O/N无显著影响,说明pH的变化不会改变刺参代谢底物,与上述研究结果不同的原因可能由于物种差异所致。
3.3 刺参“参优1号”苗种在不同pH条件下的免疫酶活性特征水体中pH过高或者过低会影响刺参体腔液的酸碱度,直接影响其各种生理过程。另外,pH变化还会导致有益微生物的大量死亡,病原菌及有害生物的大量繁殖打破了水体中的生态平衡,进而间接影响到刺参机体的代谢和免疫过程。研究表明,pH胁迫会影响水产动物免疫酶的活性(魏炜等, 2001; 王维娜等, 2002),因此,可以通过检测刺参体内主要免疫酶的活性来反映对pH的适应情况。ACP和AKP是动物体内参与免疫防御等活动的2种重要的水解酶, 是溶酶体酶的重要标志酶(文春根等, 2009)。超氧化物歧化酶(SOD)是生物体内重要的抗应激酶,它可以将机体内过多的O2–催化生成H2O2和O2,从而起到保护机体的作用(Sui et al, 2016)。本研究结果表明,pH变化显著影响了刺参“参优1号”的ACP、AKP、LZM和SOD活性。从相同pH条件下30 d实验期内酶指标的测定结果可以看出,LZM活性在第10天最高,SOD活性在第0天最高,而后开始降低,ACP和AKP则随时间延长呈波动变化,表明刺参体腔细胞在应对pH变化过程中,不同酶指标的变化响应时间存在差异性。Gullian等(2017)研究发现,墨西哥海参体内的SOD在pH 7.7的时候活性较高。Zhao等(2010)通过添加酵母多糖进行pH胁迫(pH为5.5和10.0) 24 h后,使LSZ和ACP活性升高,但其仅代表 24 h的数据,并未验证该pH条件下海参能否长期存活。赵先银等(2011)研究发现,对虾的多种酶活性对不同pH条件的响应时间也存在差异。从不同的pH组之间酶指标的测定结果可以看出,4种免疫酶的活性均在最适生长的pH 8.0实验组最低,随着pH的偏移,4种免疫酶活性均出现升高趋势,变化趋势与付监贵等(2016)对日本沼虾(Macrobrachium nipponense)的研究结果类似;樊甄姣等(2006)对栉孔扇贝(Chlamys farreri)的研究也发现,在pH 7.0~9.0之间,实验组呈现出随pH偏移,各种酶活性升高的现象;文春根等(2009)研究发现,无齿蚌(Anodonta woodiana)体内的多种免疫酶活性随pH的改变而出现波动变化,可能是为避免环境对机体的损伤而发生的免疫调节反应,也可能是由“毒物兴奋效应”所导致(Calabrese et al, 2005)。
综上所述,在刺参“参优1号”苗种养殖生产过程中应保持水体pH在7.5~8.5范围内,苗种生长速度较快,pH过高或过低均会引起刺参的应激反应,表现为生长下降和存活率降低等现象,生理指标表现为RO和RN升高以及免疫酶活性发生变化。因此,在良种推广过程中,应根据相应海域或养殖模式下的pH周年变化范围,选择适宜的推广区域并控制养殖管理工艺,避免暴雨、水体污染等自然或人为因素造成pH大幅波动,保障良种在适宜的环境条件下生长,以获得最佳的良种贡献率。
Asha PS, Muthiah P. Effects of temperature, salinity and pH on larval growth, survival and development of the sea cucumber Holothuria spinifera Theel. Aquaculture, 2005, 250(3-4): 823-829 DOI:10.1016/j.aquaculture.2005.04.075 |
Calabrese E, Cook R. Hormesis: How it could affect the risk assessment process. Human and Experimental Toxicology, 2005, 24(5): 265-270 DOI:10.1191/0960327105ht523oa |
Cao SM, Song B, Wang LM, et al. Effect of temperature, salinity and pH on respiration and excretion in gammarid Eogammarus sinensis. Journal of Dalian Ocean University, 2015, 30(5): 519-532 [曹善茂, 宋博, 王利明, 等. 温度、盐度和pH对中华原钩虾呼吸和排泄的影响. 大连海洋大学学报, 2015, 30(5): 519-523] |
Conover RJ, Corner DES. Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles. Journal of the Marine Biological Association of the United Kingdom, 1968, 48(1): 49-75 DOI:10.1017/S0025315400032410 |
Cui P, Qiang J. Growth and hepatic SOD activity of darkbarbel catfish Pelteobagrus vachelli under influences of water pH and ammonia nitrogen. Freshwater Fisheries, 2018(4): 39-44 [崔平, 强俊. pH与氨氮对黄颡鱼幼鱼生长与肝脏超氧化物歧化酶的影响. 淡水渔业, 2018(4): 39-44 DOI:10.3969/j.issn.1000-6907.2018.04.006] |
Fan ZJ, Yang AG, Liu ZH, et al. Effect of pH on the immune factors of Chlamys farreri. Journal of Fishery Sciences of China, 2006, 13(4): 650-654 [樊甄姣, 杨爱国, 刘志鸿, 等. pH对栉孔扇贝体内几种免疫因子的影响. 中国水产科学, 2006, 13(4): 650-654 DOI:10.3321/j.issn:1005-8737.2006.04.022] |
Fu JG, Zhang LL, Xu L, et al. Effects of pH on survival of oriental river prawn (Macrobrachium nipponense) and activities of liver function enzymes. Freshwater Fisheries, 2016, 46(5): 100-104 [付监贵, 张磊磊, 徐乐, 等. pH对日本沼虾存活及肝功能相关酶活性的影响. 淡水渔业, 2016, 46(5): 100-104 DOI:10.3969/j.issn.1000-6907.2016.05.017] |
Gullian KM, Terrats PM. Effect of pH on temperature-controlled degradation of reactive oxygen species, heat shock protein expression, and mucosal immunity in the sea cucumber Isostichopus badionotus. PLoS One, 2017, 12(4): e0175812 DOI:10.1371/journal.pone.0175812 |
Han S, Hu W, Li CL, et al. Effect of pH stress on growth and activities of immune enzyme of different-sized sea cucumber, Apostichopus japonicus Selenka. Marine Sciences, 2018a, 42(11): 51-58 [韩莎, 胡炜, 李成林, 等. pH胁迫对不同规格刺参生长及免疫酶活性的影响. 海洋科学, 2018a, 42(11): 51-58] |
Han S, Hu W, Li CL, et al. Effects of pH stress on survival rate, growth and antioxidant enzyme activities of the sea cucumber, Apostichopus japonicus Selenka. Progress in Fishery Sciences, 2018b, 39(5): 91-98 [韩莎, 胡炜, 李成林, 等. pH胁迫对刺参存活、生长及抗氧化酶活性的影响. 渔业科学进展, 2018b, 39(5): 91-98] |
Hu M, Li L, Sui Y, et al. Effect of pH and temperature on antioxidant responses of the thick shell mussel Mytilus coruscus. Fish and Shellfish Immunology, 2015, 46(2): 573-583 DOI:10.1016/j.fsi.2015.07.025 |
Ikeda T. Nutrition ecology of marine zooplankton. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 1-97 |
Jiang HB, Bao J, Jiang CJ, et al. Effects of pH on survival and respiratory metabolism of Chinese grass shrimp (Palaemonetes sinensis). Chinese Journal of Zoology, 2017, 52(2): 322-330 [姜宏波, 包杰, 姜春玖, 等. pH对中华小长臂虾存活及呼吸代谢的影响. 动物学杂志, 2017, 52(2): 322-330] |
Liao YL. Fauna Sinica Echinodermata Holothuroidea. Beijing: Science Press, 1997: 148-150 [廖玉麟. 中国动物志棘皮动物门海参纲. 北京: 科学出版社, 1997: 148-150]
|
Liu JS, Wang J, Yue WC, et al. The effect of pH on the molting, growth and related gene expression in juvenile mitten crab, Eriocheir sinensis. Freshwater Fisheries, 2016, 46(4): 96-100 [刘金生, 王军, 岳武成, 等. 水体pH对中华绒螯蟹幼蟹蜕壳生长及其相关基因表达的影响. 淡水渔业, 2016, 46(4): 96-100 DOI:10.3969/j.issn.1000-6907.2016.04.016] |
Liu Y, Yu RH, Zhang Z, et al. Effects of different pH on embryo development and larval growth of bay scallop (Argopecten irradia). Progress in Fishery Sciences, 2020, 41(6): 108-114 [刘洋, 于瑞海, 张哲, 等. 不同pH对海湾扇贝胚胎发育及幼虫生长发育的影响. 渔业科学进展, 2020, 41(6): 108-114] |
Luo YM, Cheng Y, Li DH, et al. Annual variation of water quality in aquaculture ponds for Apostichopus japonicus. Asian Agricultural Research, 2019, 11(11): 25-27 |
Mayzalld P. Respiration and nitrogen excretion of zooplankton Ⅳ: The influence of starvation on the metabolism and the biochemical composition of some species. Marine Biology, 1976, 37: 47-58 DOI:10.1007/BF00386778 |
Savant KB, Amte GK. Influence of some environmental factors on respiratory responses in the tropical estuarine crab Ilyoplax gangetica. Journal of Environmental Biology, 1995, 16(4): 311-317 |
Stumpp M, Trübenbach K, Brennecke D, et al. Resource allocation and extracellular acid-base status in the sea urchin Strongylocentrotus droebachiensis in response to CO2 induced seawater acidification. Aquatic Toxicology, 2012, 110-111: 194-207 DOI:10.1016/j.aquatox.2011.12.020 |
Stumpp M, Wren J, Melzner F, et al. CO2 induced seawater acidification impacts sea urchin larval development Ⅰ: Elevated metabolic rates decrease scope for growth and induce developmental delay. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2011, 160(3): 331-340 DOI:10.1016/j.cbpa.2011.06.022 |
Sui YM, Huang XZ, Kong H, et al. Physiological responses to salinity increase in blood parrotfish (Cichlasoma synspilum female×Cichlasoma citrinellum male). Springerplus, 2016, 5(1): 1-12 DOI:10.1186/s40064-015-1659-2 |
Wang SY, Wang X, Jiang ZQ, et al. Effects of pH on growth and biochemical indices of juvenile turbot (Scophthalmus maximus). Journal of Guangdong Ocean University, 2013, 33(6): 42-46 [王双耀, 王鑫, 姜志强, 等. pH值对大菱鲆生长及鱼体生化组成的影响. 广东海洋大学学报, 2013, 33(6): 42-46] |
Wang WN, Sun RY, Wang AL, et al. Effect of different environmental factors on the activities of digestive enzymes and alkaline phosphatase of Macrobrochium nipponense. Chinese Journal of Applied Ecology, 2002, 13(9): 1153-1156 [王维娜, 孙儒泳, 王安利, 等. 环境因子对日本沼虾消化酶和碱性磷酸酶的影响. 应用生态学报, 2002, 13(9): 1153-1156 DOI:10.3321/j.issn:1001-9332.2002.09.023] |
Wang Y, Li J, Zhang Z, et al. Effect of pH and ammonia-N stresses on HSP90 gene expression of Fenneropenaeus chinensis. Progress in Fishery Sciences, 2013, 34(5): 43-50 [王芸, 李健, 张喆, 等. pH、氨氮胁迫对中国对虾HSP90基因表达的影响. 渔业科学进展, 2013, 34(5): 43-50 DOI:10.3969/j.issn.1000-7075.2013.05.007] |
Wang YG, Rong XJ, Liao MJ, et al. Sea cucumber culture and disease control technology. Beijing: China Agriculture Press, 2014 [王印庚, 荣小军, 廖梅杰, 等. 刺参健康养殖与病害防控技术丛解. 北京: 中国农业出版社, 2014]
|
Wei W, Zhang HY, Shi AJ. The study of relationship between acid phosphatase activity and oyster defence. Acta Hydrobiologica Sinica, 2001(4): 413-415 [魏炜, 张洪渊, 石安静. 育珠蚌酸性磷酸酶活力与免疫反应关系的研究. 水生生物学报, 2001(4): 413-415 DOI:10.3321/j.issn:1000-3207.2001.04.018] |
Wen CG, Zhang LH, Hu BQ, et al. Effect of pH on the five immune factors of Anodonta woodiana. Journal of Nanchang University (Natural Science), 2009, 33(2): 172-176 [文春根, 张丽红, 胡宝庆, 等. pH对背角无齿蚌(Anodonta woodiana)5种免疫因子的影响. 南昌大学学报(理科版), 2009, 33(2): 172-176 DOI:10.3969/j.issn.1006-0464.2009.02.018] |
Yan JX, Chen MQ, Wu KC, et al. Effect of salinity and pH on oxygen consumption rate and ammonia excretion rate in Asian moon scallop Amusium pleuronectes. Fisheries Science, 2018, 37(2): 181-186 [严俊贤, 陈明强, 吴开畅, 等. 盐度和pH对长肋日月贝耗氧率和排氨率的影响. 水产科学, 2018, 37(2): 181-186] |
Yang JQ, Jiang M, Li L, et al. Effects of pH and salinity on respiration and excretion in Meretrix meretrix. Marine Fisheries, 2016, 38(4): 406-414 [杨杰青, 蒋玫, 李磊, 等. pH、盐度对文蛤呼吸与排泄的影响. 海洋渔业, 2016, 38(4): 406-414 DOI:10.3969/j.issn.1004-2490.2016.04.008] |
Ye B, Cheng ZY, Peng MX, et al. Effects of pH and carbonate alkalinity on survival rate, Na+/K+-ATPase activity and phagocytic ability of the razor clam (Sinonovacula constricta). Journal of Fisheries of China, 2019, 43(8): 1724-1732 [叶博, 程之扬, 彭茂潇, 等. 急性pH和碳酸盐碱度对缢蛏存活率, Na+/K+-ATPase活性及血淋巴吞噬能力的影响. 水产学报, 2019, 43(8): 1724-1732] |
Zhan YY, Huang XY, Duan LZ, et al. Review on the impacts of ocean acidification on nearshore marine life. Journal of Dalian University, 2013, 34(3): 79-84 [湛垚垚, 黄显雅, 段立柱, 等. 海洋酸化对近岸海洋生物的影响. 大连大学学报, 2013, 34(3): 79-84 DOI:10.3969/j.issn.1008-2395.2013.03.018] |
Zhang LZ, Yang JH, Liu JY, et al. Effects of water temperature, salinity, pH, and anaesthetics on oxygen consumption rate of juvenile Siganus canaliculatus. Chinese Journal of Ecology, 2009, 28(8): 1494-1498 [章龙珍, 杨金海, 刘鉴毅, 等. 温度, 盐度, pH和麻醉剂对长鳍篮子鱼幼鱼耗氧率的影响. 生态学杂志, 2009, 28(8): 1494-1498] |
Zhao W, Liang M, Zhang P. Effect of yeast polysaccharide on the immune function of juvenile sea cucumber, Apostichopus japonicus Selenka under pH stress. Aquaculture International, 2010, 18(5): 777-786 DOI:10.1007/s10499-009-9300-4 |
Zhao XY, Li J, Chen P, et al. Effects of pH stress on survival rate and activities of ion-transport enzyme, immune-related enzymes in three species of shrimps. Journal of Shanghai Ocean University, 2011, 20(5): 720-728 [赵先银, 李健, 陈萍, 等. pH胁迫对3种对虾存活率、离子转运酶和免疫酶活力的影响. 上海海洋大学学报, 2011, 20(5): 720-728] |
Zhu AY, Zhao XJ, Fu J. Study on the oxygen consumption rate and asphyxiation point of Sebastiscus marmoratus. Marine Fisheries Research, 2007, 28(1): 95-100 [朱爱意, 赵向炯, 付俊. 褐菖鲉耗氧率及窒息点的初步研究. 海洋水产研究, 2007, 28(1): 95-100] |



