2. 贵州大学特种水产研究所 贵州 贵阳 550025
2. Special Fisheries Research Institute, Guizhou University, Guiyang, Guizhou 550025, China
裂腹鱼类是原始鲃类随着青藏高原隆升而分化形成的一个自然类群,栖息于我国青藏高原及邻近地区的河流、湖泊(乐佩琦, 2000; 王绪祯等, 2016)。四川裂腹鱼(Schizothorax kolzovi)分布于我国长江水系金沙江、雅砻江和乌江上游以及珠江水系北盘江等(伍律, 1989; 乐佩琦, 2000)。
遗传多样性是指种内个体之间或一个群体内不同个体的遗传变异总和。遗传多样性是进化和适应的基础,种群遗传多样性或变异性愈丰富,物种对环境变化的适应能力愈强,其进化潜力也愈大(施立明, 1990)。生物种群遗传变异的大小与其进化速率成正比,通过遗传多样性研究可以揭示物种或种群的进化历史,也能为进一步分析其进化潜力和未来命运提供资料(Soltis, 1991)。研究表明,气候变化、过度捕捞、生境破碎化、人为干扰等一系列因素可影响物种种群的遗传多样性,而种群遗传多样性的降低会影响其适合度,进而加剧物种局域灭绝的风险(Fourtuneet al, 2016; Bertin et al, 2017)。
扩增片段长度多态性(amplified fragment length polymorphism, AFLP)标记是近年来发展起来的一种研究生物群体遗传多样性的技术,具有灵敏度高、重复性好、信息量丰富、不需要预先了解物种基因组序列信息以及呈孟德尔式和共显性遗传等优点(王伟继等, 2005; 叶宁等, 2017)。该技术用少量引物组合即可检测到大量多态位点,获得丰富的遗传信息,是研究基因组DNA变异的有效方法,现已被广泛用于水生动物遗传多样性研究。Sharifi等(2015)利用7对AFLP引物对波斯湾乌鲳(Parastromateus niger)进行了遗传多样性研究,检测到阿巴斯港、布什尔港和阿巴丹沿海水域乌鲳群体多态性条带数占总条带数比例分别为73.61%、91.30%和84.78%。叶宁等(2017)对凡纳滨对虾(Litopenaeus vannamei)引进群体与养殖群体遗传多样性的AFLP分析中,用筛选出的7对引物共计扩增了90个多态位点,多态位点数占总位点数比例达85.71%。
乌江位于贵州境内,为长江上游右岸最大的支流,河流落差大,鱼类多样性丰富(史方, 2010)。四川裂腹鱼为乌江上游重要野生经济鱼类。迄今,有关四川裂腹鱼的研究主要集中在对其生理生化特性、生物学特征、核型、基因克隆以及基于线粒体DNA测序的种群遗传多样性等方面(代应贵等, 2010; 张晓杰等, 2011; 李忠利等, 2015; He et al, 2016; 何勇凤等, 2017; Dai et al, 2018),而采用AFLP分子标记基于全基因组信息的四川裂腹鱼种群遗传结构及多样性研究尚未见报道。本研究采用AFLP技术对乌江上游六冲河四川裂腹鱼种群进行遗传结构及多样性检测和分析,旨在深入揭示其种群遗传多样性的现状,为其种群保护以及种质资源的开发利用提供科学依据。
1 材料与方法 1.1 样品采集2010年于乌江上游支流六冲河赫章、大河、维新、金龙等采样点(图 1),用刺网采集的四川裂腹鱼样品数分别为7、8、10、5,共计30尾。解剖取其背部肌肉样品,用酒精固定,带回实验室于–20℃冰箱保存备用。

|
图 1 乌江四川裂腹鱼样品采集点 Fig.1 Map of the sampling sites for S. kolzovi in the Wujiang River |
采用北京天根生化科技有限公司提供的动物组织DNA提取试剂盒及方法提取基因组DNA。用1%的琼脂糖凝胶电泳检测DNA的完整性和纯度。用无菌双蒸水溶解,4℃保存备用。
1.3 AFLP分析AFLP分析所用的接头和引物由上海生工生物工程技术服务有限公司合成。AFLP实验过程包括基因组DNA双酶切(EcoRⅠ和MseⅠ)。酶切连接一步进行,其连接产物用于后续的预扩增和选择性扩增反应。预扩增反应体系为25 μL,含模板DNA 2 μL,Pre-Amp Mix 1 μL,dNTPs 1 μL,10×PCR buffer 2.5 μL,Taq DNA polymerase 0.5 μL,H2O 18 μL。离心数秒,其PCR反应程序:94℃变性2 min,94℃变性30 s,56℃复性30 s,72℃延伸80 s,72℃延伸5 min,循环30轮。经预扩增实验筛选出形成清晰条带的选择性扩增引物组合,对30尾四川裂腹鱼个体进行选择性扩增。将预扩增产物按1∶20稀释,作为选择性扩增反应的模板。选择性扩增反应体系为25 μL,含预扩增稀释样品2 μL,10×PCR buffer 2.5 μL,dNTPS 0.5 μL,EcoRⅠ引物1 μL,MseⅠ引物1 μL,Taq酶0.5 μL,H2O 17.5 μL。混匀,离心数秒,PCR反应程序:94℃ 30 s,65℃ 30 s,72℃ 80 s (每轮循环温度递减0.7℃,12轮),94℃ 30 s,55℃ 30 s,72℃ 80 s,循环23轮。PCR产物4℃保存。
采用贝克曼库尔特公司CEQ8000遗传分析系统,运用荧光标记技术和毛细管电泳分离技术,使PCR产物在毛细管中电泳分离,以激光激发荧光采集数据,电泳结果通过软件自动统计分析并转换成"0、1"矩阵,保存于Excel表格供数据处理。
1.4 数据处理及计算用Popgene 1.32软件统计位点总数、多态位点数,计算观测等位基因数(Na)、有效等位基因数(Ne)、Nei多样性指数(H)、Shannon信息指数(I)和多态位点比例(PPL)等遗传参数。利用NTSYS 2.10软件计算个体间遗传相似性系数S,采用公式D=l–S计算遗传距离,并用MEGA 6.0软件基于遗传距离构建个体间的UPGMA、NJ系统树。
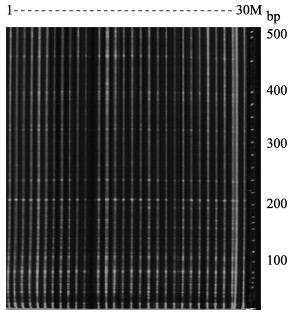
2 结果 2.1 不同AFLP引物组合的扩增结果通过预扩增实验筛选,获得了形成扩增条带丰富、图谱分布清晰的7对引物(表 1)。用该7对引物对30尾四川裂腹鱼基因组DNA进行选择性扩增,形成了条带清晰的电泳指纹图谱(图 2)。
|
|
表 1 乌江四川裂腹鱼种群7对引物扩增片段多态性指标 Tab.1 Polymorphic indices of amplification fragment with 7 primer pairs for S. kolzovi population in the Wujiang River |
|
图 2 乌江四川裂腹鱼种群AFLP扩增结果 Fig.2 Results of AFLP amplification of S. kolzovi population from the Wujiang River 引物组合E-AGG/M-CTA。1~30表示样品编号;M为DNA marker Primer pair E-AGG/M-CTA. 1~30 represent sample numbers, and M represents DNA marker |
在30尾四川裂腹鱼中,用7对引物共计扩增到856个片段,代表856个扩增位点。其中,多态位点为796个,多态位点数占总位点数的比例为92.99% (表 1)。该7对引物扩增的片段数在5~73之间,片段长度为69~500 bp,总位点数为84~155,多态位点数为83~141个。以引物组合E-AGG/M-CTA扩增的多态位点最多,达155个;引物组合E-AAC/M-CAC扩增的多态位点最少,仅83个。
由表 1可知,该群体中7对引物检出的基因型数与样本数相同,均为30,即基于每对引物每个个体的扩增电泳图谱与其他个体都不相同,表明30尾四川裂腹鱼个体之间在DNA序列上存在差异,并且用每对引物均能检测出个体之间的遗传差异。
2.2 乌江四川裂腹鱼种群的遗传多样性基于30尾四川裂腹鱼扩增的856个AFLP位点,计算了每个引物组合扩增的遗传多样性参数(表 2)。该7对引物对应的观测等位基因数(Na)、有效等位基因数(Ne)、Nei多样性指数(H)和Shannon信息指数(I)平均值分别为1.933 6、1.338 8、0.212 2和0.338 7。
|
|
表 2 乌江四川裂腹鱼种群遗传多样性参数 Tab.2 Parameters of genetic diversity for S. kolzovi population in the Wujiang River |
基于7对引物的扩增结果,30尾裂腹鱼个体之间的遗传距离为0.169 1~0.531 9,平均值为0.306 8。
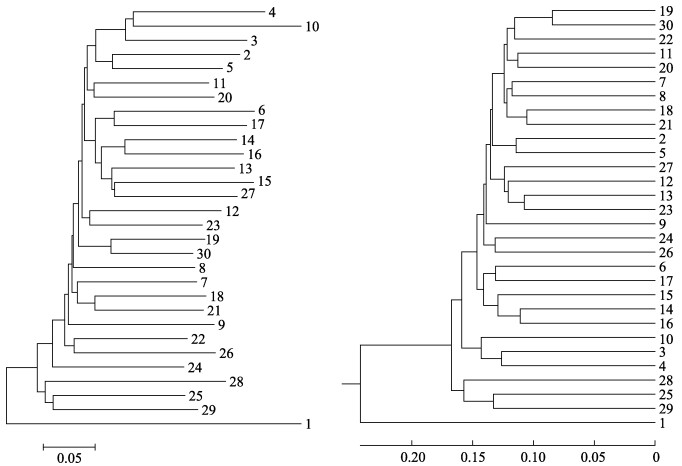
根据遗传距离构建的30尾四川裂腹鱼NJ、UPGMA系统树拓扑结构相似,均由2个分支构成。其中,个体1为一个分支,而其余29个个体聚为另一个分支(图 3)。
|
图 3 30尾乌江四川裂腹鱼种群NJ (左)和UPGMA (右)系统树 Fig.3 NJ phylogenetic tree (on the left) and UPGMA phylogenetic tree (on the right) based on genetic distance between the 30 individuals of S. kolzovi from the Wujiang River |
检测和评价生物种群遗传变异及多样性的分子标记方法主要有两类:一类是在特定条件下,以基因组DNA为模板扩增出不同长度的DNA片段,经电泳获得不同的指纹图谱,进而分析其遗传多样性;另一类是对基因组特定DNA片段进行直接测序,检测其碱基序列的变异。基于DNA扩增片段长度多态性的分子标记常采用RAPD、RFLP、AFLP以及SSR等技术(马召腾等, 2011)。其中,AFLP分子标记技术兼有RFLP技术高重复性和PCR技术简便快捷等优点,却克服了RFLP技术复杂和RAPD稳定性差的缺点(刘祥芳等, 2017)。AFLP检测位点真实性高且扩增的条带丰富(卢建峰等, 2010)。韩志强等(2007)采用AFLP、RAPD和Cytb等标记对半滑舌鳎(Cynoglossus semilaevis)群体遗传变异研究表明,以AFLP标记对半滑舌鳎群体间遗传差异的检测最为灵敏。本研究中,用7对引物进行AFLP分子标记,共检测到乌江四川裂腹鱼种群856个位点,其中,多态位点796个(表 1),从而较好地反映了群体的遗传结构并显示该种群有较丰富的遗传变异。
丰富的遗传多样性意味着物种具有较高的适应生存潜力、蕴藏着较大的进化潜能以及较丰富的育种和遗传改良的潜力,而种群贫乏的遗传多样性则会给物种生存、进化及种质资源的保护和利用带来不利影响(季维智等, 1999)。多态位点比例(PPL)、有效等位基因数(Ne)、Nei多样性指数指数(H)、Shannon信息指数(I)是衡量群体遗传多样性的常用指标。本研究中,乌江四川裂腹鱼种群的PPL、Ne、H和I平均值分别为93.36%、1.338 8、0.212 2和0.338 7 (表 2),与塔里木裂腹鱼(Schizothorax biddulphi)塔什库尔干河群体(PPL=90.62%、H=0.376 2、I=0.544 3) (杨天燕等, 2012)和齐口裂腹鱼(Schizothorax prenanti)野生种群(PPL=87.28%) (宋昭彬, 2005)处于同一水平,高于已被证实遗传多样性较低的野生哲罗鱼(Hucho taime)呼玛河、海青、虎头、抓吉群体(PPL=43.6%~55.64%、Ne=1.254 1~1.335 3、H=0.148 0~0.195 3、I=0.221 5~ 0.291 3) (佟广香等, 2009)、长江合江江段岩原鲤(Procypris rabaudi)种群(PPL=46.89%) (宋君等, 2005)。AFLP标记的遗传符合孟德尔定律(王伟继等, 2005; 叶宁, 2017),因此,在数据分析中可将1个扩增位点视为1个基因,1个个体的全部扩增位点组合即为该个体的基因型。本研究中,基于30个个体,用7对引物共计获得了乌江四川裂腹鱼种群30个基因型(表 1),即每个个体均具有各自独特的基因型。因此,乌江四川裂腹鱼种群具有较丰富的遗传多样性。除AFLP标记外,线粒体DNA分子标记也常用于鱼类种群遗传多样性研究(韩志强等, 2007; 刘滨等, 2013; 黄镇宇等, 2019)。代应贵等(2010)基于mtDNA控制区464 bp不完全序列的测序结果分析了乌江四川裂腹鱼种群遗传多样性,结果表明该种群遗传多样性较低。这可能低估了乌江四川裂腹鱼种群遗传多样性的水平。可见,本研究采用AFLP标记比采用线粒体DNA分子标记检测出了该种群更丰富的遗传变异和多样性。乌江四川裂腹鱼种群丰富的遗传多样性表明,四川裂腹鱼在乌江上游水域生境具有较强的适应能力、生存能力和进化潜力,乌江四川裂腹鱼种群具有较好的种质资源价值。
四川裂腹鱼在乌江水系仅分布于乌江上游(伍律, 1989)。乌江上游为位于化物基村上游的乌江河段,主要有六冲河、三岔河2条支流。其中,六冲河少部分河段为喀斯特地表下浅层伏流。三岔河沿岸为煤矿分布区(郭振春, 2004) (图 1),受煤矿污染河水常年乌黑浑浊,野生鱼类资源贫乏,本研究未能在该支流采集到四川裂腹鱼样品。乌江蕴藏着丰富的水力资源,是国家梯级水电开发的重要基地。乌江中、上游先后规划修建了普定电站、引子渡电站、洪家渡电站、东风电站和索风营电站,至2005年已全部截流蓄水(郭艳娜等, 2010; 沛吉, 2003) (图 1)。这些电站大坝的修建,改变了河流的水流情势,使河流环境由急流变为缓流乃至静水,阻断了鱼类的洄游路径,导致该河流中适应原急流环境的土著鱼类分布区缩小。目前,四川裂腹鱼主要分布于洪家渡电站大坝以上的六冲河河段(詹会祥等, 2009)。另一方面,多年来六冲河沿岸渔民的酷渔滥捕已使该支流中四川裂腹鱼种群数量急剧减少,个体呈现出明显低龄化的特点(李忠利等, 2015)。可见,受水域污染、水电站建坝和过度捕捞等的影响,四川裂腹鱼在乌江上游分布区已缩小,种群数量减少,处于生态受威胁状态。因此,尽管乌江四川裂腹鱼种群仍保存着较丰富的遗传多样性,但仍需开展对乌江四川裂腹鱼种群及种质资源的保护。
研究表明,进行DNA扩增片段长度多态性分析中,当用于群体遗传多样性研究的样本量不少于30时,基于不同样本数量获得的群体遗传多样性参数值差异不显著(戴习林等, 2017)。本研究中,乌江四川裂腹鱼种群样本量为30,刺网捕捞采样设置的4个采样点覆盖了乌江上游六冲河的全部河段,采集的四川裂腹鱼标本样品代表性强。因此,本研究获得的乌江四川裂腹鱼种群遗传多样性参数结果具有较高的可信度。然而,今后仍需结合DNA测序分析技术和扩增片段长度多态性分析技术,在乌江设置更多的采样点,并在每个采样点采集更多的四川裂腹鱼个体,增加样本量,开展进一步的实验分析,以更加全面、深入地了解乌江四川裂腹鱼种群的遗传背景、遗传结构及多样性,为乌江四川裂腹鱼种质资源的开发利用与保护提供科学依据。
BERTIN A, GOUIN N, BAUMEL A, et al. Genetic variation of loci potentially under selection confounds species: Genetic diversity correlations in a fragmented habitat. Molecular Ecology, 2017, 26(2): 431-443 DOI:10.1111/mec.13923 |
DAI X L, LIU J, LI J J, et al. Effects of sample size and loci number on genetic diversity index in Macrobrachium rosenbergii with microsatellite markers. Journal of Fisheries of China, 2017, 41(7): 1083-1095 [戴习林, 刘洁, 李晶晶, 等. 罗氏沼虾种群SSR分析中样本量及标记量对遗传多样性指标的影响. 水产学报, 2017, 41(7): 1083-1095] |
DAI Y G, HAN H F. Karyological analysis of two species in the subfamily Schizothoracinae (Cypriniformes: Cyprinidae) from China, with notes on karyotype evolution in Schizothoracinae. Turkish Journal of Fisheries and Aquatic Sciences, 2018, 18: 175-186 |
DAI Y G, ZHOU X J, XIAO H. Genetic diversity of the mtDNA D-loop in the population of Schizothorax kozlovi from the Wujiang River. Sichuan Journal of Zoology, 2010, 29(4): 505-509 [代应贵, 邹习俊, 肖海. 四川裂腹鱼乌江种群mtDNA控制区序列的遗传多样性分析. 四川动物, 2010, 29(4): 505-509] |
FOURTUNE L, PAZ-VINAS I, LOOT G, et al. Lessons from the fish: A multispecies analysis reveals common processes underlying similar species genetic-diversity correlations. Freshwater Biology, 2016, 61(11): 1830-1845 DOI:10.1111/fwb.12826 |
GUO Y N, WU Z, LI H, et al. Effect of cascade hydro-electric stations on phytoplankton in Wujiang watershed. Environmental Science and Technology, 2010, 33(12): 176-179 [郭艳娜, 伍志, 李海, 等. 水电梯级开发对乌江流域浮游植物分布的影响. 环境科学与技术, 2010, 33(12): 176-179 DOI:10.3969/j.issn.1003-6504.2010.12.042] |
GUO Z C. The main characteristics of mineral resources and the division of metallogenic areas (zones) in Guizhou Province. Guizhou Geology, 2004, 21(4): 271 [郭振春. 贵州省矿产资源主要特点及成矿区(带)划分. 贵州地质, 2004, 21(4): 271] |
HAN Z Q, ZHUANG Z M, GAO T X, et al. Genetic diversity in Cynoglossus semilaevis by AFLP, RAPD and mtDNA markers. Journal of Fishery Sciences of China, 2007, 14(2): 192-200 [韩志强, 庄志猛, 高天翔, 等. 半滑舌鳎DNA的群体遗传变异. 中国水产科学, 2007, 14(2): 192-200 DOI:10.3321/j.issn:1005-8737.2007.02.003] |
HE Y F, WU X B, WANG X G, et al. Otolith carbon and oxygen stable isotopes in laboratory-reared Schizothorax kozlovi. Chinese Journal of Applied Ecology, 2017, 28(7): 2339-2343 [何勇凤, 吴兴兵, 王旭歌, 等. 四川裂腹鱼耳石碳、氧稳定同位素特征. 应用生态学报, 2017, 28(7): 2339-2343] |
HE Y F, WU X B, ZHU Y J, et al. Cloning of gonadal aromatase gene Cyp19a in an endemic fish (Schizothorax kozlovi) of the upper Yangtze River, and temperature effects on its expression. Genes and Genomics, 2016, 38: 841-848 DOI:10.1007/s13258-016-0429-z |
HUANG Z Y, ZHANG Q, LU L F, et al. Genetic diversity of Liza affinis in coastal waters of China deduced from mitochondrial COⅠ sequences. Progress in Fishery Sciences, 2019, 40(1): 46-52 [黄镇宇, 章群, 卢丽锋, 等. 基于线粒体COⅠ序列的中国前鳞鮻遗传多样性分析. 渔业科学进展, 2019, 40(1): 46-52] |
JI W Z, SU B. Principles and methodologies of genetic diversity studies. Hangzhou: Zhejiang Science and Technology Press, 1999 [季维智, 宿兵. 遗传多样性研究的原理与方法. 杭州: 浙江科学技术出版社, 1999]
|
LI Z L, HU S Y, CHEN Y X, et al. Age structure and growth characteristics of Schizothorax kozlori in the upper Wujiang River. Journal of Hydroecology, 2015, 36(2): 75-80 [李忠利, 胡思玉, 陈永祥, 等. 乌江上游四川裂腹鱼的年龄结构与生长特性. 水生态学杂志, 2015, 36(2): 75-80] |
LIU B, LIU X F, LIU S T, et al. Genetic diversity of partial mtDNA D-loop region among stocks of turbot Scophthalmus maximus recently introduced and long-farmed in China. Progress in Fishery Sciences, 2013, 34(6): 31-36 [刘滨, 刘新富, 刘思涛, 等. 大菱鲆引进群体与国内累代繁养群体线粒体D-loop区部分序列的遗传多态性分析. 渔业科学进展, 2013, 34(6): 31-36 DOI:10.3969/j.issn.1000-7075.2013.06.005] |
LIU X F, ZHENG J B, JIA Y Y, et al. AFLP analysis on genomic sexual dimorphism of Erythroculter ilishaeformis and current genetic diversity of the Taihu strain. Acta Hydrobiologica Sinica, 2017, 41(6): 1200-1206 [刘祥芳, 郑建波, 贾永义, 等. 翘嘴红鲌雌雄基因组差异及太湖野生群体遗传多样性现状的AFLP分析. 水生生物学报, 2017, 41(6): 1200-1206] |
LU J F, BAI J J, LI S J, et al. AFLP analysis of genetic diversity in consecutive selected populations of largemouth bass (Micropterus salmoides). Freshwater Fisheries, 2010, 40(3): 3-7 [卢建峰, 白俊杰, 李胜杰, 等. 大口黑鲈选育群体遗传多样性的AFLP分析. 淡水渔业, 2010, 40(3): 3-7 DOI:10.3969/j.issn.1000-6907.2010.03.001] |
MA Z T, PAN L D. Molecular biological techniques for genetic diversity analysis of aquatic animal populations. Bulletin of Biology, 2011, 46(10): 1-5 [马召腾, 潘连德. 水生动物种群遗传多样性分析的分子生物学技术. 生物学通报, 2011, 46(10): 1-5 DOI:10.3969/j.issn.0006-3193.2011.10.001] |
PEI J. The Limited Liability Company of Wujiang Hydropower Development in Guizhou vigorously promoted the development of Cascade Hydropower along the Wujiang River. Water Power, 2003, 29(8): 49 [沛吉. 贵州乌江水电开发有限责任公司大力推动乌江梯级水电开发. 水力发电, 2003, 29(8): 49] |
SHARIFI M, SOURINEJAD I, HOSSEINI S J, et al. Application of AFLP molecular marker for genetic analysis of black pomfret Parastromateus niger from the Persian Gulf. Iranian Journal of Fisheries Sciences, 2015, 14(4): 857-875 |
SHI F. Conservation genetics of Semilabeo prochilus and Procypris rabaudi populations in the middle and lower reaches of Wujiang River. Doctoral Dissertation of University of Chinese Academy of Sciences, 2010 [史方. 乌江中下游泉水鱼和岩原鲤群体的保护遗传学研究. 中国科学院大学博士研究生学位论文, 2010]
|
SHI L M. Genetic diversity and its conservation. Bioscience Communication, 1990, 2(4): 159-164 [施立明. 遗传多样性及其保存. 生物科学信息, 1990, 2(4): 158-164] |
SOLTIS P S, SOLTIS D E. Genetic variation in endemic and widespread plant species: examples from Saxifragaceae and Polystichum (Dryopteridaceae). Aliso, 1991, 13(1): 215-223 DOI:10.5642/aliso.19911301.10 |
SONG J, SONG Z B, YUE B S, et al. Study on genetic diversity based on AFLP fingerprint of rock carp from Hejiang section of Yangtze River. Sichuan Journal of Zoology, 2005, 24(4): 495-499 [宋君, 宋昭彬, 岳碧松, 等. 长江合江江段岩原鲤种群遗传多样性的AFLP分析. 四川动物, 2005, 24(4): 495-499 DOI:10.3969/j.issn.1000-7083.2005.04.013] |
SONG Z B. Studies on genetic diversity of wild populations of prenant's schizothoracin (Schizothorax prenanti) and rock carp (Procypris rabaudi). Postdoctoral Research of Sichuan University, 2005 [宋昭彬. 齐口裂腹鱼和岩原鲤野生种群遗传多样性研究. 四川大学博士后研究论文, 2005]
|
TONG G X, KUANG Y Y, YIN J S. AFLP analysis of genetic diversity of taimen (Hucho taime) in wild populations. Journal of Fishery Sciences of China, 2009, 16(6): 833-841 [佟广香, 匡友谊, 尹家胜. 野生哲罗鱼种质资源遗传多样性的AFLP分析. 中国水产科学, 2009, 16(6): 833-841 DOI:10.3321/j.issn:1005-8737.2009.06.004] |
WANG W J, YUE Z Q, KONG J, et al. Development of AFLP and its application in marine organism. Marine Fisheries Research, 2005, 26(1): 80-85 [王伟继, 岳志芹, 孔杰, 等. AFLP分子标记技术的发展及其在海洋生物中的应用. 海洋水产研究, 2005, 26(1): 80-85] |
WANG X Z, GAN X N, LI J B, et al. Cyprininae phylogeny revealed independent origins of the Tibetan Plateau endemic polyploid cyprinids and their diversifications related to the Neogene uplift of the plateau. Scientia Sinica Vitae, 2016, 46(11): 1277-1295 [王绪祯, 甘小妮, 李俊兵, 等. 鲤亚科多倍体物种独立起源及其与第三纪青藏高原隆升的关系. 中国科学: 生命科学, 2016, 46(11): 1277-1295] |
WU L. Fishes of Guizhou. Guiyang: Guizhou Peoplesxs Press, 1989 [伍律. 贵州鱼类志. 贵阳: 贵州人民出版社, 1989]
|
YANG T Y, GUO Y, MENG W, et al. AFLP analysis of genetic diversity of Schizothorax biddulphi populations. Freshwater Fisheries, 2012, 42(4): 83-87 [杨天燕, 郭焱, 孟玮, 等. 塔里木裂腹鱼群体遗传多样性的AFLP分析. 淡水渔业, 2012, 42(4): 83-87 DOI:10.3969/j.issn.1000-6907.2012.04.017] |
YE N, BAO X F, LIU J Y. AFLP analysis of genetic diversity of imported Litopenaeus vannamei populations and cultured stocks. Journal of Fisheries of China, 2017, 41(3): 339-346 [叶宁, 包秀凤, 刘建勇. 凡纳滨对虾引进群体与养殖群体遗传多样性的AFLP分析. 水产学报, 2017, 41(3): 339-346] |
YUE P Q. Fauna Sinica, Osteichthyes, Cypriniformes Ⅲ. Beijing: Science Press, 2000 [乐佩琦. 中国动物志, 硬骨鱼纲, 鲤形目(下卷). 北京: 科学出版社, 2000]
|
ZHAN H X, YAN H, AN Q P, et al. Countermeasure suggestion and reasons for decline of fish resources in Liuchong River. Journal of Hydroecology, 2009, 30(1): 147-149 [詹会祥, 晏宏, 安全平, 等. 六冲河鱼类资源衰退的原因与对策建议. 水生态学杂志, 2009, 30(1): 147-149] |
ZHANG X J, DAI Y G. Feeding habits and resources protection of Schizothorax kozlovi. Journal of Hydroecology, 2011, 32(2): 110-114 [张晓杰, 代应贵. 四川裂腹鱼摄食习性与资源保护. 水生态学杂志, 2011, 32(2): 110-114] |



