通常在天然或养殖水体中的溶解氧(dissolved oxygen, DO)含量丰富,鱼类的摄食量大、生长速度快。一般情况下,天然水体中的溶氧含量接近饱和状态,但由于物理、化学或生物等因素的季节性或突发性改变,引起水体中溶解氧降低甚至缺氧。近年来,集约化养殖采用高密度和高投饵模式,常常引起养殖水体中溶解氧浓度的剧烈波动。溶解氧是影响水产动物生长代谢、诱发各类鱼病的不可忽视的主要环境因子之一(况新宇, 2016; Kennish, 2002)。刘旭佳等(2005)研究发现,水中溶解氧含量降低,导致鲻(Mugil cephalus)幼鱼的摄食量下降,生长缓慢。杨凯等(2010)研究发现,低溶解氧条件下,黄颡鱼(Pelteobagrus fulvidraco)稚鱼常保持静止状态,摄食时间短,游泳缓慢。吴垠等(2007)研究表明,在一定程度上提高水中溶解氧含量能够提高工厂化养殖虹鳟(Oncorhynchus mykiss)的代谢率。Person-Le Ruyet等(2002)研究指出,与溶解氧含量为91%时相比,大菱鲆(Scophthalmus maximus)在溶解氧含量达135%时,活动加快、摄食量增大。程香菊等(2019)研究发现,在一定范围内,随着溶解氧浓度的增加,室内曝气推流循环水养殖罗非鱼(Oreochromis niloticus)的食物转化效率和生长速度加快。也有人提出,溶解氧浓度过高并不会影响鱼类的生长,但会增加鱼类的生存压力(张钊等, 2014; Ritola et al, 2002)。由此可见,探讨不同溶解氧浓度对鱼类生长和代谢产生的影响具有重要意义。
团头鲂(Megalobrama amblycephala),又名武昌鱼,属草食性鱼类,病害少、易捕捞、生长速度快、养殖成本低、管理简便,在人工养殖条件下,第2年即可达到商品规格,养殖效益较好(刘国信, 2008)。近年来,关于团头鲂的低氧研究颇多,主要集中在对低氧相关基因HIF、(HO)2、PHD2、EPO,低氧引起的相关生理生化指标变化,低氧时团头鲂鳃组织形态学分析等研究(吴成宾, 2016; 沈睿杰, 2011; Wang et al, 2015; 田玉梅, 2012; 张雪丽, 2017),而对高氧胁迫尚未见相关研究。本实验研究了在高氧和低氧2种条件下团头鲂耐低氧新品系F5代鳃形态以及各组织酶活性的变化,探讨团头鲂对溶解氧的适应性,以期为提高团头鲂集约化养殖水平、促进团头鲂耐低氧选育以及健康养殖提供参考依据。
1 材料与方法 1.1 实验鱼实验组为团头鲂耐低氧新品系F5代,来自上海海洋大学农业农村部团头鲂遗传育种中心。挑选健康的实验鱼,共24尾[体重:低氧组为(27.3±1.2) g,高氧组为(23.1±1.4) g],在室内恒温循环水中(水温约为26℃,pH为7.1~7.5,盐度约为3.56)饲养1周,适应新环境后再进行实验。期间每天投喂2次,经常检查鱼的活动情况并清除粪便。
1.2 低氧与高氧胁迫设置2个处理组(低氧组和高氧组),每个处理设3个重复组。每组捞取12尾幼鱼(20~30 g),分别置于体积为20 L的盛有曝气72 h自来水的玻璃缸中(水温为26℃左右)。每天使用溶解氧仪(YSL)监测溶解氧。低氧组采用与N2一起充气的方法,使水体中的溶解氧含量维持在(1.7±0.2) mg/L。高氧组只充入少量O2,使水中的溶解氧含量维持在(19.3±0.5) mg/L。在开始处理前(0 d)、处理4 d和处理7 d时,从每个处理中取样3尾鱼。此后,剩下的3尾鱼在常氧条件下[DO为(7.8±0.3) mg/L]恢复1周后取样。
1.3 石蜡切片与光学显微镜(LM)用0.5 g/L MS-222麻醉后活体冰上解剖。从每条鱼的左侧取下第3片鳃,沿鳃丝修成若干小块后将鳃组织固定于波恩氏溶液中24 h。固定好的样品经过酒精梯度脱水、二甲苯透明、石蜡包埋、连续切片,切片厚约为5 μm,用苏木精–伊红(HE)染色,中性树胶封片,并在光学显微镜下观察并拍照(杨明等, 2019)。
1.4 酶活性测定从1.3麻醉后的鱼中取下右侧第3片鳃、肌肉、肠道、肝胰腺样本各0.1 g,按质量体积比1∶9加入0.86%的生理盐水,将其制成10%的组织匀浆液。3000 r/min离心15 min,取上清液测定酶活性。采用南京建成生物工程研究所的检测试剂盒测定各组织中丙二醛(malondialdehyde, MDA)含量、过氧化氢酶(catalase, CAT)、琥珀酸脱氢酶(succinate dehydrogenase, SDH)、乳酸脱氢酶(lactate dehydrogenase, LDH)的活性和总蛋白的含量(吴萌, 2017)。
1.5 数据测量及分析采用Image J软件对各组鳃丝进行测量,记录鳃小片长度、宽度和间距。酶活性测定实验重复3次,取测量平均值,用Excel 2010软件制作直方图。采用SPSS 22.0分析数据,实验结果用平均值±标准差(Mean±SD)表示,不同处理组数据间的差异采用方差分析,P < 0.05为显著性差异(吴小嫚等, 2020)。
2 结果 2.1 缺氧对鳃组织形态的影响由图 1和表 1可见,随着低氧时间的增加,团头鲂耐低氧新品系F5的鳃小片之间的层间细胞团(ILCM)逐渐变少,鳃小片平均间隔在缺氧4 d和7 d后分别为(31.80±1.00)和(35.75±2.11) μm,显著大于常氧组[(13.95±3.63) μm](P < 0.05)。同样,鳃小片长度在低氧状态下更加向外延伸,在低氧4 d和7 d之后分别为(122.69±5.81)和(132.69±2.86) μm,显著大于常氧组鳃小片的长度[(108.53±4.43) μm] (P < 0.05)。另外,鳃小片宽度在低氧4 d后为(13.61±0.84) μm,显著小于常氧组[(22.06±0.74) μm] (P < 0.05)。低氧7 d后,鳃小片宽度为(9.80±0.28) μm,显著小于低氧4 d (P < 0.05)。经过1周的常氧恢复,团头鲂耐低氧新品系F5鳃组织基本恢复到正常形态,各项数据均有所恢复,但与处理前相比也存在明显差异。
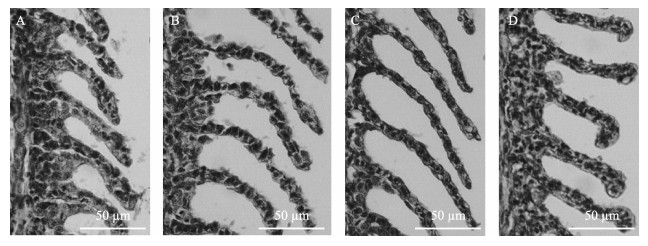
|
图 1 团头鲂耐低氧新品系F5在低氧条件下[DO为(1.7±0.2) mg/L]鳃丝的组织切片 Fig.1 Histological section of hypoxia-tolerant new strain of M. amblycephalaunder hypoxic conditions [DO: (1.7±0.2) mg/L] A:低氧处理前;B:低氧4 d;C:低氧7 d;D:恢复常氧7 d A: Before treatment; B: Hypoxia for 4 days; C: Hypoxia for 7 days; D: Recovery for 7 days |
|
|
表 1 低氧处理0、4、7 d以及恢复7 d之后鳃小片各项数值 Tab.1 Data of gill lamella after hypoxic treatment for 0, 4, 7 days and recovery for 7 days |
由图 2和表 2可见,鳃小片之间的ILCM随着高氧处理时间的增加而增加,鳃小片之间的平均间隔在高氧处理4 d后为(9.87±0.16) μm,显著小于常氧组[(11.43±1.17 μm) (P < 0.05)。高氧处理7 d后,鳃小片间距为(6.81±1.38) μm,显著小于高氧处理4 d (P < 0.05)。鳃小片宽度在高氧状态下逐渐增加,在高氧处理4 d和7 d的之后分别为(23.51±1.35) μm和(26.37± 1.51) μm,均显著大于常氧组鳃小片的宽度[(18.76± 2.24) μm] (P < 0.05)。在正常氧气浓度的条件下,鳃小片长度为(91.92±6.63) μm,高氧处理4 d和7 d后,分别显著减少至(71.00±6.57) μm与(54.30±3.92) μm (P < 0.05)。在持续1周输入正常溶解氧进行恢复后,鳃组织形态恢复,各项数据均有所恢复,但与处理前相比也存在明显差异,其中,鳃小片长度与处理前无显著差异(P > 0.05)。
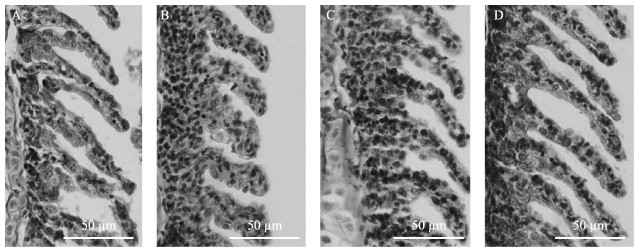
|
图 2 团头鲂耐低氧新品系F5在高氧条件下[DO为(19.3±0.5) mg/L]鳃丝的组织切片 Fig.2 Histological section of hypoxia-tolerant new strain of M. amblycephala under hyperoxic conditions [DO: (19.3±0.5) mg/L] A:高氧处理前; B:高氧4 d; C:高氧7 d; D:恢复常氧7 d A: Before treatment; B: Hyperoxia for 4 days; C: Hyperoxia for 7 days; D: Recovery for 7 days |
|
|
表 2 高氧处理0、4、7 d以及恢复7 d之后鳃小片各项数值 Tab.2 Data of gill lamella after hyperoxic treatment for 0, 4, 7 days and recovery for 7 days |
由图 3可知,随着低氧时间的增加,鳃、肝胰腺和肠道中的CAT活性先降低后升高,在肌肉中先升高后降低,各组数据之间均存在显著差异(图 3A)(P < 0.05)。鳃中的MDA含量持续降低,肝胰腺中的MDA持续上升,肠道中的MDA先降低后升高,肌肉中的MDA先升高后降低,各组数据之间均存在显著差异(图 3B)(P < 0.05)。各组织中的LDH活性持续升高,低氧7 d时显著高于正常值;SDH活性持续降低,且处理7 d时的数值均显著低于正常值(图 3C、图 3D)(P < 0.05)。经过1周的常氧恢复后,不同酶活性在各组织中均有所恢复,但仍与常氧组存在显著差异(P < 0.05)。

|
图 3 团头鲂耐低氧新品系F5在低氧条件下各组织中CAT (A)、MDA (B)、SDH (C)和LDH (D)的变化 Fig.3 Changes of CAT (A), MDA (B), SDH (C) and LDH (D) in hypoxia-tolerant new strain of M. amblycephala under hypoxic conditions 0 d、4 d、7 d、R-7 d分别表示低氧处理前、低氧处理4 d、低氧处理7 d、恢复常氧7 d。柱形图上方字母不同表示差异显著(P < 0.05),下同 0 d, 4 d, 7 d and R-7 d represent before treatment, hypoxic for 4 days, hypoxic for 7 days and recovery for 7 days, respectively.Different letters on the column indicate significant difference (P < 0.05). The same as below |
由图 4可知,随着高氧处理时间的增加,鳃和肠道中的CAT活性持续下降,肝胰腺中的CAT活性持续上升,肌肉中的CAT活性先升高后下降,各组数据之间均存在显著差异(图 4A)(P < 0.05)。鳃和肌肉中的MDA含量先降低后升高,肝胰腺中的MDA含量持续上升,肠道中的MDA含量持续下降,各组数据之间均存在显著差异(图 4B)(P < 0.05)。各组织中的LDH活性持续降低,高氧7 d时,LDH活性显著低于正常值;SDH活性持续升高,且处理7 d时的SDH活性均显著高于正常值(图 4C、图 4D)(P < 0.05)。经过1周的常氧恢复后,不同酶活性在各组织中均有恢复,但仍与常氧组存在显著差异(P < 0.05)。

|
图 4 团头鲂耐低氧新品系F5在高氧条件下各组织中CAT (A)、MDA (B)、SDH (C)和LDH (D)的变化 Fig.4 Changes of CAT (A), MDA (B), SDH (C) and LDH (D) in hypoxia-tolerant new strain of M. amblycephala under hyperoxic conditions |
鳃是鱼类的呼吸器官,主要承担气体交换任务,并且具有代谢产物排泄、渗透调节等功能。鱼类的鳃与其生活的水环境直接接触,所以对水体环境的变化尤其敏感(吴玲玲等, 2007)。研究表明,水中的许多因素均会对鱼类组织尤其是鳃产生不利影响,进而威胁鱼类生存。如急性镉暴露对早期斑马鱼(Danio rerio)胚胎发育具有较强的毒性作用,并且会造成严重的氧化损伤(杨瑞瑞等, 2019)。高水平氨氮和亚硝氮对红剑鱼(Xiphophorus hellerii)和孔雀鱼(Poecilia reticulate)的鳃组织造成不利影响(张蓉等, 2019)。低浓度和高浓度的铜都会使尼罗罗非鱼(Oreochromis niloticus)的鳃组织产生不同程度的变化(Monteiro et al, 2009)。高盐度的水环境和较大的盐度变化会引起花鲈(Lateolabrax maculatus)幼鱼鳃、脾及肌肉组织结构变化,对花鲈幼鱼的生长发育产生不利影响(温久福等, 2020)。溶解氧浓度是水生生物生存和生长重要因素之一,当水中溶解氧浓度发生变化时,鱼类也会通过一些行为来适应这种变化。Sollid等(2003)研究发现,当溶解氧降至极低水平时,鲫鱼(Carassius aumtus)的鳃出现鳃间质凋零、鳃丝延长等变化,使鱼体从水环境中获取更多的溶解氧,当溶解氧恢复正常后,其鳃结构也逐渐恢复正常。在面对低氧环境时,花罗汉鱼(Cichlasoma spp.)会减少运动量及食物的摄入来降低其新陈代谢(Kupittayanant et al, 2011)。吉富罗非鱼(Oreochromis niloticus)在低氧条件下摄食量少、生长缓慢;而在高氧条件下生长速率明显加快(陈德举等, 2019)。在溶解氧过饱和的水体中,胭脂鱼(Myxocyprinus asiaticus)发生酸中毒,其鳃盖和鳍条下充满气泡,并且出现狂游等异常行为活动(吴湘香等, 2014)。本研究发现,团头鲂F5代在低氧条件下,通过减少鳃小片ICLM,增加鳃小片长度,使鳃小片与氧气接触面积增大,增加了吸收氧气的能力,满足其对氧气消耗的需要,由此可以说明,团头鲂F5对低氧环境具有较好的适应性(Wu et al, 2017)。当溶氧恢复时,其组织结构形态显著恢复,这一结果与低氧胁迫下日本沼虾(Macrobrachium nipponense)、虹鳟等鳃组织结构变化的规律一致(Matey et al, 2011; 杨明等, 2019)。在高氧条件下,鳃小片ILCM随着处理时间的延长而增大,鳃小片宽度增加,使其暴露在水中的呼吸面积减少,可能是溶解氧浓度过高,其结构产生变化,减少氧气的输入来防止溶解氧过饱和引起的一系列疾病,这一结果与西伯利亚鲟(Acipenser baerii)的鳃组织在高氧胁迫时无明显变化的结果不同(况新宇, 2016)。当溶解氧恢复时,其组织结构形态显著恢复。
3.2 溶解氧对团头鲂新品系各组织酶活性的影响CAT是抗氧化系统中的关键酶之一,当鱼类受到氧化胁迫时,鱼体中CAT的活性会上升(Lushchak et al, 2001),这种过氧化胁迫一般是由于体内过多的氧自由基导致的。本研究发现,CAT活性变化没有明显规律,低氧条件下,鳃和肠组织中的CAT活性先降低后升高;高氧条件下,肠组织中的CAT活性同样先降低后升高,可能与组织特异性相关,也可能与机体中其他抗氧化物质相关,这个结果与花鲈幼鱼各组织中CAT活性在低氧胁迫下的变化不尽相同,与大菱鲆幼鱼在低氧和高氧下CAT活性并未表现出明显规律的结果相似(吴志昊等, 2011; 常志成等, 2018)。MDA是过氧化产物的标志性物质,反映细胞受自由基攻击的严重程度(Rio et al, 2005; Filho et al, 2005; 吴鑫杰等, 2016)。本研究发现,在低氧和高氧2种条件下,肝胰腺中的MDA含量均显著上升,在低氧4 d和高氧7 d时,肌肉组织中的MDA含量也显著高于处理前,氧化损伤严重,这一结果与低氧胁迫下鲻幼鱼肝脏组织、褐牙鲆(Paralichthys olivaceus)幼鱼肌肉组织中的MDA含量显著上升相似(熊向英等, 2016; 李洁等, 2015)。Ritola等(2002)研究发现,过饱和溶解氧使虹鳟的鳃及其他组织细胞受到氧化损伤,进而影响呼吸和生长代谢。由此证明,过高或过低的溶解氧含量均会造成团头鲂体内产生过多的活性氧自由基,使脂质过氧化物增多,机体表现出氧化损伤,给养殖带来消极影响。在低氧和高氧条件处理7 d时,鳃和肠组织中的MDA含量均显著低于处理前,可能是因为体内积累的过量氧自由基,导致体内的抗氧化系统发挥作用,从而减轻了脂质过氧化程度(徐军等, 2004)。
SDH参与柠檬酸循环及呼吸电子的传递,是有氧代谢中的一种标志酶,其活性能大致反映有氧代谢的水平,所以,通常被用作衡量机体有氧呼吸能力大小的重要指标(Cohen et al, 2001)。LDH能够催化丙酮酸和乳酸相互转化,是无氧代谢中非常重要的酶,其活性通常能反映无氧代谢的水平,故常被用作反映无氧代谢能力大小的重要指标(Rutter et al, 2010)。在本研究中,低氧7 d时,实验鱼各组织中的SDH活性显著低于常氧状态,而LDH活性显著高于常氧状态,证明溶解氧浓度的降低影响团头鲂耐低氧新品系F5对氧气的摄取和运输,进而导致有氧呼吸的减弱和无氧呼吸的增强,并以此来应对低氧胁迫。本结果与低氧环境导致青海沙蜥(Phrynocephalus vlangalii)和日本沼虾组织中的SDH活性降低、LDH活性增强的研究结果相同(He et al, 2013; 管越强等, 2010)。在高氧条件下,团头鲂的SDH活性显著升高,LDH活性显著降低,表明团头鲂在面对高氧胁迫时也能调节自身的呼吸作用酶来保证其正常活动。
CHANG Z C, WEN H S, ZHANG M Z, et al. Effects of dissolved oxygen levels on oxidative stress response and energy utilization of juvenile Chinese sea bass (Lateolabrax maculatus) and associate physiological mechanisms. Periodical of Ocean University of China (Natural Science), 2018, 48(7): 20-28 [常志成, 温海深, 张美昭, 等. 溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制. 中国海洋大学学报(自然科学版), 2018, 48(7): 20-28] |
CHEN D J, QIANG J, TAO Y F, et al. Effects of different dissolved oxygen levels on the growth, blood biochemistry, fatty acid composition and against Streptococcus iniae infection of GIFT juvenile (Oreochromis niloticus). Freshwater Fisheries, 2019, 49(4): 89-95 [陈德举, 强俊, 陶易凡, 等. 不同溶氧水平对吉富罗非鱼幼鱼生长、血液生化、脂肪酸组成及其抗海豚链球菌病的影响. 淡水渔业, 2019, 49(4): 89-95 DOI:10.3969/j.issn.1000-6907.2019.04.014] |
CHENG X J, JU J Q, HU J C, et al. Response model construction of fish growth to water environmental factors in recirculating aquaculture mode. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(11): 188-194 [程香菊, 具家琪, 胡佳纯, 等. 循环水养殖模式下鱼生长对水环境因子的响应模型构建. 农业工程学报, 2019, 35(11): 188-194 DOI:10.11975/j.issn.1002-6819.2019.11.022] |
COHEN A, NUGEGODA D, GAGNON M M. Metabolic responses of fish following exposure to two different oil spill remediation techniques. Ecotoxicology and Environmental Safety, 2001, 48(3): 306-310 DOI:10.1006/eesa.2000.2020 |
FILHO D W, TORRES M A, ZANIBONI-FILHO E, et al. Effect of different oxygen tensions on weight gain, feed conversion, and antioxidant status in piapara, Leporinus elongatus (Valenciennes, 1847). Aquaculture, 2005, 244(1/2/3/4): 349-357 |
GUAN Y Q, LI L, WANG H C, et al. Effects of hypoxia on respiratory metabolism and antioxidant capability of Macrobrachium nipponense. Journal of Hebei University (Natural Science), 2010, 30(3): 301-306 [管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响. 河北大学学报(自然科学版), 2010, 30(3): 301-306 DOI:10.3969/j.issn.1000-1565.2010.03.017] |
HE J Z, XIU M H, TANG X L, et al. The different mechanisms of hypoxic acclimatization and adaptation in lizard Phrynocephalus vlangalii living on Qinghai-Tibet Plateau. Journal of Experimental Zoology Part A: Ecological Genetics and Physiology, 2013, 319(3): 117-123 DOI:10.1002/jez.1776 |
KENNISH M J. Environmental threats and environmental future of estuaries. Environmental Conservation, 2002, 29(1): 78-107 DOI:10.1017/S0376892902000061 |
KUANG X Y. Effects of high dissolved oxygen on growth, oxidative stress, and immune capacity of Acipenser baerii and hybrid sturgeon.. Masterxs Thesis of Dalian Ocean University, 2016 [况新宇. .高溶氧量对西伯利亚鲟、杂交鲟生长、氧化应激及免疫功能的影响. 大连海洋大学硕士研究生学位论文, 2016] |
KUPITTAYANANT P, KINCHAREON W. Hematological and biochemical responses of the flowerhorn fish to hypoxia. Journal of Animal and Veterinary Advances, 2011, 10(20): 2631-2638 |
LI J, TANG X, ZHANG L Y, et al. Study on the energy metabolism and oxidative stress of juvenile brown flounder, Paralichthys olivaceus in dissolved oxygen content descending water. Journal of Guangxi Academy of Sciences, 2015, 31(1): 22-27 [李洁, 唐夏, 张灵燕, 等. 溶解氧水平对褐牙鲆幼鱼能量代谢和氧化应激的影响研究. 广西科学院学报, 2015, 31(1): 22-27 DOI:10.3969/j.issn.1002-7378.2015.01.004] |
LIU G X. Breeding technology of Megalobrama amblycephala. Shandong Fisheries, 2008, 25(2): 31-32 [刘国信. 团头鲂养殖技术. 齐鲁渔业, 2008, 25(2): 31-32] |
LIU X J, HUANG G Q, PENG Y H. Effect of different dissolved oxygen levels on growth, energy metabolism and oxidative stress of Mugil cephalus. South China Fisheries Science, 2005, 11(4): 88-94 [刘旭佳, 黄国强, 彭银辉. 不同溶解氧水平对鲻生长、能量代谢和氧化应激的影响. 南方水产科学, 2005, 11(4): 88-94] |
LUSHCHAK V I, LUSHCHAK L P, MOTA A A, et al. Oxidative stress and antioxidant defenses in goldfish Carassius auratus during anoxia and reoxygenation. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2001, 280(1): 100-107 DOI:10.1152/ajpregu.2001.280.1.R100 |
MATEY V, FATHIMA I I, DE BOECK G, et al. Gill morphology and acute hypoxia: Responses of mitochondria-rich, pavement, and mucous cells in the Amazonian oscar (Astronotus ocellatus) and the rainbow trout (Oncorhynchus mykiss), two species with very different approaches to the osmo-respiratory compromise. Canadian Journal of Zoology, 2011, 89(4): 307-324 DOI:10.1139/z11-002 |
MONTEIRO S M, ROCHA E, MANCERA J M, et al. A stereological study of copper toxicity in gills of Oreochromis niloticus. Ecotoxicology and Environmental Safety, 2009, 72(1): 213-223 DOI:10.1016/j.ecoenv.2008.02.008 |
PERSON-LE RUYET J, PICHAVANT K, VACHER C, et al. Effects of O2 supersaturation on metabolism and growth in juvenile turbot (Scophthalmus maximus L.). Aquaculture, 2002, 205(3/4): 373-383 |
RIO D D, STEWART A J, PELLEGRINI N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases, 2005, 15(4): 316-328 DOI:10.1016/j.numecd.2005.05.003 |
RITOLA O, LIVINGSTONE D R, PETERS L D, et al. Antioxidant processes are affected in juvenile rainbow trout (Oncorhynchus mykiss) exposed to ozone and oxygen- supersaturated water. Aquaculture, 2002, 210(1/2/3/4): 1-19 |
RUTTER J, WINGE D R, SCHIFFMAN J D. Succinate dehydrogenase — Assembly, regulation and role in human disease. Mitochondrion, 2010, 10(4): 393-401 DOI:10.1016/j.mito.2010.03.001 |
SHEN R J. Structural and functional studies of hypoxia inducible factors in Megalobrama amblycephala. Masterxs Thesis of Shanghai Ocean University, 2011 [沈睿杰. 团头鲂缺氧诱导因子的结构和功能研究. 上海海洋大学硕士研究生学位论文, 2011] |
SOLLID J, DE ANGELIS P, GUNDERSEN K, et al. Hypoxia induces adaptive and reversible gross morphological change in crucian carp gills. Journal of Experimental Biology, 2003, 206 |
TIAN Y M. Molecular structure and functional mechanisms of hypoxia response genes in Megalobrama amblycephala. Masterxs Thesis of Shanghai Ocean University, 2012 [田玉梅. 团头鲂缺氧应答相关基因的分子调控机制的研究. 上海海洋大学硕士研究生学位论文, 2012] |
WANG H J, HUANG C X, CHEN N, et al. Molecular characterization and mRNA expression of HIF-prolyl hydroxylase-2 (phd2) in hypoxia-sensing pathways from Megalobrama amblycephala. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 186: 28-35 DOI:10.1016/j.cbpb.2015.04.001 |
WEN J F, LAN J N, CAO M, et al. Effects of salinity on histological structure of gills, spleen and muscle in Lateolabrax maculatus juveniles. Progress in Fishery Sciences, 2020, 41(1): 112-118 [温久福, 蓝军南, 曹明, 等. 盐度对花鲈幼鱼鳃、脾及肌肉组织结构的影响. 渔业科学进展, 2020, 41(1): 112-118] |
WU C B, LIU Z Y, LI F G, et al. Gill remodeling in response to hypoxia and temperature occurs in the hypoxia sensitive blunt snout bream (Megalobrama amblycephala). Aquaculture, 2017, 479: 479-486 DOI:10.1016/j.aquaculture.2017.06.020 |
WU C B. Karyotype analysis of Parabramis and Megalobrama and the studies on hypoxia adaptive in gills of Megalobrama amblycephala. Masterxs Thesis of Shanghai Ocean University, 2016 [吴成宾. 鳊鲂鱼类染色体核型特征分析及团头鲂鳃低氧适应性研究. 上海海洋大学硕士研究生学位论文, 2016] |
WU L L, CHEN L, ZHANG Y L, et al. Effects of phenanthrene toxicity on histopathology of Brachydanio rerio gill and liver. Chinese Journal of Ecology, 2007, 26(5): 688-692 [吴玲玲, 陈玲, 张亚雷, 等. 菲对斑马鱼鳃和肝组织结构的影响. 生物学杂志, 2007, 26(5): 688-692] |
WU M. Effect of low temperature stress on respiratory performance and antioxidant capacity of Litopenaeus vanname. Masterxs Thesis of Huazhong Agricultural University, 2017 [吴萌. 低温胁迫对凡纳滨对虾呼吸性能及抗氧化能力的影响. 华中农业大学硕士研究生学位论文, 2017] |
WU X J, CHEN N, HUANG C X, et al. Effects of hypoxia on cardiomyocyte apoptosis and activity of antioxidant enzymes in Megalobrama amblycephala heart. Journal of Huazhong Agricultural University, 2016, 35(3): 108-113 [吴鑫杰, 陈楠, 黄春筱, 等. 低氧对团头鲂心肌细胞凋亡及抗氧化酶活性的影响. 华中农业大学学报, 2016, 35(3): 108-113] |
WU X M, HU Y Q. Study on preparation and in vitro digestive characteristics of Lactobacillus acidophilus-Bifidobacterium probiotics microcapsules feed by composite method. Chinese Journal of Animal Nutrition, 2020, 32(1): 372-381 [吴小嫚, 胡乐琴. 复合法制备嗜酸乳杆菌-双歧杆菌益生菌微胶囊饲料工艺及体外消化特性研究. 动物营养学报, 2020, 32(1): 372-381 DOI:10.3969/j.issn.1006-267x.2020.01.043] |
WU X X, LI Y F, ZHANG Y, et al. The preliminary study on the effects of dissolved gas supersaturation in water on the acid-base balance in Myxocyprinus asiaticus. Freshwater Fisheries, 2014, 44(6): 55-57 [吴湘香, 李云峰, 张燕, 等. 溶解气体过饱和水体对胭脂鱼血气平衡影响初步研究. 淡水渔业, 2014, 44(6): 55-57 DOI:10.3969/j.issn.1000-6907.2014.06.010] |
WU Y, ZHANG H, ZHAO H H, et al. Effects of different dissolved oxygen concentration on metabolic level of juvenile rainbow trout (Oncorhynchus mykiss) in the recirculating systems. Journal of Shanghai Fisheries University, 2007, 16(5): 437-442 [吴垠, 张洪, 赵慧慧, 等. 在循环养殖系统中不同溶氧量对虹鳟幼鱼代谢水平的影响. 上海水产大学学报, 2007, 16(5): 437-442] |
WU Z H, YOU F, WANG Y F, et al. The effects of hypoxia and hyperoxia on nucleus anomaly, SOD, CAT activities and MDA content in juvenile turbot Scophthalmus maximus. Journal of Shanghai Ocean University, 2011, 20(6): 808-813 [吴志昊, 尤锋, 王英芳, 等. 低氧和高氧对大菱鲆幼鱼红细胞核异常及氧化抗氧化平衡的影响. 上海海洋大学学报, 2011, 20(6): 808-813] |
XIONG X Y, HUANG G Q, PENG Y H, et al. Effect of hypoxia on growth performance, energy metabolism and oxidative stress of Mugil cephalus. Journal of fisheries of China, 2016, 40(1): 73-82 [熊向英, 黄国强, 彭银辉, 等. 低氧胁迫对鲻幼鱼生长、能量代谢和氧化应激的影响. 水产学报, 2016, 40(1): 73-82] |
XU J, MA G Z. Effects of ozone on GPX activity and content of GSH and MDA in blood of grass carp (Ctenopharygodon idellus) fingerling. Journal of South China Normal University (Natural Science), 2004, 11061106(2): 110-113 [徐军, 马广智. 臭氧对草鱼鱼种血液MDA、GSH浓度以及GPX活性的影响. 华南师范大学学报(自然科学版), 2004, 11061106(2): 110-113 DOI:10.3969/j.issn.1000-5463.2004.02.021] |
YANG K, FAN Q X, ZHANG L, et al. Effects of dissolved oxygen on feed intake, growth and respiratory metabolism of juvenile Pelteobagrus fulvidraco R. Freshwater Fisheries, 2010, 40(2): 24-29 [杨凯, 樊启学, 张磊, 等. 溶氧水平对黄颡鱼稚鱼摄食、生长及呼吸代谢的影响. 淡水渔业, 2010, 40(2): 24-29 DOI:10.3969/j.issn.1000-6907.2010.02.005] |
YANG M, SUN S M, FU H T, et al. Hypoxia and reoxygenation on antioxidant enzyme activities and histological structure of Macrobrachium nipponense. Journal of Fishery Sciences of China, 2019, 26(3): 493-503 [杨明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响. 中国水产科学, 2019, 26(3): 493-503] |
YANG R R, WANG L, SUN M, et al. Toxic effects of acute cadmium exposure on early embryonic development of zebrafish (Danio rerio). Journal of Shanxi Agricultural Sciences, 2019, 47(3): 351-356 [杨瑞瑞, 王兰, 孙敏, 等. 急性镉暴露对斑马鱼早期胚胎发育的毒性效应. 山西农业科学, 2019, 47(3): 351-356] |
ZHANG R, WANG X W, LIU L L, et al. Effects on toxicity and antioxidant indices in Xiphophorus hellerii and Poecilia reticulate: Ammonia and nitrite. Chinese Agricultural Science Bulletin, 2019, 35(24): 150-155 [张蓉, 王晓雯, 刘丽丽, 等. 氨氮和亚硝氮对红剑和孔雀鱼毒性及抗氧化指标的影响. 中国农学通报, 2019, 35(24): 150-155 DOI:10.11924/j.issn.1000-6850.casb19010070] |
ZHANG X L. Hypoxia response analysis of Heme Oxygenase (HO)2 repeated gene in Megalobrama amblycephala and insertion mutagenesis of PB-Tgf2 transposition systems. Masterxs Thesis of Shanghai Ocean University, 2017 [张雪丽. 团头鲂血红素加氧酶(HO)2重复基因低氧应答分析及PB-Tgf2复合转座元件的插入诱变研究. 上海海洋大学硕士研究生学位论文, 2017] |
ZHANG Z, LI R, GUO H, et al. Effects of dissolved oxygen levels on growth and biochemical composition in turbot intensively cultured. Fisheries Science, 2014, 33(8): 516-519 [张钊, 李荣, 郭惠, 等. 不同溶解氧水平对工厂化养殖大菱鲆生长及肌肉生化组分的影响. 水产科学, 2014, 33(8): 516-519 DOI:10.3969/j.issn.1003-1111.2014.08.011] |



