2. 中国科学院实验海洋生物学重点实验室 山东 青岛 266071;
3. 中国科学院海洋大科学研究中心 山东 青岛 266071;
4. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 山东 青岛 266071;
5. 中国科学院大学 北京 100049;
6. 大连海宝渔业有限公司 辽宁 大连 116045
2. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao, Shandong 266071, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao, Shandong 266071, China;
4. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
5. University of Chinese Academy of Sciences, Beijing 100049, China;
6. Dalian Haibao Fishery Co., Ltd., Dalian, Liaoning 116045, China
裙带菜(Undaria pinnatifida)是在亚洲国家常见的大型食用褐藻。在我国,裙带菜作为出口导向型产品在辽东半岛和山东半岛广泛种植。裙带菜的叶片及孢子囊叶几乎全部出口日本,柄部深加工产品深受国内市场喜爱,近10年来,内销产值不断攀升,目前已占裙带菜总产值的50%。根据2019年中国渔业统计年鉴报道,辽宁省年产裙带菜115, 725 t,占我国总产量的65.9%,是我国裙带菜生产第一大省(农业农村部渔业渔政管理局等, 2019)。
辽宁省大连市旅顺口区柏岚子海域和黄金山海域是我国仅有的2个裙带菜新品种“海宝1号”和“海宝2号”的主产区,也是我国传统的裙带菜养殖区(Shan et al, 2016; 许淑芬等, 2015)。每年10月下旬,裙带菜全人工育苗的幼苗开始由海上暂养阶段进入海上养殖阶段。2019年11月1日,据国家藻类体系大连综合试验站报导,柏岚子海域下海养殖的裙带菜出现大面积脱苗,部分养殖区受灾严重,苗绳上裙带菜幼苗几乎不可见,且养殖设施上发现大量节肢动物聚集。
节肢动物门(Arthropoda)中的端足目(Amphipoda)生物如麦杆虫(Caprella spp.)、藻钩虾(Ampithoe spp.)等均为海藻养殖中常见的污损生物,2019年之前未见污损生物对旅顺地区的裙带菜养殖造成严重影响的报道。随着气候变暖、海水温度上升和沿海工业、海水养殖业的迅猛发展(吕兑安等, 2019; 柳春福, 2019; 胡婉彬等, 2015),养殖生态环境正发生巨大变化,外来物种入侵和铜藻(Sargassum horneri)金潮等生态灾害对我国的海藻养殖业造成了严重的经济损失(Gonzalez et al, 2011; 苏丽, 2018; 吕芳等, 2018),我国裙带菜养殖业正面临着前所未有的挑战。本研究通过对受灾海域实地调查,采集虫害样品并结合形态学鉴定和分子生物学手段,探究造成本次灾害的主要原因,并提出相应的解决方案。
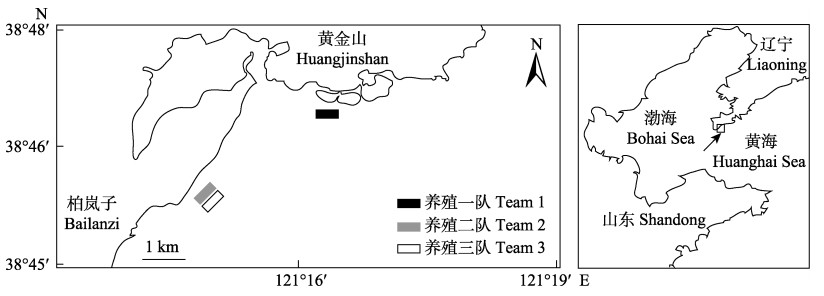
1 材料与方法 1.1 调查地点及受灾概况虫害受灾海区位于辽宁省大连市旅顺口区。实验共设立3个采样站点,分布如图 1所示。旅顺口区柏岚子海域设立2个采样地点:受灾严重的养殖三队海区;与三队相隔20 m航道未受灾的养殖二队海区。在距离养殖三队3 km的黄金山海域未受灾的养殖一队海区设立第3个采样点。
|
图 1 采样站点分布 Fig.1 Location of sampling stations |
此次养殖三队受灾裙带菜共16, 000绳,受灾面积达15.36 hm2。
养殖三队裙带菜夹苗下海时间为2019年10月25~27日;初次发现海上裙带菜异常脱苗时间为10月28日;至11月1日发现裙带菜苗已经全部脱光,同时开始裙带苗补种工作;11月4日现场调查发现补种裙带苗状态正常。
1.2 调查方法2019年11月2日—5日,在设立的3处采样站点进行污损生物的采集和现场调查,详细调查养殖裙带菜的受害情况,记录危害状况、发生地点、危害程度,拍摄污损生物图片。每个采样站点随机选取3处取样,将长度为5 cm的苗绳上附着的所有害虫标本带回计数。虫害鉴定依据成虫形态特征,辅助分子标记手段。对采集到的活体样本带回实验室进行养殖培养实验。虫害危害程度依据田间病虫发生实地估测法,根据单位长度苗绳上采集到的害虫数量分别以轻度(0只/cm < 计数 < 1只/cm)、中度(1只/cm≤计数≤5只/cm)和重度(计数 > 5只/cm)记录,分别以“+”、“+ +”、“+ + +”符号表示。
1.3 虫害生物基因组提取和COⅠ基因的扩增从完成形态学分类的所有麦杆虫采集样本中,选择具有形态代表性的个体及形态学鉴定特征不明显的个体共12只,采用海洋动物组织基因组DNA提取试剂盒(天根生化科技有限公司, 北京)提取基因组DNA。使用麦杆虫属专用COⅠ基因扩增引物(Cabezas et al, 2013)对上述DNA分别进行PCR扩增:上下游引物分别为Cp_COⅠF2 (5′-GGAGATGAYCA AATTTATAATG-3′)和Cp_COⅠR1 (5′-AATATAYACT TCTGGRTGACC-3′)。使用TaKaRa Ex Taq DNA聚合酶(宝日医生物技术有限公司, 北京)进行PCR反应:94℃预变性3 min;94℃变性45 s,48℃退火30 s,72℃延伸1 min,循环40次;最后,72℃延伸7 min。PCR产物经琼脂糖凝胶电泳检测确认扩增成功后,将产物原液送交北京擎科新业生物技术有限公司进行测序。
1.4 测序数据处理与系统发育分析使用MEGA-X (Kumar et al, 2018)对得到的序列进行校正,计算COⅠ基因片段的碱基含量、种间和种内Kimura2-paramter遗传距离、保守位点(conserved sites, C)、变异位点(variable sites, V)、简约信息位点(parsimony informative sites, Pi)和单突变位点(singleton sites, S),分析碱基组成及转换颠换率。将获得的COⅠ基因序列在NCBI上通过BLAST (Johnson et al, 2008)进行同源性比对分析,从检索到的麦杆虫属不同种中分别选择同源性最高的2条核苷酸序列下载,共下载包含Caprella acanthifera和Caprella linearis等在内的36条序列,使用MEGA-X软件进行多重比对分析和手工校正。核苷酸序列的最佳碱基替换模型使用jModelTest (Darriba et al, 2012)进行计算。选择麦杆虫总科(Caprelloidea)的Dulichia falcata作为外群,使用贝叶斯法通过MrBayes 3.1.2 (Huelsenbeck et al, 2001)软件构建系统发育树。测序所得COⅠ基因序列上传至GenBank (https://www. ncbi.nlm.nih.gov/)。
2 结果与分析 2.1 裙带菜苗种来源黄金山养殖场暂养了来自大连海宝渔业有限公司苗场的裙带菜品种“家系”(以下简称cultivar1),于2019年10月24日交付养殖一队和养殖二队在各自海域进行养殖。同时期,养殖三队受灾裙带菜苗种来自金石滩某育苗场,品种为“海宝1号”(以下简称HB1)和某未知种裙带菜品种(以下简称cultivar2)。上述裙带菜苗由金石滩运输至黄金山养殖场进行下海暂养。2019年10月24日,HB1和部分cultivar2裙带菜交付养殖三队,剩余HB1交付养殖一队。
2.2 现场调查结果养殖一队海域(黄金山):HB1于10月24日夹苗,生长状态良好,有轻微脱苗现象;cultivar2养殖区裙带菜正常生长,状态好于HB1;2个养殖区苗绳上同样发现节肢动物附着,平均密度为5.8只/cm。该养殖海区裙带菜筏架未发现漂浮铜藻。
养殖二队海域(柏岚子):cultivar1于10月25日夹苗,生长状态良好;裙带菜苗绳上同样发现节肢动物存在,密度为6.0只/cm。漂浮铜藻内同样发现大量节肢动物,平均密度为6.0只/cm。
养殖三队海域(柏岚子):HB1养殖区,每根养殖绳上仍有少量10月25日下海的裙带菜小苗存活生长(< 30%),个体较大(8~10 cm);cultivar2养殖区大苗全部脱落;2个养殖区养殖绳上均发现大量节肢动物聚集,平均密度为8.0只/cm。在养殖海区发现大量漂浮铜藻缠绕在养殖筏上,铜藻内发现大量节肢动物,平均密度为9.6只/cm。
3处调查海域近年开始出现少量的节肢动物聚集生长现象,但未对裙带菜生长造成影响,且历年裙带菜苗下海时期未观察到节肢动物暴发生长的现象。
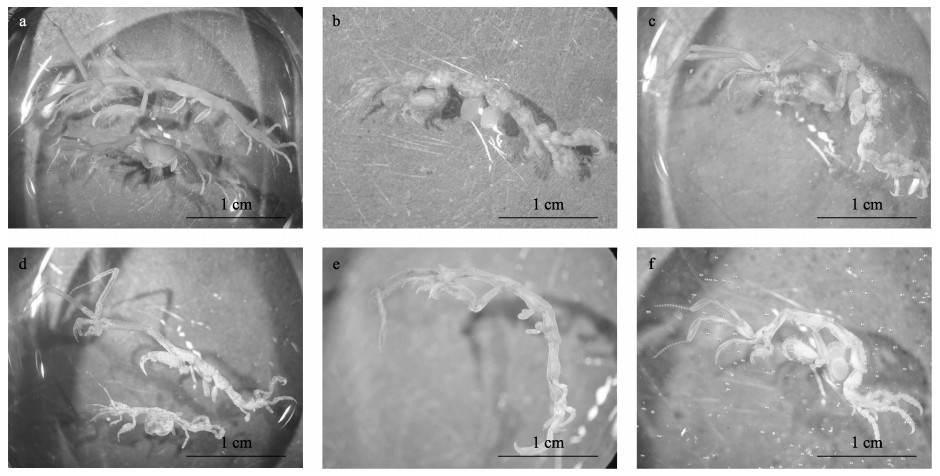
2.3 虫害生物种类及危害程度本次调查共获得标本663个,其中,在一队、二队和三队养殖苗绳中分别采集139、60和290个,二队和三队漂浮铜藻中分别采集131和43个,分属2目3科12种(任先秋等, 2016)。其中7种鉴定到种,分别为丹氏麦杆虫(Caprella danilevskii Czerniavski, 1868)、尖额麦杆虫(Caprella penantis Leach, 1814)、多棘麦杆虫(Caprella acanthogaster Mayer, 1890)、长颈麦杆虫(Caprella equilibra Say, 1818)、背棘麦杆虫(Caprella scaura Templeton, 1836)、强壮藻钩虾(Ampithoe valida)和理石叶钩虾(Jassa marmorata Holmes, 1905);1种鉴定到属,麦杆虫一种(Caprella sp.1);另有4种鉴定到科,其中,钩虾科(Gammaridae) 3种,团水虱科(Sphaeromatidae) 1种。此次采集的标本中,团水虱为等足目(Isopoda),其余均为端足目(Amphipoda)。麦杆虫属物种显微照片如图 2所示。
|
图 2 麦杆虫属物种显微照片 Fig.2 Microscopic pictures of Caprella spp. a:丹氏麦杆虫;b:尖额麦杆虫;c:多棘麦杆虫;d:长颈麦杆虫;e:背棘麦杆虫;f:麦杆虫一种 a: C. danilevskii Czerniavski, 1868; b: C. penantis Leach, 1814; c: C. acanthogaster Mayer, 1890; d: C. equilibra Say, 1818; e: C. scaura Templeton, 1836; f: Caprella sp.1 |
上述鉴定到的物种中,在三队养殖海区及漂浮铜藻中观察到重度发生1种,为丹氏麦杆虫;中度发生3种,分别是尖额麦杆虫(于养殖三队采集统计)、麦杆虫一种(于漂浮铜藻采集统计)、理石叶钩虾(于养殖一队、二队采集统计);其他虫害均为轻度发生(表 1)。实验室培养中发现,麦杆虫能以裙带菜幼苗为唯一食物来源进行正常的生长和产卵繁殖,推断以丹氏麦杆虫为代表的麦杆虫属动物暴发生长和啃食是造成此次虫害的主要原因。
|
|
表 1 辽宁裙带菜养殖区采集点污损生物名录 Tab.1 List of fouling organisms of sampling sites in the U. pinnatifida farms, Liaoning Province, China |
本研究采集的麦杆虫属物种标本主要鉴别特征描述如下:
丹氏麦杆虫身体细长,雄性体长可达17 mm以上,雌性体长可达10 mm以上,采集样本的体色呈深红色至深棕色。无明显额角。鳃为长卵形。第5~7胸足掌节没有抓捕刺(图 3a)。雄性腹部明显,且第2鳃足指节较短(Guerra-García et al, 2002、2004)。

|
图 3 几种麦杆虫的形态特征 Fig.3 Morphological features of Caprella spp. a:丹氏麦杆虫;b、d:多棘麦杆虫;c:尖额麦杆虫;e:背棘麦杆虫;f:麦杆虫一种 a: C. danilevskii Czerniavski, 1868; b, d: C. acanthogaster Mayer, 1890; c: C. penantis Leach, 1814; e: C. scaura Templeton, 1836; f: Caprella sp.1 |
尖额麦杆虫体型粗壮,雄性体长可达11 mm以上,雌性体长可达6 mm以上,采集样本的体色呈紫红色或密布橘红色花纹。头部前端有粗壮明显的额角。第1触角柄的第1、第2节较细(雄性第1触角柄的第1节有时较粗壮)。第2鳃足掌节的毒牙位于近端。第3、第4胸节侧甲十分发达(图 3c)。鳃呈卵圆形略延长。第5~7胸足掌节未膨大,抓捕刺位于近端。在全球范围内均有报道发现(Cabezas et al, 2013; Guerra-García et al, 2004、2006; Masunari et al, 2006; Rueckert et al, 2011)。
多棘麦杆虫采集样本的体色呈粉红或浅黄色,胸节及鳃足多具有红色或橘红色斑点。雄性第1、第2胸节较长。第1、第2胸节及第2鳃足密布绒毛。第2~7胸节上有许多小棘。第5~7胸足掌节有抓捕刺(图 3b、图 3d)。鳃呈长卵形。多棘麦杆虫是我国海藻养殖业常见的污损生物(曹善茂等, 2013; 魏龑伟, 2014)。
长颈麦杆虫身体细长,雄性体长可达12 mm以上,雌性体长可达7 mm以上,采集样本的体色呈浅黄至半透明,带有深色斑点。前额略呈角状。雄性第1、第2胸节较长。第2胸节腹侧第2鳃足之间有一个明显的尖椎状突起(图 3e),第2鳃足基部前缘亦各有1个小齿。第2鳃足腕节腹面突出1个齿,掌节宽大。鳃为长卵形。第5~7胸足掌节有2对抓捕刺(Guerra-García et al, 2004)。
背棘麦杆虫体色不明。头部顶端有1个尖锐额角。鳃为长条形。第5~7胸足掌节有抓捕刺。此次采集中仅发现1只(Guerra-García et al, 2004)。
麦杆虫一种雄性体长可达11 mm以上,雌性体长可达5 mm以上,体色呈粉色或淡黄色半透明且带有红色或橘红色斑点。胸节光滑。雄性第2鳃足掌节密布刚毛,毒牙强而锐利,位于腹侧中部。鳃大而圆(图 3f)。在铜藻中中度发生,数量仅次于镇氏麦杆虫。通过形态学观察未能鉴定到具体种。
2.5 COⅠ基因序列分析以12只麦杆虫的基因组DNA为模板,分别进行COⅠ基因的扩增,校正后序列长度为479 bp,BLAST比对证实为线粒体COⅠ基因。未检测到缺失或插入现象,保守位点共300个,变异位点共179个,简约信息位点共136个,单突变位点共43个。各碱基平均含量分别为T(38%)、C(19%)、A(25%)和G(18%)。
12只麦杆虫COⅠ基因的碱基颠换率[sv/(si+sv)]为46.914%,低于转换率[si/(si+sv)] (53.086%),转换/ 颠换偏倚率R值为1.130。碱基的转换以TC为主(66.667%),AG间的转换为33.333%。颠换主要发生在TA间(57.895%),TG、CA和CG分别占颠换总数的18.421%、18.421%和5.263% (表 2)。
|
|
表 2 麦杆虫属物种COⅠ基因片段碱基替换 Tab.2 Base substitution in COⅠ genes of Caprella spp. |
基于Kimura2-parameter模型分析12只麦杆虫的COⅠ基因,计算种间及种内的遗传距离,结果见表 3。由表 3可知,种间遗传距离平均值为0.231,其中,丹氏麦杆虫与长颈麦杆虫的遗传距离最小,为0.210;尖额麦杆虫与麦杆虫一种的遗传距离最大,为0.279。种内遗传距离平均值为0.014,介于0~0.030之间。
|
|
表 3 麦杆虫属物种的种间和种内遗传距离 Tab.3 The interspecific and intraspecific genetic distance of the COⅠ gene in Caprella spp. |
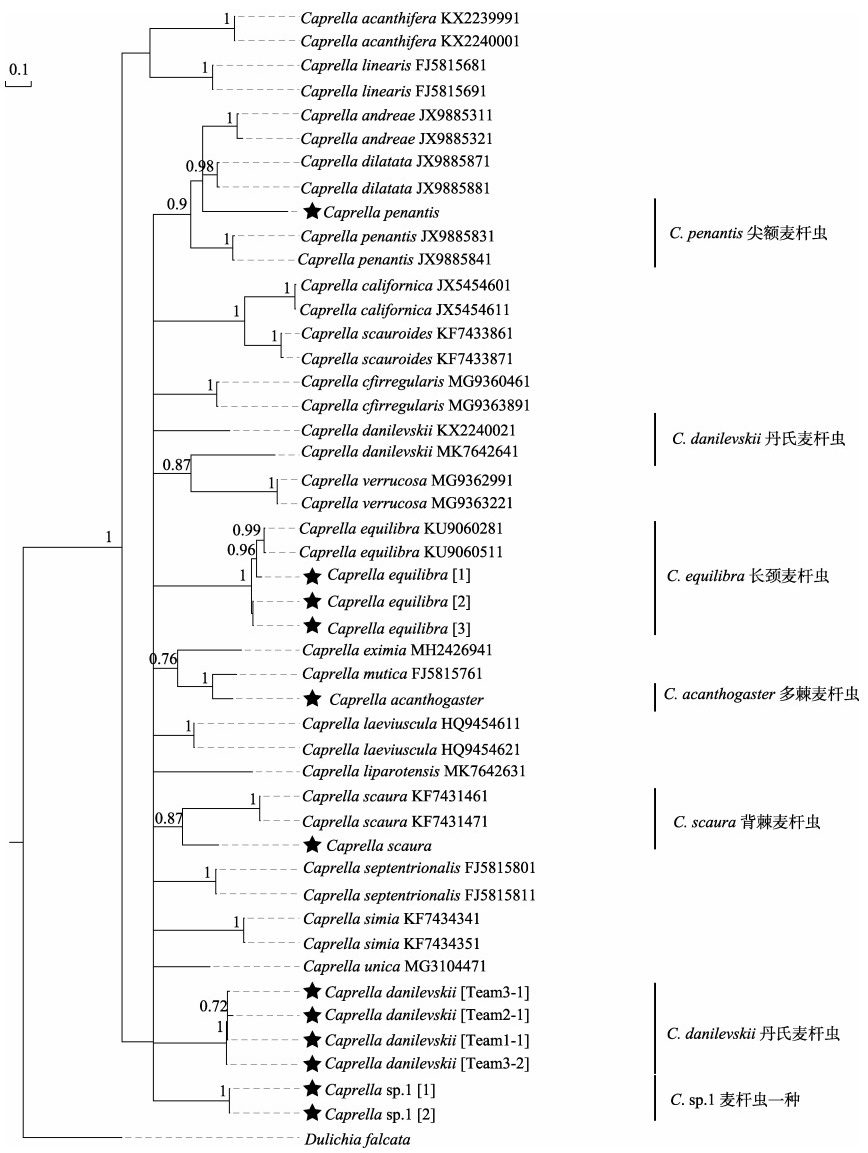
采用BI法构建基于COⅠ基因(表 4)的系统进化树,系统发生分析使用的核苷酸最佳模型为GTR+I+ G,结果如图 4所示。麦杆虫属的所有物种聚为一支,与外群分开,并分化为2大支,第1支由Caprella acanthifera和C. linearis聚为1个单元,其余物种组成第2支位于系统树基部的位置。本研究由3个采集点收集的丹氏麦杆虫聚为一支,Caprella danilevskii MK7642641与C. verrucosa亲缘关系最近,聚为一支,Caprella danilevskii KX2240021单独为一支,三者互为姐妹群。GenBank收录的尖额麦杆虫聚为一支,与本研究采集的尖额麦杆虫分开,且支持率为0.900。多棘麦杆虫与C. mutica亲缘关系最近,聚为一支。麦杆虫一种聚为一支,位于系统树的基部。除上述物种外,其余实验采集样品可很好地与NCBI检索到的同种麦杆虫聚为一支,且支持率均≥0.87。
|
|
表 4 本研究获得的序列 Tab.4 List of sequences obtained in this study |
|
图 4 基于COⅠ基因的麦杆虫物种系统发育树 Fig.4 Phylogenetic trees of Caprella spp. based on COⅠ sequences 支持率≥0.7的值标注在分支上,星标(★)标记为本研究采集样品 Bootstrap support ≥0.7 for branches is indicated, and stars (★) mark the collected samples |
麦杆虫属(Caprella)隶属节肢动物门(Arthropoda)、甲壳亚门(Crustacea)、软甲纲(Malacostraca)、囊虾总目(Peracarida)、端足目(Amphipoda)、麦杆虫总科(Caprelloidea)。在温度为2℃~28℃、盐度高于19的环境中均可生存,是海水养殖设施上的常见种类,以海藻或浮游动植物为食,为常见小型污损生物。麦杆虫繁殖力强,生殖周期短(一世代可产卵4~6次,平均间隔20 d),能连续世代繁殖。其胚胎发育时间一般为5~8 d,性成熟时间为15~20 d (在14℃~18℃范围内,发育及性成熟时间随温度升高而缩短)。麦杆虫摄食率随温度升高而逐渐增加,当温度高于18℃时,摄食率随温度升高而下降,在温度为14℃~20℃内均有较高的摄食率(Takeuchi et al, 1991; 魏龑伟, 2014)。
麦杆虫与藻类养殖之间存在着脆弱的平衡关系。近年来,随着海水养殖规模的不断扩增及沿海工业化的迅猛发展,海水富营养化加剧,我国原有自然藻场的生态环境遭到不同程度的破坏。裙带菜等大型海藻作为海洋生态系统的初级生产者,同时也是环境自我修复的重要一环。大型海藻为端足目动物提供了栖息地和庇护所,同时,藻体上的附生生物群落(epiphyte)也为其提供了大量的食物;而端足类动物的摄食作用能够清除遮挡在海藻表面的遮蔽物,减少附生植物对光和营养盐的竞争,从而促进大型海藻的生长(Brawley et al, 1987; Duffy, 1990; 郑新庆, 2008)。对枸杞岛岩礁生境的调查发现,褐菖鲉(Sebastiscus marmoratus)、斑头鱼(Agrammus agrammus)、大泷六线鱼(Hexagrammos otakii)等以麦杆虫为主食的狭食性鱼类是麦杆虫在自然界中的常见天敌(王凯等, 2012),沿海养殖水体单一的养殖模式对自然藻场原有的生态平衡造成了一定程度的破坏,压缩了鱼类等麦杆虫天敌的生存空间。
蒋日进等(2015)在对烟台近海海域典型污损生物调查中发现,麦杆虫的食物来源主要是附生微藻、底栖微藻及颗粒有机物等。在钩虾和麦杆虫的同位素研究中,钩虾稳定同位素值与大型海藻稳定同位素值更为接近,麦杆虫稳定同位素值与浮游植物更为接近,二者在对海藻食用层面的利用存在差异,说明钩虾主要以大型海藻作为其栖息场所及营养来源,而麦杆虫则主要以大型海藻作为其栖息场所(刘书荣等, 2018)。研究表明,藻钩虾和麦杆虫能够明显抑制马尾藻上附生植物的生长(郑新庆, 2008);Brawley等(1987)在青岛沿岸开放性海藻养殖场中引入不规则麦杆虫(Caprella irregularis)和雷氏藻钩虾(Ampithoe lacertosa),研究发现,二者能有效抑制附生植物在江蓠(Gracilaria asiatica)上的大量生长。端足类、宿主海藻、附生藻类相互作用,啃食者对附生藻类的摄食偏好使大型海藻在竞争中得到解放并获得生长优势。
然而,端足类生物一旦密度过高或可选择的食物有限,也会大量啃食宿主海藻,甚至对藻场造成毁灭性的破坏(郑新庆, 2008)。2012年夏季,在山东荣成桑沟湾龙须菜(Gracilaria lemaneaformis)养殖区,多种麦杆虫大量栖居在龙须菜枝条上并啃食龙须菜,使龙须菜出现负生长,给养殖产业造成巨大损失(魏龑伟, 2014)。麦杆虫和藻钩虾是硇洲马尾藻幼苗海区培育的主要危害,它们会摄食藻苗枝叶,当数量大时会造成幼苗残缺,影响幼苗生长发育,严重时甚至导致人工育苗失败。麦杆虫还常挂于藻苗分枝上,当其大量聚集时会遮蔽藻苗,妨碍幼苗光合作用,影响幼苗生长(贾柽等, 2012)。羊栖菜(Sargassum fusiforme)是洞头县主要的海水养殖藻类,在羊栖菜收获晒干处理时,因麦杆虫混杂其中,不易去除,大大影响干品质量(林位琅, 2008)。
Ashton等(2010)研究表明,人工海水养殖设施为麦杆虫等端足类动物提供了稳定的栖息地。麦杆虫常见于我国北方牡蛎、扇贝、贻贝养殖设施上,该生态环境中大量的贝类排泄产物可能是麦杆虫的食物来源之一;麦杆虫的大量繁殖会影响养殖网袋中海水与外界的交换,也易造成缺氧等问题(曹善茂等, 2013)。
直到近年来,才开始频繁在旅顺地区海上养殖中观察到麦杆虫,其在一定密度范围内会优先啃食附生在大型海藻上的微藻(Brawley et al, 1987; 郑新庆, 2008),直至本次虫害暴发前,未对裙带菜的正常养殖造成危害,故附生在裙带菜养殖设施上的麦杆虫未得到重视。20世纪80年代,李传燕等(1982)对旅顺海区附着生物进行了调查,冬季低温月份几乎没有发现生物附着,在统计全年调查结果时仅发现1只长颈麦杆虫,出现频率为0.002%。麦杆虫的游泳能力弱,只能依靠海藻被动扩散,且附着性海藻物种可以为其提供栖息场所(陈义华等, 2019)。
本调查发现,大量铜藻缠绕在养殖筏架上,其中附生大量虫害生物。铜藻是一种常见的潮下带大型褐藻,是西北太平洋特有的一种大型褐藻,在我国南北方沿海较常见,藻体由固着器、主干、侧枝、叶片、气囊和生殖托构成;其幼苗阶段固着生长在岩石上或低潮带石沼中,成体阶段通过发达的气囊可实现漂浮生长和远距离迁移(Su et al, 2018)。推测此次导致虫害的麦杆虫可能由漂浮铜藻携带而来。
3.2 导致虫害暴发的因素根据水温记录,2019年10月25日—11月1日,平均水温为16.37℃,最高水温为17.24℃(10月25日, 11:49:05),最低水温为15.61℃(2019年11月1日, 19:52:01);2018年同期,平均水温为15.77℃,最高水温为16.60℃ (2018年10月25日, 15:23:11),最低水温为14.93℃ (2018年10月31日, 03:25:23)。水温均呈逐渐下降趋势。2019年水温明显高于去年同期,且满足麦杆虫摄食、繁殖的最佳水温要求(魏龑伟, 2014)。
裙带菜幼苗下海养殖时的藻体长度为1~3 cm,藻体脆弱,在实验室培养发现,麦杆虫能以裙带菜幼苗为唯一食物来源进行正常的生长和产卵繁殖。三队裙带菜从第1天夹苗(10月25日)到虫害暴发全部被啃食殆尽(11月1日)共144 h,不满足麦杆虫暴发性繁殖、生长所需时间(Takeuchi et al, 1991);3个养殖队养殖的裙带菜均在黄金山海区进行统一暂养,其中cultivar1裙带菜在二队可正常生长,HB1裙带菜在一队养殖区可正常生长,而三队养殖区的HB1 (受灾比例70%)和cultivar2 (受灾比例100%)均受灾严重。因此,造成本次虫灾的大量麦杆虫来源不是苗种上附着的,而是本身存在于柏岚子三队养殖海区,推测漂浮铜藻为麦杆虫的传播提供了栖息地和食物来源。目前,裙带菜抗虫害原理研究尚属空白。养殖观察发现,麦杆虫的啃食对藻体较大的裙带菜影响较小,推测不同品种的抗虫害能力强弱与生长速度存在一定关系,下海前期生长速度较快的品种抗虫害能力更强。
二队与三队养殖海区近,相隔20 m,具有相似的水文环境,但此次并未受到虫灾影响,推测原因如下:麦杆虫本身的游泳能力弱,需要借助铜藻等漂浮藻类进行传播(陈义华等, 2019),而铜藻又是一种具有食用价值的经济藻类,二队养殖工人会定期从海上打捞漂浮铜藻,一定程度上阻断了麦杆虫的传播途径。
综上所述,大量的漂浮铜藻为麦杆虫提供了栖息生长和繁殖的场所,当温度适宜且有充足适宜的食物来源时,麦杆虫开始暴发生长,最终导致本次虫害的发生。
3.3 麦杆虫的防除碳酸氢铵简称碳铵,是农作物养殖中常见的化肥,具有速效、价廉、经济等优点。碳酸氢铵还可为大型藻类提供生长所需的氮元素,促进藻类的光合作用,起到增产的效果。碳酸氢铵对直接栖居在生物表面的麦杆虫有很强的急性毒性作用,在短时间内有很高的脱落率和致死率。碳酸氢铵已用于龙须菜养殖中多棘麦杆虫的防除:碳酸氢氨溶液浓度为7.360 g/L (对应的非离子氨浓度为37.720 mg/L),浸泡时间为5 min,可达到对麦杆虫100%的致死效应(魏龑伟等, 2014)。
裙带菜的养殖中可以借鉴“挂袋肥”(张海灵, 2001)的施肥方法,将碳酸氢铵封装于表面有小孔的塑料袋中,挂于养殖筏架上,起到对麦杆虫的防除作用,具体的剂量和挂袋密度需要进一步的实验研究。
3.4 基于COⅠ基因的麦杆虫系统发育分析本研究扩增得到麦杆虫属6个物种线粒体COⅠ基因序列,GC含量明显低于AT含量,表现出对AT含量的偏斜,说明该序列碱基存在明显的偏向性,符合后生动物的线粒体基因组AT含量普遍高的特点(Beard et al, 1993)。碱基替换是DNA序列重要的进化方式,转换/颠换偏倚率R值是序列进化的重要指标(王茜等, 2017)。转换和颠换伴随进化进程的推进不断发生,转换首先趋于饱和,R值不断下降,当序列差异达到最大时,R值最小(DeSalle et al, 1987)。本研究中,COⅠ基因的R值为1.130,远高于Holmquist等(1983)提出的系统学分析的临界值0.400,说明COⅠ基因能够提供系统发育信息。
Hebert等(2003a)对包含脊椎动物和无脊椎动物在内的动物界COⅠ基因序列的比较分析得出:98%的物种种间平均遗传距离可达0.113,可有效地用于动物鉴定。基于COⅠ基因的遗传距离分析显示,种间遗传距离为种内遗传距离的16.500倍,COⅠ基因可有效地进行麦杆虫属种间鉴定(Hebert et al, 2003b)。
基于BI法构建的系统发生树拓扑结构显示,本研究采集的丹氏麦杆虫样品很好地聚为一支,且与其他种的种间遗传距离在0.200以上,大于种内距离16倍以上。本研究采集的尖额麦杆虫与C. andreae和C. dilatata互为姐妹群,亲缘关系更接近。尖额麦杆虫世界广布,与C. andreae和C. dilatata的形态十分相似。然而,C. andreae第1触角十分粗壮,鳃大而圆,第5~7胸足掌节膨大,抓捕刺位于中间位置,生活于龟壳或漂流物上;C. dilatata体型较大,鳃大而圆,第2鳃足掌节近端的毒牙仅出现于雌性及未成熟雄性个体,成熟雄性第2鳃足掌节近端的毒牙消失,但于中间位置多出1个小刺,且生活于浮标和绳索上(Guerra-García, 2014; Guerra-García et al, 2002、2004、2006; Masunari et al, 2006)。尖额麦杆虫不具有上述2种特征,并且在各种栖地都有发现(表 1, 图 3f)。GenBank中未曾收录多棘麦杆虫的COⅠ基因序列,拓扑结构显示本研究采集的多棘麦杆虫与C. mutica亲缘关系最近。麦杆虫一种无法通过形态学和COⅠ基因鉴定到已知种,麦杆虫一种在铜藻中的丰度仅次于丹氏麦杆虫,且种间遗传距离均在0.210以上。其他种的形态鉴定结果与COⅠ基因鉴定结果一致。
麦杆虫作为典型的海水养殖入侵污损生物,曾经在世界范围内引起关注(Ashton et al, 2007; Takeuchi et al, 2001),并对我国的龙须菜和羊栖菜养殖业造成严重影响(李生尧等, 2009; 魏龑伟, 2014)。麦杆虫属的物种种类繁多,基于麦杆虫线粒体COⅠ基因的DNA条形码技术能够为我国的海水养殖虫害检测提供可靠的鉴定方法,对保障我国海水养殖农业生产安全具有重要意义。
本次采集中同时收集到虫害发生中度的钩虾科(Gammaridae)种类。韩永望(2012)和郑新庆等(2013)研究表明,强壮藻钩虾的主要食物为大型藻类和水体中的有机质碎屑,且表现出端足类常见的补偿性摄食现象,即对于高含水量、低碳含量的藻类,只能通过增加摄食来满足自身代谢需求。Duffy等(1991)对藻钩虾属(Ampithoe spp.)种类的研究表明,藻钩虾对海藻的摄食选择并不是以海藻的营养价值为优先考量标准。本调查中,丰度最高的物种为丹氏麦杆虫,但不能忽略钩虾对裙带菜的啃食作用。关于钩虾与麦杆虫对裙带菜的摄食作用以及钩虾科物种的分子鉴定工作将在后续研究中进一步完善和讨论。
全球气候变暖趋势的加剧带来的海水温度上升、沿海水体富营养化和单一养殖模式(吕兑安等, 2019; 柳春福, 2019; 胡婉彬等, 2015)造成养殖水体生态失衡是未来辽东半岛裙带菜养殖业乃至全国海水养殖业要面临的巨大考验。开发耐高温、抗虫害、生长速度快、产量高的新品种裙带菜是应对挑战的有效措施;同时,根据海区环境承载力合理分配养殖密度和搭配养殖品种,对环境修复和可持续发展具有重要意义。
ASHTON G V, BURROWS M T, WILLIS K J, et al. Seasonal population dynamics of the non-native Caprella mutica (Crustacea, Amphipoda) on the west coast of Scotland. Marine and Freshwater Research, 2010, 61(5): 549-559 DOI:10.1071/MF09162 |
ASHTON G V, WILLIS K J, COOK E J, et al. Distribution of the introduced amphipod, Caprella mutica Schurin, 1935 (Amphipoda: Caprellida: Caprellidae) on the west coast of Scotland and a review of its global distribution. Hydrobiologia, 2007, 590(1): 31-41 DOI:10.1007/s10750-007-0754-y |
BEARD C, HAMM D M, COLLINS F H. The mitochondrial genome of the mosquito Anopheles gambiae: DNA sequence, genome organization, and comparisons with mitochondrial sequences of other insects. Insect Molecular Biology, 1993, 2(2): 103-124 DOI:10.1111/j.1365-2583.1993.tb00131.x |
BRAWLEY S H, FEI X G. Studies of mesoherbivory in aquaria and in an unbarricaded mariculture farm on the Chinese coast. Journal of Phycology, 1987, 23(4): 614-623 |
CABEZAS M P, NAVARRO-BARRANCO C, ROS M, et al. Long-distance dispersal, low connectivity and molecular evidence of a new cryptic species in the obligate rafter Caprella andreae Mayer, 1890 (Crustacea: Amphipoda: Caprellidae). Helgoland Marine Research, 2013, 67(3): 483-497 DOI:10.1007/s10152-012-0337-9 |
CAO S M, HAO S, GAO X, et al. Effect of different ecological factors on the oxygen consumption rate of Caprella acanthogaster. Hebei Fisheries, 2013(6): 5-7 [曹善茂, 郝帅, 高雪, 等. 不同生态因子对多棘麦秆虫耗氧率的影响. 河北渔业, 2013(6): 5-7 DOI:10.3969/j.issn.1004-6755.2013.06.002] |
CHEN Y H, DONG Z G, LI X Y, et al. Study on fouling organisms in Pacific oysters (Crassostrea gigas) culture area of the Haizhou Bay. Genomics and Applied Biology, 2019, 38(4): 1572-1579 [陈义华, 董志国, 李晓英, 等. 海州湾长牡蛎养殖区污损生物研究. 基因组学与应用生物学, 2019, 38(4): 1572-1579] |
DARRIBA D, TABOADA G L, DOALLO R, et al. jModelTest 2: More models, new heuristics and high-performance computing. Nature Methods, 2012, 9(8): 772 |
DESALLE R, FREEDMAN T, PRAGER E M, et al. Tempo and mode of sequence evolution in mitochondrial DNA of Hawaiian Drosophila. Journal of Molecular Evolution, 1987, 26(1/2): 157-164 DOI:10.1007/BF02111289 |
DUFFY J E, HAY M E. Food and shelter as determinants of food choice by an herbivorous marine amphipod. Ecology, 1991, 72(4): 1286-1298 DOI:10.2307/1941102 |
DUFFY J E. Amphipods on seaweeds: Partners or pests?. Oecologia, 1990, 83(2): 267-276 DOI:10.1007/BF00317764 |
Fishery Bureau of Ministry of Agriculture and Rural Affairs of China, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook. Beijing: China Agriculture Press, 2019 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴. 北京: 中国农业出版社, 2019]
|
GONZALEZ M L, PEREZ-SCHULTHEISS J, LOPEZ D A. Exotic amphipods in aquaculture systems: Presence and potential use. Crustaceana, 2011, 84(7): 769-775 DOI:10.1163/001121611X579132 |
GUERRA-GARCÍA J M, TAKEUCHI I. The Caprellidea (Crustacea: Amphipoda) from Ceuta, North Africa, with the description of three species of Caprella, a key to the species of Caprella, and biogeographical discussion. Journal of Natural History, 2002, 36(6): 675-713 DOI:10.1080/00222930010025923 |
GUERRA-GARCÍA J M, TAKEUCHI I. The Caprellidea (Crustacea: Amphipoda) from Tasmania. Journal of Natural History, 2004, 38(8): 967-1044 DOI:10.1080/0022293021000054497 |
GUERRA-GARCÍA J M, REDONDO-GÓMEZ S, ESPINA Á G, et al. Caprella penantis Leach, 1814 and Caprella dilatata Kroyer, 1843 (Crustacea: Amphipoda) from the Strait of Gibraltar: A molecular approach to explore intra-and interspecific variation. Marine Biology Research, 2006, 2(2): 100-108 DOI:10.1080/17451000600672511 |
GUERRA-GARCÍA J M. Caprellidea. Identification guide to British caprellids v. 3.2. NMBAQC 2012 Taxonomic Workshop Dove Marine Laboratory. NMBAQC Workshop 2012, 1-17. NMBAQC; 2014
|
HAN Y W, LI J, CHEN P, et al. Analysis of the feeding habits of Ampithoe valida and its response to different temperature and salinity. Progress in Fishery Sciences, 2012, 33(6): 53-58 [韩永望, 李健, 陈萍, 等. 强壮藻钩虾食性分析及其对温度、盐度变化的响应. 渔业科学进展, 2012, 33(6): 53-58 DOI:10.3969/j.issn.1000-7075.2012.06.008] |
HEBERT P D N, CYWINSKA A, BALL S L, et al. Biological identifications through DNA barcodes. Proceedings of the Royal Society B: Biological Sciences, 2003a, 270(1512): 313-321 DOI:10.1098/rspb.2002.2218 |
HEBERT P D N, RATNASINGHAM S, DEWAARD J R. Barcoding animal life: Cytochrome c oxidase subunit 1 divergences among closely related species. Proceedings of the Royal Society B: Biological Sciences, 2003b, 270(supp 1): S96-S99 |
HOLMQUIST R. Transitions and transversions in evolutionary descent: An approach to understanding. Journal of Molecular Evolution, 1983, 19(2): 134-144 DOI:10.1007/BF02300751 |
HU W B, DUAN L Z, CHANG Y Q, et al. Review on the response of marine organisms to the change of marine environmental limiting factors. Hebei Fisheries, 2015, 41(11): 71-77 [胡婉彬, 段立柱, 常亚青, 等. 海洋生物对海洋环境限制因子变化的响应. 河北渔业, 2015, 41(11): 71-77 DOI:10.3969/j.issn.1004-6755.2015.11.026] |
HUELSENBECK J P, RONQUIST F. MRBAYES: Bayesian inference of phylogenetic trees. Bioinformatics (Oxford, England), 2001, 17(8): 754-755 DOI:10.1093/bioinformatics/17.8.754 |
JIA C, YANG B, XIE E Y. Studies on the prevention and cure for predators and rivals in artificial breeding of Sargassum naozhouense Tseng et Lu. Journal of Aquaculture, 2012, 33(7): 35-39 [贾柽, 杨彬, 谢恩义. 硇洲马尾藻人工育苗常见敌害生物及防治初探. 水产养殖, 2012, 33(7): 35-39 DOI:10.3969/j.issn.1004-2091.2012.07.010] |
JIANG R J, ZHANG S Y, BI Y X, et al. Food sources of small invertebrates in the macroalgal bed of Gouqi Island. Journal of Fisheries of China, 2015, 39(10): 1487-1498 [蒋日进, 章守宇, 毕远新, 等. 枸杞岛海藻场小型无脊椎动物的食物来源. 水产学报, 2015, 39(10): 1487-1498] |
JOHNSON M, ZARETSKAYA I, RAYTSELIS Y, et al. NCBI BLAST: A better web interface. Nucleic Acids Research, 2008, 36(web server issue): W5-W9 |
KUMAR S, STECHER G, LI M, et al. MEGA X: Molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution, 2018, 35(6): 1547-1549 DOI:10.1093/molbev/msy096 |
LI C Y, HUANG Z G, ZHANG L X, et al. Studies on the ecology of fouling organisms in Lushun harbor, Liaoning Province, China. Acta Ecologica Sinica, 1982, 2(1): 59-65 [李传燕, 黄宗国, 张良兴, 等. 旅顺港附着生物生态的研究. 生态学报, 1982, 2(1): 59-65] |
LI S Y, YE D S, GUO W L, et al. Investigation and prevention of harmful organisms for the cultivation of Sargassum fusiforme (Harv.) Okam. Modern Fisheries Information, 2009, 24(9): 19-22 [李生尧, 叶定书, 郭温林, 等. 羊栖菜栽培敌害生物调查及其防治. 现代渔业信息, 2009, 24(9): 19-22 DOI:10.3969/j.issn.1004-8340.2009.09.007] |
LIN W L. The raft cultivation of Sargassum fusiforme. Fujian Agriculture, 2008, 67(7): 31 [林位琅. 羊栖菜浮筏栽培技术. 福建农业, 2008, 67(7): 31] |
LIU C F. Research on the development strategy of ecological aquaculture and new aquaculture model. Peasant Staff, 2019, 35(11): 152 [柳春福. 水产生态养殖与新养殖模式发展战略探究. 农家参谋, 2019, 35(11): 152] |
LIU S R, ZHOU X J, ZHANG S Y, et al. Relationship between epiphytic seaweeds and two seaweed-associated amphipods in mussel raft culture area. Chinese Journal of Ecology, 2018, 37(9): 2737-2744 [刘书荣, 周曦杰, 章守宇, 等. 贻贝筏式养殖区附生大型海藻与两种附着端足目的关系. 生态学杂志, 2018, 37(9): 2737-2744] |
LÜ D A, CHENG J, MO W, et al. Pollution and ecological restoration of mariculture. Ocean Development and Management, 2019, 36(11): 43-48 [吕兑安, 程杰, 莫微, 等. 海水养殖污染与生态修复对策. 海洋开发与管理, 2019, 36(11): 43-48 DOI:10.3969/j.issn.1005-9857.2019.11.007] |
LV F, GUO W, DIND G, et al. Analysis of the similarity of ITS and coxI sequences of Sargassum horneri along the offshore of China. Progress in Fishery Sciences, 2018, 39(6): 141-146 [吕芳, 郭文, 丁刚, 等. 中国近海铜藻ITS与coxI序列相似性分析. 渔业科学进展, 2018, 39(6): 141-146] |
MASUNARI S, TAKEUCHI I. Redescription of Caprella dilatata Krøyer, 1843 (Caprellidae: Amphipoda: Crustacea) from Brazil, with note on its biogeographical distribution in South America. Zootaxa, 2006, 1298(1): 49-60 DOI:10.11646/zootaxa.1298.1.5 |
REN X Q, SHA Z L. The Benthic Amphipoda (Crustacea) of the Yellow Sea. Beijing: Science Press, 2016 [任先秋, 沙忠立. 黄海底栖端足类. 北京: 科学出版社, 2016]
|
RUECKERT S, SIMDYANOV T G, ALEOSHIN V V, et al. Identification of a divergent environmental DNA sequence clade using the phylogeny of Gregarine parasites (Apicomplexa) from crustacean hosts. PLoS One, 2011, 6(3): e18163 DOI:10.1371/journal.pone.0018163 |
SHAN T F, PANG S J, LI J, et al. Breeding of an elite cultivar Haibao No. 1 of Undaria pinnatifida (Phaeophyceae) through gametophyte clone crossing and consecutive selection. Journal of Applied Phycology, 2016, 28(4): 2419-2426 DOI:10.1007/s10811-015-0748-5 |
SU L, SHAN T F, PANG S J, et al. Analyses of the genetic structure of Sargassum horneri in the Yellow Sea: Implications of the temporal and spatial relations among floating and benthic populations. Journal of Applied Phycology, 2018, 30(2): 1417-1424 DOI:10.1007/s10811-017-1296-y |
SU L. The study on reproduction and cultivation problems related to variety breeding of the economic seaweed Saccharina japonica. Doctoral Dissertation of University of Chinese Academy of Sciences (Institute of Oceanology, Chinese Academy of Sciences), 2018 [苏丽. 与海带品种培育相关的繁殖与栽培问题的研究. 中国科学院大学(中国科学院海洋研究所)博士研究生学位论文, 2018]
|
TAKEUCHI I, HIRANO R. Growth and reproduction of Caprella danilevskii (Crustacea: Amphipoda) reared in the laboratory. Marine Biology, 1991, 110(3): 391-397 DOI:10.1007/BF01344358 |
TAKEUCHI I, TAKAHASHI S, TANABE S, et al. Caprella watch: A new approach for monitoring butyltin residues in the ocean. Marine Environmental Research, 2001, 52(2): 97-113 DOI:10.1016/S0141-1136(00)00265-8 |
WANG K, ZHANG S Y, WANG Z H, et al. Dietary composition and food competition of six main fish species in rocky reef habitat off Gouqi Island. Chinese Journal of Applied Ecology, 2012, 23(2): 536-544 [王凯, 章守宇, 汪振华, 等. 枸杞岛岩礁生境主要鱼类的食物组成及食物竞争. 应用生态学报, 2012, 23(2): 536-544] |
WANG Q, WANG X H. Phylogenetic analysis on several genera of the subfamily Orthocladiinae (Diptera: Chironomidae) based on 16S rDNA. Acta Scientiarum Naturalium Universitatis Neimongol, 2017, 48(3): 284-290 [王茜, 王新华. 直突摇蚊亚科(双翅目: 摇蚊科)部分属基于16S rDNA序列的系统发育研究. 内蒙古大学学报(自然科学版), 2017, 48(3): 284-290] |
WEI Y W, ZHANG J H, WU W G. Removal of the biofouling organism Caprella acanthogaster attached on cultivated seaweed Gracilaria lemaneaformis using ammonium bicarbonate. Progress in Fishery Sciences, 2014, 35(4): 97-102 [魏龑伟, 张继红, 吴文广. 碳酸氢铵对龙须菜(Gracilaria lemaneaformis)污损生物多棘麦杆虫(Caprella acanthogaster)的防除效果. 渔业科学进展, 2014, 35(4): 97-102] |
WEI Y W. Basic ecology research on biofouling Caprella acanthogaster in Sungo Bay. Masterxs Thesis of Ocean University of Shanghai, 2014 [魏龑伟. 桑沟湾污损生物—多棘麦杆虫的基础生态学研究. 上海海洋大学硕士研究生学位论文, 2014]
|
XU S F, LI D, ZHANG X C, et al. The Undaria pinnatifida cultivar No. 2 Haibao. China Fisheries, 2015, 56(11): 55-57 [许淑芬, 李丹, 张喜昌, 等. 裙带菜"海宝2号". 中国水产, 2015, 56(11): 55-57 DOI:10.3969/j.issn.1002-6681.2015.11.029] |
ZHANG H L. Scientific fertilization of Saccharina japonica. Journal of Aquaculture, 2001(6): 17 [张海灵. 海带的科学施肥. 水产养殖, 2001(6): 17 DOI:10.3969/j.issn.1004-2091.2001.06.008] |
ZHENG X Q, HUANG L F, LI Y C, et al. The feeding selectivity of an herbivorous amphipod Ampithoe valida on three dominant macroalgal species of Yundang Lagoon. Acta Ecologica Sinica, 2013, 33(22): 7166-7172 [郑新庆, 黄凌风, 李元超, 等. 啃食性端足类强壮藻钩虾对筼筜湖三种大型海藻的摄食选择性. 生态学报, 2013, 33(22): 7166-7172] |
ZHENG X Q. A preliminary study on the impacts of amphipodsx grazing on the macroalgal community in Yundang Lagoon. Masterxs Thesis of Xiamen University, 2008 [郑新庆. 端足类啃食作用对筼筜湖大型海藻群落影响的初步研究. 厦门大学硕士研究生学位论文, 2008]
|



