2. 江苏省海洋水产研究所 江苏 南通 226007
2. Jiangsu Institute of Marine Fisheries, Nantong, Jiangsu 226007, China
水体溶解氧(DO)是水生生物生存的必需因素之一,在其生长、发育和繁殖等方面发挥重要作用。当前,在我国水产养殖过程中,由于养殖密度高、养殖投入品的广泛使用和气候变化等,导致水体中DO含量经常波动,有时可能会下降到生物体的生理极限以下,形成低氧环境,对水产养殖造成巨大威胁。李志华等(2004)研究表明,在虾类养殖过程中,DO含量应该不低于3 mg/L。当低氧发生时,会对虾的呼吸、代谢和抗氧化能力等方面产生影响。Richard等(1996)研究表明,短刀小长臂虾(Palaemonetes pugio)的耗氧量随着氧分压力的降低显著下降。Marion等(2016)研究表明,在长期低氧条件下,北方长额虾(Pandalus borealis)肌肉组织乳酸脱氢酶(LDH)活力显著降低。此外,Li等(2016)研究表明,在低氧条件下,凡纳滨对虾(Litopenaeus vannamei)鳃、肝胰腺、血淋巴组织的超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)活力均增加。
脊尾白虾(Exopalaemon carinicauda)广泛分布于我国沿岸,因其具有生长快、繁殖能力强、味道鲜美且营养价值高等优点,已成为我国海水池塘养殖的主要虾类品种(连春盎等, 2017; 窦全伟等, 2019)。但脊尾白虾对氧的需求比较高,尤其是夏季高温季节,易出现缺氧死亡。目前,关于DO对脊尾白虾影响方面的研究相对较少,仅李明云等(1992)研究了脊尾白虾的窒息点和耗氧率;王琦等(2013)研究了干露胁迫对脊尾白虾HSP70和ferritin基因表达的影响;连春盎(2016)研究了干露胁迫对脊尾白虾呼吸代谢相关酶和低氧诱导因子的影响。尚未见对脊尾白虾进行渐变式低氧胁迫并分析其生理响应的研究。因此,本研究在封闭水体中,通过脊尾白虾的呼吸消耗逐渐产生低氧环境,模拟自然环境下水体低氧的形成过程,研究低氧–复氧对脊尾白虾呼吸代谢和抗氧化能力的影响,分析其生理指标的变化趋势,以期为脊尾白虾的健康养殖和耐低氧品系的选育提供基础资料。
1 材料与方法 1.1 实验材料实验材料取自江苏省海洋水产研究所如东海水虾类科研基地。随机挑选体长为(5.1±0.2) cm,体重为(2.38±0.19) g,健康、活力好的脊尾白虾,于1000 L塑料圆桶中暂养7 d。暂养期间,海水盐度为25、水温为20℃~21℃,持续充氧。每天投喂适量的配合饲料,实验前1 d停止投喂。每天换水1次,换水量约为总水量体积1/3。
1.2 实验设计实验在盐度为25、温度为20℃~21℃条件下进行。按预实验结果,随机将脊尾白虾分到装有5 L海水的三角瓶中,共48瓶,每瓶10尾,每3瓶为1个组。充气稳定0.5 h后,将实验组三角瓶停止充气,并用带有橡胶导管的橡胶塞密封,开始计时,待5 h后,打开橡胶塞,开始对实验组复氧并计时;对照组一直保持充气供氧。
1.3 样品的采集与测定 1.3.1 水样和组织采集根据预实验结果,分别于实验开始0、1、2、4、5 h和复氧1、4、8 h,将水样采集至水样瓶中,用碱性碘化钾和MnCl2固定液固定,用于后续DO的测定;同时,在每组水样取完后,立即打开橡胶塞,从各瓶中随机选取6尾活虾,取完整的鳃、肝胰腺和肌肉组织,液氮冻存后放入–80℃冰箱保存,用于后续酶活力的测定。
1.3.2 溶解氧测定待水样固定1 h后(沉淀完全),按照海水监测规范(GB 17378.4-2007)规定的方法进行DO的测定。
1.3.3 酶活力测定按1︰9质量体积比,于上述鳃、肝胰腺和肌肉组织样品中加入0.86% NaCl溶液,冰浴下匀浆制成10%的组织匀浆液,离心,上清液分装后用于抗氧化酶和LDH活力测定;沉淀经匀浆介质重悬、超声破碎后制成线粒体匀浆液,用于细胞色素C氧化酶(CCO)、琥珀酸脱氢酶(SDH)和延胡索酸还原酶(FRD)活力测定。CCO活力测定采用武汉纯度生物科技有限公司试剂盒;抗氧化酶、LDH和SDH活力以及蛋白含量测定均采用南京建成生物工程研究所试剂盒;FRD活力测定参照Xiao等(1993)方法。酶活力单位以U/mg prot表示,代表每毫克组织含有的酶活力单位数。
1.4 数据分析采用SPSS统计软件进行数据分析,所有实验结果均采用平均值±标准差(Mean±SD)表示。不同组同一时间点的数据采用t检验比较,同一组不同时间点的数据采用单因素方差分析(one-way ANOVA)进行比较,以P < 0.05作为显著标准。
2 结果与分析 2.1 溶解氧浓度变化分析对照组与实验组DO浓度的变化曲线见图 1。从图 1可以看出,随着静室呼吸耗氧时间的延长,实验组水体中DO含量不断降低,在呼吸耗氧2 h时,DO含量为3.70 mg/L;5 h时,DO含量已经由最初的7.92 mg/L降至1.10 mg/L,而对照组DO含量一直保持相对稳定。实验组各时间点DO含量与对照组相比均差异显著(P < 0.05)。复氧后,实验组DO含量迅速恢复到对照组水平,且随着复氧时间的延长而一直保持稳定。
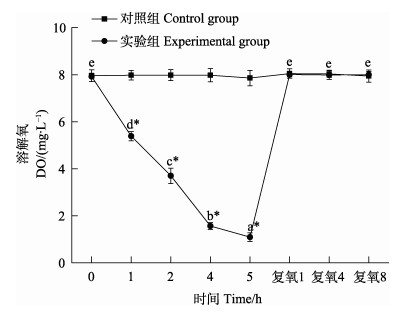
|
图 1 溶解氧浓度变化 Fig.1 Changes in dissolved oxygen concentration 不同小写字母表示同一处理组不同时间点差异显著,*表示实验组与对照组在相同时间点差异显著。下同 Different lowercases indicate significance difference (P < 0.05) among the same treatment in different time points, *indicate significant differences (P < 0.05) between experimental group and the control group at the same time. The same as below |
从图 2可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织CCO活力均呈逐渐降低的趋势。在呼吸耗氧5 h时,酶活力降到最低值,分别下降了80.2%、48.7%、80.1%。鳃和肌肉组织酶活力在呼吸耗氧1 h时,分别与各自的对照组相比差异显著(P < 0.05);而肝胰腺组织酶活力在呼吸耗氧4 h时与对照组间存在显著差异(P < 0.05)。鳃和肌肉组织酶活力分别在呼吸耗氧2、4、5 h和4、5 h时均呈下降趋势,但差异不显著(P > 0.05)。复氧后,3种组织CCO活力均逐渐升高,3种组织在复氧4 h时与各自的对照组相比均无显著差异(P > 0.05),但肌肉组织酶活力在复氧8 h时,显著低于对照组(P < 0.05)。
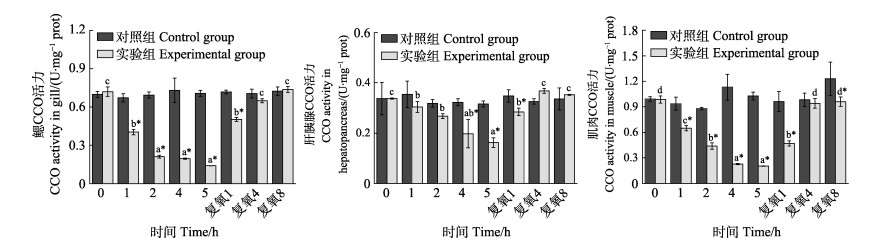
|
图 2 脊尾白虾鳃、肝胰腺和肌肉CCO活力的变化 Fig.2 Changes of CCO activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 3可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾的鳃、肝胰腺和肌肉组织SDH活力均呈逐渐降低的趋势。鳃和肌肉组织酶活力在呼吸耗氧2 h、肝胰腺在呼吸耗氧4 h时,才开始与各自的对照组相比差异显著(P < 0.05)。3种组织酶活力在呼吸耗氧5 h时降到最低,分别下降了48.4%、66.8%、52.3%。复氧后,3种组织酶活力均呈逐渐升高的趋势。在复氧1 h时,3种组织酶活力虽然升高但均显著低于各自的对照组(P < 0.05)。在复氧4 h时,鳃和肌肉组织酶活力与各自对照组相比差异不显著(P > 0.05),而肝胰腺组织酶活力却显著低于对照组(P < 0.05);复氧8 h时,3种组织酶活力与各自对照组相比均无显著差异(P > 0.05)。

|
图 3 脊尾白虾鳃、肝胰腺和肌肉SDH活力的变化 Fig.3 Changes of SDH activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 4可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织FRD活力均呈逐渐升高的趋势。在呼吸耗氧2 h时,3种组织酶活力与各自对照组之间相比差异显著(P < 0.05);在呼吸耗氧5 h时,3种组织酶活力均达到最大值,分别升高了77.4%、179.5%、81.6%。复氧后,3种组织酶活力均呈逐渐降低的趋势。在复氧1 h时,酶活力虽然显著下降但依旧显著高于各自的对照组(P < 0.05),继续复氧,酶活力逐渐恢复至对照组水平,在复氧8 h与各自对照组相比均无显著差异(P > 0.05)。
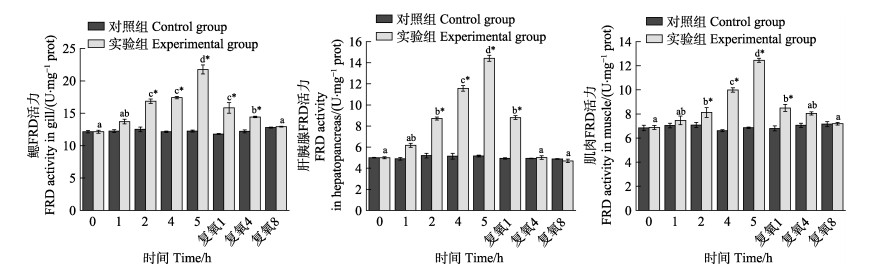
|
图 4 脊尾白虾鳃、肝胰腺和肌肉FRD活力的变化 Fig.4 Changes of FRD activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 5可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织LDH活力均呈现逐渐升高的变化趋势。在呼吸耗氧2 h时,3种组织酶活力与对照组相比存在显著差异(P < 0.05);在吸耗氧5 h时,3种组织酶活力均达到最大值,分别升高了189.1%、103.6%、74.9%。复氧后,鳃和肌肉组织酶活力均逐渐降低,鳃组织酶活力在复氧1 h时仍显著高于对照组(P < 0.05);肌肉组织酶活力在复氧1、4、8 h与对照组相比均无显著差异(P > 0.05);肝胰腺组织酶活力在复氧阶段呈波动性变化,但在复氧1、4、8 h与对照组相比均无显著差异(P > 0.05)。
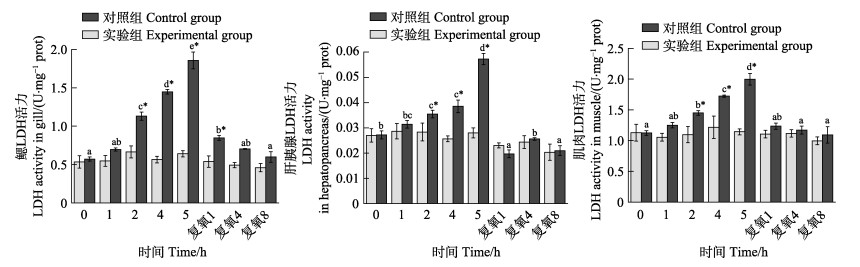
|
图 5 脊尾白虾鳃、肝胰腺和肌肉LDH活力的变化 Fig.5 Changes of LDH activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 6可以看出,脊尾白虾鳃、肝胰腺和肌肉组织SDH/FRD值的变化规律基本相似。随着静室呼吸耗氧时间的延长,该比值呈逐渐降低的趋势,在呼吸耗氧5 h时降到最低值;复氧后,该比值逐渐升高。从图 6还可以看出,该比值在下降和升高阶段,肌肉和肝胰腺组织变化幅度相比于鳃组织中的变化幅度较大。
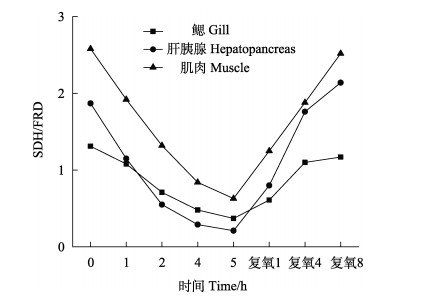
|
图 6 脊尾白虾鳃、肝胰腺和肌肉SDH/FRD值的变化 Fig.6 Changes on value of SDH/FRD in gill, hepatopancreas and muscle of E. carinicauda |
从图 7可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织SOD活力均呈先升高后降低的趋势,在呼吸耗氧4 h达到最大值,分别升高了54.2%、29.9%、199.6%;呼吸耗氧5 h时,3种组织酶活力均显著下降,但只有肝胰腺组织酶活力显著低于对照组(P < 0.05)。复氧后,3种组织酶活力均呈先升高后降低的趋势,在复氧1 h时,酶活力均显著高于各自的对照组(P < 0.05);复氧4、8 h时,酶活力与各自对照组相比均无显著差异(P > 0.05)。
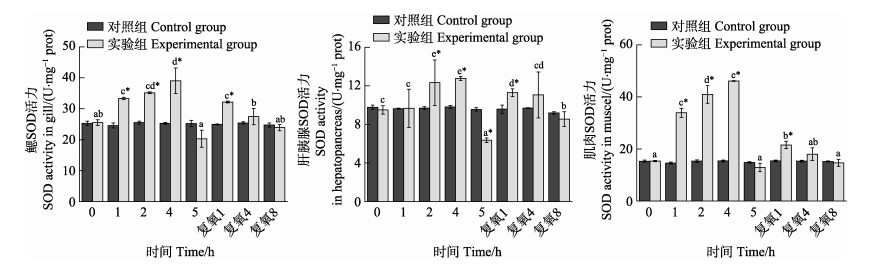
|
图 7 脊尾白虾鳃、肝胰腺和肌肉SOD活力的变化 Fig.7 Changes of SOD activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 8可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾肝胰腺和肌肉组织CAT活力均呈先升高后降低的趋势,在呼吸耗氧4 h达到最大值并显著高于各自对照组(P < 0.05)。呼吸耗氧5 h时,酶活力均显著降低(P < 0.05),但与对照组相比无显著差异(P > 0.05);鳃组织酶活力在呼吸耗氧阶段呈波动性变化,在呼吸耗氧1 h时,酶活力显著低于对照组(P < 0.05);在呼吸耗氧4 h时显著升高并达到最大值,继续呼吸耗氧至5 h时,酶活力又显著降低(P < 0.05)但与对照组相比无显著差异(P > 0.05)。复氧后,实验组脊尾白虾鳃、肝胰腺和肌肉3种组织酶活力均呈先升高后降低的趋势,复氧4、8 h时,3种组织酶活力与各自对照组相比无显著差异(P > 0.05)。
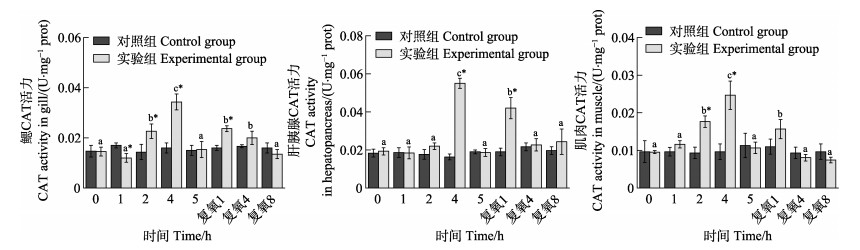
|
图 8 脊尾白虾鳃、肝胰腺和肌肉CAT活力的变化 Fig.8 Changes of CAT activity in gill, hepatopancreas and muscle of E. carinicauda |
从图 9可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃和肌肉组织POD活力呈“降–升–降”的变化趋势,但鳃组织酶活力在呼吸耗氧5 h时显著低于对照组(P < 0.05);肌肉组织酶活力呼吸耗氧2 h时显著低于对照组(P < 0.05);呼吸耗氧4 h时酶活力显著升高但与对照组相比无显著差异(P > 0.05);肝胰腺组织酶活力呈逐渐降低的趋势,呼吸耗氧2 h时显著低于对照组(P < 0.05)。复氧后,实验组脊尾白虾鳃、肝胰腺和肌肉3种组织酶活力均呈先升高后降低的趋势。复氧1 h时,3种组织酶活力显著升高并显著高于各自的对照组(P < 0.05),继续复氧酶活力不断降低,但在复氧8 h时,鳃和肌肉组织酶活力显著低于对照组(P < 0.05),肝胰腺组织酶活力虽高于对照组但差异不显著(P > 0.05)。
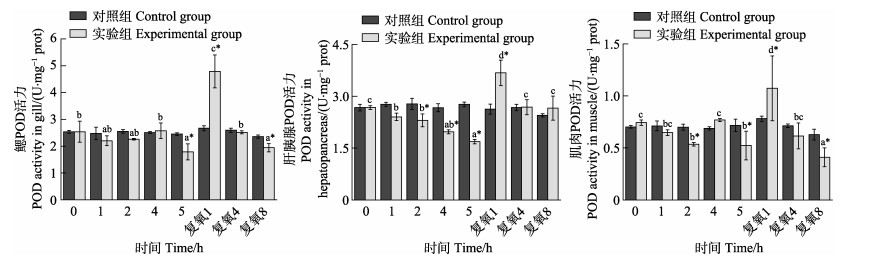
|
图 9 脊尾白虾鳃、肝胰腺和肌肉POD活力的变化 Fig.9 Changes of POD activity in gill, hepatopancreas and muscle of E. carinicauda |
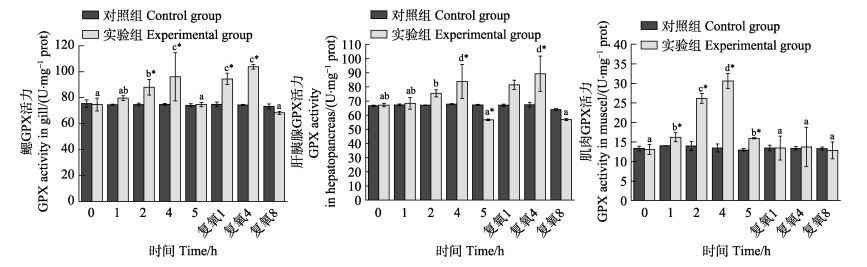
从图 10可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织GPX活力均呈先升高后降低的趋势,在呼吸耗氧4 h时达到最大值,并显著高于各自的对照组(P < 0.05);呼吸耗氧5 h时,3种组织酶活力均显著降低,但肝胰腺组织酶活力显著低于对照组(P < 0.05),而肌肉组织酶活力显著高于对照组(P < 0.05)。复氧后,实验组脊尾白虾鳃和肝胰腺组织酶活力均呈先升高后降低的趋势。复氧4 h时,酶活力达到最大值并显著高于对照组(P < 0.05);复氧8 h时,酶活力下降至低于对照组水平,但差异不显著(P > 0.05)。肌肉组织酶活力在复氧1 h时显著降低(P < 0.05),但与对照组相比无显著差异(P > 0.05),继续复氧后,GPX活力维持相对稳定。
|
图 10 脊尾白虾鳃、肝胰腺和肌肉GPX活力的变化 Fig.10 Changes of GPX activity in gill, hepatopancreas and muscle of E. carinicauda |
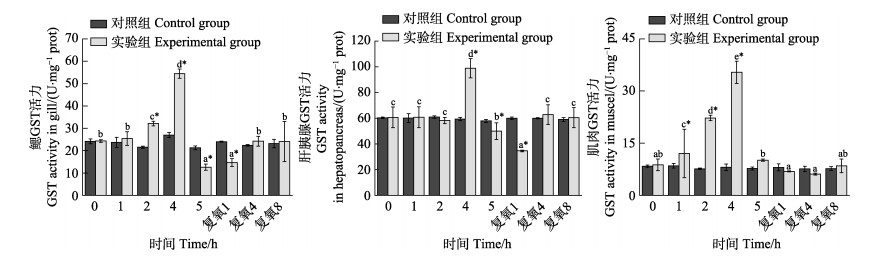
从图 11可以看出,随着静室呼吸耗氧时间的延长,实验组脊尾白虾鳃、肝胰腺和肌肉组织GST活力均呈先升高后降低的趋势,在呼吸耗氧4 h时达到最大值并显著高于各自的对照组(P < 0.05);呼吸耗氧5 h时,酶活力均显著降低,鳃和肝胰腺组织酶活力显著低于对照组(P < 0.05),但肌肉组织酶活力与对照组相比无显著差异(P > 0.05)。复氧后,肝胰腺和肌肉组织酶活力均呈先下降后升高的趋势,肝胰腺组织在复氧1 h时显著低于对照组(P < 0.05),肌肉组织酶活力在复氧期间与对照组相比无显著差异(P > 0.05);鳃组织酶活力逐渐升高,但复氧1 h时仍显著低于对照组(P < 0.05),继续复氧,GST活力升高至对照组水平。
|
图 11 脊尾白虾鳃、肝胰腺和肌肉GST活力的变化 Fig.11 Changes of GST activity in gill, hepatopancreas and muscle of E. carinicauda |
呼吸代谢常被用来评估十足目(Decapoda)甲壳动物在各种压力环境下的生理反应(Li et al, 2019)。在代谢过程中,特定的酶会加速代谢产物的转化,产生能量以满足机体的需要,呼吸代谢酶活性的变化是代谢能力变化的直接反映(Bao et al, 2018)。CCO是电子传递链末端的酶,负责将将电子从还原的细胞色素c转移到氢中,从而产生H2O,其活性是评价不同组织有氧呼吸产生能量的重要指标(Yau et al, 2018)。SDH是唯一同时参加三羧酸循环和电子传递链的酶复合物(Haroon, 2018),其活性在一定程度上可以反映有氧代谢水平;FRD在三羧酸循环中催化其可逆反应(Messeder et al, 2017)。LDH催化丙酮酸转变为乳酸及其可逆反应,是生物体内参加无氧代谢的关键酶(Sun et al, 2018)。此外,丁银娣等(2005)研究显示,SDH/FRD值可以作为判断动物代谢类型的依据。
本研究结果显示,随着静室呼吸耗氧时间的延长,脊尾白虾鳃、肝胰腺、肌肉组织CCO和SDH活力均逐渐降低,LDH和FRD酶活力逐渐升高,且SDH/FRD值呈逐渐降低的变化趋势。复氧后,酶活力均逐渐恢复到对照组水平,SDH/FRD值也逐渐升高。管越强等(2010)对日本沼虾(Macrobrachiumnip ponense)的研究显示,随着低氧[(2.0±0.2) mg/L, 8 h]暴露时间的延长,肝胰腺和肌肉组织细胞CCO和SDH活力显著下降,LDH和FRD活力显著上升;恢复常氧水平[(7±0.2) mg/L, 2.5 h]后,CCO、SDH和LDH、FRD活力逐渐恢复正常水平。Gutierrez等(2013)研究表明,在对凡纳滨对虾缺氧条件下,CCO活性降低,但随着缺氧时间的延长逐渐恢复。Bao等(2019)研究表明,在对中华小长臂虾(Palaemonetes sinensis)的研究中,随着环境缺氧时间的延长,SDH活力逐渐降低,LDH活力逐渐升高;复氧后,SDH和LDH活力均逐渐恢复到正常水平。另外,李泽健(2012)研究表明,在低氧条件下,对中华绒螯蟹(Eriocheir sinensis)呼吸代谢产生一定的影响,SDH/FRD值呈下降趋势,复氧阶段呈上升趋势。这些研究结果与本研究结果基本一致,说明在低氧条件下,脊尾白虾有氧代谢能力逐渐降低,无氧代谢能力逐渐升高。复氧后,这种代谢调控的转变又逐渐恢复,机体可以通过代谢水平调控来适应逐渐缺氧的水生环境。
3.2 低氧–复氧对脊尾白虾抗氧化酶活力的影响在正常细胞呼吸过程中, O2消耗量的0.1%~0.2%在逐步减少O2的过程中转化为活性氧(ROS),ROS是具有未配对电子的高活性氧,包括超氧自由基(O2–)、过氧化氢(H2O2)、羟基自由基(OH–)等,ROS会损害细胞大分子,如核酸、蛋白质和膜脂(Savín et al, 2006)。内源性抗氧化系统在抵消活性氧保护细胞免受氧化应激中发挥重要作用,这个系统主要由清除活性氧的酶组成,包括SOD、CAT、POD、GPX和GST(Li et al, 2016; 李根瑞等, 2016)。O2–是最先产生的氧活性前体,SOD将其催化为H2O2,尽管H2O2依然有害,但后续会被CAT、POD、GPX和GST催化转变为无害的H2O(Wang et al, 2012; Casey et al, 2014; Han et al, 2018)。
本研究结果显示,随着静室呼吸耗氧时间的延长,SOD、CAT、GPX和GST活力均呈先升高后降低的趋势,可能因为在实验前期的呼吸耗氧过程中,实验组水体DO含量还处于比较高的水平,虾体内摄氧量高,O2–产生多,因此,SOD活力升高,导致产生的H2O2水平上升,CAT、GPX和GST活力也随之升高;呼吸耗氧到实验后期时,水体DO含量降至极低水平,虾体内摄氧量下降,O2–的产生减少,SOD活力下降,导致产生的H2O2水平降低,CAT、GPX和GST活力也随之降低。在复氧后,SOD、CAT、GPX和GST活力均呈先升高后降低逐渐恢复至对照组水平,可能在复氧初期,突然O2含量增加,使脊尾白虾机体在短期内的摄氧量突然增加,导致O2–和H2O2产生增多,SOD、CAT、GPX和GST活力也随之升高,随着复氧时间的延长,机体逐渐适应并恢复,酶活力也逐渐恢复至对照组水平。李利(2010)研究表明,随着低氧暴露时间的延长,日本沼虾肝胰腺组织SOD活力逐渐下降,CAT、GST活力逐渐升高;在常氧恢复阶段,SOD、CAT、GST活力均恢复至对照组水平。杨明等(2019)在对日本沼虾的研究中发现,低氧胁迫期间,肌肉组织SOD、CAT和GPX活力呈先升高后下降的趋势。另外,Taylor等(2011)研究也表明,凡纳滨对虾在缺氧胁迫下,肝胰腺组织中SOD,CAT和GST活力均高于对照组;在复氧1 h时,SOD和GST活力又明显的下降。这些研究结果与本研究结果有所不同,可能是因为在实验低氧胁迫处理的方式存在差异。另外,在本研究中,鳃和肌肉POD活力在静室呼吸耗氧阶段呈波动性变化,肝胰腺POD活力逐渐降低;复氧处理后,POD活力在鳃、肝胰腺和肌肉3种组织均呈现先升高后降低的变化趋势。Li等(2006)在中国对虾(Fenneropenaeus chinensis)的研究中发现,随着养殖密度的增加,实验组水体DO含量逐渐降低,POD在低密度养殖中有较高的活力。而王春琳等(2008)在曼氏无针乌贼(Sepiella maindrona)的研究表明,随着水体DO含量的不断下降,POD活力呈先升高后降低的趋势。张晓梅等(2010)研究发现,随着水体中DO胁迫程度的增加,长蛸(Octopusvariabilis sasaki)体内的POD活力呈“降–升–降”的变化趋势。推测可能由于物种和实验处理方式的差异,POD在不同生物体所处地位存在差异。总之,脊尾白虾在低氧胁迫及低氧后的复氧期间,机体内抗氧化酶活力会发生显著变化,这可能在脊尾白虾适应低氧及复氧环境处理机体产生的氧化损伤中发挥重要作用。
4 小结本研究结果显示,渐变式低氧–复氧对脊尾白虾呼吸代谢和抗氧化能力存在影响,处于水体DO逐渐降低的环境中时,脊尾白虾体有氧代谢水平下降,无氧代谢水平升高,同时,在DO低至一定程度时会激活机体的抗氧化酶系统;复氧后,有氧代谢能力逐渐恢复;此外,从低氧环境骤然复氧到对照组水平也会使抗氧化功能再次被激活,但经过一段时间的适应,虾体会逐渐恢复。目前,在我国虾类水产养殖业中,随着养殖规模的扩大,高密度养殖已成为池塘养殖的主要模式,这也加剧了缺氧发生的可能性,必然会导致缺氧胁迫。因此,有必要进一步深入探究低氧下脊尾白虾适应及调控的分子机制,为今后耐低氧品系的育种工作做准备。
BAO J, LI X D, YU H, et al. Respiratory metabolism responses of Chinese mitten crab, Eriocheir sinensis and Chinese grass shrimp, Palaemonetes sinensis, subjected to environmental hypoxia stress. Frontiers in Physiology, 2018(9): 1559 |
CASEY D K, LOUIS E B, KAREN G B. Recovery from hypoxia and hypercapnic hypoxia: Impacts on the transcription of key antioxidants in the shrimp Litopenaeus vannamei. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2014, 170(1): 43-49 |
CHU C, YU J L, WANG H, et al. Experiment on freshwater domestication aquaculture of Exopalaemon carinicauda. Shandong Journal of Animal Science and Veterinary Medicine, 2017, 38(12): 76-77 [褚春, 于杰伦, 王慧, 等. 脊尾白虾淡水驯化养殖试验. 山东畜牧兽医, 2017, 38(12): 76-77 DOI:10.3969/j.issn.1007-1733.2017.12.050] |
DING Y D, WANG Q, LI K, et al. Biochemical composition and sperm metabolism in male reproductive system of crayfish, Cherax quadricarinatus. Journal of Fishery Sciences of China, 2005, 22(5): 562-568 [丁银娣, 王群, 李恺, 等. 红螯螯虾雄性生殖系统的生化组成及精子代谢. 中国水产科学, 2005, 22(5): 562-568 DOI:10.3321/j.issn:1005-8737.2005.05.006] |
DOU Q W, LI J T, LIU P, et al. cDNA cloning and immunological properties of two variants of hemocyanin subunit with higher molecular weight in Exopalaemon carinicauda. Acta Hydrobiologica Sinica, 2019, 43(1): 37-44 [窦全伟, 李吉涛, 刘萍, 等. 脊尾白虾2种血蓝蛋白大亚基变体的克隆及功能分析. 水生生物学报, 2019, 43(1): 37-44] |
GUAN Y Q, LI L, WANG H C, et al. Effects of hypoxia on respiratory metabolism and antioxidant capability of Macrobrachium nipponense. Journal of Hebei University (Natural Science), 2010, 30(3): 301-306 [管越强, 李利, 王慧春, 等. 低氧胁迫对日本沼虾呼吸代谢和抗氧化能力的影响. 河北大学学报(自然科学版), 2010, 30(3): 301-306 DOI:10.3969/j.issn.1000-1565.2010.03.017] |
GUTIERREZ L R J, LOPEZ J H, OSUNA M A I, et al. Three nucleus-encoded subunits of mitochondrial cytochrome c oxidase of the whiteleg shrimp Litopenaeus vannamei: cDNA characterization, phylogeny and mRNA expression during hypoxia and reoxygenation. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2013, 166(1): 30-39 DOI:10.1016/j.cbpb.2013.06.008 |
HAROON A R M. Succinate dehydrogenase complex: An updated review. Archives of Pathology and Laboratory Medicine, 2018, 142(12): 1564-1570 DOI:10.5858/arpa.2017-0285-RS |
HAN S Y, WANG M Q, LIU M, et al. Comparative sensitivity of the hepatopancreas and midgut in the white shrimp Litopenaeus vannamei to oxidative stress under cyclic serious/medium hypoxia. Aquaculture, 2018, 490: 44-52 DOI:10.1016/j.aquaculture.2018.02.021 |
LI G R, REN L H, SUN G H, et al. Effects of hypoxic stress on oxidative stress indices in Apostichopus japonicus. Progress in Fishery Sciences, 2016, 37(5): 133-139 [李根瑞, 任利华, 孙国华, 等. 低溶氧胁迫对刺参(Apostichopus japonicus)氧化应激指标的影响. 渔业科学进展, 2016, 37(5): 133-139] |
LI J T, XU X W, LI W T, et al. Linking energy metabolism and locomotor variation to osmoregulation in Chinese shrimp Fenneropenaeus chinensis. Comparative Biochemistry and Physiology, Part B: Biochemistry and Molecular Biology, 2019, 234: 58-67 DOI:10.1016/j.cbpb.2019.05.006 |
LI L.. Effects of hypoxia on respiratory metabolism, energy metabolism and antioxidant capability of Macrobrachium nipponense. Master′s Thesis of Hebei University, 2010 [李利. 低氧胁迫对日本沼虾呼吸代谢、能量代谢和抗氧化能力的影响. 河北大学硕士研究生学位论文, 2010] |
LI M Y, BAO J M, WU C E. Experiment on the oxygen consumption rate and the asphyxiant point of Exopalaemon carinicauda. Marine Fisheries, 1992(6): 251-253 [李明云, 包坚敏, 吴春娥. 脊尾白虾窒息点与耗氧率的试验观察. 海洋渔业, 1992(6): 251-253] |
LI Y H, WEI L, CAO J R, et al. Oxidativestress, DNA damage andantioxidant enzyme activities in the pacific white shrimp (Litopenaeus vannamei) when exposed to hypoxia and reoxygenation. Chemosphere, 2016, 144: 234-240 DOI:10.1016/j.chemosphere.2015.08.051 |
LI Y Q, LI J, WANG Q Y. The effects of dissolved oxygen concentration and stocking density on growth and non-specific immunity factors in Chinese shrimp, Fenneropenaeus chinensis. Aquaculture, 2006, 256(1/2/3/4): 608-616 |
LI Z H, WANG J H, XIE S. Analysis of the role of environmental factors in shrimp farming. Reservoir Fisheries, 2004(5): 1-4 [李志华, 王军霞, 谢松. 环境因子在虾类养殖中的作用分析. 水利渔业, 2004(5): 1-4 DOI:10.3969/j.issn.1003-1278.2004.05.001] |
LI Z J. Effects of hypoxia Stress on energy metabolism, respiratory metabolism and antioxidant metabolism of Eriocheir sinensis. Master′s Thesis of Hebei University, 2012 [李泽健. 低氧胁迫对中华绒螯蟹能量代谢、呼吸代谢及抗氧化代谢的影响. 河北大学硕士研究生学位论文, 2012] |
LIAN C A, LI J, LI J T, et al. Effects of dry exposure on the respiratory metabolism-related enzymes of Exopalaemon carinicauda. Progress in Fishery Sciences, 2017, 38(4): 53-60 [连春盎, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾(Exopalaemon carinicauda)呼吸代谢相关酶的影响. 渔业科学进展, 2017, 38(4): 53-60] |
LIAN C A. Effect of dry exposure on the respiratory metabolism- related enzymes and HIF-1 of Exopalaemon carinicauda. Master′s Thesis of Shanghai Ocean University, 2016 [连春盎. 干露胁迫对脊尾白虾呼吸代谢相关酶和低氧诱导因子的影响. 上海海洋大学硕士研究生学位论文, 2016] |
MARION P, AURELIE D P, DENIS C, et al. Effects of exposure to hypoxia onmetabolic pathways in northern shrimp (Pandalus borealis) and Greenland halibut (Reinhardtius hippoglossoides). Journal of Experimental Marine Biology and Ecology, 2016, 483: 88-96 DOI:10.1016/j.jembe.2016.07.002 |
MESSEDER D J, CAGLIAN C C, RAUBER R, et al. Fumarate reductase superfamily: A diverse group of enzymes whose evolution is correlated to the establishment of different metabolic pathways. Mitochondrion, 2017, 34: 56-66 DOI:10.1016/j.mito.2017.01.002 |
RICHARD E C, LOUIS E B. Respiratory responses of the salt marsh animals, Fundulus heteroclitus, Leiostomus xanthurus, and Palaemonetes pugio to environmental hypoxia and hypercapnia and to the organophosphate pesticide, azinphosmethyl. Journal of Experimental Marine Biology and Ecology, 1996, 195(1): 125-144 DOI:10.1016/0022-0981(95)00102-6 |
SAVIN T Z, SALDIEMA R, SANDOVAL M A. Superoxide radical production in response to environmental hypoxia in cultured shrimp. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 2006, 142(3-4): 301-308 DOI:10.1016/j.cbpc.2005.11.001 |
SUN S M, FU H T, ZHU J, et al. Molecular cloning and expression analysis of lactate dehydrogenase from the oriental river prawn Macrobrachium nipponense in response to hypoxia. International Journal of Molecular Sciences, 2018, 19(7): 1990 DOI:10.3390/ijms19071990 |
TAYLOW D P P, SAVIN T Z. Antioxidant enzyme activities in Pacific white shrimp (Litopenaeus vannamei) in response to environmental hypoxia and reoxygenation. Aquaculture, 2011, 318(3/4): 379-383 |
WANG C L, WU D H, DONG T Y, et al. Oxygen consumption rate and effects of hypoxia stress on enzyme activities of Sepiella maindron. Chinese Journal of Applied Ecology, 2008, 19(11): 2420-2427 [王春琳, 吴丹华, 董天野, 等. 曼氏无针乌贼耗氧率及溶氧胁迫对其体内酶活力的影响. 应用生态学报, 2008, 19(11): 2420-2427] |
WANG D D, LI F H, CHI Y H. Potential relationship among three antioxidant enzymes in eliminating hydrogen peroxide in penaeid shrimp. Cell Stress and Chaperones, 2012, 17: 423-433 DOI:10.1007/s12192-011-0317-z |
WANG Q, LI J, LI J T, et al. The effect of dry exposure on HSP70 and ferritin gene expression level in Exopalaemon carinicauda. Oceanologia et Limnologia Sinica, 2013, 44(2): 409-414 [王琦, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾(Exopalaemon carinicauda) HSP70和ferritin基因表达的影响. 海洋与湖沼, 2013, 44(2): 409-414] |
XIAO S H, FENG J J, GUO H F, et al. Efects of mebendazole, albendazole, and praziquantel on succinate dehydrogenase, fumarate reductase, and malate dehydrogenase in Echinococcus granulosus cysts harbored in mice. Acta Pharmacologica Sinic, 1993, 14(2): 151-154 |
YAU C H, MENG H C, TSUNG H L. An assay of optimal cytochrome c oxidase activity in fish gills. Analytical Biochemistry, 2018, 553: 38-45 DOI:10.1016/j.ab.2018.05.017 |
YANG M, SUN S M, FU H T, et al. Hypoxia and reoxygenation on antioxidant enzyme activities and histological structure of Macrobrachium nipponense. Journal of Fishery Sciences of China, 2019, 26(3): 493-503 [杨明, 孙盛明, 傅洪拓, 等. 低氧和复氧对日本沼虾抗氧化酶活力及组织结构的影响. 中国水产科学, 2019, 26(3): 493-503] |
ZHANG X M, WANG C L, LI L G, et al. Oxygen consumption rateand effect of hypoxia stresson enzyme activity of Octopus variabili. Journal of Hydroecology, 2010, 3(2): 72-79 [张晓梅, 王春琳, 李来国, 等. 耗氧率及溶氧胁迫对长蛸体内酶活力的影响. 水生态学杂志, 2010, 3(2): 72-79] |




