温度、溶解氧、光照强度等环境因子对鱼类存活、生长、生理代谢等有重大影响(徐革锋等, 2014; Tsuji et al, 2014),而鱼类早期生活史与温度有密切的联系(Yasuhisa et al, 1993; Mihelakakis et al, 1994; Fielder et al, 2005; Suresh et al, 2012)。温度的变化将直接影响鱼类仔、稚鱼的形态发育和生长,甚至影响其存活率。因此,在实际的育苗中,根据不同的发育阶段来确定其适宜的温度有利于缩短生长发育时间,促进鱼苗的加速生长,提高存活率,从而为养殖户带来较高的收益(张淞琳, 2012)。近几年来,关于温度对仔、稚鱼生长发育的研究主要集中在冷水性鱼类上,如尖裸鲤(Oxygymnocypris stewartii)(刘艳超等, 2018)、哲罗鲑(Hucho taimen)(王金燕, 2011)、细鳞鲑(Brachymystax lenok)(常杰等, 2016)等。
四川华鳊(Sinibrama taeniatus),隶属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲌亚科(Cultrinae)、华鳊属(Sinibrama),为长江上游特有的小型经济鱼类。近年来,四川华鳊资源量不断下降(李斌等, 2015; 解崇友等, 2016)。目前,四川华鳊的人工繁殖技术已突破(李青芝等, 2019)。鱼类早期生活史是其整个生活史中的重要环节,也是死亡高发时期,该阶段的存活率直接影响其种群数量和年龄结构(肖真明等, 2008)。有关四川华鳊的研究甚少,仅有关于四川华鳊繁殖生物学(李斌等, 2015; 李青芝等, 2019; 尹敏等, 2019a、2019b)、年龄与生长(解崇友等, 2016)、形态发育(王亚利等, 2020)及线粒体基因(Li et al, 2016)等少量报道。本研究设计了不同温度条件下四川华鳊仔、稚鱼发育的影响实验,探究四川华鳊早期生活史的最适温度条件,为后续的人工规模化苗种培育提供参考资料。
1 材料与方法 1.1 材料实验选取刚出膜且发育正常的四川华鳊720尾,平均全长为(4.54±0.04) mm。整个孵化过程在自制绢网孵化框(长×宽×高为640 mm×360 mm×60 mm)中进行,温度用恒温加热棒控制在(25.0±0.5)℃。
1.2 温度设置设置6个温度梯度(16℃、19℃、22℃、25℃、28℃和31℃),每个梯度4个重复,每个重复30尾初孵仔鱼,饲养于1 L的大烧杯中,4个烧杯放入一个作为恒温水浴的玻璃缸中(450 mm×250 mm×250 mm),其中,每个温度组的1个重复为备用,用于补充死亡后的空缺,以确保实验烧杯内的养殖密度相等。从仔鱼出膜水温(25.0±0.5)℃开始,以每8 h升温或降温1℃的速率调整至实验温度,水温变化均控制在±0.5℃内。
1.3 实验方法仔鱼出膜初期每天观察记录各温度组四川华鳊生长发育情况,之后,根据发育情况逐步延长取样观察间隔。每次观察时,取重复组(除备用组)各3尾,在体视显微镜(Nikon SMZ25, 日本)下活体观察,并拍照记录仔、稚鱼形态特征,统计各温度条件下开始摄食、卵黄囊消失、鳞片开始出现和鳞片完整4个早期发育的重要节点的时间,发育时间以50%以上个体到达该期的时间为准,并以最先达到鳞片出现和鳞被完整发育节点的温度组与其他温度组进行四川华鳊形态及生长指标的比较。不同温度条件下,4个节点的仔、稚鱼用Bouin氏液和中性甲醛固定溶液各固定4尾标本以备复查。整个养殖密度随着仔、稚鱼的生长及取材的消耗而改变,因死亡和取材造成的密度不同则用备用组的仔、稚鱼进行补充,以保证各个温度组的密度一致。养殖用水均为曝气的自来水,pH值为7.6±0.5,溶解氧 > 7 mg/L,光照周期为14 L:10 D。仔鱼开口后,每天09:00和18:00各投喂1次丰年虫(Artemia sp.),之后根据口裂大小逐渐使用升索鱼苗专用微粒子配合饲料代替,投喂30 min后,吸去粪便和残饵,并换水1/3。记录各个温度组的死亡数量,实验结束后,计算其死亡率。
1.4 数据处理使用Image J图像分析软件测量相关数据,运用Excel 2010、SPSS 22.0软件对数据进行统计分析。采用单因素方差分析(one-way ANOVA)检验温度对四川华鳊仔、稚鱼全长、体重和存活率的影响,t检验分析不同温度条件下四川华鳊生长指标的差异;多项式回归分析得出全长和体重的曲线拟合方程。所有统计值均以平均值±标准差(Mean±SD)表示。参数计算公式:
存活率(survival rate, SR, %)=(1-Nt/N0)×100%
全长特定生长率(specific growth rate of total length, SGRL, %/d)(ln LT2-ln LT1)/(t2-t1)×100%
体重特定生长率(specific growth rate of weight, SGRw, %/d)=(ln LW2-ln LW1)/(t2-t1)×100%
式中,Nt为死亡尾数(不计观察和采样造成的死亡数),N0为起始尾数;t1、t2为日龄;LT1、LT2分别为t1、t2时的全长;LW1、LW2分别为t1、t2时的体重。
2 结果 2.1 温度对四川华鳊仔、稚鱼生长发育的影响从图 1可以看出,温度对四川华鳊仔、稚鱼的生长发育有明显的影响。各温度条件下,四川华鳊仔、稚鱼的鳍、鳔以及肠道的发育情况见表 1。
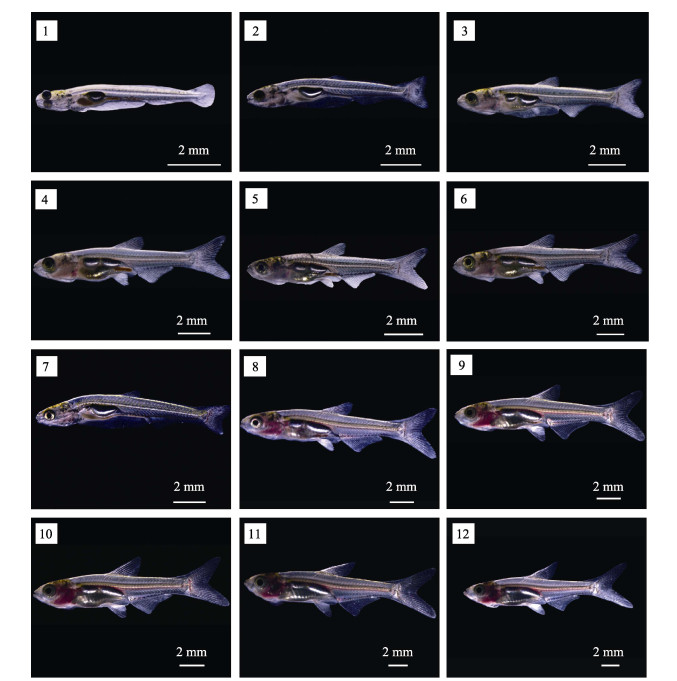
|
图 1 不同温度条件下,四川华鳊仔、稚鱼的形态发育 Fig.1 The development of S. taeniatus larvae and juveniles at different temperatures 1:16℃ 30日龄仔鱼;2:19℃ 30日龄仔鱼;3:22℃ 30日龄仔鱼;4:25℃ 30日龄仔鱼;5:28℃ 30日龄仔鱼;6:31℃ 30日龄仔鱼;7:16℃ 80日龄仔鱼;8:19℃ 80日龄稚鱼;9:22℃ 80日龄稚鱼;10:25℃ 80日龄稚鱼;11:28℃ 80日龄稚鱼;12:31℃ 80日龄稚鱼 1: 30th day post hatching(dph) (16℃); 2: 30th dph (19℃); 3: 30th dph (22℃); 4: 30th dph (25℃); 5: 30th dph (28℃); 6: 30th dph (31℃); 7: 80th dph (16℃); 8: 80th dph (19℃); 9: 80th dph (22℃); 10: 80th dph (25℃); 11: 80th dph (28℃); 12: 80th dph (31℃) |
|
|
表 1 温度对四川华鳊仔、稚鱼发育的影响 Tab.1 The effects of temperature on the development of S. taeniatus larvae and juveniles |
不同温度条件下,四川华鳊仔、稚鱼生长性能见表 2。30 d时,在全长方面,28℃组仔鱼生长最快,全长最大,约为12.90 mm,其中,16℃、19℃、22℃组与25℃、28℃、31℃组全长存在显著差异(P < 0.05),而25℃、28℃、31℃组之间无显著差异(P > 0.05);在不同温度条件下,30 d内仔、稚鱼的SGRL从大到小依次为28℃ > 31℃ > 25℃ > 22℃ > 19℃ > 16℃。在体重方面,28℃组仔鱼体重最大,约为0.062 4 g/尾,与其余各组相比具有显著差异(P < 0.05),而19℃与22℃之间无显著差异(P > 0.05),25℃与31℃之间也无显著差异(P > 0.05),低温(16℃)组仔鱼的体重几乎未增长。
|
|
表 2 温度对四川华鳊仔、稚鱼生长的影响(平均值±标准差) Tab.2 Effects of temperature on the growth of S. taeniatus larvae and juveniles (Mean±SD) |
80 d时,在全长方面,28℃组稚鱼生长最快,全长和体重均最大,分别约为20.473 3 mm和0.116 6 g/尾。仔、稚鱼的SGRL从大到小依次为28℃ > 25℃ > 31℃ > 22℃ > 19℃ > 16℃,可以看出,25℃的稚鱼期生长快于31℃,说明温度过高或过低,对仔鱼生长都有一定的限制作用。30~80 d内的SGRw从大到小依次为22℃ > 16℃ > 31℃ > 25℃ > 19℃ > 28℃,由此可知,16℃组仔鱼适应低温条件后,SGRw加快,但体重仍显著低于其余各温度组(P < 0.05);28℃组稚鱼体重虽最高,但是SGRw明显减慢,显著低于其余各温度组(P < 0.05)。
2.2 温度对四川华鳊仔、稚鱼发育进程的影响不同温度条件下,四川华鳊仔、稚鱼的4个发育进程历时,即初孵仔鱼—开口摄食、开口摄食—卵黄囊消失、卵黄囊消失—鳞片开始出现、鳞片开始出现—鳞被完整(表 3)。从表 3可以看出,水温为16℃~28℃时,随着温度的升高,四川华鳊仔、稚鱼的发育进程加快,而当温度升至31℃,实验鱼鳞被完整总历时与28℃相等。在仔鱼期阶段(鳞片出现之前),温度对初孵仔鱼到开口摄食的发育进程影响较小;而从开口摄食到卵黄囊消失,随着温度的升高,卵黄囊的消耗速率加快,16℃组,从初孵到卵黄囊消失历时是28℃和31℃的3倍。卵黄囊消失到鳞片出现的阶段,温度较低组16℃和19℃的历时远远长于22℃、25℃、28℃、31℃组,19℃的发育历时是22℃组的2倍,说明温度对此发育阶段影响较大。鳞片开始出现到鳞被完整的阶段,各温度组的发育历时差距小于卵黄囊消失到鳞片开始出现阶段的发育历时,说明温度对鳞片逐步完整的影响较小。整体来看,28℃、31℃组鳞被完整的总历时均早于其他温度组,但与25℃组的历时差距不大。
|
|
表 3 温度对四川华鳊仔、稚鱼发育进程的影响 Tab.3 The effects of temperature on the development of S. taeniatus larvae and juveniles |
统计各温度组四川华鳊仔、稚鱼发育至80日龄的全长数值,全长(L)与日龄(D)的关系拟合成3次多项式函数(表 4),四川华鳊仔、稚鱼全长观测值与拟合模型相关系数值均达到0.99以上,表明Cubic生长模型能很好地估计四川华鳊仔、稚鱼全长在不同温度条件下随日龄的生长情况。从表 4可以看出,25℃、28℃和31℃组的仔、稚鱼生长速度明显快于其他3个温度组,同时,生长曲线较好地反映了在一定的温度范围内,仔、稚鱼的全长随温度的升高而增长。
|
|
表 4 四川华鳊全长(L)与日龄(D)的回归方程 Tab.4 Regression equations of total length (L) and days (D) post hatching of S. taeniatus |
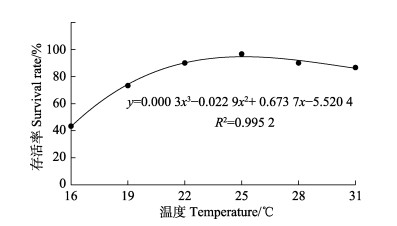
本研究从四川华鳊仔鱼出膜开始,统计至25℃组鳞片完备期间各温度组仔、稚鱼的存活率,并拟合3次曲线方程为y=0.000 3x3-0.022 9x2+0.673 7x- 5.520 4 (R2=0.995 2)(图 2)。此期间,16℃组存活率最低,仅为43%,其次是19℃组,存活率为73%,22℃~28℃组的存活率均达90%,其中,25℃组存活率最高,达97%;而31℃组的存活率为87%。从图 2可以看出,温度对四川华鳊仔、稚鱼的存活率影响较大,在一定温度范围内,存活率随温度的升高而升高;温度过低或过高,都不利于仔、稚鱼的存活。
|
图 2 不同温度组四川华鳊仔、稚鱼存活率 Fig.2 Survival rate of S. taeniatus larvae and juveniles at different temperatures |
在鱼类早期生活史阶段,仔鱼期和稚鱼期是胚后发育的2个主要时期。处于早期发育阶段的仔鱼,其形态、消化器官等均处于快速生长期,这些器官的发生、发育速度与其存活、生长及摄食行为习性的变化等密切相关(王林龙等, 2018)。本研究观察不同温度条件下,四川华鳊仔、稚鱼的生长发育情况发现,温度对四川华鳊仔、稚鱼的发育速度有明显的影响,各温度组的形态及器官发育进度不同,同时,在体重、全长等方面也有明显的不同。
温度对四川华鳊仔、稚鱼的发育影响显著。仔鱼期,四川华鳊由内源性营养转向外源性营养,同时,较高温度组(25℃、28℃和31℃)中卵黄囊的消耗速率快,开口摄食时间早,说明开口摄食的时间会随着温度升高而提前,与南方鲶(Silurus meridionalis Chen)的研究结果一致(邓思平等, 2000)。25℃、28℃和31℃条件下的仔鱼,在6~8 d时,卵黄囊已消失,促使较高温度组与摄食相关的器官发育快于低温组。例如,较高温度组为寻求食物,各鳍褶退化更快,并出现鳍条,运动能力明显更强,鳔由一室向两室转变,从而辅助鱼体快速摄食;同时,胃部膨大,肠道开始弯曲盘回,从而加速食物的消化。稚鱼期,28℃和31℃组的鳞片完整时间快于其他温度组。由此可见,温度不同,各器官完善的历程也不一致,在28℃和31℃条件下,器官分化亦提早完成。
在适温范围内,鱼类的代谢强度一般与温度呈正相关,而鱼类的生长与机体的新陈代谢密切联系(Nurdiani et al, 2007)。本研究表明,80 d时,28℃条件下,稚鱼的全长和体重均最大,其次是25℃,说明在一定范围内,随着温度的升高,四川华鳊的生长加快,但温度过高,反而会抑制生长。因此,四川华鳊仔、稚鱼培育阶段的水温为25℃~28℃时,其生长速度相对较快。徐革锋等(2014)研究表明,适宜的温度会引起鱼类摄食节律变化,达到较好的生长效果,从而缩短仔、稚鱼培育周期。
3.2 温度与仔、稚鱼存活率李斌等(2015)研究表明,分布在长江上游岷江眉山段的四川华鳊种群已经出现了小型化趋势,而繁殖后代仔鱼的存活率将直接影响该物种的种群数量。温度是影响鱼类生存的重要的环境因子之一,对鱼类代谢反应起控制作用,从而能够影响鱼类的存活率(Lushchak et al, 2006)。本研究与张廷廷等(2016)和蔡瑞钰等(2018)的研究结果一致,发现温度过高或过低都有可能导致仔、稚鱼大量死亡。仔、稚鱼种类与温度有极显著的相关性(王九江等, 2019),不同种类的鱼具有不同的适温范围,这与其自身遗传特性以及对生活环境的长期适应有关(谢忠明, 1993)。在室内养殖发现,四川华鳊仔鱼在出膜1周左右存在死亡高峰期。因此,在人工养殖过程中,探究适宜的温度,可降低四川华鳊仔、稚鱼的死亡率。
本研究发现,整个实验的养殖过程,四川华鳊的死亡集中在仔鱼期,而在稚鱼期的死亡数量相对较少,表明,仔鱼期对温度更为敏感,稚鱼期对温度已逐步适应,此现象与云南盘
在生产上追求的是较高的存活率和较快的生长速度。因此,可将25℃~28℃作为人工养殖四川华鳊仔、稚鱼生长的最适温度,并在仔鱼出膜后3 d可投喂饵料。
CAI R Y, ZHAO J R, HUANG J, et al. The effects of different temperature on the growth and survival rate of Discogobio yunnanensis larvae and juveniles. Freshwater Fisheries, 2018, 48(3): 96-100 [蔡瑞钰, 赵健蓉, 黄静, 等. 温度对云南盘  仔稚鱼生长及存活率的影响. 淡水渔业, 2018, 48(3): 96-100 DOI:10.3969/j.issn.1000-6907.2018.03.016] 仔稚鱼生长及存活率的影响. 淡水渔业, 2018, 48(3): 96-100 DOI:10.3969/j.issn.1000-6907.2018.03.016] |
CHANG J, XU G F, LI S G, et al. Effect of temperature and salinity on the survival and growth of larval and juvenile stage Manchurian trout (Brachymystax lenok Pallas). Journal of Hydroecology, 2016, 37(5): 87-91 [常杰, 徐革锋, 李树国, 等. 温度与盐度对细鳞鲑仔、稚鱼存活和生长的影响. 水生态学杂志, 2016, 37(5): 87-91] |
DENG S P, WU T L, WANG D S, et al. Effect of temperature on the growth and development of larva southern catfish (Silurus meridionalis Chen). Journal of Southwest China Normal University (Natural Science), 2000, 25(6): 674-679 [邓思平, 吴天利, 王德寿, 等. 温度对南方鲶幼鱼生长与发育的影响. 西南师范大学学报(自然科学版), 2000, 25(6): 674-679 DOI:10.3969/j.issn.1000-5471.2000.06.012] |
FIELDER D S, BARDSLEY W J, ALLAN G L, et al. The effects of salinity and temperature on growth and survival of Australian snapper Pagrus auratus larvae. Aquaculture, 2005, 250(1/2): 201-214 |
LI B, XIE C Y, ZHANG T, et al. The reproductive biology of Sinibrama taeniatus from the Minjiang River (in Meishan City). Chinese Journal of Zoology, 2015, 50(4): 563-570 [李斌, 解崇友, 张婷, 等. 岷江眉山段四川华鳊的繁殖生物学资料. 动物学杂志, 2015, 50(4): 563-570] |
LI Q Z, LI H, CHEN Y L, et al. Embryonic development of Sinibrama taeniatus. Journal of Hydroecology, 2019, 40(6): 106-110 [李青芝, 李华, 陈彦伶, 等. 四川华鳊胚胎发育观察. 水生态学杂志, 2019, 40(6): 106-110] |
LI W T, SHAO K, XIONG M H, et al. The complete mitochondrial genome of Sinibrama taeniatus (Cyprinidae: Cultrinae). Mitochondrial DNA, 2016, 27(3): 1597-1598 |
LIU Y C, LIU H P, LIU S Y, et al. Effect of temperature on embryonic development and growth traits of Oxygymnocypris stewartii larvae and juvenile. Chinese Journal of Zoology, 2018, 53(6): 910-923 [刘艳超, 刘海平, 刘书蕴, 等. 温度对尖裸鲤胚胎发育及其仔稚鱼生长性状的影响. 动物学杂志, 2018, 53(6): 910-923] |
LUSHCHAK V I, BAGNYUKOVA T V. Temperature increase results in oxidative stress in goldfish tissues. 1. Indices of oxidative stress. Comparative Biochemistry and Physiology C: Toxicology and Pharmacology, 2006, 143(1): 30-35 DOI:10.1016/j.cbpc.2005.11.017 |
MIHELAKAKIS A, KITAJIMA C. Effects of salinity and temperature on incubation period, hatching rate and morphogenesis of the silver sea bream, Sparus sarba. Aquaculture, 1994, 126(3/4): 361-371 |
NURDIANI R, ZENG C S. Effects of temperature and salinity on the survival and development of mud crab, Scylla serrata (Forsskål), larvae. Aquaculture Research, 2007, 38(14): 1529-1538 DOI:10.1111/j.1365-2109.2007.01810.x |
SURESH B C, SHAILENDER M, SARMAL K P, et al. Effects of temperature and salinity on growth, hatching rate and survival of the giant freshwater prawn, Macrobrachium rosenbergii under captive conditions. International Journal of Bioassays, 2012, 1(15): 150-155 |
TSUJI M, ABE H, HANYUU K, et al. Effect of temperature on survival, growth and malformation of cultured larvae and juveniles of the seven-band grouper Epinephelus septemfasciatus. Fisheries Science, 2014, 80(1): 69-81 DOI:10.1007/s12562-013-0680-z |
WANG J J, LIU Y, XIAO Y Y, et al. Population characteristics of fish eggs and larvae and their relationship with environmental factors in Daya Bay. Journal of Fishery Sciences of China, 2019, 26(1): 14-25 [王九江, 刘永, 肖雅元, 等. 大亚湾鱼卵、仔稚鱼种群特征与环境因子的相关关系. 中国水产科学, 2019, 26(1): 14-25] |
WANG J Y. The study of biochemical composition changes in embryonic and larval development and temperature on the larvae growth of Hucho taimen. Masterxs Thesis of Shanghai Ocean University, 2011 [王金燕. 哲罗鲑胚胎和仔鱼发育期的生化组成变化及温度对仔稚鱼生长的影响研究. 上海海洋大学硕士研究生学位论文, 2011]
|
WANG L L, WANG Z, ZHANG X M, et al. Effects of different substrate and temperature on hunger tolerance in Sepia esculenta juveniles. Journal of Fishery Sciences of China, 2018, 25(5): 1071-1081 [王林龙, 王展, 张雪梅, 等. 不同底质和温度对金乌贼仔乌饥饿耐受能力的影响. 中国水产科学, 2018, 25(5): 1071-1081] |
WANG Y L, LIU Y, TIAN J J, et al. Growth and morphological development of larva and juvenile Sinibrama taeniatus. Progress in Fishery Sciences, 2020, 41(4): 58-67 [王亚利, 刘玥, 田佳佳, 等. 四川华鳊仔稚鱼生长与形态发育研究. 渔业科学进展, 2020, 41(4): 58-67] |
XIAO Z M, GUO X Z. Advances and studies on early life history stages of fish. Journal of Beijing Fisheries, 2008(1): 43-45 [肖真明, 郭小泽. 鱼类早期生活史分期研究进展. 北京水产, 2008(1): 43-45] |
XIE C Y, NI L Y, WU D, et al. Age and growth of Sinibrama taeniatus in Meishan Section of Minjiang River. Sichuan Journal of Zoology, 2016, 35(1): 78-83 [解崇友, 倪露芸, 吴迪, 等. 岷江眉山段四川华鳊年龄与生长. 四川动物, 2016, 35(1): 78-83] |
XIE Z M. Freshwater breeding fish breeding technology. Beijing: China Agricultural Press, 1993: 445 [谢忠明. 淡水良种鱼类增养殖技术. 北京: 中国农业出版社, 1993: 445]
|
XU G F, WANG Y Y, HAN Y, et al. Effect of locomotion and feeding on metabolic mode of juvenile lenok, Brachymystax lenok (Pallas) under different water temperatures. Chinese Journal of Applied Ecology, 2014, 25(4): 1156-1162 [徐革锋, 王裕玉, 韩英, 等. 不同温度条件下运动和摄食对细鳞鲑幼鱼代谢模式的影响. 应用生态学报, 2014, 25(4): 1156-1162] |
YASUHISA K, TSUZUMI M. Effects of salinity on the embryonic development and larval survival activity index of red spotted grouper Epinephelus akaara. Saibai Giken, 1993, 22(1): 35-38 |
YIN M, XIE C Y, JIN L, et al. Microstructure and ultrastructure observation of spermatogenesis in Sinibrama taeniatus. Freshwater Fisheries, 2019a, 49(2): 32-37 [尹敏, 解崇友, 金丽, 等. 四川华鳊精子发生显微及超微结构观察. 淡水渔业, 2019a, 49(2): 32-37] |
YIN M, XIE C Y, PU D Y, et al. Microstructure of oogenesis in Sinibrama taeniatus. South China Fisheries Science, 2019b, 15(2): 127-132 [尹敏, 解崇友, 蒲德永, 等. 四川华鳊卵子发生的显微结构观察. 南方水产科学, 2019b, 15(2): 127-132] |
ZHANG C G, ZHAO Y H. Early development of Chinese sucker (Myocyprinus asiaticus). Acta Zoologica Sinica, 2000, 46(4): 438-447 [张春光, 赵亚辉. 胭脂鱼的早期发育. 动物学报, 2000, 46(4): 438-447] |
ZHANG S L. Breeding biology and artificial breeding cultivate technology research of Epinephelus coioides. Masterxs Thesis of Jimei University, 2012 [张淞琳. 斜带石斑鱼养殖生物学及人工苗种培育技术研究. 集美大学硕士研究生学位论文, 2012]
|
ZHANG T T, CHEN C, SHI Z H, et al. Effects of temperature on the embryonic development and larval activity of Epinephelus moara. Progress in Fishery Sciences, 2016, 37(3): 28-33 [张廷廷, 陈超, 施兆鸿, 等. 温度对云纹石斑鱼(Epinephelus moara)胚胎发育和仔鱼活力的影响. 渔业科学进展, 2016, 37(3): 28-33] |
ZHOU Q, WANG Y C, SU J X. Effects of water temperature on the growth, development, feeding PNR of larval Marbled (Limanda yokohamae). Journal of Fishery Sciences of China, 1998, 5(1): 31-38 [周勤, 王迎春, 苏锦祥. 温度对黄盖鲽仔鱼生长、发育、摄食及PNR的影响. 中国水产科学, 1998, 5(1): 31-38] |



