2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 水产科学国家级实验教学示范中心(上海海洋大学) 上海 201306;
4. 河北省水产良种与渔业环境监测保护总站 河北 石家庄 050001
2. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University), Shanghai 201306, China;
4. Hebei Aquatic Breeds and Fisheries Environmental Monitoring and Protection General Station, Shijiazhuang, Hebei 050001, China
中国明对虾(Fenneropenaeus chinensis)为我国近海特有的品种,主要分布在黄海、渤海和朝鲜西部沿海,是我国海水养殖的重要种类。为了满足人们的需求,水产养殖的不断扩大和过度集约化,高密度养殖已成为提高养殖产量、降低养殖成本的重要途径。然而,高密度养殖增加了个体之间对资源与空间的竞争,虾在高密度养殖下会更频繁地游动,造成更多的能量消耗而影响生长(Costa et al, 2016),最终可能会导致对虾生存能力降低。
神经内分泌系统的调节机制是将应激反应产生的激素分泌到血液中,由血液循环系统带到靶细胞上发挥作用,会引起机体发生一系列的生理生化反应,包括主要能量物质代谢、免疫能力、呼吸作用等。能量的储存与释放是一切生物生存最基本的活动,所以,主要能量代谢是研究的重要部分。当生物体处于胁迫时,糖类作为首要和迅速的能源物质被用于供能,动用的碳水化合物以单糖形式进入血淋巴,导致血糖浓度升高(Sancho et al, 1997)。其中,血液是发挥物质运输、调节生理等功能的一项非常重要组织,可以反映机体的健康状况;血糖已被认为是动物受到胁迫的一个灵敏指标,而脂类、蛋白质含量的改变也是甲壳动物在遭遇胁迫时的一种常见效应。已有研究表明,重复取样(Racotta et al, 2007; Palacios et al, 1999)、缺氧(Hall et al, 2010)及氨氮(NH4+-N)胁迫(Racotta, et al, 2000)等条件均使对虾血液中能量物质发生不同程度的变化。密度胁迫作为养殖过程中重要环境因子,会对养殖对虾造成一定的生理生化影响。衣萌萌等(2012)研究发现,养殖密度可改变凡纳滨对虾(Litopenaeus vannamei)的营养物质和能量在体内的积累过程,所以,研究主要能量物质的代谢和利用具有重要的意义。
目前,有关中国明对虾在密度胁迫下生长与能量代谢关系的研究相对较少。本研究通过对不同养殖密度下,中国明对虾生长指标、血液能量代谢产物含量和相关酶活力指标的测定,探究中国明对虾生长性能及体内能量代谢需求的类型,以期为进一步研究中国明对虾在不同密度胁迫下的适应机制提供参考,并为中国明对虾的养殖提供相应的技术支撑。
1 材料与方法 1.1 实验材料本实验所用中国明对虾于2018年7月取自山东省潍坊昌邑市海丰水产养殖有限责任公司。平均体长为(7.20±0.21) cm,体重为(4.50±0.04) g,置于养殖公司室内养殖池暂养7 d后用于密度实验。
1.2 实验设计本实验采用单个规格为50 cm×50 cm×80 cm的网箱进行养殖实验,所有实验网箱统一放置在半径为1.5 m、高为0.8 m的圆形水泥池中,水位保持0.6 m,消除环境因素对实验的影响。实验共设置4个养殖密度,每个网箱分别放养15、30、45和60尾中国明对虾,密度分别设为100、200、300和400尾/m3,标记为G1、G2、G3和G4组,每个养殖密度3个重复,实验周期为28 d,分别在0、1、7、14、28 d取样,每个时间点取3尾对虾。
1.3 饲养管理实验用水为过滤净化后的天然海水,盐度为31.52~33.61,水温为25℃~28℃,pH为8.06~8.19,溶解氧(DO)为5.81~6.62 mg/L,24 h持续充氧,每天投喂对虾配合饲料(天马科技公司,粒径为1.4 mm,水分≤11.0,粗蛋白质≥50,粗脂肪≥4.0,粗纤维≤5.0,氨基酸≥2.4,粗灰分≤17.0),投喂量为中国明对虾体重的6%,分3次投喂(08:00、16:00和22:00)。实验用虾在实验开始时用眼标标记,养殖过程中,死亡对虾及时取出。为保持实验密度,从备养群体中选取规格一致的对虾进行补充。每天换水1/3,每3 d检测1次水质,使亚硝酸盐等指标保持在中国明对虾的安全阈值内。每7 d测量1次体长、体重,记录每个实验组的死亡个数,统计死亡率。
1.4 实验方法 1.4.1 样品的采集按照取样时间从各实验组随机选取3尾中国明对虾,抽取血淋巴,使用1 mL一次性注射器吸取0.5 mL 4℃预冷的抗凝剂,从对虾的围心腔抽取0.5 mL的血淋巴液,将每组的3尾对虾的血淋巴充分混合后,加入不含RNase的1.5 mL离心管,以4500 r/min离心15 min,取上清液,置-80℃冰箱保存。
1.4.2 生长指标的测定增重率(weight gain rate, WGR, 100%)=100×(W2-W1)/W1;
相对增长率(relative growth rate, AGR, %/d)= 100×(L2-L1)/d;
特定生长率(specific growth rate, SGR, %/d)= 100×(lnW2-lnW1)/d;
体重差异系数(coefficient of variability weight, CVW, 100%)=体重标准差/平均体重;
成活率(survival rate, SR, %)=100×N2/N1
式中,W1和W2分别为初始体重和末体重;L1和L2分别为初始体长和末体长;N1和N2分别为实验初始尾数和结束尾数,d为养殖天数。
1.4.3 能量代谢相关产物的测定葡萄糖(Glc)、乳酸(LA)、丙酮酸(PA)、甘油三酯(TG)和游离氨基酸(FAA)含量,均采用南京建成生物工程研究所的试剂盒测定,测定方法参照所附说明书。
1.4.4 能量代谢相关酶含量测定琥珀酸脱氢酶(SDH)、乳酸脱氢酶(LDH)、己糖激酶(HK)、丙酮酸激酶(PK)和6-磷酸果糖激酶(6-PFK)活性,均采用上海酶联生物科技有限公司生产的试剂盒测定,测定方法参照所附说明书。
1.5 数据分析实验数据采用平均值±标准误(Mean±SE)表示,数据分析采用SPSS 17.0软件单因素方差分析(one-way ANOVA)进行处理,Duncan多重比较进行差异显著性检验。P < 0.05为差异显著水平,以P < 0.01为差异极显著,使用Origin软件作图。
2 结果与分析 2.1 养殖密度对中国明对虾生长的影响从表 1可以看出,中国明对虾的SR、WGR、AGR、SGR呈现随养殖密度的增加而降低的趋势。G1组SR最高,为73.2%,与G2组相比差异不显著(P > 0.05);G3和G4组与G1组相比差异显著(P < 0.05)和差异极显著(P < 0.01),SR分别下降,为47.1%和38.2%。G2组的WGR、AGR和SGR均最高,与G1组相比差异不显著(P > 0.05);G3和G4组与G1组相比,分别达显著水平(P < 0.05)和极显著水平(P < 0.01)。随着养殖密度的增加,CVW呈上升趋势;与G1组相比,G2组的CVW显著升高(P < 0.05);G1组与G3、G4组相比差异极显著(P < 0.01),说明随着养殖密度的升高,中国明对虾生长的整齐度开始下降。
|
|
表 1 密度胁迫下对中国明对虾生长指标的影响 Tab.1 Effects of density stress on growth indicators of F. chinensis |
从图 1A~C可以看出,除G1组外,随着养殖密度的增加,中国明对虾体内的Glc、LA和PA含量整体呈上升的趋势,并随着养殖时间的增加,3种含量呈先上升后下降的趋势。其中,G2组的Glc、LA和PA含量变化最小,趋于稳定,与G1组相比差异不显著(P > 0.05);G3和G4组的含量均显著高于G1组(P < 0.05);G4组在养殖7 d时达到最大值,与G1组相比差异极显著(P < 0.01)。
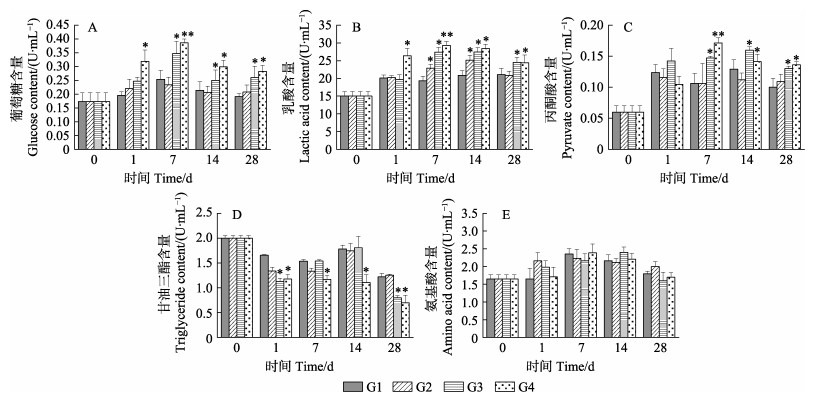
|
图 1 养殖密度对中国明对虾能量代谢产物的影响 Fig.1 Effects of density on energy metabolism products of F. chinensis |
随着养殖密度的增加,中国明对虾体内TG含量整体呈下降的趋势,且随养殖时间增加,TG含量呈先下降后上升再下降的变化趋势。其中,G2组的TG与G1组相比差异不显著(P > 0.05);G3组分别在1和28 d显著低于G1组(P < 0.05);G4组在不同养殖时间均显著低于G1和G2组(P < 0.05)(图 1D)。不同养殖密度下,中国明对虾的FAA含量变化差异不显著(P > 0.05)(图 1E)。
2.3 养殖密度对中国明对虾代谢酶活性的影响从图 2A、图 2C~E可以看出,随着养殖密度的增加,中国明对虾的LDH、6-PEK、HK和PK的活性整体呈上升的趋势,且随养殖时间的增加呈先上升后下降的趋势。其中,G2组的LDH、6-PEK、HK和PK活性整体变化与G1组相比差异不显著(P > 0.05);G3组的4种酶活性均在养殖7 d时开始显著提高(P < 0.05)。6-PEK在14 d时达到最大值,与G1组相比差异极显著(P < 0.01);G4组的4种酶活性最高且显著高于G1和G2组(P < 0.05)。LDH、6-PEK、HK和PK在14 d时均达到最大值,与G1组相比差异极显著(P < 0.01)。随着养殖密度的增加,中国明对虾体内SDH活性整体呈下降的趋势,且随着养殖时间的增加,G1和G2组SDH活性呈先下降后上升的趋势,G1和G2组之间相比差异不显著(P > 0.05);G3和G4组SDH活性显著降低(P < 0.05),G4组在28 d时与G1组相比差异极显著(P < 0.01)(图 2B)。
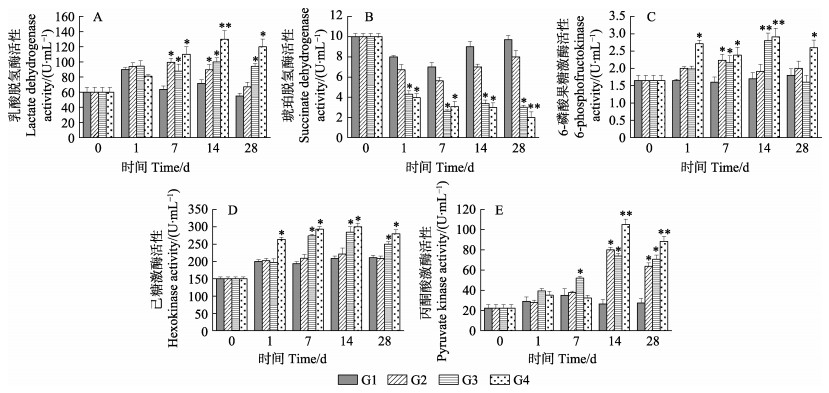
|
图 2 养殖密度对中国明对虾能量代谢酶活性的影响 Fig.2 Effects of density on the activities of energy metabolism enzymes of F. chinensis |
通常认为,个体增长速度可以作为一个衡量密度胁迫的指标,不同养殖密度对个体生长的影响不同。刘国兴等(2014)对克氏原螯虾(Procambarus clarkii)研究表明,随着养殖密度增加,对虾个体体重增长减少。在本研究中,G2组对虾的各生长指标最高,说明养殖密度为200尾/m3对中国明对虾的生长影响不显著,但随着养殖密度的增加,中国明对虾的SR、WGR、AGR和SGR均显著降低,CVW显著提高,与刘国兴等(2014)对克氏原螯虾及Marques等(2000)对凡纳滨对虾的研究结果相一致,表明高养殖密度严重影响对虾的生长。同时也说明,200尾/m3密度为本研究的临界点。在对溪红点鲑(Salvelinus leucomaenis) (Vijayan et al, 1988)、史氏鲟(Acipenser schrencki)(李大鹏等, 2004)和大西洋鳙鲽(Hippoglossus hippoglossus) (Björnsson, 1994)等研究发现,在某个密度范围内,随着个体的不断增长,空间的制约对生物个体的影响越大。当密度低于某个临界值时,个体的生长指标与密度之间呈正相关或不相关,但当密度高于此临界值时,个体的生长指标与密度之间呈负相关(张龙岗等, 2017)。本研究中,G2组的生长指标最高,所以,当中国明对虾规格为4.5 g时,其养殖密度在100~200尾/m3为宜。
3.2 养殖密度对中国明对虾能量代谢的影响能量代谢主要涉及糖酵解、三羧酸循环和氧化磷酸化等途径,外界任何刺激都需要通过动员体内能源物质来满足其对能量的额外需求,缓解环境带来的压力(连春盎等, 2017)。在胁迫条件下,增加糖代谢是对胁迫的常见反应,同样,机体也会通过相关代谢酶的响应,消耗脂肪和蛋白质来满足其对能量的需求(韩宇田等, 2012)。
在本研究中,G1和G2组Glc、LA和PA含量变化平稳,随着养殖密度的增加,G3和G4组的三者含量显著提高。在对鲮鱼(Cirrhinus molitorella)的研究中,密度胁迫下,Glc和LA含量的变化趋势与本研究一致(Tejpal et al, 2009),Glc显著升高,这表明对能源的需求增加,必须提高可代谢物质的利用,这可能是由于高密度引起对虾种内激烈争斗,从而使肝糖元或肌糖元不断分解,产生Glc并被运送至血液所致(韩宇田, 2012)。LA含量显著升高,说明养殖密度增加可能导致对虾机体补偿厌氧代谢升高。另外,机体进行糖代谢时,Glc首先通过糖酵解水解成PA,为机体提供少量能量,引起PA含量的升高(戴超等, 2013)。除了上述物质,中国明对虾体内TG含量也发生了变化,G3和G4组TG含量显著下降,这说明高密度养殖可能导致了对虾机体更高的能量需求和补偿性响应,继续利用脂类作为能源物质。在硬骨鱼类中,已经报道了在密度胁迫条件下可增强脂类代谢,以应对增加的能量需求(Polakof et al, 2006)。在本研究中,不同养殖密度组之间游离氨基酸变化不显著,则表明蛋白质代谢未受到显著影响。Wu等(2000)研究表明,在饥饿胁迫和蜕皮中,中国明对虾优先利用蛋白质和脂质满足能源需求,所以,在不同胁迫条件下,中国明对虾利用能量代谢物质种类的顺序不同。在密度胁迫下,中国明对虾更倾向于利用糖类和脂类作为能源。
大多数无脊椎动物、甲壳类动物面临环境胁迫等不良条件下,会切换成另一种厌氧能量代谢,即糖酵解。HK、6-PEK和PK是糖分解过程中的限速酶,这3种酶的活性可以反映糖酵解水平(Greenberg et al, 1960)。糖酵解速率的提高,有利于三磷酸腺苷酶(ATP)的生成,提高机体抵抗胁迫的耐受能力(Raúl et al, 2002)。本研究结果表明,G3和G4组3种限速酶活力显著提高,表明高密度养殖下,对虾通过提高糖酵解速率,提高机体对高养殖密度的耐受能力,从而用于对虾生长部分的能量减少。戴超等(2013)对低温胁迫下三疣梭子蟹(Portunus trituberculatus)的能量变化研究中也有相似结果。LDH是一种重要的糖酵解酶,当机体在胁迫状态下需要额外能量供给的时候,显得尤为重要。本研究结果表明,G3和G4组显著提高了中国明对虾LDH活力,说明丙酮酸向乳酸的转化增加,高密度养殖增强了组织的无氧代谢,与Gao等(2018)研究结果相一致。SDH作为参与三羧酸循环的关键酶,是唯一嵌入到线粒体内膜中的酶,可在一定程度上反映有氧代谢的水平(王镜岩等, 2002)。本研究中,SDH活性在G3和G4组中显著降低,其活性的降低表明三羧酸循环活性的下降,进一步表明高养殖密度抑制了组织的有氧代谢。
4 结论综上研究表明,随着养殖密度的增加,中国明对虾的SR降低,生长的整齐度开始下降,显著影响中国明对虾的生长。在高养殖密度下,中国明对虾更倾向于利用糖类和脂类作为能源,密度过高导致机体氧化代谢途径发生变化,分解代谢增强,有氧代谢受到抑制,而无氧代谢被激活。在本研究中,200尾/m3的生长指标最高,且能量代谢消耗小。所以,当中国明对虾规格为4.5 g时,其养殖密度100~200尾/m3为宜。
BJÖRNSSON B. Effect of stocking density on growth rate of halibut (Hippoglossus hippoglossus L.) reared in large circular tanks for three years. Aquaculture, 1994, 123(3/4): 259-270 |
COSTA D, FELIPE P, GOMES B S F D, et al. Influence of stocking density on the behaviour of juvenile Litopenaeus vannamei (Boone, 1931). Aquaculture Research, 2016, 47(3): 912-924 DOI:10.1111/are.12550 |
DAI C, WANG F, FANG Z H, et al. Effects of temperature on energy metabolic enzymes of swimming crab (Portunus trituberculatus) in the post-molt stage. Journal of Fisheries of China, 2013, 37(9): 1334-1341 [戴超, 王芳, 房子恒, 等. 温度对蜕壳后期三疣梭子蟹能量代谢酶活力的影响. 水产学报, 2013, 37(9): 1334-1341] |
GAO X L, LI X, SHI C, et al. Effects of stocking density on growth, metabolism, and energy budget of Haliotis discus hannai Ino. Aquaculture, 2018, 483: 84-95 DOI:10.1016/j.aquaculture.2017.09.045 |
GREENBERG D M, JAGENDORF A T. Metabolic pathways. Quarterly Review of Biology, 1960(4): 613 |
HALL M R, HAM E H. The effects of different types of stress on blood glucose in the giant tiger prawn Penaeus monodon. Journal of the World Aquaculture Society, 2010, 29(3): 290-299 |
HAN Y T, WANG G Q. Metabolism and regulation of fish crowding stress. Feed Industry, 2012(22): 48-49 [韩宇田, 王桂芹. 鱼类拥挤胁迫的代谢及调控. 饲料工业, 2012(22): 48-49] |
LAIZ-CARRIÓN R, VIANA I R, CEJAS J R, et al. Influence of food deprivation and high stocking density on energetic metabolism and stress response in red porgy, Pagrus pagrus L. Aquaculture International, 2012, 20(3): 585-599 DOI:10.1007/s10499-011-9488-y |
LIAN C A, LI J, LI J T, et al. Effects of dry exposure on the respiratory metabolism-related enzymes of Exopalaemon carinicauda. Progress in Fishery Sciences, 2017, 38(4): 53-60 [连春盎, 李健, 李吉涛, 等. 干露胁迫对脊尾白虾(Exopalaemon carinicauda)呼吸代谢相关酶的影响. 渔业科学进展, 2017, 38(4): 53-60] |
LI D P, ZHUANG P, YAN A S. The influences of illuminaiton, waetr currellt and sotcikng desnity on feeding, behavior and growth in juveulles Acipenser schernciki. Journal of Fisheries of China, 2004, 28(1): 54-61 [李大鹏, 庄平, 严安生, 等. 光照、水流和养殖密度对史氏鲟稚鱼摄食、行为和生长的影响. 水产学报, 2004, 28(1): 54-61] |
LIU G X, LI L, PENG G, et al. Effects of stocking density on growth of Procambarus clarkii and aquaculture water quality. Acta Agriculturae Jiangxi, 2014, 26(4): 86-89 [刘国兴, 李玲, 彭刚, 等. 放养密度对克氏原螯虾生长和养殖水质的影响. 江西农业学报, 2014, 26(4): 86-89 DOI:10.3969/j.issn.1001-8581.2014.04.024] |
MARQUES H L D E A, LOMBARDI J V, BOOCK M V. Stocking densities for nursery phase culture of the freshwater prawn Macrobrachium rosenbergii in cages. Aquaculture, 2000, 187(1): 127-132 |
PALACIOS E, CARREFIO D, RODRÍGUEZ-JARAMILLO M C, et al. Effect of eyestalk ablation on maturation, larval performance, and biochemistry of white Pacific shrimp, Penaeus vannamei, Broodstock. Journal of Applied Aquaculture, 1999, 9(3): 1-23 DOI:10.1300/J028v09n03_01 |
POLAKOF S, ARJONA F J, SANGIAO-ALVARELLOS S, et al. Food deprivation alters osmoregulatory and metabolic responses to salinity acclimation in gilthead sea bream Sparus auratus. Journal of Comparative Physiology Part B: Biochemical Systemic and Environmental Physiology, 2006, 176(5): 441 |
RACOTTA I S, PALACIOS E. Hemolymph metabolic variables in response to experimental manipulation stress and serotonin injection in Penaeus vannamei. Journal of the World Aquaculture Society, 2007, 29(3): 351-356 |
RACOTTA I S, HERNÁNDEZ-HERRERA R. Metabolic responses of the white shrimp, Penaeus vannamei, to ambient ammonia. Comparative Biochemistry Physiology Part A: Molecular and Integrative Physiology, 2000, 125(4): 437-443 DOI:10.1016/S1095-6433(00)00171-9 |
RAÚL L C, SUSANA S A, JOSÉ M G. Energy metabolism in fish tissues related to osmoregulation and cortisol action. Fish Physiology and Biochemistry, 2002, 27(3/4): 179-188 DOI:10.1023/B:FISH.0000032725.96481.b8 |
SANCHO E, FERRANDO M D, ANDREU E. Sublethal effects of an organophosphate insecticide on the European eel, Anguilla anguilla. Ecotoxicology and Environmental Safety, 1997, 36(1): 57-65 DOI:10.1006/eesa.1996.1488 |
VIJAYAN M M, LEATHERLAND J F. Effect of stocking density on the growth and stress-response in brook charr, Salvelinus fontinalis. Aquaculture, 1988, 75(1): 159-170 |
WANG J Y, ZHU S G, XU C F. Biochemistry. 3rd edition. Beijing: Higher Education Press, 2002: 104-105 [王镜岩, 朱圣庚, 徐长法. 生物化学. 第3版. 北京: 高等教育出版社, 2002: 104-105]
|
WU L X, DONG S L, WANG F, et al. Compensatory growth response following periods of starvation in Chinese shrimp, Penaeus chinensis Osbeck. Journal of Shellfish Research, 2000, 19(2): 717-722 |
YI M M, YU H N, LIN X T, et al. Effects of stocking densities on behavior and physiological activity in Litopenaeus vannamei. Journal of Jinan University (Natural Science), 2012, 33(1): 81-86 [衣萌萌, 于赫男, 林小涛, 等. 密度胁迫下凡纳滨对虾的行为与生理变化. 暨南大学学报(自然科学版), 2012, 33(1): 81-86] |
ZHANG L G, MENG Q L, LIU Y Q, et al. Effects of breeding density on the growth and survival of large-scale seedlings of Procambarus clarkii. Hebei Fisheries, 2017(5): 12-14 [张龙岗, 孟庆磊, 刘羽清, 等. 养殖密度对克氏原螯虾大规格苗种生长和存活的影响. 河北渔业, 2017(5): 12-14] |



