2. 上海海洋大学水产与生命学院 上海 201306;
3. 山东省海洋生物研究院 山东 青岛 266104;
4. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Marine Biology Institute of Shandong Province Qingdao, Shandong 266104;
4. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China
二甲基硫(DMS)是海洋中重要的挥发性生源硫化物,被认为是一种“负温室气体”,其进入大气的氧化产物增加大气云凝结核的数量,提高云层对太阳光的反射率,使全球热量收入减少,进而缓解全球气候变暖(Charlson et al, 1987)。二甲基巯基丙酸(DMSP)是DMS的重要前体物质,其主要分布在浮游植物和大型藻类中,是渗透压调节物质(Kirst, 1996)。浮游植物通过浮游动物摄食、微生物的新陈代谢、病毒侵蚀、藻细胞的衰老等途径在DMSP裂解酶作用下产生DMS (Dacey et al, 1986; Malin et al, 1994; 杨桂朋等, 2009; Belviso et al, 1990; Christaki et al, 1996)。其中,浮游动物摄食作用是导致DMS产生的重要途径,浮游植物细胞中DMSP和DMSP裂解酶分别处在不同细胞隔室内,浮游动物摄食使分隔的DMSP和DMSP裂解酶在其食物液泡中得以混合,从而促进DMS的释放(张瑜, 2013);另外,浮游植物细胞内的DMSP不易通过正常的细胞膜渗透到细胞外,经浮游动物摄食作用使浮游植物细胞破裂,促进了DMSP的释放,造成了DMSP和酶的相互作用(Dacey et al, 1986)。Wolfe等(1996)研究认为,浮游动物摄食促进了浮游植物细胞中DMSP裂解酶的活性,从而促进DMS的释放。
我国是海水养殖大国,贝类占海水养殖总产量的70%以上,其中,牡蛎(Ostrea gigas)、蛤、扇贝和贻贝(Mytilus edulis)等滤食性贝类占贝类总产量的90%以上(中国渔业统计年鉴, 2019)。滤食性贝类与浮游动物生态位相似,食物来源均以浮游植物为主,通过鳃丝和其上着生的前纤毛、前侧纤毛、侧纤毛的相互配合摄取食物颗粒(董波等, 2000),滤食性贝类摄食活动对浮游植物产生二甲基硫化物[DMS(P)]可能存在重要影响,然而,目前有关滤食性贝类、浮游植物、DMS(P)三者之间作用关系的研究较少,仅有Hill等(2007)研究了静水条件下,紫贻贝(Mytilus edulis)和海湾扇贝(Argopecten irradians)摄食扁藻(Tetraselmis sp.)对DMS(P)的影响。本研究以长牡蛎(Crassostrea gigas)、栉孔扇贝(Chlamys farreri)、紫贻贝、菲律宾蛤仔(Ruditapes philippinarum) 4种主要经济滤食性贝类为研究对象,以DMSP含量较高的球等鞭金藻(Isochrysis galbana)作为饵料藻种,探讨了静水和扰动条件下,水体的DMS(P)变化以及贝类粪便DMS(P)释放的影响,研究结果将为深入探讨贝类摄食活动对海洋硫循环的影响提供数据支撑,并拓展气候变化背景下养殖贝类生态功能的认识。
1 材料与方法 1.1 实验藻种和贝类实验所用球等鞭金藻由中国水产科学研究院黄海水产研究所微藻培养实验室提供。采用脱脂棉过滤后的灭菌自然海水,pH为8.0,盐度为35,使用f/2培养液,将藻液置于光照培养箱中培养至指数生长期待用。光暗周期为12∶12,培养温度为18℃,每天轻摇2次,使用血球计数板测定微藻密度。
实验贝类选用长牡蛎、栉孔扇贝、紫贻贝、菲律宾蛤仔,壳长分别为6.5~7.6、6.0~6.8、5.6~6.4、3.0~3.3 cm,放于水温为18℃流水池中充氧暂养,每天投喂2次金藻。预实验结果显示,贝类摄食作用会导致粪便DMSP的产生,因此,在正式实验前进行饥饿处理24 h。选择规格相似、活性良好的贝类,除去体表附着物,对于紫贻贝和栉孔扇贝2种具有足丝的贝类,将其足丝沿贝壳边缘小心剪除。
1.2 静水条件下,摄食对金藻产生DMS(P)的影响 1.2.1 不同浓度饵料实验为了探究贝类摄食不同浓度的金藻对水体DMS(P)的影响,选用紫贻贝作为实验贝类,将指数生长期的金藻稀释,分成浓度分别为2×105、3×105、4×105和5×105 cells/mL进行投喂。
选用5.6 L高约30 cm的聚乙烯塑料桶作为实验容器,向其中加入藻液至满,水温为18℃时向实验组容器底部放入1个贻贝,以不添加贻贝组作为对照组,并向其中充入等量的微量O2,保证溶解氧(DO) > 8.0 mg/L,气石置于贝类上方,确保贻贝进行正常的摄食活动并不扰动粪便。向液面顶部覆盖保鲜膜以尽量避免与外界接触,摄食过程避光进行。每组设置3个平行。通过预实验得知,饥饿处理的贝类并不会增加去DMS海水的DMS(P)浓度。
实验以贻贝开始摄食计时,持续21 h。实验结束后,在无扰动的条件下,虹吸上层水体约1 L,测定DMS、总DMSP(DMSPt)、溶解态DMSP(DMSPd)浓度和颗粒态DMSP(DMSPp)。使用均质仪将剩余含贝类粪便的少量水体(100~200 mL)混匀,测定粪便DMSP(DMSPf)浓度。通过预实验得知,对照组DMSPp在21 h内变化很小,被摄食DMSPp采用对照组和实验组DMSPp的差值表示(下同)。
1.2.2 不同贝类摄食实验为了探讨不同贝类摄食金藻对水体DMS(P)的影响,选择长牡蛎、栉孔扇贝、紫贻贝、菲律宾蛤仔作为实验贝类,投喂与1.2.1中相同批次浓度为4×105 cells/mL的金藻。采用相同的实验条件和测定方法。
1.3 扰动条件下,粪便对水体DMS(P)产生的影响为了探究扰动条件下贝类粪便对水体DMS(P)的影响,选择紫贻贝作为摄食贝类,贝类及金藻与1.2.1中批次相同,在1.2.2静置摄食实验结束后,取出紫贻贝,选用贝类摄食后的水体,进行原水总水体扰动实验;另选平行组进行定量粪便扰动实验。
1.3.1 原水总水体扰动实验使用数显恒温磁力搅拌器(85-2型, 丹瑞),设定5个扰动速度0 (对照组)、15、70、200、500 r/min,对原水总水体(粪便及水体)进行5 min扰动处理。整个实验期间,水温未出现明显升高现象,始终稳定在18℃~19℃之间,测定各组实验前后的DMS、DMSPt和DMSPd的浓度,每组各设置3个平行。
1.3.2 定量粪便扰动实验将上层水体虹吸移除,仅保留粪便,使用改装后的一次性塑料滴管小心移取,使用分析天平称量5份0.08 g紫贻贝粪便,分别置于2 L聚乙烯塑料桶中,加入1 L经高温灭菌处理后的去DMS海水,使用数显恒温磁力搅拌器,设定5个扰动速度0 (对照组)、15、70、200、500 r/min,对水体进行5 min扰动处理。整个实验期间,水温未发生明显变化,始终稳定在18℃~19℃之间,测定各组DMS、DMSPt和DMSPd的浓度。
1.4 二甲基硫化物分析 1.4.1 检测方法建立及工作曲线绘制使用固相微萃取-气相色谱与质谱联用法(solid-phase microextraction and gas chromatography-mass spectrometry)测定DMS,具体操作方法及工作曲线绘制如下:
QP2010SE气相色谱与质谱联用仪(岛津,日本)搭配AOC-5000自动进样器(CTC),使用60 m × 0.32 mm 1.8 μm Vocol色谱柱(Supleco)进样口温度为210℃,使用分流模式,分流比为7.5∶1,离子源温度为200℃,载气为高纯氦气(99.999%),流速为3 mL/min,进样时间为1 min,柱前压为85.0 kPa,柱箱温度为35℃,保持3 min后,以3℃/min的速率升到40℃,保持1 min后,以10℃/min的速率升到100℃,再以20℃/min的速率升到210℃,保持10 min,溶剂延迟时间为1 min,MS检测器电压为100 eV,检测和数据采集选择SIM模式,质荷比m/z选择47和62。萃取温度为24℃,萃取时间为20 min,解析时间为2 min,使用Carboxen/Polydimethylsiloxane (CAR/PDMS)萃取纤维(75 μm, Supleco)。
将DMS标准品(色谱纯,Sigma-Aldrich)加入甲醇(色谱纯,ThermoFisher公司,美国)中,配制成1.0 g/L的标准储备液,-20℃避光保存。绘制工作曲线时,取10.0 mL去DMS海水装于预先加入2.5 g NaCl (分析纯)的20.0 mL顶空瓶中,再加入一定量的DMS储备液配制成一系列浓度的标准品,拧紧瓶盖,使用外标法定量并绘制标准曲线。在10~100, 000 ng/L的范围内均展现出良好的线性,方法的性能参数见表 1。
|
|
表 1 方法的性能参数 Tab.1 Performance parameter of SPME-GC/MS |
DMS的分析:待测样品采取与DMS标准品同样的操作方法,吸取10 mL待测样品注入到装有2.5 g NaCl的顶空瓶中,拧紧瓶盖,放于自动进样器中待测。
DMSP的分析:DMSP在强碱作用下(pH≥13)会按1∶1的比例完全转化为DMS和丙烯酸(Dacey et al, 1987),故通过测定DMS含量即可间接得到DMSP的含量。DMSP样品(浓度过高时进行稀释)分成2份,取10 mL DMSP样品直接加入预先装有2.5 g NaCl的顶空瓶中,加入0.5 mL 10.0 mol/L的NaOH,密封玻璃瓶,4℃避光保存24 h,使DMSP完全碱解为DMS,通过测定DMS含量间接得到DMSPt的含量;另一份DMSP样品经0.45 μm Whatman GF/F滤膜进行小体积重力过滤(SVDF)(Kiene et al, 2006),滤液使用相同处理方法测定DMSPd。DMSPp由DMSPt减去DMSPd得到。DMSPf测定步骤同DMSPt,注意扣除水体DMS和DMSPt浓度。
1.5 数据处理与分析数据处理和柱状图绘制采用Excel 2016软件,差异显著采用SPSS 19.0分析软件。
2 结果与分析 2.1 静水条件下,贝类摄食金藻对DMS(P)产生的影响 2.1.1 静水条件下,贻贝摄食不同浓度金藻对DMS(P)产生的影响从图 1可以看出,不同浓度饵料实验中,金藻浓度分别为2×105、3×105、4×105、5×105 cells/mL,实验组和对照组的DMS浓度分别为(177.93±7.42)和(181.83±8.50)、(240.33±9.50)和(230.03± 10.05)、(299.09±9.67)和(297.17±12.00)、(391.93±17.04)和(384.69±16.06) nmol/L。与对照组相比,实验组的DMS变化范围在97.0%~104.6%之间,差异不显著(P > 0.05) (图 1a)。

|
图 1 贻贝摄食不同浓度金藻对DMS(P)产生和转移的影响 Fig.1 Effects of mussel feeding on I. galbana at different concentrations on production and transfer of DMS(P) a:贻贝摄食不同浓度金藻对DMS的影响;b:贻贝摄食不同浓度金藻对DMSPd的影响;c:贻贝摄食不同浓度金藻对DMSPp的影响;d:贻贝摄食不同浓度金藻对DMSPf产量的影响;e:摄食量占饵料总量比 a: Effects of mussel feeding on I. galbana at different concentrations on DMS production; b: Effects of mussel feeding on I. galbana at different concentrations on DMSPd production; c: Effects of mussel feeding on I. galbana at different concentrations on DMSPp production; d: Effects of mussel feeding on I. galbana at different concentrations on DMSPf production; e: Ratio of intake to total |
DMSPd实验组和对照组的浓度分别为(27.93±11.24)和(36.10±16.15)、(45.33±17.00)和(40.38± 15.73)、(39.67±18.44)和(30.33±19.73)、(45.01±14.11)和(45.33±11.50) nmol/L。各实验组均并未有显著的升高或者降低现象(P > 0.05),且无论对照组还是实验组,相对于DMSPp,DMSPd的浓度较低,约为DMSPp的1% (图 1b)。
DMSPp实验组和对照组的浓度分别为(40.99± 40.29)和(3234.83±208.90)、(81.97±91.06)和(4908.58± 318.25)、(97.58±55.29)和(6503.17±458.98)、(968.67± 463.19)和(8220.42±302.08) nmol/L。与对照组相比,实验组DMSPp浓度均呈显著降低趋势(P < 0.01),且贝类的摄食百分比越高,对应的DMSPp降低程度越大(图 1c)。
DMSPf分别为1305.8、1421.8、3259.6、2507.5 nmol/L,分别占据摄入DMSPp的40.9%、29.5%、50.9%和34.6% (图 1d)。贻贝摄食量分别占投喂总量的99.0%、98.7%、99.0%和87.2% (图 1e)。
2.1.2 静水条件下,不同贝类摄食金藻对DMS(P)产生的影响从图 2可以看出,对于DMS,在牡蛎、贻贝、扇贝、蛤仔的摄食下,实验组浓度分别为(288.17±12.35)、(299.01±9.55)、(305.17±17.23)、(310.97±10.55) nmol/L,对照组DMS浓度为(297.17± 12.00) nmol/L,与对照组相比,实验组的DMS变化范围在97.0%~104.6%之间,差异不显著(P > 0.05) (图 2a)。
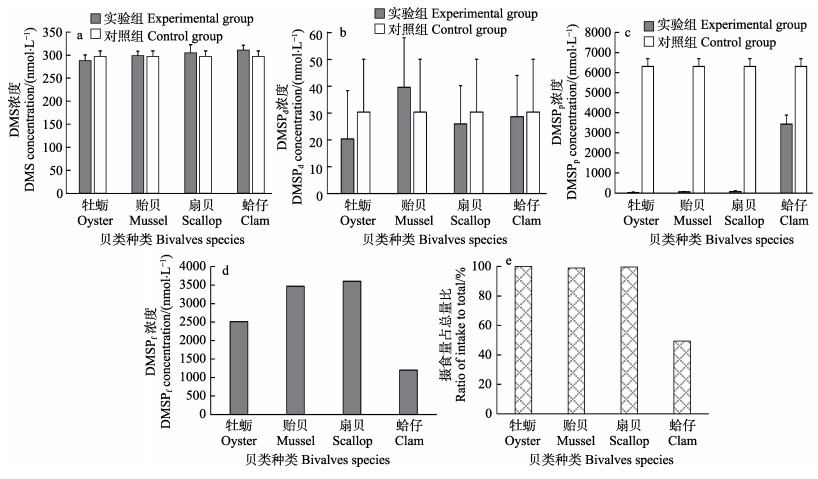
|
图 2 不同贝类摄食金藻对DMS(P)产生和转移的影响 Fig.2 Effects of feeding on I. galbana by different bivalves on production and transfer of DMS(P) a:不同贝类摄食金藻对DMS的影响;b:不同贝类摄食金藻对DMSPd的影响;c:不同贝类摄食金藻对DMSPp的影响;d:不同贝类摄食金藻对DMSPf产量的影响;e:摄食量占饵料总量比 a: Effects of feeding on I. galbana by different bivalves on DMS production; b: Effects of feeding on I. galbana by different bivalves on DMSPd production; c: Effects of feeding on I.galbana by different bivalves on DMSPp production; d: Effects of feeding on I. galbana by different bivalves on DMSPf production; e: Ratio of intake to total |
DMSPd实验组浓度分别为(20.33±18.02)、(39.67± 18.43)、(26.01±14.19)、(28.67±30.33) nmol/L,对照组浓度为(30.33±19.74) nmol/L。各实验组中均并未有显著的升高或者降低现象(P > 0.05),无论对照组还是实验组,相对于DMSPp,DMSPd的浓度较低,约为DMSPp的1% (图 2b)。
DMSPp实验组浓度分别为(23.36±24.74)、(60.33±17.50)、(78.67±28.02)、(3433.44±451.09) nmol/L,对照组为(6304.2±384.32) nmol/L。与对照组相比,实验组DMSPp浓度均极显著降低(P < 0.01),并且贝类的摄食百分比越高,对应的DMSPp浓度降低程度越大(图 2c)。
牡蛎、贻贝、扇贝和蛤仔组DMSPf浓度分别为2510.8、3467.8、3604.5和1200.5 nmol/L,分别占据了摄入DMSPp的40.0%、55.5%、57.9%和41.8% (图 2d)。
牡蛎、贻贝、扇贝和蛤仔组摄食量分别占投喂总量的100.0%、99.0%、99.70%和49.4% (图 2e)。
2.2 扰动条件下,贝类粪便对水体DMS(P)产生的影响 2.2.1 原水总水体扰动不同扰动程度对原水总水体DMS(P)的影响见图 3。从图 3可以看出,在0、15、70、200和500 r/min转速下,原水总水体DMS分别为(302.21±11.59)、(318±11.11)、(345.07±15.31)、(353.09±18.02)和(349.57 ±14.05) nmol/L。随着扰动程度的增加,DMS浓度均有增加的现象,其中,70、200和500 r/min组与对照组相比差异显著(P < 0.05),扰动能促进粪便中DMS(P)的释放而导致水体DMS浓度显著增加,最大可使原水总水体DMS增加16.8% (图 3a)。
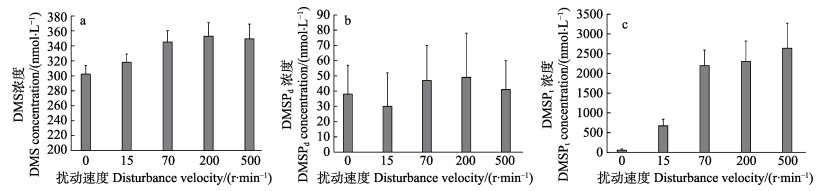
|
图 3 不同扰动程度对原水总水体DMS(P)的影响 Fig.3 Effects of different disturbance velocity on total original water DMS(P) a:不同扰动速度对原水总水体DMS的影响;b:不同扰动速度对原水总水体DMSPd的影响;c:不同扰动程度对原水总水体DMSPt的影响 a: Effects of different disturbance velocity on total original water DMS; b: Effects of different disturbance velocity on total original water DMSPd; c: Effects of different disturbance velocity on total original water DMSPt |
原水总水体DMSPd浓度分别为(38.01±19.08)、(29.98± 22.00)、(46.99±23.10)和(41.07±19.00) nmol/L,扰动处理下,与对照组相比均未出现显著的升高或者降低现象(图 3b)。
原水总水体DMSPf浓度分别为58.32、672.91、2200.40、2305.82和2641.28 nmol/L,随着水体扰动程度的增加,粪便向水体的扩散量增加,DMSPt浓度逐渐增加,最大可使原水总水体DMSPt增加38.5倍(图 3c)。
2.2.2 定量粪便扰动不同扰动程度水体中DMS(P)浓度变化情况见表 2。从表 2可以看出,在0~500 r/min转速范围内,随着扰动程度的加强,水体中DMS和DMSPt的浓度均呈现升高的趋势,二者的浓度分别从静置状态下的7.6和906.4 nmol/L升高到最大21.3和2505.9 nmol/L,分别增加了180%和174%。
|
|
表 2 不同扰动速度下粪便水体中DMS(P)浓度变化 Tab.2 Variation of DMS(P) concentration in fecal water with different disturbance velocity |
自Dacey等(1986)首次通过室内桡足类摄食鞭毛藻(Gymnodinium nelson)的研究表明,浮游动物对浮游植物的摄食作用可促进水体中DMS的增加,已有众多研究得到了类似的结论(Belviso et al, 1990; Leck et al, 1990; Christaki et al, 1996; 张瑜, 2013)。Kasamatsu等(2004)研究指出,浮游动物的“Sloppy feeding”摄食方式,使其摄食过程中对浮游植物细胞摄食不完全,机械破碎导致DMS的产生。与上述结果不同,Kwint等(1996)在桡足类近亲真帘水蚤(Eurytemora affinis)摄食浮游三角褐指藻(Phaeodactylum tricornutum)和威氏海链藻(Thalassiosira weissflogii)研究中发现,桡足类的摄食活动并未导致水体中的DMS增加,DMSP几乎均以粪便颗粒的形式排出,进一步分析表明,浮游动物摄食最重要的作用是将浮游植物中的DMSP转移到粪便颗粒中。Hill等(2007)对静水条件下,紫贻贝和海湾扇贝摄食扁藻(Tetraselmis sp.)的研究也表明,滤食性贝类的摄食活动对微藻DMS的释放未产生明显的促进作用,这与本研究结果相一致。产生这种现象的原因可能与滤食性贝类的摄食机制有关,贝类通过选食器官(鳃、唇瓣、食物选择盲囊)完成食物颗粒的收集、运输、截取和筛选后,进入消化道进行消化吸收,未消化的食物颗粒以粪便形式排出体外(董波等, 2000),这种摄食机制使得浮游植物以被鳃分泌黏液包裹的形式进入消化器官内完成同化,同时,排出的粪便也被代谢产生的黏液包裹,使得静水条件下,粪便中的DMS(P)难以通过固-液界面形成扩散,由此导致静水条件下,水体中DMS没有出现显著增加的现象。对于紫贻贝和栉孔扇贝等具有足丝的贝类来说,除了摄食活动是影响水体DMS浓度因素外,足丝腺分泌的足丝蛋白极强的吸附作用也是可能的因素之一。凌文康等(2019)研究表明,紫贻贝足丝分泌的足丝蛋白对海水中的重金属等化学物质具有很强的吸附能力,但关于足丝蛋白吸附作用与DMS迁移和转化之间潜在的关系目前尚未见相关报道,值得在后续的研究进一步深入探讨。在静水实验中发现,粪便中约占据了贝类摄入DMSPp的40%,如此高的含量可能对水体DMSP和DMS产生潜在的影响。滤食性贝类通过生物沉积过程在水环境和沉积环境之间发挥着生物耦联作用。在广岛湾牡蛎养殖区,一台200 m2筏架在300 d养殖期内可产生19.3 t粪物质(干重)。Hatcher等(1994)在加拿大的一个封闭海湾观察到贻贝养殖区的沉积速率是非养殖海区的2倍以上;在烟台四十里湾,壳高为41.1 mm的栉孔扇贝生物沉积速率最高达230 mg/(g·d)(周毅等, 2003)。稳定碳氮同位素的研究结果表明,长牡蛎生物沉积物对沉积物有机质的贡献率平均为(13.96±8.62)% (任黎华, 2014)。滤食性贝类养殖活动的主要区域在浅海,由于受到海底地形、区域构造环境、径流、海洋环流等影响,浅海的环境复杂而多变(尹燕欣, 2012)。扰动实验发现,随着粪便中DMSP的扩散,水体中DMSPt和DMS的量增加。在总水体扰动实验中,相比对照组,实验组DMS和DMSPt浓度最大分别增加了16.8%和38.5倍。同时海区调查也发现,在近岸海域Niel海湾(Jean, 2009)、威尼斯泻湖(Gambaro, 2002)甚至白令海海盆西南部海域的深层海水中(> 2000 m) (Li et al, 2007)均具有很高的DMS(P)浓度,高DMS(P)含量的沉积物再悬浮和扩散作用可能是诱发此现象的原因。在这样的背景下,仅仅基于实验室内的静水实验结果将大大局限对于DMS(P)生物地球化学过程的认识,这也是本研究尝试开展一定程度扰动实验的出发点和落脚点。对于养殖海区来说,外界环境对生物沉积物的扰动作用主要有2个过程:一个过程是在生物沉积物向海底沉降的过程中。研究表明,中等规格(5.46±0.54) cm的长牡蛎生物沉积物的平均沉降速率约为(1.16±0.54) cm/s (任黎华, 2014)。以桑沟湾的平均水深为7 m来估算,需要10 min到达海底,在此过程中,浪、流等作用导致生物沉积物破碎、扩散、悬浮,生物沉积物与水体接触的比表面积增大,接触时间延长,使沉积物-水界面得到充分的物质交换。另一个过程发生在沉降到海底的生物沉积物的再悬浮作用。王丕波等(2005)研究表明,在浅水区海底沉积物再悬浮更为显著,风浪、潮汐、潮流等因素引起的海水运动是重要诱因。以我国典型滤食性贝类养殖海湾桑沟湾为例,沉积物再悬浮通量的数量级在10-5~10-6 kg/(m2·s)之间,全年约有171 d沉积物处于再悬浮状态(蒋增杰, 2008);浅水湖Apopka湖每年70%时段有50%沉积物受到风浪扰动而悬浮(蒋增杰, 2008),如此频繁且强烈的再悬浮作用使生物沉积物中的DMS(P)有了向水体中再次释放的机会。
本研究虽然获得了贝类通过生物沉积物再释放过程对DMS(P)如DMS、DMSPt浓度有一定影响的一些数据和线索,但是并未发现DMSPd浓度显著增加现象。DMSPd转化时间较快,本身浓度变化并不明显,加之DMSPd的测定方法为间接法测定,这些因素均可能是此结果的原因。最后,本研究的结论是基于室内可控条件下,模拟获得的养殖海区的水文条件。实际水环境条件等极为复杂,相应的DMS(P)的产生和迁移转化过程也更为复杂,研究结果向海区的拓展和应用尚需要后续开展一系列现场围隔等形式的野外观测研究进行综合解读。
BELVISO S, KIM S, Rassoulzadegan F, et al. Production of dimethylsulfonium propionate (DMSP) and dimethylsulfide (DMS) by a microbial food web. Limnology and Oceanography, 1990, 35(8): 1810-1821 DOI:10.4319/lo.1990.35.8.1810 |
CHARLSON R J, LOVELOCK J E, ANDREAE M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate. Nature, 1987, 326(6114): 655-661 DOI:10.1038/326655a0 |
CHRISTAKI U, BELVISO S, DOLAN J R, et al. Assessment of the role of copepods and ciliates in the release to solution of particulate DMSP. Marine Ecology Progress, 1996, 141(1/2/3): 119-127 |
DACEY J W H, BLOUGH N V. Hydroxide decomposition of dimethylsulfoniopropionate to form dimethylsulfide. Geophysical Research Letters, 1987, 14(12): 1246-1249 DOI:10.1029/GL014i012p01246 |
DACEY J W H, WAKEHAM S G. Oceanic dimethylsulfide: Production during zooplankton grazing on phytoplankton. Science, 1986, 233(4770): 1314-1316 DOI:10.1126/science.233.4770.1314 |
DONG B, XUE Q Z, LI J. Advances in studies on the feeding physiology of suspension-feeding of luscs. Marine Sciences, 2000, 24(7): 31-34 [董波, 薛钦昭, 李军. 滤食性贝类摄食生理的研究进展. 海洋科学, 2000, 24(7): 31-34 DOI:10.3969/j.issn.1000-3096.2000.07.012] |
Fisheries Bureau of Ministry of Agriculture. 2019 China fishery statistical yearbook. Beijing: China Agriculture Press, 2019 [农业农村部渔业渔政管理局. 2019中国渔业统计年鉴. 北京: 中国农业出版社, 2019]
|
GAMBARO A, MORET I, PIAZZA R, et al. Winter evolution of DMS and DMSP in Venice Lagoon water and sediment. Annalidi Chimica, 2002, 92(92): 217-227 |
HATCHER A, GRANT J, SCHOFIELD B. Effects of suspended mussel culture (Mytilus spp.) on sedimentation, benthic respiration and sediment nutrient dynamics in a coastal bay. Marine Ecology Progress Series, 1994, 115(3): 219-235 |
HILL R W, DACEY J W H. Processing of ingested dimethylsulfoniopropionate by mussels Mytilus edulis and scallops Argopecten irradians. Marine Ecology Progress, 2007, 343(1): 131-140 |
JEAN N, BOGE G, JAMET J L, et al. Plankton origin of particulate dimethylsulfoniopropionate in a Mediterranean oligotrophic coastal and shallow ecosystem. Estuarine Coastal and Shelf Science, 2009, 81(4): 470-480 DOI:10.1016/j.ecss.2008.12.006 |
JIANG Z J. Dynamic mechanism of sediment resuspension and its ecological effects on polyculture of shellfish and macroalgae in shallow sea. Doctoral Dissertation of Graduate University of Chinese Academy of Sciences, 2008 [蒋增杰. 浅海贝藻养殖水域沉积物再悬浮的发生机制及生态效应. 中国科学院研究生院博士研究生学位论文, 2008]
|
KASAMATSU N, KAWAGUCHI S, WATANABE S, et al. Possible impacts of zooplankton grazing on dimethylsulfide production in the Antarctic Ocean. Canadian Journal of Fisheries and Aquatic Sciences, 2004, 61(5): 736-743 DOI:10.1139/f04-072 |
KIENE R P, SLEZAK D. Low dissolved DMSP concentrations in seawater revealed by small-volume gravity filtration and dialysis sampling. Limnology and Oceanography Methods, 2006, 4(4): 80-95 DOI:10.4319/lom.2006.4.80 |
KIRST G O. Osmotic adjustment in phytoplankton and macroalgae: The use of dimethylsulfoniopropionate (DMSP). In: Kiene RP, Visscher PT, Keller MD, et al. Biological environment chemistry of DMSP and related sulfonium compounds. New York: Plenum Press, 1996, 121-130
|
KWINT R L J, IRIGOIEN X, KRAMER K J M. Copepods and DMSP. In: Kiene RP, Visscher PT, Keller MD, et al. Biological and environmental chemistry of DMSP and related sulfonium compounds. New York: Plenum Press, 1996, 239-252
|
LECK C, LARSSON U, BÅGANDER L E, et al. Dimethyl sulfide in the Baltic Sea: Annual variability in relation to biological activity. Journal of Geophysical Research Oceans, 1990, 95(C3): 3353-3363 DOI:10.1029/JC095iC03p03353 |
LI C X, WANG B D, YANG G P, et al. Occurrence and turnover of biogenic sulfur in the Bering Sea during summer. Journal of Geophysical Research: Oceans, 2017, 122(11): 8567-8592 DOI:10.1002/2017JC013299 |
LING W K, HUANG H W, LIU B, et al. Mercury and cadmium resistance and enrichment mechanism of mussel foot fibroin. Journal of Shenzhen University Science and Engineering, 2019, 36(4): 361-366 [凌文康, 黄慧炜, 刘冰, 等. 贻贝足丝蛋白的汞、镉抗性及富集机制. 深圳大学学报(理工版), 2019, 36(04): 361-366] |
MALIN G, LISS P S, TURNER S M. Dimethyl sulphide: production and atmospheric consequences. In: Green JC, Leadbeater BSC. The hapotophyte algae. Oxford: Clarendon Press, 1994, 303-320
|
REN L H. Research on carbon sequestration of cultured oyster Crassostrea giga and its fouling organisms in Sanggou Bay. Doctoral Dissertation of Graduate University of Chinese Academy of Sciences, 2014 [任黎华. 桑沟湾筏式养殖长牡蛎及其主要滤食性附着生物固碳功能研究. 中国科学院研究生院博士研究生学位论文, 2014]
|
WANG P B, SONG J M, GUO Z Y, et al. The inducements of resuspention of sea surface sediment and their effects on recycle of biogenic elements. Marine Sciences, 2005, 29(10): 77-80 [王丕波, 宋金明, 郭占勇, 等. 海洋表层沉积物再悬浮的诱因及其对生源要素循环的影响. 海洋科学, 2005, 29(10): 77-80 DOI:10.3969/j.issn.1000-3096.2005.10.018] |
WOLFE G V, STEINKE M. Grazing-activated production of dimethyl sulfide (DMS) by two clones of Emiliania huxleyi. Limnology and Oceanography, 1996, 41(6): 1151-1160 DOI:10.4319/lo.1996.41.6.1151 |
YANG G P, LI C X. Biologic processes that influence the production of dimethylsulfide (DMS) from marine phytoplankton. Periodical of Ocean University of China (Natural Science)., 2009, 39(3): 453-460, 542 [杨桂朋, 厉丞烜. 海洋生物对二甲基硫生产的控制作用研究. 中国海洋大学学报(自然科学版), 2009, 39(3): 453-460, 542] |
YIN Y X. Study of shallow water "a characteristics" based on marine seismology. Doctoral Dissertation of Ocean University of China, 2012 [尹燕欣. 基于海洋地震学的浅海水体特征研究. 中国海洋大学博士研究生学位论文, 2012]
|
ZHANG Y. Influence of zooplankton grazing on the production and transfer of dimethylsulfide. Master's Thesis of Ocean University of China, 2012 [张瑜. 浮游动物摄食对二甲基硫产生和转移的影响. 中国海洋大学硕士研究生学位论文, 2012]
|
ZHOU Y, YANG H S, ZHANG F S. Biodeposition by seawater bivalve mollusk. Marine Sciences, 2003, 27(2): 23-26 [周毅, 杨红生, 张福绥. 海水双壳贝类的生物沉积及其生态效应. 海洋科学, 2003, 27(2): 23-26 DOI:10.3969/j.issn.1000-3096.2003.02.008] |



