2. 中国水产科学研究院黄海水产研究所 农业农村部海水养殖病害防治重点实验室 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266071;
3. 中国海洋大学三亚海洋研究院 海南 三亚 572000;
4. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Maricultural Organism Disease Control, Ministry of Agriculture and Rural Affairs; Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266071, China;
3. Sanya Ocean Institute, Ocean University of China, Sanya, Hainan 572000, China;
4. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
细菌向外界环境或宿主进行物质输送是通过蛋白分泌系统跨膜转运蛋白实现的。在革兰氏阴性细菌(G–)中已发现6种蛋白分泌系统(Holland, 2010)。其中,Ⅵ型分泌系统(T6SS)于2006年首次在霍乱弧菌(Vibrio cholerae)中发现(Pukatzki et al, 2006),其结构类似于倒置的T4噬菌体(Boyer et al, 2009),广泛存在于不同种类的细菌中。T6SS的结构组成在不同细菌间存在差异,但其核心结构均由至少13个蛋白组成,组装成类似“注射器”的跨膜结构(Aksyuk et al, 2009)。其中,溶血素共调节蛋白(Hcp)与缬氨酸–甘氨酸重复蛋白G (VgrG)既是T6SS的结构蛋白,也是T6SS的分泌蛋白,它们形成“注射器”的针尖,可刺穿靶细胞的细胞膜,将效应蛋白释放进靶细胞或周围环境中(Pukatzki et al, 2009),以实现T6SS在细菌的种间竞争(Pukatzki et al, 2009; Dana et al, 2010; Basler et al, 2013; Hood, 2010)、与其他细菌相互作用、提高自身环境适应性及适应外界环境变化等功能(Aschtgen et al, 2008; Weber et al, 2009; Schwarz et al, 2010; Murdoch et al, 2011)。因此,Hcp或VgrG的分泌与否代表了T6SS是否发挥了功能。T6SS功能的发挥受多种因素调控,包括磷酸化机制、密度感应系统(quorum sensing, QS)、铁离子、σ因子、环境因子及胆盐(Hsu et al, 2009; Sheng et al, 2012; Casabona et al, 2013; Salomon et al, 2013; Burtnick et al, 2013; Shao et al, 2014; 王晓冉, 2017)等。
鳗弧菌(Vibrio anguillarum)生存于各种海洋环境中,同时也是多种海洋生物的正常菌群之一,因此,
适应不同的海洋环境是其生存的重要机制。研究发现,密度感应系统、RpoS等因子在鳗弧菌的菌膜形成和存活中发挥作用(Croxatto et al, 2002; Buch et al, 2003; Weber et al, 2008)。进一步研究发现,T6SS在调控鳗弧菌的QS和应激反应中发挥作用(Weber et al, 2009)。我们通过全基因组序列测定和分析,发现不同的鳗弧菌菌株存在不同拷贝的T6SS。比如,致病株M3的基因组具有2套T6SS,分别分布在染色体Ⅰ和染色体Ⅱ上(Li, 2013),而非致病株MHK3仅在染色体Ⅱ上有1套T6SS。在M3的胞内胞外均未检测到Hcp (Li, 2013);相反,在MHK3的胞内胞外均可检测到Hcp,并发现Hcp的分泌影响MHK3对其他细菌的杀菌活力(Tang, 2016)。以上发现说明,不同鳗弧菌菌株在T6SS的表达和功能上存在差异。rpoS编码RpoS因子,又叫σS,是RNA聚合酶的σ亚基,是一种广泛性调节因子,在细菌的生长、应激反应中发挥重要作用(Tian et al, 2008)。研究发现,在大肠杆菌(Escherichia coli)基因组中,23%的基因受到RpoS的调控(Wong et al, 2017)。在鳗弧菌和假结核耶尔森氏菌(Yersinia pseudotuberculosis)中,RpoS参与了T6SS的调控(Weber et al, 2009; Guan et al, 2015)。为了明确RpoS是否参与调控鳗弧菌T6SS的表达,本研究构建了鳗弧菌MHK3的rpoS突变株,检测了该突变株的表型特征及其Hcp在转录和翻译水平上的表达情况,并探究了该突变株的杀菌活性,以进一步认识rpoS的调控机制及鳗弧菌T6SS在环境适应中的作用机制。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和培养条件本实验所使用的菌株和质粒及相关信息见表 1。大肠杆菌的培养基为LB,培养条件为37℃、150 r/min;鳗弧菌的培养基为TSB或TSA,培养条件为28℃、150 r/min;杀菌实验所用培养基为含3% NaCl的LB培养基。根据实验需要,培养基中添加的抗生素浓度分别为氯霉素(Cm) 10 μg/mL、氨苄青霉素(Amp) 50 μg/mL、卡那霉素(Km) 50 μg/mL、利福平(Rif) 200 μg/mL。
|
|
表 1 实验所用的菌株和质粒 Tab.1 The strains and plasmids used in this study |
Taq酶、限制性内切酶和T4连接酶等购自TaKaRa;质粒提取试剂盒和胶回收试剂盒购自OMEGA;戊二醛固定液和ONPG (o-nitrophenyl-ß-D-galactopyranoside)购自Solarbio公司;2%的磷钨酸购自北京中镜科仪;大鼠抗Hcp抗体为本实验室前期制备,小鼠抗RNAP购自Santa Cruz公司,辣根过氧化物酶标记山羊抗小鼠IgG和山羊抗大鼠IgG购自中杉金桥。生物恒温培养箱购自上海一恒,低温离心机购自德国Eppendorf公司,PCR仪购自美国Life生物公司,电转杯、电转仪购自美国Bio-Rad公司。
1.2 MHK3∆rpoS突变株的构建通过Overlap PCR (Ho et al, 1989)获得rpoS基因缺失片段DrpoS,然后通过二次同源重组方法(O'toole et al, 1997)获得∆rpoS突变株,所用引物见表 2。首先,以MHK3基因组DNA为模板,用引物MHK3-rpoS- dele-for/MHK3-rpoS-int-rev和MHK3-rpoS-int-for/MHK3- rpoS-dele-rev分别进行PCR扩增获得rpoS的上游、下游同源臂片段。将上下游同源臂PCR产物混合作为模板,以引入KpnI酶切位点的引物MHK3-rpoS- dele-for/rev进行PCR,将上下游同源臂连接,得到缺失rpoS基因内25~859 bp的片段DrpoS。将该片段与自杀质粒pRE112连接,得到pRE112重组子,再将该重组子依次电转到感受态细胞SM10和S17-1中。S17-1 (pRE112-DrpoS)作为接合供体菌株,与受体菌MHK3进行接合实验。以蔗糖–氯霉素平板筛选阳性克隆,最后以引物MHK3-rpoS-dele-for/rev对阳性克隆进行PCR,对产物测序,确认突变株构建成功。
|
|
表 2 本研究所用引物 Tab.2 Primers used in this study |
通过携带lacZ报告基因的pVIK112质粒,构建MHK3ΔrpoS的lacZ融合菌株:MHK3lacZ: : hcp1ΔrpoS和MHK3lacZ: : hcp2ΔrpoS。以MHK3lacZ: : hcp1ΔrpoS的构建为例,以MHK3基因组DNA为模板,以引物MHK3-hcp1-lacZ-for/rev进行PCR扩增,获得hcp1同源臂DNA片段,将该同源臂DNA片段与pVIK112质粒连接,得到pVIK112重组子。将该重组子依次电转至感受态细胞MC1061和S17-1中。S17-1 (pVIK112- hcp1)作为接合供体菌株,与受体菌ΔrpoS进行接合实验,将lacZ插入到ΔrpoS的hcp1的启动子区域,利用pVIK112载体的卡那霉素抗性(Kmr)筛选阳性克隆。以引物MHK3-hcp1-lacZ-for/lacZ-rev对阳性克隆进行PCR并测序确认。用同样的方法构建了MHK3lacZ: : hcp2ΔrpoS。
1.4 MHK3和MHK3∆rpoS的表型检测对鳗弧菌MHK3和MHK3∆rpoS的生长情况、菌体形态、泳动性、胞外酶分泌及菌膜形成能力等表型特征进行检测。进行生长曲线测定时,将过夜培养的MHK3和MHK3∆rpoS的菌液调节至OD540 nm = 0.5,以1∶100的比例转接至盛有200 mL新鲜TSB培养基的三角瓶中,每株菌设3个平行,于28℃摇床培养。在不同时间点测定培养液的OD540 nm;每个平行取3个样品测量,将每个时间点测得的OD540 nm取平均值,绘制生长曲线。
进行透射电镜形态观察时,采用磷钨酸负染色法制备样品。将过夜培养的MHK3和MHK3∆rpoS的菌液于1000 r/min离心5 min,弃上清液后,以无菌PBS重悬菌体沉淀,滴入2~4 mL 0.5%戊二醛固定液,于4℃固定30 min。低速离心后,用无菌水轻轻吹洗,制成菌悬液。用倒置法将铜网倒扣在菌液上,静置数分钟,用滤纸吸去多余的液体,滴加2%的磷钨酸,染色1~2 min后,用滤纸吸去染液,待干后用于电镜观察。
以含0.3%琼脂的TSA平板测定细菌的泳动性,在接种后24 h和30 h测量泳动圈直径;以含1%明胶的2216E平板检测胞外明胶酶活性,在接种后24 h和48 h时测定明胶酶透明圈直径;以含1%脱脂奶粉的酪蛋白平板检测酪蛋白酶的产生(郭东升, 2009)。在接种后48 h和72 h时,测定酪蛋白酶透明圈的直径。按照郝彬(2012)的方法,检测菌膜形成能力,使用96孔细胞培养板培养细菌,在培养至8 h和24 h时分别取出,吸弃培养基,得到粘附在培养板上的菌膜。依次进行固定、1%结晶紫染色、95%乙醇脱色,测定OD595 nm。上述实验每株菌至少设置3个平行,每个平行至少取样3次。
1.5 β-半乳糖苷酶活性的测定用ONPG方法(Zheng et al, 2007)对鳗弧菌MHK3lacZ: : hcp1ΔrpoS和MHK3lacZ: : hcp2ΔrpoS进行β-半乳糖苷酶活性的测定。将过夜培养的菌液调节至OD540 nm=0.5,以1∶100的比例转接至新鲜的TSB培养基中,于28℃摇床中培养,每株菌设3个平行。在培养至3、6、12、24、36、72和96 h时,取适量菌液,将菌液浓度调节至OD540 nm为0.5,用于检测β-半乳糖苷酶活性。每分钟水解ONPG的数量为酶活性单位。
1.6 Western blot检测Hcp以Western blot检测鳗弧菌MHK3及MHK3∆rpoS的Hcp表达和分泌情况。菌液培养方法及取样时间同1.5。用TCA-丙酮沉淀法(Beuzón et al, 1999)提取细菌的胞内蛋白(ICP)和胞外蛋白(ECP)。取10 μL蛋白样品进行SDS-PAGE电泳,电转至PVDF膜上,以大鼠抗Hcp抗体为一抗,辣根过氧化物酶标记的山羊抗大鼠IgG为二抗,进行蛋白杂交,检测Hcp。以RNAP (RNA polymerase)蛋白作为检测胞内蛋白的内参,检测时用小鼠抗RNAP为一抗,辣根过氧化物酶标记的山羊抗小鼠IgG为二抗。最后用ECL化学发光方法对PVDF膜进行显色曝光。采用ImageJ图像分析软件对蛋白条带结果进行分析。
1.7 抑菌检测鳗弧菌野生株MHK3具有杀菌能力(Tang et al, 2016)。为了确定∆rpoS突变株的杀菌能力是否受到影响,以大肠杆菌E5为靶细胞比较MHK3和MHK3∆rpoS的杀菌能力。参考Tang等(2016)的方法进行细菌接触抑制实验。将过夜培养的菌液调节至OD540 nm为0.5,按照鳗弧菌∶大肠杆菌=4∶1 (V∶V)的比例混合菌液,制备实验组共培养体系(MHK3+E5和MHK3∆rpoS+E5);按照鳗弧菌∶PBS=4∶1和PBS∶大肠杆菌=4∶1的比例混合菌液,制备空白组共培养体系(MHK3+PBS、MHK3∆rpoS+PBS和PBS+E5)。取各体系菌液25 μL,点接于MLB平板上,于28℃培养4 h,用PBS洗下菌苔,混匀后进行梯度稀释,将适宜稀释度的菌液分别涂布于TSA+Amp和LB+Rif平板,测定鳗弧菌和大肠杆菌E5的数量。上述实验进行3次重复,每个共培养体系设置3组平行。
2 结果与分析 2.1 菌株的构建和表型检测 2.1.1 菌株的构建实验扩增得到了DrpoS,完成pRE112重组子的构建,通过电转化以及接合实验进行了二次同源重组,经PCR筛选得到突变株的阳性克隆并测序验证,最终得到rpoS基因的25~879 bp部分缺失的MHK3∆rpoS突变株。实验也扩增得到hcp1和hcp2同源臂DNA片段,分别与pVIK112质粒连接得到重组子,经电转化和接合实验,最终获得目的菌株MHK3lacZ: : hcp1ΔrpoS和MHK3lacZ: : hcp2ΔrpoS。
2.1.2 生长曲线的测定在TSB培养基正常培养条件下,测定本实验构建的∆rpoS突变株、融合株与野生型MHK3的生长情况,统计结果绘制生长曲线(图 1)。4株实验菌株在各生长阶段的生长趋势及速度非常接近,数据分析显示,菌株之间不具有显著性差异(P > 0.05)。说明在正常培养条件下,rpoS基因的敲除及lacZ报告基因的插入均未对MHK3的生长产生显著影响。
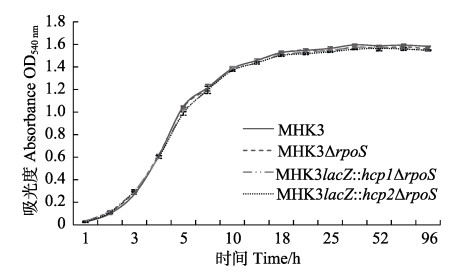
|
图 1 实验菌株的生长曲线 Fig.1 The growth curves of strains |
利用透射电镜观察菌株的细胞形态。电镜照片显示,∆rpoS突变株的细胞形态和大小与MHK3野生菌株相比均无明显变化,均存在正常的、单一的极性鞭毛,单个菌体形态如图 2所示。说明rpoS的缺失未对MHK3的细胞形态特征产生明显影响。

|
图 2 MHK3(A)及MHK3ΔrpoS(B)的透射电镜照片 Fig.2 Transmission electron micrographs of MHK3 (A) and MHK3ΔrpoS (B) |
分别对鳗弧菌MHK3野生株和∆rpoS突变株的泳动圈直径、明胶酶透明圈直径及酪蛋白酶透明圈直径进行测量并进行数据统计。结果显示,∆rpoS突变株与MHK3野生株在泳动性、明胶酶活性和酪蛋白酶活性上均无显著性差异(P > 0.05),说明在鳗弧菌MHK3株中rpoS对这3种表型特征无显著影响。
2.1.5 菌膜形成能力检测对野生株MHK3及∆rpoS突变株的菌膜形成能力检测结果如图 3所示。在培养至8 h即对数生长期,二者的菌膜形成情况无显著性差异(P > 0.05);而在24 h即平台早期时,∆rpoS突变株的菌膜形成能力比野生株MHK3有显著上升(P < 0.01)。说明在平台早期的鳗弧菌MHK3中,rpoS对菌膜的形成发挥一定的负调控作用。
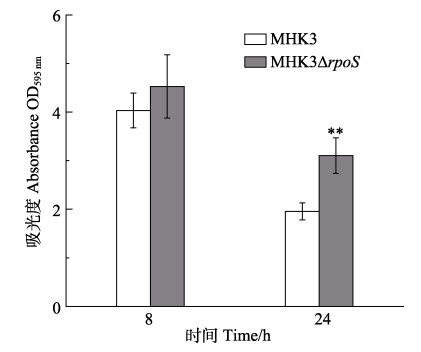
|
图 3 MHK3及MHK3ΔrpoS的菌膜形成能力检测 Fig.3 Test of biofilm production of MHK3 and MHK3ΔrpoS **代表差异极显著(P < 0.01)。下同 ** represents highly significant difference (P < 0.01). The same as below |
对MHK3lacZ: : hcp1/hcp2和MHK3lacZ: : hcp1/hcp2ΔrpoS进行β-半乳糖苷酶活性的测定结果见图 4。由图 4A可看出,MHK3lacZ: : hcp1ΔrpoS在检测的每个时间点的β-半乳糖苷酶活性均显著高于MHK3lacZ: : hcp1 (P < 0.01),在12 h和36 h时(对数生长期和平台期)均达到1.79倍。由图 4B可看出,MHK3lacZ: : hcp2ΔrpoS在各时间点的β-半乳糖苷酶活性也显著高于MHK3lacZ: : hcp2 (P < 0.01),在36 h (生长平台期)时,达到1.94倍。表明rpoS对鳗弧菌MHK3中hcp1和hcp2的转录发挥一定的负调控作用。
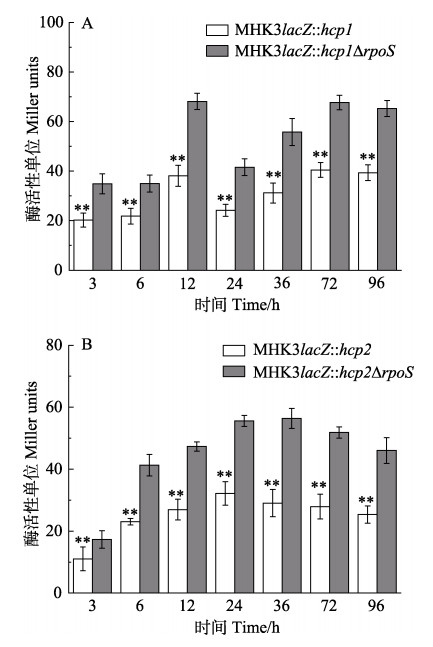
|
图 4 β-半乳糖苷酶活性测定结果 Fig.4 Results of β-galactosidase activity assay A:MHK3lacZ: : hcp1和MHK3lacZ: : hcp1ΔrpoS的β-半乳糖苷酶酶活;B:MHK3lacZ: : hcp2和MHK3lacZ: : hcp2ΔrpoS的β-半乳糖苷酶酶活 A: β-galactosidase activity assay of MHK3lacZ: : hcp1 and MHK3lacZ: : hcp1ΔrpoS; B: β-galactosidase activity assay of MHK3lacZ: : hcp2 and MHK3lacZ: : hcp2ΔrpoS. * represents significant difference (P < 0.05) |
通过Western blot检测鳗弧菌MHK3及MHK3∆rpoS的Hcp胞内表达和胞外分泌情况,结果如图 5所示。图 5A为胞内Hcp的检测结果,在6、12、24、36和72 h时,MHK3及MHK3∆rpoS均有Hcp蛋白表达。

|
图 5 rpoS对鳗弧菌MHK3不同生长时期Hcp表达的影响 Fig.5 Effects of gene rpoS on the expression of Hcp in different growth periods of V. anguillarum MHK3 A和C:菌株不同生长时期的胞内Hcp蛋白含量;B和D:菌株不同生长时期的胞外Hcp蛋白含量。*代表差异显著(P < 0.05)。下同 A and C: Hcp protein content in intracellular proteins of each strain during growth period; B and D: Hcp protein content in extracellular proteins of various growth stages of strains. The same as below |
在3 h即对数生长前期,2株菌的Hcp表达较少。随着细菌的生长,Hcp的表达开始增多并趋于稳定,在72 h即平台末期开始逐渐减少。定量分析结果见图 5C,在6、12和24 h (对数生长期,平台早期),∆rpoS突变株的Hcp表达量显著高于野生株MHK3 (P < 0.05),24 h时达1.59倍。图 5B为胞外分泌Hcp的检测结果,在6和12 h (对数生长期)分泌的Hcp较多,细菌生长到24 h (平台早期)后,分泌的Hcp开始减少,到72和96 h (平台末期,衰退期)几乎检测不到分泌的Hcp。定量分析结果见图 5D,在6和12 h (对数生长期)时,∆rpoS突变株的Hcp表达量显著高于野生株(P < 0.05),12 h时达1.31倍。以上结果表明,rpoS对对数生长期和平台早期的鳗弧菌MHK3的Hcp蛋白表达和分泌具有一定的负调控作用。
2.4 细菌拮抗实验鳗弧菌MHK3株具备氨苄青霉素抗性,而对利福平敏感;靶细菌大肠杆菌E5对氨苄青霉素敏感,而具备利福平抗性。故涂布于TSA+Amp平板上得到的是杀菌实验后鳗弧菌MHK3的数量,LB+Rif平板上得到的是靶细菌大肠杆菌E5的数量,结果如图 6所示。在MHK3+E5的作用体系中,MHK3杀菌后的数量与对照组相比有极显著增长(P < 0.01);同时,杀菌实验后,靶细菌E5的数量与对照组相比极显著降低(P < 0.01),其存活率不到对照组的百万分之一(图 6A);在MHK3∆rpoS+E5的作用体系中,MHK3∆rpoS杀菌实验后的数量与对照组相比也有极显著增长(P < 0.01),同时,靶细菌E5的数量也较对照组显著降低(P < 0.01),存活率为对照组的万分之一(图 6B)。
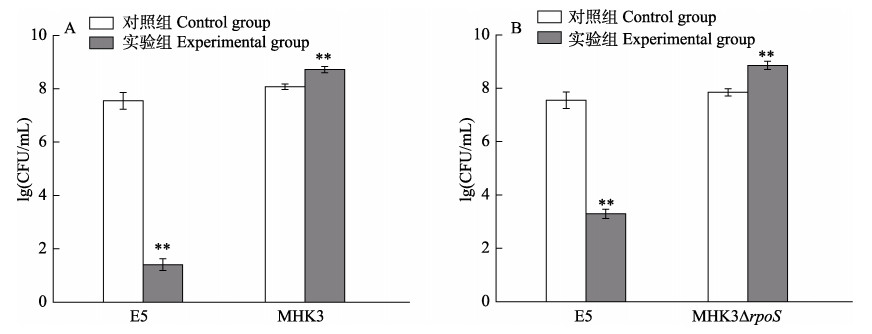
|
图 6 鳗弧菌对大肠杆菌E5的杀菌作用 Fig.6 V. anguillarum display bactericidal activity towards E.coil E5 A:鳗弧菌野生株MHK3+大肠杆菌E5;B:鳗弧菌突变株MHK3ΔrpoS+大肠杆菌E5 A: V. anguillarum wild-type strain MHK3+E. coli E5; B: V. anguillarum mutant MHK3ΔrpoS+E. coli E5 |
以上实验结果显示,在与大肠杆菌E5的混合培养体系中,鳗弧菌MHK3及突变株MHK3∆rpoS对大肠杆菌E5均具有显著杀菌能力,且同时维持自身在混合培养体系的数量优势。但通过比较与野生株MHK3和突变株MHK3∆rpoS混合培养的靶细菌E5的存活率,发现rpoS的缺失使鳗弧菌MHK3对靶细菌大肠杆菌E5的杀菌能力显著降低到原来的1% (P < 0.01)。以上结果表明,rpoS参与调控鳗弧菌MHK3的杀菌能力,并发挥一定的正调控作用。
3 讨论鳗弧菌为革兰氏阴性菌,是海水环境中广泛存在的正常菌群,也是水生生物肠道微生物的正常组成部分。但在水产养殖中,当养殖密度过高或水体环境变差时,鳗弧菌极易被诱导成致病菌,可感染鱼类、双壳贝类及甲壳动物等(Paillard et al, 2004; Aguirre-Guzmán et al, 2004)。目前,对于鳗弧菌的具体致病机制和环境适应机制的探究还不够完善。唐磊(2016)研究发现,在鳗弧菌非致病株MHK3中具有一套正常表达的T6SS。岳舒(2015)研究表明,环境因子(温度、盐度及pH)对MHK3的Hcp合成及分泌具有调控作用,密度感应系统调节因子luxO正调控Hcp的分泌,但抑制T6SS的表达。而tsrA对MHK3中的Hcp和T6SS均具有负调控作用(唐磊, 2016)。以上luxO和tsrA对MHK3的T6SS的调控同在霍乱弧菌中的调控作用是相反的(Ma et al, 2009),表明不同弧菌、不同菌株为了提高自身对环境的适应性,对T6SS的调控机制也在不断进化,产生差异。
鳗弧菌MHK3中的rpoS含有1002 bp的开放阅读框,编码334个氨基酸残基,蛋白质分子量约为38 kDa。本研究构建了MHK3ΔrpoS及其lacZ融合菌株,检测了对菌株适应外界环境较重要的部分表型特征。结果显示,ΔrpoS突变株与MHK3野生株相比并无显著性差异,而在鳗弧菌致病株M3中,rpoS的缺失对细菌的生长速度、泳动性以及明胶酶、酪蛋白酶的活性等均出现不同程度的影响(郭东升, 2009; 郝彬, 2012)。Tian等(2008)在溶藻弧菌(Vibrio alginolyticus)的研究中也发现,rpoS的缺失对细菌的明胶酶活性和酪蛋白酶活性等有影响。据此分析,本实验是在营养丰富、温度适宜的培养条件下进行,菌株不具有毒力作用,也未受到外界环境的胁迫,在这种情况下,rpoS对部分表型特征的影响较小。但在菌膜形成能力上,平台早期的MHK3ΔrpoS较MHK3有显著上升,说明rpoS对平台早期的MHK3的菌膜形成能力发挥负调控作用。在大肠杆菌的研究中也同样发现,rpoS对菌膜的形成能力具有负调控作用(Sheldon et al, 2012)。这仍然与郝彬(2012)在鳗弧菌致病株M3中的结果相反。以上分析说明,在不同菌株中,rpoS对同种表型的调控有所不同,也表明了具有不同特性的菌株在适应不同或相同的环境时,会进化出不同的调控机制。
在β-半乳糖苷酶活性实验中,鳗弧菌MHK3ΔrpoS的hcp1在12和36 h时(对数生长期,平台期)的转录水平是野生株MHK3的1.79倍,hcp2在36 h时(生长平台期)的转录水平是野生株MHK3的1.94倍。说明rpoS对鳗弧菌MHK3中hcp1和hcp2的转录具有负调控作用。在翻译水平上,平台期的MHK3ΔrpoS在胞内和胞外Hcp的表达和分泌上均有显著增加,在12 h (对数生长期)时,突变株胞外蛋白的分泌是野生株的1.31倍,在24 h (平台早期)时,突变株胞内蛋白表达量是野生株的1.59倍,表明rpoS对平台期MHK3的Hcp蛋白表达和分泌也具有负调控作用。而在杀菌实验中,MHK3ΔrpoS的杀菌能力仅为野生株MHK3的1%,说明rpoS对鳗弧菌的杀菌能力具有一定的正调控作用,这与rpoS对hcp1/2的调控作用相反。结合唐磊(2016)的研究结果,即Hcp是鳗弧菌MHK3发挥杀菌作用的必要条件,在本研究中,rpoS虽然对Hcp的转录和翻译发挥一定的负调控作用,但并未完全抑制Hcp的表达和分泌,菌株仍然具有发挥杀菌作用的条件,但杀菌作用的强弱并非与Hcp的表达和分泌量正相关。故推测,在鳗弧菌MHK3中杀菌作用的强弱变化更可能是rpoS通过对T6SS2基因簇的调控或对具有杀菌效应因子的调控实现的。有关机制还需进一步探究。
AGUIRRE-GUZMÁN G, RUÍZ H M, ASCENCIO F. A review of extracellular virulence product of Vibrio species important in diseases of cultivated shrimp. Aquaculture Research, 2004, 35(15): 1395-1404 DOI:10.1111/j.1365-2109.2004.01165.x |
AKSYUK A A, LEIMAN P G, KUROCHKINA L P, et al. The tail sheath structure of bacteriophage T4: A molecular machine for infecting bacteria. EMBO Journal, 2009, 28(7): 821-829 DOI:10.1038/emboj.2009.36 |
ASCHTGEN M S, BERNARD C S, DE BENTZMANN S, et al. SciN is an outer membrane lipoprotein required for type Ⅵ secretion in enteroaggregative Escherichia coli. Journal of Bacteriology, 2008, 190(22): 7523-7531 DOI:10.1128/JB.00945-08 |
BASLER M, HO B T, MEKALANOS J J. Tit-for-tat, type Ⅵ secretion system counterattack during bacterial cell-cell interactions. Cell, 2013, 152(4): 884-894 DOI:10.1016/j.cell.2013.01.042 |
BEUZÓN C R, BANKS G, DEIWICK J, et al. pH-dependent secretion of SseB, a product of the SPI-2 type Ⅲ secretion system of Salmonella typhimurium. Molecular Microbiology, 1999, 33(4): 806-816 DOI:10.1046/j.1365-2958.1999.01527.x |
BOYER F, FICHANT G, BERTHOD J, et al. Dissecting the bacterial type Ⅵ secretion system by a genome wide in silico analysis: What can be learned from available microbial genomic resources?. BMC Genomics, 2009, 10: 104 DOI:10.1186/1471-2164-10-104 |
BUCH C, SIGH J, NIELSEN J, et al. Production of acylated homoserine lactones by different serotypes of Vibrio anguillarum both in culture and during infection of rainbow trout. Systematic and Applied Microbiology, 2003, 26(3): 338-349 DOI:10.1078/072320203322497365 |
BURTNICK M N, BRETT P J. Burkholderia mallei and Burkholderia pseudomallei cluster 1 type Ⅵ secretion system gene expression is negatively regulated by iron and zinc. PLoS One, 2013, 8(10): e76767 DOI:10.1371/journal.pone.0076767 |
CASABONA M G, SILVERMAN J M, SALL K M, et al. An ABC transporter and an outer membrane lipoprotein participate in post translational activation of type Ⅵ secretion in Pseudomonas aeruginosa. Environmental Microbiology, 2013, 15(2): 471-486 DOI:10.1111/j.1462-2920.2012.02816.x |
CROXATTO A, CHALKER V J, LAURITZ J, et al. VanT, a homologue of Vibrio harveyi LuxR, regulates serine, metalloprotease, pigment, and biofilm production in Vibrio anguillarum. Journal of Bacteriology, 2002, 184(6): 1617-1629 DOI:10.1128/JB.184.6.1617-1629.2002 |
EDWARDS R A, KELLER L H, SCHIFFERLI D M. Improved allelic exchange vectors and their use to analyze 987P fimbria gene expression. Gene, 1998, 207(2): 149-157 DOI:10.1016/S0378-1119(97)00619-7 |
GUAN J Y, XIAO X, XU S J, et al. Roles of RpoS in Yersinia pseudotuberculosis stress survival, motility, biofilm formation and type Ⅵ secretion system expression. Journal of Microbiology, 2015, 53(9): 633-642 DOI:10.1007/s12275-015-0099-6 |
GUO D S. A study on the rpoS function of Vibrio anguillarum. Masterxs Thesis of Institute of Oceanology, Chinese Academy of Sciences, 2009 [郭东升. 鳗弧菌rpoS功能的研究. 中国科学院海洋研究所硕士研究生学位论文, 2009]
|
HAO B. Research on the function and regulation of type Ⅵ secretion system (T6SS) in Vibrio anguillarum. Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2012 [郝彬. 鳗弧菌Ⅵ型分泌系统(T6SS)的功能及调控研究. 中国科学院海洋研究所博士研究生学位论文, 2012]
|
HO S N, HUNT H D, HORTON R M, et al. Site-directed mutagenesis by overlap extension using the polymerase chain-reaction. Gene, 1989, 77(1): 51-59 DOI:10.1016/0378-1119(89)90358-2 |
HOLLAND I B. The extraordinary diversity of bacterial protein secretion mechanisms. Methods in Molecular Biology, 2010, 619: 1-20 |
HOOD R D, SINGH P, HSU F S, et al. A type Ⅵ secretion system of Pseudomonas aeruginosa targets a toxin to bacteria. Cell Host and Microbe, 2010, 7(1): 25-37 DOI:10.1016/j.chom.2009.12.007 |
HSU F S, SCHWARZ S, MOUGOUS J D. TagR promotes PpkA-catalysed type Ⅵ secretion activation in Pseudomonas aeruginosa. Molecular Microbiology, 2009, 72(5): 1111-1125 DOI:10.1111/j.1365-2958.2009.06701.x |
KALOGERAKI V S, WINANS S C. Suicide plasmids containing promoterless reporter genes can simultaneously disrupt and create fusions to target genes of diverse bacteria. Gene, 1997, 188(1): 69-75 DOI:10.1016/S0378-1119(96)00778-0 |
LI G Y, MO Z L, LI J, et al. Complete genome sequence of Vibrio anguillarum M3, a serotype O1 strain isolated from Japanese flounder in China. Genome Announcements, 2013, 1(5): e00769-13 |
MA L S, LIN J S, LAI E M. An IcmF family protein, ImpLM, is an integral inner membrane protein interacting with ImpKL, and its walker a motif is required for typeⅥ secretion system-mediated Hcp secretion in Agrobacterium tumefaciens. Journal of Bacteriology, 2009, 191(13): 4316-4329 DOI:10.1128/JB.00029-09 |
MACINTYRE D L, MIYATA S T, KITAOKA M, et al. The Vibrio cholerae type Ⅵ secretion system displays antimicrobial properties. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(45): 19520-19524 DOI:10.1073/pnas.1012931107 |
MILLER V L, MEKALANOS J J. A novel suicide vector and its use in construction of insertion mutations: Osmoregulation of outer membrane proteins and virulence determinants in Vibrio cholerae requires toxR. Journal of Bacteriology, 1988, 170(6): 2575-2583 DOI:10.1128/jb.170.6.2575-2583.1988 |
MURDOCH S L, TRUNK K, ENGLISH G, et al. The opportunistic pathogen Serratia marcescens utilizes type Ⅵ secretion to target bacterial competitors. Journal of Bacteriology, 2011, 193(21): 6057-6069 DOI:10.1128/JB.05671-11 |
O'TOOLE R, MILTON D L, HORSTEDT P, et al. RpoN of the fish pathogen Vibrio (Listonella) anguillarum is essential for flagellum production and virulence by the water-borne but not intraperitoneal route of inoculation. Microbiology, 1997, 143(12): 3849-3859 DOI:10.1099/00221287-143-12-3849 |
PAILLARD C, LEROUX F, BORREGO J J. Bacterial disease in marine bivalves, review of recent studies: Trends and evolution. Aquatic Living Resources, 2004, 17(4): 477-498 DOI:10.1051/alr:2004054 |
PUKATZKI S, MA A T, STURTEVANT D, et al. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533 DOI:10.1073/pnas.0510322103 |
PUKATZKI S, MCAULEY S B, MIYATA S T. The type Ⅵ secretion system: Translocation of effectors and effector- domains. Current Opinion in Microbiology, 2009, 12(1): 11-17 DOI:10.1016/j.mib.2008.11.010 |
RUBIRÉS X, SAIGI F, PIQUÉ N, et al. A gene (wbbL) from Serratia marcescens N28b (O4) complements the rfb-50 mutation of Escherichia coli K-12 derivatives. Journal of Bacteriology, 1997, 179(23): 7581-7586 DOI:10.1128/jb.179.23.7581-7586.1997 |
SALOMON D, GONZALEZ H, UPDEGRAFF B L, et al. Vibrio parahaemolyticus type Ⅵ secretion system 1 is activated in marine conditions to target bacteria, and is differentially regulated from system 2. PLoS One, 2013, 8(4): e61086 DOI:10.1371/journal.pone.0061086 |
SCHWARZ S, WEST T E, BOYER F, et al. Burkholderia type Ⅵ secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathogens, 2010, 6(8): e1001068 DOI:10.1371/journal.ppat.1001068 |
SHAO Y, BASSLER B L. Quorum regulatory small RNAs repress type Ⅵ secretion in Vibrio cholerae. Molecular Microbiology, 2014, 92(5): 921-930 DOI:10.1111/mmi.12599 |
SHELDON J R, YIM M S, SALIBA J H, et al. Role of rpoS in biofilm development and survival of Escherichia coli O157: H7 strain H32. Applied and Environmental Microbiology, 2012, 78(23): 8331-8339 DOI:10.1128/AEM.02149-12 |
SHENG L L, GU D, WANG Q Y, et al. Quorum sensing and alternative sigma factor RpoN regulate type Ⅵ secretion system I (T6SSVA1) in fish pathogen Vibrio alginolyticus. Archives of Microbiology, 2012, 194(5): 379-390 DOI:10.1007/s00203-011-0780-z |
SIMON R, PRIEFER U, PÜHLER A. A broad host range mobilization system for in vivo genetic engineering: Transposon mutagenesis in gram negative bacteria. Nature Biotechnology, 1983, 1(9): 784-791 DOI:10.1038/nbt1183-784 |
TANG L, YUE S, LI G Y, et al. Expression, secretion and bactericidal activity of type Ⅵ secretion system in Vibrio anguillarum. Archives of Microbiology, 2016, 198(8): 751-760 DOI:10.1007/s00203-016-1236-2 |
TANG L. Expression regulation and bactericidal activity of T6SS in V. anguillarum. Masterxs Thesis of Ocean University of China, 2016 [唐磊. 鳗弧菌T6SS的表达调控及其抗菌特性的研究. 中国海洋大学硕士研究生学位论文, 2016]
|
TIAN Y, WANG Q Y, LIU Q, et al. Role of RpoS in stress survival, synthesis of extracellular autoinducer 2, and virulence in Vibrio alginolyticus. Archives of Microbiology, 2008, 190(5): 585-594 DOI:10.1007/s00203-008-0410-6 |
WANG M, LUO Z, DU H, et al. Molecular characterization of a functional type Ⅵ secretion system in Salmonella enterica serovar Typhi. Current Microbiology, 2011, 63(1): 22-31 DOI:10.1007/s00284-011-9935-z |
WANG X R. RpoN and its activator vasH regulate the type Ⅵ secretion system 2 in Vibrio anguillarum. Masterxs Thesis of Ocean University of China, 2017 [王晓冉. rpoN及其激活因子vasH对鳗弧菌T6SS2的调控. 中国海洋大学硕士研究生学位论文, 2017]
|
WEBER B, CROXATTO A, CHEN C, et al. RpoS induces expression of the Vibrio anguillarum quorum-sensing regulator VanT. Microbiology, 2008, 154(3): 767-780 DOI:10.1099/mic.0.2007/014167-0 |
WEBER B, HASIC M, CHEN C, et al. Type Ⅵ secretion modulates quorum sensing and stress response in Vibrio anguillarum. Environmental Microbiology, 2009, 11(12): 3018-3028 DOI:10.1111/j.1462-2920.2009.02005.x |
WONG G T, BONOCORA R P, SCHEP A N, et al. Genome-wide transcriptional response to varying RpoS levels in Escherichia coli K-12. Journal of Bacteriology, 2017, 199(7) |
YUE S. Functional expression of T6SS of Vibrio anguillarum MHK3 and its antibacterial properties. Masterxs Thesis of Ocean University of China, 2015 [岳舒. 鳗弧菌MHK3 T6SS的表达及抗菌特性. 中国海洋大学硕士研究生学位论文, 2015]
|
ZHENG J, LI N, TAN Y P, et al. EscC is a chaperone for the Edwardsiella tarda type Ⅲ secretion system putative translocon components EseB and EseD. Microbiology, 2007, 153(6): 1953-1962 DOI:10.1099/mic.0.2006/004952-0 |



