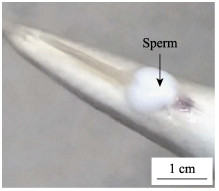
宽口裂腹鱼(Schizothorax eurystomus)隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothpracinae)、裂腹鱼属(Schizothorax),又名白条(龙见全等, 2019),其显著特征为下颚有角质,手触有较为明显的粗糙感。国外分布于阿姆河水系、锡尔河水系,国内分布于阿克苏河、渭干河、叶尔羌河、克孜勒苏河和伊犁河,是塔里木河水系的土著鱼类、新疆特有经济鱼类。由于人为和环境变化等原因,宽口裂腹鱼的数量急剧减少,在自然环境中,宽口裂腹鱼产卵的受精率和成活率不高。2019年4月在乌恰县境内的克孜勒河中捕捞到体长6 cm左右的宽口裂腹鱼,通过按压腹部,在泄殖孔出现大量的乳白色精液(图 1),且体长6 cm以下的宽口裂腹鱼也能按压挤出精液,表现出不同程度的早熟现象。环境变化、气候变化、栖息地的破坏加剧了裂腹鱼的濒危(魏杰等, 2020)。目前,市场上少见宽口裂腹鱼,市场价在200~ 400元/kg,资源量正在减少,自治区拟将其列为保护鱼类(龙见全等, 2019)。
|
图 1 宽口裂腹鱼挤出的精液 Fig.1 Sperm squeezed out from S. eurystomus |
细胞培养技术是在体外人工模拟体内环境的培养基中,细胞经过大量培养成为简单的单细胞或极少分化的多细胞的技术。世界上第一个鱼类细胞系是由Wolf等(1962)建立的虹鳟(Oncorhynchus mykiss)生殖腺细胞系RTG-2。我国最早建立的细胞系是张念慈等(1981)报道的草鱼(Ctenopharyngodon idellus)吻端组织细胞系ZC-7901和上皮样细胞亚株ZC-7901S1。目前,关于鱼类细胞培养的细胞系的报道有34科80种300株(Fryer et al, 1994),并应用于病毒学、免疫学、细胞生物学、基因工程和环境毒理学等领域。
鱼类细胞培养材料来源广泛,如斑点叉尾
2019年4月于新疆克孜勒河采集宽口裂腹鱼,取其中1条健康宽口裂腹鱼,体重为93.98 g,体长为15.89 cm,全长为18.66 cm。
DME/F12、L-15、MEM、RPMI-1640和M199培养基购自Hyclone公司;胎牛血清(FBS)购自Gibco公司;磷酸缓冲液(PBS)、青霉素–链霉素双抗、二甲基亚砜(DMSO)和吉姆萨购自Solarbio公司;台盼蓝和0.25%胰酶购自Biotopped公司;MS-222购自渔夫宝公司;25 cm2和75 cm2细胞培养瓶、15 mL和50 mL离心管、移液管、细胞冻存管、24孔细胞培养板均为Corning公司产品;基因组DNA提取试剂盒购自天根生化科技有限公司;其他化学试剂均为分析纯。
1.2 实验方法 1.2.1 宽口裂腹鱼的预处理将宽口裂腹鱼在实验室暂养3 d后,放入20 mg/mL的KMnO4溶液中浸泡30 min,然后加入0.1 μL/g的MS-222麻醉剂麻醉,致死。将鱼全身喷涂75%酒精,放入超净台的解剖盘中。取4个培养皿,其中1个培养皿中加75%酒精,另3个培养皿均加含500 IU/mL的青霉素、500 μg/mL的链霉素和12.5 μg/mL两性霉素B的PBS。用解剖学方法取出宽口裂腹鱼鱼鳔之上、脊柱下侧的中肾,将取出中肾组织放入75%的酒精浸泡30 s之后,再依次放入另外3个含有PBS的培养皿中浸泡。经处理的中肾组织放入2 mL无菌离心管中,用无菌眼科剪剪至1~3 mm的大小均匀的组织碎块。
1.2.2 原代培养与传代培养将已剪好的中肾组织碎块移入25 cm2细胞培养瓶,放入25℃的CO2培养箱中,观察贴壁情况,过4 h后反相放置。6 h后,加入1 mL含20% FBS、500 IU/mL青霉素、500 μg/mL链霉素和500 μg/mL两性霉素B的DME/F-12培养液,正相放入25℃、5% CO2培养箱中进行培养。每天观察组织生长的情况。2~3 d后更换培养液,当宽口裂腹鱼中肾组织块周围出现细胞的悬浮物时,悬浮细胞,移至15 mL的离心管中,1000 r/min离心5 min,倒掉上清液后加入PBS使细胞悬浮,1000 r/min离心5 min,如此重复3次。加入DME/F-12培养液,按照1∶2进行传代培养。第5代之后,将培养液中的链霉素、青霉素和FBS的浓度分别调整为200 μg/mL、200 IU/mL和15%,到第8代时,培养液换为含10% FBS和1% P/S的DME/F-12培养液。
1.2.3 最佳培养基的选择使用5种培养基:DME/F-12、M199、L-15、MEM和RPMI-1640。观察细胞的生长状况。分别向培养基中加入10% FBS和1% P/S,混匀。取一定量的中肾细胞,分别接种在5个培养基中,中肾细胞数量保持一致。在25℃、5%的CO2培养箱中培养96 h,在培养0、24、48、72和96 h时用血球计数板对细胞进行计数,并绘制5种培养基中细胞的生长曲线。
1.2.4 最适温度的选择观察不同温度(20℃、25℃和30℃)对中肾细胞生长的影响。每种温度下的培养基皆为10% FBS和1% P/S的DME/F-12培养基。在0、24、48、72和96 h,使用血球计数板对细胞进行计数,并绘制不同温度下的生长曲线。
1.2.5 最适血清浓度的选择在得到最适温度和培养基后,保持其他条件一致,调节FBS浓度(0%、5%、10%和20%)。将相同数量的中肾细胞接种于除血清浓度不同而其他条件均相同的培养基中,放在25℃、5%的CO2培养箱中进行培养,在培养0、24、48、72和96 h时,用血球计数板对细胞进行计数,并绘制不同FBS下的生长曲线。
1.2.6 标准生长曲线取中肾细胞溶液,接种到24孔培养板上,将其分为8组,每组3个孔,放入25℃、5% CO2培养箱中培养,连续7 d计数,使用血球计数板每天计数1次。以天数为横坐标(t),以每天计数的平均数为纵坐标(细胞密度×104),计算细胞群体倍增的时间:
| $ T = t \cdot \lg /\lg \left({{N_t}/{N_0}} \right) $ |
式中,Nt为时间t时的细胞数,N0为起始细胞数。
1.2.7 细胞冻存与复苏冻存:配置10%二甲基亚砜、20% FBS、70% DME/F-12的细胞冻存液,预冷,细胞浓度为2×106个/mL,倒入冷冻管,液氮中保存。
复苏:按细胞∶培养液=1∶5的比例,细胞复苏培养,在培养0、24、48和72 h时,用MTT法测定细胞的OD值,绘制细胞复苏后增殖曲线。
1.2.8 细胞污染与检测鉴定细胞培养过程中容易被污染,为了检查培养过程是否受到污染,采用通用引物,用PCR技术进行鉴定(表 1)。
|
|
表 1 引物序列 Tab.1 Primer sequence |
用基因组DNA试剂盒提取中肾组织细胞DNA。根据宽口裂腹鱼16S rRNA设计引物(表 1)。通过PCR扩增,50 μL反应体系:25 μL 2×Taq PCR MasterMix,引物各2.5 μL,5 μL模板DNA,15 μL的灭菌超纯水。PCR反应条件:95℃预变性3 min;94℃变性30 s,48.9℃退火30 s,72℃延伸40 s,循环35次。扩增反应结束后,取8 μL PCR产物在1%琼脂糖凝胶中进行电泳检测。PCR产物测序,比较并获得与GenBank中已发表序列的一致率。
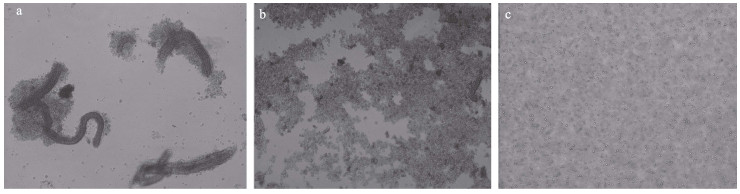
2 结果 2.1 原代培养与传代培养每天观察细胞瓶,从4 d后开始,宽口裂腹鱼的中肾组织块周围开始迁出细胞,由组织块向周围溢出,形状呈不规则团状连接结构(图 2a);第9天开始,70%的细胞瓶底面被铺满(图 2b);第15天,细胞呈悬浮生长(图 2c),按照1∶2进行传代培养,每天观察细胞生长状况,生长速度较快。
|
图 2 宽口裂腹鱼中肾组织细胞原代培养 Fig.2 Primary culture of kidney tissue cells of S. eurystomus (100 μm) |
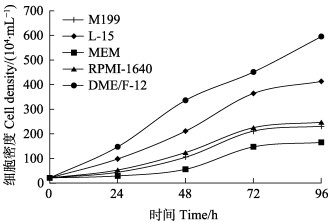
在M199、L-15、MEM、RPMI-1640和DME/F-12培养基中同条件培养4 d,在每个时间相对细胞数量为DME/F-12 > L-15 > RPMI-1640 > M199 > MEM,其中,DME/F-12增势较大(图 3)。3 d后,除DME/F-12外,其他4种培养基的增长速度趋于平缓。L-15比其他3种培养基效果较好,在2 d后较为明显。M199和RPMI-1640效果较为相似,RPMI-1640略高一点。相比之下,最适培养基为DME/F-12。
|
图 3 细胞培养的最适培养基 Fig.3 Optimal medium for cell culture |
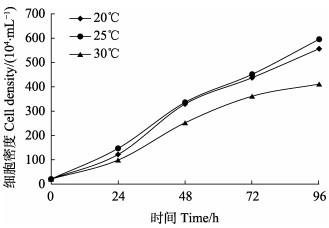
在3种较适宜温度20℃、25℃和30℃下,将中肾细胞同条件培养4 d后,统计中肾细胞数量(图 4)。20℃和25℃时,效果非常相似,而这2个温度相对于30℃,效果更明显,在1 d后开始出现差别。20℃比25℃效果较好,但并不明显,尤其在2、3 d中几乎相似,4 d后出现差别,25℃细胞数量略高于20℃。因此,最适温度为25℃。
|
图 4 细胞培养最适温度 Fig.4 Optimum temperature for cell culture |
取定量中肾细胞在0(对照组)、5%、10%和20%的浓度血清培养基中同条件培养,除在对照组血清中生长较缓,在其余浓度的血清中均生长较好。在10%和20%浓度的血清中细胞生长的数量较为接近,尤其在1、3和4 d时。而在5%浓度血清中,生长情况明显比除对照组外的浓度组效果差。除对照组血清培养基外,其他培养基中的细胞生长速度均较快(图 5)。比较4组数据,最适血清的浓度为20%。

|
图 5 细胞培养的最适血清 Fig.5 Optimum serum for cell culture |
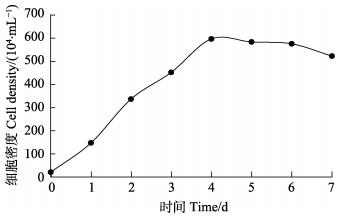
绘制生长曲线(图 6)。接种一定数量的细胞,在最适条件下生长,在1~4 d时细胞生长的速度较快,到5~6 d时生长速度放缓趋于平稳,之后细胞数量下降。经计算,细胞群体倍增的时间为23.26 h。
|
图 6 细胞生长标准曲线 Fig.6 Standard curve of cell growth |
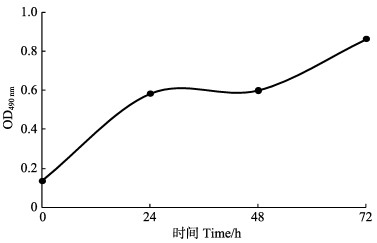
冻存细胞复苏后,经台盼蓝染色,细胞计数并计算存活率,重复10组取平均值。对第6代细胞液氮冷冻保存后,复苏经台盼蓝染色并计数统计,6个月后复苏存活率达91.91% (表 2);细胞具有活性,且复苏后增殖速度快(图 7),可正常传代(图 8)。
|
|
表 2 冻存后复苏的存活率 Tab.2 Survival rate of recovery after freezing |
|
图 7 MTT法测定复苏细胞增殖 Fig.7 MTT was used to determine the value added of resuscitated cells |

|
图 8 宽口裂腹鱼中肾组织细胞复苏培养 Fig.8 Recovery culture of mesonephros cells in S. eurystomus(50 μm) |
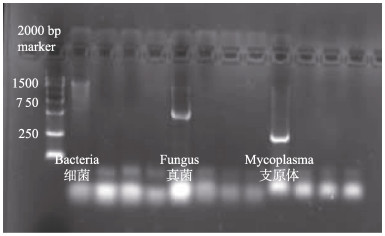
经PCR法鉴定细菌、真菌、支原体污染,样品均无与阳性对照组一致的条带,样品中无细菌、真菌、支原体,宽口裂腹鱼中肾组织细胞未被污染(图 9)。
|
图 9 细菌、真菌、支原体PCR鉴定结果 Fig.9 PCR identification results of bacteria, fungi and mycoplasma |
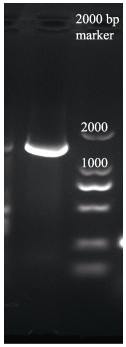
经PCR扩增,获得1077 bp的基因片段,在琼脂糖凝胶中电泳检测,大小符合(图 10)。测序序列片段,并在GenBank数据库中进行Blast比对。结果显示,与GenBank中发布的来源于宽口裂腹鱼线粒体基因(NC0369331)的序列同源性为99.81%。证明细胞系来自宽口裂腹鱼。
|
图 10 宽口裂腹鱼中肾组织细胞16S rRNA基因PCR扩增产物 Fig.10 PCR amplified products of 16S rRNA gene of mesonephros cells in S. eurystomus |
宽口裂腹鱼是新疆的土著鱼类,在20世纪60年代数量仍然可观,但由于人为因素和环境变化,现已成为濒危物种。随着宽口裂腹鱼的数量急剧下降,保护宽口裂腹鱼已刻不容缓。建立宽口裂腹鱼的细胞系,可以有效保护宽口裂腹鱼的种质资源,为细胞生物学、环境毒理学和基因工程的研究奠定基础。如王京真等(2010)对长江江豚(Neophocaena phocaenoides asiaeorientalis)的静脉细胞进行培养,尝试转染SV40大T抗原,得到永久细胞系。
关于鱼类细胞培养生长特性的研究主要集中在培养基、温度、血清、冻存复苏等方面。本研究采用DME/F-12、L-15、RPMI-1640、M-199和MEM培养基,应用于宽口裂腹鱼中肾组织细胞的体外培养,DME/F-12培养基的效果最好,而在前人研究的鱼类细胞培养中大部分采用的是L-15 (Wang et al, 2003; Leibovitz et al, 1977; Fryer et al, 1994),其有效的缓冲系统可防止pH的过大波动,可保证细胞的长时间培养,符合鱼类细胞的生长特征,如云纹石斑鱼(Epinephelus moara)肾组织细胞系(EMK) (Liu et al, 2018)最佳培养基为L-15,但不适宜本研究中的宽口裂腹鱼的细胞培养。本研究使用DME/F-12培养基时,宽口裂腹鱼中肾组织细胞生长更好,可能由于不同种鱼类生长环境不同,且所需营养不同。除了L-15培养基,其他培养液也逐渐应用于鱼类细胞培养,如RPMI-1640和M199等。大多数细胞的生长与温度密切相关,鱼类是变温动物,其细胞培养的温度范围比哺乳动物广。宽口裂腹鱼在20℃~30℃条件下均能生长,最佳温度为25℃,此时的细胞生长良好、稳定,过高或过低的温度均对细胞的生长有影响。樊廷俊等(2007)研究表明,大菱鲆(Scophthalmus maximus)鳍细胞体外培养在16℃~20℃均能生长,最适温度为20℃~ 24℃;张念伟等(2017)对大菱鲆脑细胞体外培养,18℃~30℃均能生长,最适温度为24℃;Wang等(2014)对大黄鱼肾组织细胞均能生长,在28℃时生长最好。鱼类细胞的生长温度范围比较广,宽口裂腹鱼中肾组织细胞体外培养在20℃~30℃均能生长,这与本研究一致。不同种和同一种不同部位的细胞来源,生长温度也不尽相同,因此,鱼类细胞培养确定培养温度至关重要。在同一条件下,用不同浓度的胎牛血清培养细胞时,胎牛血清组比无血清组的细胞生长好。在5%、10%和20%血清中生长时,10%和20%浓度的血清比5%血清组生长差别明显,说明牛血清浓度对细胞的生长有明显影响(李自良等, 2020)。当血清浓度为10%和20%时,细胞的生长不是特别明显,但相对10%浓度的血清,20%浓度的血清效果最好,与相关文献的结果相似(Li et al, 2017; 谭凤霞, 2008)。
本研究中,宽口裂腹鱼中肾细胞呈现悬浮生长,悬浮培养的细胞一般为淋巴细胞等血液系统来源的细胞,这种细胞体积小,缺乏粘附分子的表达,Ribas等(2014)研究抗炎药物对淡水鱼虎利齿脂鲤(Hoplias malabaricus)的原代肾细胞培养的影响时应用的肾细胞呈悬浮状态。宽口裂腹鱼中肾细胞呈悬浮生长可能与其体积和粘附分子的表达有关系,具体原因有待于进一步研究。
本研究对第10代中肾组织细胞进行生长曲线测定,细胞的生长曲线为“S”型。在第4天时,细胞生长达到峰值,由于空间和营养不足等原因,细胞生长开始减弱。将细胞放入液氮中冷冻后,6个月后复苏,复苏存活率达到91.91%,细胞生长正常,可以传代,生长很旺盛。
细胞是实验的重要模型,污染却是实验中最大的阻碍,对实验结果造成严重影响。比较常见的污染有细菌、真菌、支原体等。在细胞污染鉴定过程中,通过PCR技术对细胞进行检测,操作简单。结果证明,培养过程中未受到污染。
采用进化缓慢的保守序列16S rRNA,进一步对细胞来源鉴定,经分析,与宽口裂腹鱼序列一致性为99.81%,表明其来源于宽口裂腹鱼。
4 结论本研究以宽口裂腹鱼中肾组织为材料进行体外培养,建立了宽口裂腹鱼中肾组织细胞系。宽口裂腹鱼作为新疆特色经济鱼类,细胞系的建立对宽口裂腹鱼的生物学、细胞工程、基因工程和种质资源保护等都有重要意义,可为新疆特色渔业建设提供支持。
DENG Y L. Establishment and application of a cell line derived from fin of Squaliobarbus curriculus. Masterxs Thesis of Hunan Agricultural University, 2016 [邓亚林. 赤眼鳟鳍条细胞系的建立及应用研究. 湖南农业大学硕士研究生学位论文, 2016]
|
FAN T J, GENG X F, CONG R S, et al. Establishment of a novel fin cell line from turbot, Scophthalmus maximus. Periodical of Ocean University of China (Natural Sciences), 2007, 37(5): 759-766 [樊廷俊, 耿晓芬, 丛日山, 等. 大菱鲆鳍细胞系的建立. 中国海洋大学学报(自然科学版), 2007, 37(5): 759-766] |
FRYER J L, LANNAN C N. Three decade of fish cell culture: A current listing of cell lines derived from fish. Journal of Tissue Culture Methods, 1994, 16(1): 87-94 |
LEIBOVITZ A. Preparation of medium L-15. Methods in Cell Science, 1977, 3(2): 557-559 DOI:10.1007/BF00918380 |
LI P, ZHOU L, WEI S, et al. Establishment and characterization of a cell line from the head kidney of golden pompano Trachinotus ovatus and its application in toxicology and virus susceptibility. Journal of Fish Biology, 2017, 90(5): 1944-1959 DOI:10.1111/jfb.13277 |
LI Z L, WANG J M, ZHAO C H, et al. Study on the effect of different types of bovine serum on MDCK cell. Journal of Biology, 2020, 37(4): 21-25 [李自良, 王家敏, 赵彩红, 等. 不同类型牛血清对MDCK细胞培养效果研究. 生物学杂志, 2020, 37(4): 21-25] |
LIU X F, WU Y H, WEI S N, et al. Establishment and characterization of a brain cell line from kelp grouper Epinephelus moara. Journal of Fish Biology, 2018, 92(2): 298-307 DOI:10.1111/jfb.13471 |
LONG J Q, HU R Y, DENG J Q, et al. Research on capture and domestication techniques of wild Schizothorax eurystomus. Scientific Fish Farming, 2019, 11061106(4): 35-36 [龙见全, 胡仁云, 邓俊强, 等. 野生宽口裂腹鱼的捕捉及驯化养殖技术的研究. 科学养鱼, 2019, 11061106(4): 35-36] |
RIBAS J L C, DA SILVA C A, DE ANDRADE L, et al. Effects of anti-inflammatory drugs in primary kidney cell culture of a freshwater fish. Fish and Shellfish Immunology, 2014, 40(1): 296-303 DOI:10.1016/j.fsi.2014.07.009 |
SHAN L J. Establishment and characterization of kidney cell lines from rough skin sculpin (Trachidermus fasciatus). Masterxs Thesis of Dalian Ocean University, 2015 [单莉娟. 松江鲈肾细胞系的建立及生物学特性分析. 大连海洋大学硕士研究生学位论文, 2015]
|
TAN F X. Establishment of three fish cell lines and research on the sensitivity of twelve fish cell lines to heavy metal toxicity. Doctoral Dissertation of Huazhong Agricultural University, 2008 [谭凤霞. 三株鱼类细胞系的建立和十二株鱼类细胞系对重金属毒性的敏感性研究. 华中农业大学博士研究生学位论文, 2008]
|
WANG G, LAPATRA S, ZENG L, et al. Establishment growth cryopreservation and species of origin identification of three cell lines from white sturgeon, Acipenser transmontanus. Methods in Cell Science, 2003, 25(3): 211-220 |
WANG J Z, JI W, XIAO W H, et al. A preliminary study of cell culture in vitro derived from Yangtze finless porpoise umbilical vein. Acta Hydrobiologica Sinica, 2010, 34(2): 436-441 [王京真, 姬伟, 肖武汉, 等. 长江江豚脐静脉细胞体外培养的初步研究. 水生生物学报, 2010, 34(2): 436-441] |
WANG M K, ZHU H, WANG Y J, et al. Establishment and characterization of two cell lines derived from spotted knifejaw Oplegnathus punctatus muscle and brain. Periodical of Ocean University of China (Natural Sciences), 2018, 48(6): 67-74 [王梦珂, 朱鹤, 王玉珏, 等. 斑石鲷肌肉、脑细胞系的建立与生物学特性. 中国海洋大学学报(自然科学版), 2018, 48(6): 67-74] |
WANG X H, WANG K R, NIE P, et al. Establishment and characterization of a head kidney cell line from large yellow croaker Pseudosciaena crocea. Journal of Fish Biology, 2014, 84(5): 1551-1561 DOI:10.1111/jfb.12386 |
WEI J, CAO X Q, REN Y L, et al. Anatomy and histological observation of digestive system in Schizothorax eurystomus. South China Fisheries Science, 2020, 16(1): 120-126 [魏杰, 曹希全, 任永丽, 等. 宽口裂腹鱼消化系统解剖和组织学观察. 南方水产科学, 2020, 16(1): 120-126] |
WOLF K, QUIMBY M C. Established eurythermic line of fish cells in vitro. Science, 1962, 135(3508): 1065-1066 |
XU J. Establishiment of channel catfish kidney cell line and pathology study of channel catfish hemorrhagic disease. Doctoral Dissertation of Huazhong Agricultural University, 2012 [徐进. 斑点叉尾  肾脏细胞系建立与出血病病原学研究, 华中农业大学博士研究生学位论文, 2012] 肾脏细胞系建立与出血病病原学研究, 华中农业大学博士研究生学位论文, 2012]
|
XU X H, FAN T J, JIANG G J, et al. Establishment and characterization of a new marine fish cell line from ovary of barfin flounder (Verasper moseri). Journal of Ocean University of China, 2015, 14(6): 1105-1110 |
ZHANG N C, YANG G Z. The establishment of strain ZC-7901 and substrain ZC-7901S1, from the snout tissue cells of Grass carp. Journal of Fisheries of China, 1981, 5(2): 111-118 [张念慈, 杨广智. 草鱼吻端组织细胞株ZC-7901及其亚株ZC-7901S1的建立和特性观察. 水产学报, 1981, 5(2): 111-118] |
ZHANG N W, LIU X F, WANG N, et al. Establishment of a brain cell line from turbot (Scophthalmus maximus). Journal of Agricultural Biotechnology, 2017, 25(5): 820-826 [张念伟, 刘肖峰, 王娜, 等. 大菱鲆脑细胞系的建立. 农业生物技术学报, 2017, 25(5): 820-826] |
ZHANG Y Y, LIANG X M, ZENG W G, et al. Establishment and characterization of a new euryhaline fish kidney cell line of spotted Scatophagus argus. Oceanologia et Limnologia Sinica, 2014, 45(3): 213-218 [张莹莹, 梁雪梅, 曾文刚, 等. 金钱鱼肾细胞系的建立及生长特性研究. 海洋与湖沼, 2014, 45(3): 213-218] |
ZHAO J Q, JIA P, LIU W Z, et al. Establishment and characterization of a cell line derived from the kidney of tilapia, Oreochromis niloticus. Journal of Fishery Sciences of China, 2019, 26(2): 165-173 [赵建青, 贾鹏, 刘文枝, 等. 罗非鱼肾脏细胞系的建立及其生物学特性. 中国水产科学, 2019, 26(2): 165-173] |
ZHENG Z Y, YANG J X, CHEN X X, et al. Development and characterization of a new cell line derived from the kidney of large yellow croaker (Larimichthys crocea). Fujian Journal of Agricultural Sciences, 2017, 32(10): 1051-1056 [郑在予, 杨金先, 陈秀霞, 等. 大黄鱼肾脏组织细胞系(YCK)的建立. 福建农业学报, 2017, 32(10): 1051-1056] |
ZUO W G, QIAN H X, XU Y F, et al. Establishment of kidney cell lines CIK from Grass carp. Freshwater Fisheries, 1984, 11061106(2): 38-39 [左文功, 钱华鑫, 许映芳, 等. 草鱼肾脏组织细胞系CIK的建立. 淡水渔业, 1984, 11061106(2): 38-39] |



