2. 上海海洋大学海洋科学学院 上海 201306;
3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266237;
4. 中国海洋大学水产学院 山东 青岛 266003
 (Lophius litulon)和小黄鱼(Larimichthys polyactis)。秋季黄海关键种并未发生变化,鳀为关键被捕食者,小黄鱼是控制群落离散变量的物种,两者的资源均出现衰退;黄
(Lophius litulon)和小黄鱼(Larimichthys polyactis)。秋季黄海关键种并未发生变化,鳀为关键被捕食者,小黄鱼是控制群落离散变量的物种,两者的资源均出现衰退;黄 作为关键捕食者,其相对资源量上升。1985—2018年间,秋季黄海优势种变化明显,由黄
作为关键捕食者,其相对资源量上升。1985—2018年间,秋季黄海优势种变化明显,由黄 和银鲳(Pampus argenteus)转变为龙头鱼(Harpadon nehereus)、细纹狮子鱼(Liparis tanakae)和鳀;以重量和数量计算的丰富度指数(Rw和Rn)、多样性指数(H′w和H′n)逐步降低,2018年以后显著回升,均匀度指数(J′w和J′n)波动较小。研究表明,近30年秋季黄海关键种没有变化,但优势种变化明显,群落结构有波动,但仍处于较稳定状态。
和银鲳(Pampus argenteus)转变为龙头鱼(Harpadon nehereus)、细纹狮子鱼(Liparis tanakae)和鳀;以重量和数量计算的丰富度指数(Rw和Rn)、多样性指数(H′w和H′n)逐步降低,2018年以后显著回升,均匀度指数(J′w和J′n)波动较小。研究表明,近30年秋季黄海关键种没有变化,但优势种变化明显,群落结构有波动,但仍处于较稳定状态。2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao, Shandong 266237, China;
4. College of Fisheries, Ocean University of China, Qingdao, Shandong 266003, China
关键种直接或间接调控着群落结构和影响群落中其他物种的分布,在维持群落稳定性和物种多样性方面起重要作用(孙刚等, 2000)。通过对群落关键种的研究,可以明确食物网中的物种关系;通过关键种的变动,可以了解物质能量在食物网中的流动情况(王凤珍等, 2019)。以节点度为位置重要性指数,可以建立其余拓扑学指标;通过食物网拓扑结构,可以确定食物网中节点之间的位置关系及联系程度,以及重要节点的变动对其他节点和整个食物网所造成的影响(Libralato et al, 2006; Jordán et al, 2006)。社会网络分析法是研究社会网络实体之间的关系结构及属性的理论和方法。目前,在水域生态系统使用的研究方法包括转移矩阵灵敏度分析法(Miller, 2012)、Ecopath with Ecosim模型法(Libralato et al, 2006)、构建食物网拓扑结构并运用网络分析法(Jordán et al, 2006)。将网络分析方法与食物网拓扑结构结合,可进一步探究影响食物网稳定性的关键物种变化,掌握食物网结构和动态,进而监测群落稳定性(朱江峰等, 2016)。目前,我国有关关键种的研究主要针对海湾生态系统,如莱州湾(杨涛等, 2018)、胶州湾(马孟磊等, 2018)、北部湾(孙龙启等, 2016)等,大面积水域的相关研究未见报道。
黄海作为我国重要的渔业水域,是多种渔业生物的产卵场、索饵场和越冬场(邱盛尧等, 2009; 金显仕等, 2005)。近30年,由于过度捕捞和环境改变,黄海鱼类群落结构和种类组成发生变化(Jin et al, 1996; 邓景耀等, 1991),低质鱼类增多,传统大型经济鱼类减少,群落结构简单化,平均营养级降低(刘静等, 2011; 单秀娟等, 2014)。黄海捕捞渔获物逐渐从长寿命、高营养级的底层鱼类向短寿命、低营养级的中上层小型鱼类或无脊椎动物转变(杜建国等, 2014)。研究发现,1985-2010年,黄海主要渔业种类超过半数出现食性转变,游泳动物食性鱼类减少,广食性鱼类增多,黄海鱼类群落食物网发生改变(张波等, 2011)。为探究黄海食物网中关键种的变化对群落结构、功能和多样性的影响,本研究基于1985、2001、2009和2018年秋季黄海渔业资源调查数据,利用拓扑学原理构建了黄海秋季鱼类群落食物网络,分析了网络中关键种的年代际更替,旨在为后续研究及资源管理提供科学基础。
1 材料与方法 1.1 数据来源数据来源于中国水产科学研究院黄海水产研究所"北斗"号1985、2001、2009和2018年秋季(10月) (2001年为11月)在黄海的底拖网渔业资源调查数据。调查海域为黄海(30°00′~39°00′N,120.5°00′~ 126°00′E)。网具参数:1985年底拖网网口周长为450目×17 cm,网囊网目为2.0 cm,网口高度为5~7 m;2001年后各年网口周长为836目×20 cm,网囊网目2.4 cm,网具高度5~7 m。根据实测数据,2001年所用网具的网口面积是1985年的1.5倍,数据进行标准化。调查站位延续历史调查站设计方案(极少数站位存在不同),调查水域范围一致(李忠炉等, 2015; 韩青鹏等, 2019),每站拖网时间为0.5~1 h,平均拖速为3.0 kn。食性数据参考邓景耀等(1988)、金显仕等(1998)、成庆泰等(1997)、韦晟等(1998)和杨纪明(2001)。
1.2 研究方法 1.2.1 群落优势度优势度由相对重要性指标(index of relative importance, IRI)来确定(Pinkas et al, 1971):
| $ {\rm{IRI}} = (N\% + W\%)F $ | (1) |
式中,N为某种鱼个体数占捕获鱼类总个体数百分比,W为某种鱼重量占捕获鱼类总重量百分比,F为某种鱼在调查中被捕获的站数与总调查站数百分比。IRI > 500为优势种,50~500为常见种,优势种与常见种合称为鱼类群落的重要组成成分(程济生, 2000)。
1.2.2 生物多样性指数采用Margalef种群丰富度指数R、Shannon-Wiener多样性指数H′和Pielou均匀度指数J′,并分别采用相对生物量和个体数进行计算。
Shannon-Wiener多样性指数H′(Shannon et al, 1949):
| $ H' = \sum\limits_{i = 1}^S {{P_i}} \ln\;{P_i} $ | (2) |
Margalef种群丰富度指数R(Margalef, 1958):
| $ R = (S - 1)/\ln\;N $ | (3) |
Pielou均匀度指数J′(Pielou, 1975):
| $ J' = H'/\ln\;S $ | (4) |
式中,S为种类数;N为渔获总重量或尾数;Pi为i种鱼重量(或尾数)占总渔获物重量(或尾数)的比例。
1.2.3 食物网拓扑结构指数点度(degree, D)包括入度(in-degree, Din)和出度(out-degree, Dout) (Dunne et al, 2002)
| $ {D_i} = {D_{in, i}} + {D_{{\rm{out }}, i}} $ | (5) |
式中,Di为i物种的捕食者及被捕食者种类总数,Din, i为i物种的被捕食者种类数量,Dout, i为i物种的捕食者种类数量。D用于描述其存在摄食关系物种的数量,Din越大,表示其被捕食者种类数量多;Dout越大,表示捕食者种类数量越多,反之亦然。
中介中心性(betweenness centrality, BC) (Freeman, 1978)
| $ {\rm{B}}{{\rm{C}}_i} = \frac{{2 \times \sum\limits_{j < k} {\frac{{{g_{jk}}(i)}}{{{g_{jk}}}}} }}{{(N - 1)(N - 2)}} $ | (6) |
式中,N为调查中出现的种类数,i≠k、i≠j且j < k,gjk表示j物种和k物种之间存在的最短路径数量,gjk(i)表示j种和k种之间存在的经过第3个i种的捷径数目。BC值越大,代表该物种对群落内信息交换的控制能力越强,在维持群落结构的稳定性上越关键。
紧密中心性(closeness centrality, CC)(Freeman, 1978; Okamoto et al, 2008)
| $ {\rm{C}}{{\rm{C}}_i} = \frac{{N - 1}}{{\sum\limits_{j = 1}^N {{d_{ij}}} }} $ | (7) |
式中,N为调查中出现的种类数,i≠k、i≠j且j < k,dij代表i物种和j物种之间的捷径距离。CC值大的物种,其在群落中信息传递中,能以最快的速度将信息传递给其他物种。
节点密度(density, Dd)(Dunne et al, 2002)
| $ {D_d} = S/L $ | (8) |
种间关联度指数(connectance, C)(Dunne et al, 2002):
| $ C = L/{S^2} $ | (9) |
式中,S为鱼类群落中种类数量;L为群落内各种间存在的摄食关系数量;Dd为节点密度,节点密度值越大,群落内物种的摄食关系的平均值就会越大;C为种间关联度,种间关联度越大,2个物种之间存在的捕食-被捕食的概率就越大。
拓扑重要性指数(topological importance index, TI) (Jordán et al, 2006):
| $ {\rm{TI}}_i^n = \frac{{\sum _{m = 1}^n{\sigma _{{m_i}}}}}{n} = \frac{{\sum _{m = 1}^n\sum _{\dot j = 1}^N{a_{m, ji}}}}{n} $ | (10) |
式中,am, ji为物种i经过m步到达物种j时,物种i对物种j的影响;TIin为物种i经过n步时,对鱼类群落拓扑结构影响的重要性指数。在本研究中,n取值为1和7。TI值越大,代表其信息扩散速度越快。
关键性指数(keystone index, K),包括上行关键指数(bottom-up keystone index, Kb)和下行关键指数(top-down keystone, Kt)(Jordán et al, 1999):
| $ {K_b}(i) = \frac{{1 + {K_b}(j)}}{{m(i)(j)}} $ | (11) |
| $ {K_t}(i) = \frac{{1 + {K_t}(j)}}{{n(i)(j)}} $ | (12) |
| $ K(i) = {k_b}(i) + {k_t}(i) $ | (13) |
式中,Kb(i)为物种i的上行关键指数,Kb(j)为物种j的上行关键指数,物种j为物种i的直接捕食者,m(i)(j)为物种j的直接被捕食者数量种类。Kt(i)为物种i的下行关键指数,Kt(j)为物种j的下行关键指数,Kt(j)为物种j的直接捕食者种类数量。K(i)为物种i的关键性指数。
KPP运算(key player problem),使用KPP-1运算法则,离散度(fragmentation, F)和距离权重离散度(distance-weighted fragmentation, DF) (Breiger et al, 2003):
| $ \Delta F = 1 - \frac{{\sum\limits_i {{s_i}} \left({{s_i} - 1} \right)}}{{N(N - 1)}} $ | (14) |
| $ {\Delta ^D}F = 1 - \frac{{2\sum\limits_{i > j} {\frac{1}{{{d_{ij}}}}} }}{{N(N - 1)}} $ | (15) |
式中,ΔF为群落离散变量,取值为(0, 1),F越接近于1,群落离散程度越大;si为物种i在第i次离散群体中的种数。ΔDF为群落的距离加权离散度,取值为(0, 1),取值越接近于1,群落的距离加权离散度越大;dij为点i与点j之间的距离。当ΔF和ΔDF越大时,代表当此物种从群落中被筛选出,会对群落结构产生越大影响。
群落种间聚类系数计算参照Watts等(1998)。
本研究使用统计分析软件SPSS 20.0、Excel 2016、网络分析软件Ucinet6 (http://www.analytictech.com/)计算D、Dout、Din、BC、CC,使用CoSBiLaB Graph 1.0(http://www.cosbi.eu/)计算TI1、TI7、K、Kb和Kt,Keypalyer 1.44 (http://analytictech.com/)计算F、DF和DR。
2 结果与分析 2.1 鱼类群落结构在1985-2018年调查期间,共捕获鱼类147种,隶属于9目68科100属,其中,2018年种类最多,共103种,隶属于13目53科83属。1985年优势种为黄
|
|
表 1 1985—2018年黄海秋季鱼类优势种组成 Tab.1 Dominant species composition in the Yellow Sea in autumn during 1985~2018 |
从图 1可以看出,1985-2018年间,黄海秋季鱼类多样性变化很大。1985年物种丰富度指数Rw和Rn达到高峰,随后逐渐降低,2009年降至最低,2018年有显著回升,但未超过1985年。多样性指数总体呈降低趋势,H'n于2001年降到最低,2009年有所回升,但并未超过1985年水平;H'w于2009年降到最低,2018年有所回升,与1985年持平。均匀度指数J'w与J'n呈相对稳定波动。
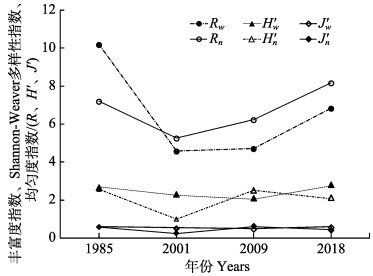
|
图 1 1985-2018年黄海秋季鱼类多样性变化 Fig.1 Fish community biodiversity in the Yellow Sea in autumn during 1985~2018 Rn:丰富度指数(尾数);Rw:丰富度指数(重量);H'n:多样性指数(尾数);H'w:多样性指数(重量);J'n:均匀度指数(尾数);J'wx:均匀度指数(重量) Rn: Margalef richness index (number); Rw: Margalef richness index (weight); H'n: Shannon diversity index(number); H'w: Shannon diversity index(weight); J'n: Pielou evenness index (number); J'w: Pielou evenness index (weight) |
1985-2018年间,黄海秋季鱼类食物网中物种数量(S)为67~103个,摄食关系数量(L)平均值为388。其中,2018年摄食关系最多,为449个,2009年最低,为300个;食物网拓扑结构密度(Dd)变化范围为0.198~0.227,平均密度为0.211,最高值出现在2018年,最低值为1985年;种间关联度(C)为0.044~0.074,平均值为0.060,最高值出现在2001年,最低值出现在2018年;聚类系数(Cl)为0.114~0.152,最低值与最高值分别出现在2009年和1985年,平均值为0.138,加权聚类系数(W-Cl)为0.093~0.137,2001年与2009年出现最高值,平均值为0.119(图 2)。物种数量S在调查期间(1985-2018年)呈先降低后增加的趋势,并于2018年超过1985年;L在1985-2009年呈逐步下降趋势,2009年降到最低,2018年增加并与1985年摄食关系数量持平;Dd于1985-2009年逐步增加,于2009年到达高峰,后续有缓慢下降;C、Cl和W-Cl在1985-2001年均呈增加趋势,Cl增加幅度相对较大;2001-2018年,三者呈缓慢下降趋势,C与Cl于2018年降至最低,但并未低于1985年水平,W-Cl下降幅度相对较大,低于1985年水平。这与丰富度指数Rw和Rn的变化趋势基本相反,其中,Cl与W-Cl和Rn呈极显著负相关(P < 0.01)(表 2)。
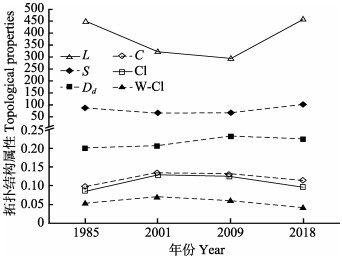
|
图 2 1985-2018年黄海秋季鱼类食物网拓扑结构属性 Fig.2 Topological properties of the fish community in the Yellow Sea in autumn during 1985~2018 L:摄食关系数量;S:鱼类群落中物种数量;Dd:鱼类群落食物网拓扑结构的节点密度;C:鱼类群落中种间关联度;Cl:聚类系数;W-Cl:加权聚类系数 L: Number of predator-prey relations in the food web; S: Species number of fish community; Dd: Node density in food web topological structure; C: Connectance between species in fish community; Cl: Clustering coefficient; W-Cl: Weighted clustering coefficient |
|
|
表 2 黄海鱼类多样性指数与食物网拓扑学指标的相关性 Tab.2 Correlation between fish biodiversity indices and topological indicators of food web in the Yellow Sea |
1985年共捕获鱼类89种,根据鱼类食性参考资料[邓景耀等(1988)、金显仕等(1998)、成庆泰等(1997)、韦晟等(1998)、杨纪明(2001)],白斑星鲨(Mustelus manazo)、乌鲳(Parastromateus Parastromateus niger)、印度无齿鲳(Ariomma indica)、短尾大眼鲷(Priacanthus macracanthus)、长鲽(Tanakius kitaharae)、宽体舌鳎(Cynoglossus robustus)、紫斑舌鳎(Cynoglossus purpureomaculatus)、中华舌鳎(Cynoglossus sinicus)、四指马鲅(Eleutheronema tetradactylum)、新鳚(Neobythites steatiticus)以上物种与其他鱼类无摄食关系,因此,在食物网拓扑学分析中不纳入计算,构建了除此以外的79种鱼类的食物网拓扑学结构(图 3a)。黄海秋季鱼类群落中,鳀与其他49种鱼类发生摄食关系,即D=Dout=49,鳀是该生态系统中重要的饵料鱼类。除鳀外,六丝矛尾虾虎鱼(Amblychaeturichthys hexanema)、矛尾虾虎鱼(Chaeturichthys stigmatias)、黄鲫(Setipinna taty)和玉筋鱼(Ammodytes personatus)也是相对重要的饵料鱼类。黄
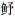


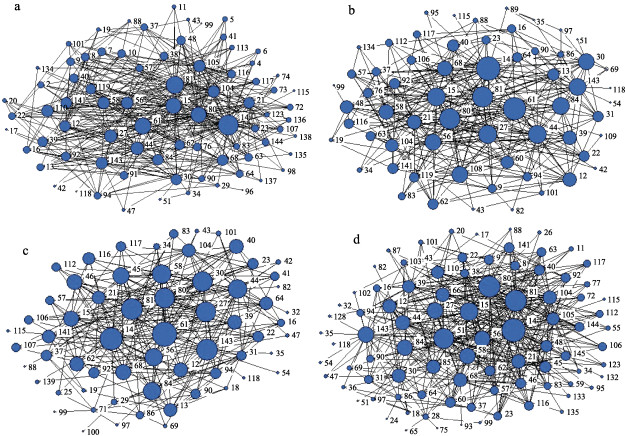
|
图 3 黄海鱼类群落食物网拓扑结构(1985-2018) Fig.3 Topological structure of fish community food-web in the Yellow Sea during 1985~2018 a:1985年;b:2001年;c:2009年:d:2018年。图中数字代表鱼类种类 a: 1985; b: 2001: c: 2009; d: 2018. The number represented different kinds of fish species |
|
|
表 3 1985-2018年黄海秋季鱼类群落拓扑结构指标 Tab.3 Topological indicators of food web in the Yellow Sea fish community in autumn 1985~2018 |
2001年共捕获鱼类67种,去除与其他鱼类无摄食关系的4种鱼类[赤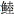




2009年共捕获鱼类69种,狭纹虎鲨(Heterodontus zebra)、粗吻海龙(Trachyrhamphus serratus)、银鲳、中华栉孔虾虎鱼(Ctenotrypauchen chinensis)、长吻红舌鳎(Cynoglossus lighti)和绿鳍马面鲀6种鱼类与该群落结构中的63种鱼类没有摄食关系[邓景耀等(1988)、金显仕等(1998)、成庆泰等(1997)、韦晟等(1998)和杨纪明(2001)],因此,计算拓扑学指标时不纳入,食物网拓扑结构见图 3c。根据表 3计算结果可知,鳀与群落中33种鱼类发生摄食关系,六丝矛尾虾虎鱼和矛尾虾虎鱼与群落中27种鱼类发生摄食关系,三者为该群落中重要的饵料鱼类。黄




2018年共捕获鱼类103种,以下14种鱼类与其他鱼类无摄食关系[邓景耀等(1988)、金显仕等(1998)、成庆泰等(1997)、韦晟等(1998)、杨纪明(2001)],不纳入食物网拓扑结构分析中:中华栉孔虾虎鱼、乌鲳、燕尾鲳(Stromateoides nozawae)、中国鲳(Pampus sinensis)、丝虾虎鱼(Myersina filifer)、桂皮斑鲆(Pseudorhombus cinnamoneus)、宽体舌鳎、窄体舌鳎(Cynoglossus gracilis)、长吻红舌鳎、大鳞舌鳎(Cynoglossus macrolepidotus)、绿鳍马面鲀、密斑马面鲀(Takifugu stictonotus)和日本海马(Hippocampus japonicus),其余89种鱼类食物拓扑结构见图 3d。鳀的Dout值最大,为48,说明其可以作为其余48种鱼类的饵料食物,六丝矛尾虾虎鱼、矛尾虾虎鱼、黄鲫和细条天竺鲷的Dout较大,可以被群落中超过25种鱼类捕食,是仅次于鳀的重要饵料鱼类。黄




根据1985-2018年黄海秋季鱼类群落拓扑结构,取各指标值最大种类为关键种(Jordán et al, 2006)。通过D、Dout、BC、CC、Kb、TI1和TI7指标,确定鳀为关键种;通过ΔF′和ΔDF′指标,确定小黄鱼为关键种;通过Din、K和Kt指标,确定黄
近30年,秋季黄海优势种由黄

鳀、小黄鱼和黄



除关键种外,不同拓扑指标排名前5位的种类发生变化。根据拓扑指标Dout,鳀在4个调查时期排名首位,矛尾虾虎鱼、六丝矛尾虾虎鱼和黄鲫均在4个时期排名前5位,1985年存在玉筋鱼,除1985年外,细条天竺鲷代替玉筋鱼跻身于前5位,成为相对比较重要的饵料鱼类。根据Din指标,黄



|
|
表 附表Ⅰ 物种编号 Tab.附表Ⅰ Species number |
BREIGER R, CARLEY K, PATTISON P, et al. Dynamic social network modeling and analysis: Workshop summary and papers. Washington: National Academies Press, 2003: 241-252
|
CHENG J H, DING F Y, LI S F, et al. Changes of fish community structure in the coastal zone of the Northern Part of East China Sea in summer. Journal of Natural Resources, 2006, 21(5): 775-781 [程家骅, 丁峰元, 李圣法, 等. 夏季东海北部近海鱼类群落结构变化. 自然资源学报, 2006, 21(5): 775-781 DOI:10.3321/j.issn:1000-3037.2006.05.011] |
CHENG J S. The structure and diversity of demersal fish communities in winter in the East China Sea and the Yellow Sea. Marine Fisheries Research, 2000, 21(3): 1-8 [程济生. 东、黄海冬季底层鱼类群落结构及其多样性. 海洋水产研究, 2000, 21(3): 1-8] |
CHENG Q T, ZHOU C W, LIN H Y, et al. Fishes of Shandong Province. Jinan: Shandong Science and Technology Press, 1997: 42-497 [成庆泰, 周才武, 林华英, 等. 山东鱼类志. 济南: 山东科学技术出版社, 1997: 42-497]
|
DENG J Y, MENG T X, REN S M. Food web of fishes in the Bohai Sea. Marine Fisheries Research, 1988, 9(2): 151-172 [邓景耀, 孟田湘, 任胜民. 渤海鱼类的食物关系. 海洋水产研究, 1988, 9(2): 151-172] |
DENG J Y, ZHAO C Y, TANG Q S, et al. Marine Fisheries Biology. Beijing: China Agriculture Press, 1991: 20-25 [邓景耀, 赵传絪, 唐启升, 等. 海洋渔业生物学. 北京: 农业出版社, 1991: 20-25]
|
DU J G, YE G Q, CHEN B, et al. Changes in the marine trophic index of Chinese marine area. Biodiversity Science, 2014, 22(4): 532-538 [杜建国, 叶观琼, 陈彬, 等. 中国海域海洋生物的营养级指数变化特征. 生物多样性, 2014, 22(4): 532-538] |
DUNNE J A, WILLIAMS R J, MARTINEZ N D. Food-web structure and network theory: The role of connectance and size. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 12917-12922 DOI:10.1073/pnas.192407699 |
FREEMAN L C. Centrality in social networks conceptual clarification. Social Networks, 1978, 1(3): 215-239 DOI:10.1016/0378-8733(78)90021-7 |
HAN Q P, SHAN X J, WAN R, et al. Spatiotemporal distribution and the estimated abundance indices of Larimichthys polyactis in winter in the Yellow Sea based on geostatistical delta-generalized linear mixed models. Journal of Fisheries of China, 2019, 43(7): 1603-1614 [韩青鹏, 单秀娟, 万荣, 等. 基于地统计二阶广义线性混合模型的黄海冬季小黄鱼时空分布和资源量指数估算. 水产学报, 2019, 43(7): 1603-1614] |
JIN X S, HAMRE J, ZHAO X Y, et al. Study on the quota management of anchovy (Engraulis japonicus) in the Yellow Sea. Journal of Fishery Sciences of China, 2001, 8(3): 27-30 [金显仕, Hamre J, 赵宪勇, 等. 黄海鳀鱼限额捕捞的研究. 中国水产科学, 2001, 8(3): 27-30 DOI:10.3321/j.issn:1005-8737.2001.03.006] |
JIN X S, TANG Q S. Changes in fish species diversity and dominant species composition in the Yellow Sea. Fisheries Research, 1996, 26(3/4): 337-352 |
JIN X S, TANG Q S. The structure, distribution and variation of the fishery resources in the Bohai Sea. Journal of Fishery Sciences of China, 1998, 5(3): 18-24 [金显仕, 唐启升. 渤海渔业资源结构、数量分布及其变化. 中国水产科学, 1998, 5(3): 18-24 DOI:10.3321/j.issn:1005-8737.1998.03.004] |
JIN X S, ZHAO X Y, MENG T X, et al. Biological resources and habitats of the Yellow Sea and the Bohai Sea. Beijing: Science Press, 2005: 262-351 [金显仕, 赵宪勇, 孟田湘, 等. 黄、渤海生物资源与栖息环境. 北京: 科学出版社, 2005: 262-351]
|
JORDáN F, LIU W, DAVIS A J. Topological keystone species: Measures of positional importance in food webs. Oikos, 2006, 112(3): 535-546 DOI:10.1111/j.0030-1299.2006.13724.x |
JORDáN F, TAKACS-SANTA A, MOLNAR I. A liability theoretical quest for key stones. Oikos, 1999, 86(3): 453-462 DOI:10.2307/3546650 |
LI Z L, SHAN X J, JIN X S, et al. Interannual variations in the biological characteristics, distribution and stock density of anglerfish Lophius litulon in the central and southern Yellow Sea. Acta Ecologica Sinica, 2015, 35(12): 4007-4015 [李忠炉, 单秀娟, 金显仕, 等. 黄海中南部黄鮟鱇生物学特征及其资源密度的年际变化. 生态学报, 2015, 35(12): 4007-4015] |
LIBRALATO S, CHRISTENSEN V, PAULY D. A method for identifying keystone species in food web models. Ecological Modelling, 2006, 195(3/4): 153-171 |
LIU J, NING P. Species composition and faunal characteristics of fishes in the Yellow Sea. Biodiversity Science, 2011, 19(6): 158-163 [刘静, 宁平. 黄海鱼类组成、区系特征及历史变迁. 生物多样性, 2011, 19(6): 764-769] |
Lü Z B, LI F, WANG B, et al. Community structure of fish resources in spring and autumn in the Yellow Sea off Shandong. Journal of Fisheries of China, 2011, 35(5): 692-699 [吕振波, 李凡, 王波, 等. 黄海山东海域春、秋季鱼类群落结构. 水产学报, 2011, 35(5): 692-699] |
MA M L, XU S N, XU Y W, et al. Comparative study of Jiaozhou Bay ecosystem based on an Ecopath model. Journal of Fishery Sciences of China, 2018, 25(2): 413-422 [马孟磊, 徐姗楠, 许友伟, 等. 基于Ecopath模型的胶州湾生态系统比较研究. 中国水产科学, 2018, 25(2): 413-422] |
MARGALEF R. Information theory in ecology. General System, 1958, 3: 36-71 |
MILLER D A W. General methods for sensitivity analysis of equilibrium dynamics in patch occupancy models. Ecology, 2012, 93(5): 1204-1213 DOI:10.1890/11-1495.1 |
MOU X X, ZHANG C, ZHANG C L, et al. The fisheries biology of the spawning stock of Scomberomorus niphonius in the Bohai and Yellow Ses. Journal of Fishery Sciences of China, 2018, 25(6): 161-169 [牟秀霞, 张弛, 张崇良, 等. 黄渤海蓝点马鲛繁殖群体渔业生物学特征研究. 中国水产科学, 2018, 25(6): 161-169] |
ODUM E P. Fundamental of ecological. Philadelphia: Saunders College Publishing, 1953: 135-147
|
OKAMOTO K, CHEN W, LI X Y. Ranking of closeness centrality for large-scale social networks. International workshop on frontiers in algorithmics. Springer, Berlin, Heidelberg, 2008, 186-195 |
PIELOU E C. Ecological Diversity. New York: Wiley, 1975: 4-50
|
PINKAS L, OLIPHANT M S, IVERSON I L K. Food habits of albacore, bluefin tuna and bonito in Californian waters. California Department of Fish and Game Fish Bulletin, 1971, 152: 1-105 |
QIU S Y, Lü Z B, JIAO J J, et al. Study on the suitable season for exploitation and utilization of fishery resources in the Yellow Sea and the Bohai Sea. Shandong Fisheries, 2009, 26(3): 18-20 [邱盛尧, 吕振波, 焦金菊, 等. 黄渤海渔业资源适宜开发利用季节的研究. 齐鲁渔业, 2009, 26(3): 18-20] |
SHAN X J, CHEN Y L, DAI F Q, et al. Variations in fish community structure and diversity in the sections of the central and southern Yellow Sea. Acta Ecologica Sinica, 2014, 34(2): 377-389 [单秀娟, 陈云龙, 戴芳群, 等. 黄海中南部不同断面鱼类群落结构及其多样性. 生态学报, 2014, 34(2): 377-389] |
SHAN X J, LI Z L, DAI F Q, et al. Seasonal and annual variation in biological characteristics of small yellow croaker Larimichthys polyactis in the central and southern Yellow Sea. Progress in Fishery Sciences, 2011, 32(6): 7-16 [单秀娟, 李忠炉, 戴芳群, 等. 黄海中南部小黄鱼种群生物学特征的季节变化和年际变化. 渔业科学进展, 2011, 32(6): 7-16 DOI:10.3969/j.issn.1000-7075.2011.06.002] |
SHAN X J, SUN P F, JIN X S, et al. Seasonal variations of fishery resource structure in the sections of the southern Yellow Sea. Journal of Fisheries of China, 2013, 37(3): 425-435 [单秀娟, 孙鹏飞, 金显仕, 等. 黄海典型断面渔业资源结构的季节变化. 水产学报, 2013, 37(3): 425-435] |
SHANNON C E, WEAVER W. The mathematical theory of communication. Urbana IL: University of Illinois Press, 1949 |
SHI L, LI T M, LIU L T. Review on China's capture fisheries policy over 70 years of PRC's founding and its prospect. Agricultural Outlook, 2019, 1(12): 16-23, 31 [史磊, 李泰民, 刘龙腾. 新中国成立70年以来中国捕捞渔业政策回顾与展望. 农业展望, 2019, 1(12): 16-23, 31 DOI:10.3969/j.issn.1673-3908.2019.12.004] |
SUN G, SHENG L X. Theory of keystone species in ecosystems: New idea, new mechanism, new approach. Journal of Northeast Normal University (Natural Science), 2000, 32(3): 73-78 [孙刚, 盛连喜. 生态系统关键种理论: 新思想、新机制、新途径. 东北师大学报(自然科学版), 2000, 32(3): 73-78 DOI:10.3321/j.issn:1000-1832.2000.03.017] |
SUN L Q, LIN Y S, CHEN L X, et al. Analysis of ecosystem structure and function in the northern Beibu Gulf Ⅶ: Nutrition structure and keystone species selection based on Ecopath with Ecosim. Journal of Tropical Oceanography, 2016, 35(4): 51-62 [孙龙启, 林元烧, 陈俐骁, 等. 北部湾北部生态系统结构与功能研究Ⅶ: 基于Ecopath模型的营养结构构建和关键种筛选. 热带海洋学报, 2016, 35(4): 51-62] |
TANG M Z, LIAN D J, Lu Y, et al. Fisheries administration and changes of anchovy resources in the East and Yellow Sea. Fisheries Science, 2002, 21(2): 44-45 [唐明芝, 连大军, 卢岩, 等. 东黄海区鳀鱼资源变动及渔业管理. 水产科学, 2002, 21(2): 44-45 DOI:10.3969/j.issn.1003-1111.2002.02.015] |
TANG Q S, YE M Z. Exploitation and protection of fishery resources in Shandong offshore. Beijing: Agriculture Press, 1990, 22-26 [唐启升, 叶懋中. 山东近海渔业资源开发与保护. 北京: 农业出版社, 1990, 22-26] |
WANG F Z, TANG Y. Determination of key species in the food web and their impact on the robustness. Biodiversity Science, 2019, 27(10): 1132-1137 [王凤珍, 唐毅. 食物网关键种的判定及其对稳健性的影响. 生物多样性, 2019, 27(10): 1132-1137 DOI:10.17520/biods.2019208] |
WATTS D J, STROGATZ S H. Collective dynamics of 'small-world' networks. Nature, 1998, 393(6684): 440-442 DOI:10.1038/30918 |
WEI S, JIANG W M. Study on food web of fishes in the Yellow Sea. Oceanologia et Limnologia Sinica, 1992, 23(2): 182-192 [韦晟, 姜卫民. 黄海鱼类食物网的研究. 海洋与湖沼, 1992, 23(2): 182-192] |
XU B D, JIN X S, LIANG Z L. Changes of demersal fish community structure in the Yellow Sea during the autumn. Journal of Fishery Sciences of China, 2003, 10(2): 148-154 [徐宾铎, 金显仕, 梁振林. 秋季黄海底层鱼类群落结构的变化. 中国水产科学, 2003, 10(2): 148-154 DOI:10.3321/j.issn:1005-8737.2003.02.013] |
YANG J M. A study on food and trophic levels of Bohai Sea fish. Fishery Information and Strategy, 2001, 16(10): 10-19 [杨纪明. 渤海鱼类的食性和营养级研究. 渔业信息与战略, 2001, 16(10): 10-19 DOI:10.3969/j.issn.1004-8340.2001.10.002] |
YANG T, SHAN X J, JIN X S, et al. Long-term changes in keystone species in fish community in spring in Laizhou Bay. Progress in Fishery Sciences, 2018, 39(1): 1-11 [杨涛, 单秀娟, 金显仕, 等. 莱州湾春季鱼类群落关键种的长期变化. 渔业科学进展, 2018, 39(1): 1-11] |
ZHANG B, JIN X S. Seasonal variations of the functional groups of fish community and their consumption of zooplankton in the Yellow Sea. Journal of Fisheries of China, 2010, 34(4): 548-558 [张波, 金显仕. 黄海鱼类功能群及其对浮游动物捕食的季节变化. 水产学报, 2010, 34(4): 548-558] |
ZHANG B, TANG Q S, JIN X S. Decadal-scale variations of trophic levels at high trophic levels in the Yellow Sea and the Bohai Sea ecosystem. Journal of Marine Systems, 2007, 67(3/4): 304-311 |
ZHANG B, TANG Q S. Study on trophic level of important resources species at high trophic levels in the Bohai Sea, Yellow Sea and East China Sea. Advances in Marine Science, 2004, 22(4): 393-404 [张波, 唐启升. 渤、黄、东海高营养层次重要生物资源种类的营养级研究. 海洋科学进展, 2004, 22(4): 393-404 DOI:10.3969/j.issn.1671-6647.2004.04.001] |
ZHANG B, WU Q, NIU M X, et al. Variation in feeding ecology within the fish community in the north Yellow Sea. Journal of Fishery Sciences of China, 2011, 18(6): 1343-1350 [张波, 吴强, 牛明香, 等. 黄海北部鱼类群落的摄食生态及其变化. 中国水产科学, 2011, 18(6): 1343-1350] |
ZHANG G Z, LI X S, JIN X S, et al. Changes of biological characteristics of small yellow croaker (Larimichthys polyactis) in the central and southern Yellow Sea. Acta Ecologica Sinica, 2010, 30(24): 174-181 [张国政, 李显森, 金显仕, 等. 黄海中南部小黄鱼生物学特征的变化. 生态学报, 2010, 30(24): 174-181] |
ZHU J F, DAI X J, WANG X F, et al. A review of methodology in marine food-web topology. Progress in Fishery Sciences, 2016, 37(2): 153-159 [朱江峰, 戴小杰, 王学昉, 等. 海洋食物网拓扑学方法研究进展. 渔业科学进展, 2016, 37(2): 153-159] |




 Konosiruspunctatus
Konosiruspunctatus Wak tingi
Wak tingi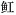 Dasyatis akajei
Dasyatis akajei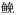 Miichthys miiuy
Miichthys miiuy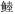 Doederleinia berycoides
Doederleinia berycoides Zonichthys nigrofasciata
Zonichthys nigrofasciata Hyporhamphus sajori
Hyporhamphus sajori Callionymus kitaharae
Callionymus kitaharae Sphyraena pinguis
Sphyraena pinguis Sillago japonica
Sillago japonica