2. 淡水鱼类资源与生殖发育教育部重点实验室 重庆 402460;
3. 河南师范大学水产学院 河南省水产动物养殖工程技术研究中心 河南 新乡 453007);
1. Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences; Key Laboratory of Leisure Fisheries
2. China Southwest University, Key Laboratory of Freshwater Fish Resources and Reproductive Development, Ministry of the Ministry of Education, Chongqing 402460, China;
3. College of Fisheries, Engineering Technology Research Center of Henan Province for;
1. Aquatic Animal Cultivation, Henan Normal University, Xinxiang, Henan 453007, China
体色是鱼类独特的表型和经济性状(Sköld et al, 2013),尤其对于观赏鱼类,体色和斑纹直接决定其观赏价值和市场价值。鱼类体色繁杂多样、五彩斑斓,深入认识鱼类体色形成的调控机制,寻求人工改良鱼类体色的有效途径,是一个非常值得探索的课题。鱼类体色的形成和维持受到一系列细胞、基因和生理因素的复杂调控(Colihueque, 2010),其体色构成不仅与色素合成有关,更取决于皮肤、鳞片和鳍条所含色素细胞的种类、数量、分布及色素细胞之间的相互作用(Inaba et al, 2012)。色素细胞是鱼类体色形成的基本单位和重要载体,目前,已报道鱼类至少有黄色素细胞(xanthophores)、红色素细胞(erythrophores)、虹彩细胞(iridophores)、白色素细胞(leucophores)、黑色素细胞(melanophores)、蓝色素细胞(cyanophores)和紫红色素细胞(erythro-iridophores) 7种不同的色素细胞(徐伟等, 2007; Goda et al, 2011; Inaba et al, 2012; Singh et al, 2015)。
成功分离和体外培养色素细胞是探究动物体色相关基因生物学功能的基础,也是了解鱼类体色形成和体色变异分子机理的前提(Gola et al, 2012; Shigeki et al, 2011)。Eisinger等(1982)通过0.25%胰酶消化处理人包皮组织后,通过添加十四烷酰佛波醇乙酸酯(TPA)和霍乱毒素(CT)首次成功分离和体外培养了人的黑色素细胞;Tamura等(1987)通过人胚胎提取物和TPA,成功从小鼠皮肤获得黑色素细胞。此后,研究者也相继在其他动物皮肤中成功分离黑色素细胞,如羊驼(Vicugna pacos)(白瑞等, 2013)、乌骨鸡(Gallus gallus)(田颖刚等, 2014)、狐(Vulpes vulpes) (鲍加荣, 2015)。但鲜见鱼类色素细胞分离培养的相关报道。本研究在参考之前哺乳动物等色素细胞提取研究的基础上,以具有典型体色褪色过程(黑色–灰色–亮黄色)的橘色双冠丽鱼(Amphilophus citrinellus)为实验对象,构建鱼类体表黑色素细胞和黄色素细胞分离、培养和鉴定方法,旨在为鱼类体色基因功能研究提供细胞模型,为利用体外培养色素细胞进行鱼类色素细胞分化和体色形成机理的相关研究奠定基础。
1 材料与方法 1.1 实验材料实验用橘色双冠丽鱼采自中国水产科学研究院珠江水产研究所观赏渔业研究基地,挑选健硕无伤的鱼暂养,黑色时期平均体长为(5.0±0.5) cm,黄色时期平均体长为(7.0±0.5) cm,保证日常投喂和正常光照,控制适宜的养殖水温(23℃~28℃)和充足的溶氧。
1.2 主要试剂K-SFM培养基、DMEM basic (1×)培养基、bFGF (碱性成纤维细胞生长因子)、大豆胰蛋白抑制剂均购自Gibco (美国);胰蛋白酶(Typsin 1∶250 for biochemistry)、EDTA(乙二胺四乙酸)、TPA、DNaseⅠ(脱氧核糖核酸酶Ⅰ)、99%胎牛血清(FBS)、胶原酶Ⅰ(CollageⅠ)、DMSO(二甲基亚砜)均购自Sigma公司(美国);左旋多巴(L-DOPA)均购自MCE(美国);牛血清蛋白、Percoll溶液购自Invitrogen公司(美国);新洁尔灭(利尔康,山东);PBS缓冲液、SSC杂交缓冲液(海利克思,上海);RNA提取试剂盒Total RNA kitⅡ购自OMEGA公司(美国);反转录试剂盒PrimeScriptTMⅡ1st Strand cDNA synthesis kit购自TaKaRa (日本);双抗原液(青霉素100 U/mL、链霉素100 μg/mL)购自中国医学科学院生物医学工程研究所;其他常规药品购自广州康龙生物科技有限公司。
1.3 实验方法 1.3.1 组织的消化处理与色素细胞分离取所需鱼鳃放血致死,用0.1%新洁尔灭洗鱼体3次,再用75%酒精消毒鱼全身。常温下取所需鱼尾鳍、皮肤、鳞片组织,将采集的组织剪碎至1 mm3大小的块状,转入50 mL离心管中,加入胰蛋白酶溶液40~45 mL,混匀,25℃~28℃下消化6~8 h。弃胰蛋白酶溶液,用1×PBS在1000 r/min离心冲洗5 min,重复5次,去除表皮组织碎块。加入胶原酶溶液混匀,25℃~28℃下消化12~15 h。转入25 μm气孔尼龙网过滤分裂组织,放置5 min,800 r/min离心8 min,过滤得液体。吸取2 mL细胞溶液样品,置于Percoll分层试剂(浓度梯度为55%-45%-35%),1000 r/min离心20~25 min,使色素细胞分离于不同浓度层。
1.3.2 色素细胞的培养、纯化与传代将分离的色素细胞悬液转移至KCl细胞培养基中,吹打均匀,取1滴溶液接种于5 mL KCl培养基的25 mL不透气培养瓶中,置于28℃培养箱中原代培养,并放入一杯水,保证培养箱内的湿度。
每3 h观察原代细胞生长情况,原代细胞长至约90%时,去培养液,胰蛋白酶消化,消化后去酶液,加入KC培养基纯化细胞,置于28℃培养箱培养,获得纯化的色素细胞。
纯化过的基础原代细胞铺满培养瓶底80%~90%时,加入MC2培养基,将细胞重悬,进行细胞传代。即在新25 mL不透气培养瓶中加入MC2培养基5 mL,加入1滴纯化过的细胞,置于28℃培养箱中培养。对2~3代细胞进行形态学观察比较。
1.3.3 色素细胞的显微观察鉴定参考常用黑色素细胞的DOPA染色法(Wang et al, 2013),分别取第3代生长旺盛的2种色素细胞各15 mL,加入4%多聚甲醛固定10 min,用1×PBS洗涤3次,加入0.1% L-DOPA溶液,孵育4 h,2 h换液1次,制作细胞爬片,鉴定色素细胞的活性和生长情况。
再各取第3代生长旺盛的2种色素细胞15 mL,1000 r/min离心3 min,弃上清液,加入1.5 mL 4%戊二醛固定液固定,保存于4℃。在JEM-1400PLUS型透射电子显微镜(日本HITACHI)下观察拍照,分析色素细胞的形态结构。
1.3.4 色素细胞体色相关基因PCR鉴定分别取第10代生长旺盛的2种色素细胞,用Total RNA KitⅡ(OMEGA)提取RNA,用PrimeScriptTMⅡ1st strand cDNA synthesis kit (TaKaRa)合成得到cDNA。
根据从NCBI的GenBank数据库中搜索与橘色双冠丽鱼序列及相关同源物种的MC1R、EDNRB、TYR基因,采用Primer Premier 6.0进行PCR引物设计(表 1),引物由广州艾基生物技术有限公司合成。以2种色素细胞提取RNA反转录的cDNA为模板,利用3对引物分别进行PCR扩增,反应体系(50 μL):ddH2O 32.5 μL,10×buffer 5 μL,dNTPs 8 μL,模板cDNA (200 ng/μL) 2 μL,Taq酶0.5 μL,正反向引物(10 μmol/L)各1 μL。PCR参数:94℃预变性4 min;94℃变性30 s,退火60 s (退火温度见表 1),72℃延伸30 s,共30个循环;72℃延伸7 min。电泳检测扩增结果。
|
|
表 1 实验所用引物 Tab.1 Primers used in this study |
以2个典型褪色时期"黑色期和黄色期"橘色双冠丽鱼为材料,提取获得的2种色素细胞均保持原有颜色(图 1A)。通过Percoll试剂55%-45%-35%浓度梯度离心分层,黑色素细胞位于梯度层的45%~35%之间(图 1B箭头b所指),而黄色素细胞位于35%浓度层上(图 1B箭头a所指)。取2种色素置于同一Percoll浓度梯度试剂离心,2种色素细胞均能明显分离和分层,黑色素细胞在下层(图 1C箭头b所指),位于45%~35%之间,黄色素细胞位于35%浓度层表面(图 1C箭头a所指)。

|
图 1 橘色双冠丽鱼色素细胞分离 Fig.1 Isolation of pigment cells from A. citrinellus A:2种色素细胞混液;B:Percoll分层后的2种色素细胞; C:同一Percoll中分层的2种色素细胞。a:黄色素细胞层;b:黑色素细胞层 A: Mixture of two pigment cells; B: Two types of pigment cells stratified by Percoll, respectively; C: Two types of pigment cells layered in the same Percoll. a: Xanthophores cell layer; b: Melanophores cell layer |
初步分离的2种色素细胞均凝聚呈絮状,形态观察发现,絮状物各自分布了大量黑色素细胞和黄色素细胞(图 2A、2B);低倍镜下观察培养的第1代色素细胞,发现黑色素细胞呈球状,有零星色素颗粒散落出细胞外(图 2C),而黄色素色素细胞全部为单个色素个体,分布在培养基表面。黄色素细胞在培养前期,细胞小,单个不聚拢(图 2D、2E);经过培养,细胞迅速生长,6~12 h覆盖培养基表面约70%后细胞个体变大,慢慢聚拢;过夜培养至覆盖培养基表面约90%时,大个体色素细胞聚拢(图 2F),与在鳞片上直接观察到的色素细胞形状大小基本一致。

|
图 2 橘色双冠丽鱼色素细胞培养后形态学观察 Fig.2 Morphological observation of A. citrinellus pigment cells in culture A和B为初步分离的黑色素细胞和黄色素细胞;C和D为培养早期呈球状的黑色素细胞和单个的椭圆形黄色素细胞;E、F为培养6 h和12 h时的黄色素细胞 A and B: Melanophore and xanthopore obtained by the cells, which are flocculated; C and D: Globular melanophores and single elliptic xanthopores in early culture; E and F: Xanthopores at 6 h and 12 h of culture |
为与分离培养的色素细胞形态进行对比,分别从橘色双冠丽鱼"黑色–灰色–黄色"体色过渡期鱼体上取下背部鳞片进行色素细胞观察,发现黑色鱼体上的色素细胞占绝大比例,黑色素细胞单个成簇状,有分散和聚拢2种形态(图 3A)。灰色鱼体上色素细胞数量少,个体小,有黑色和黄色色素同时存在,黑色素细胞颜色较黑色鱼体鳞片上的浅,为棕色,细胞个体也较小;出现的黄色素细胞为弥散状,分布于黑色素细胞下层,色素细胞不显现完整清晰的形状(图 3B)。黄色鱼体上基本无黑色素细胞,有数量较多、个体较大的黄色素细胞,有的细胞颜色较深且偏红,呈凝聚状,类似于红色素细胞(图 3C)。

|
图 3 橘色双冠丽鱼鳞片色素细胞 Fig.3 Pigment cells from scales of A. citrinellus A:黑色期;B:灰色期;C:黄色期 A: Black period; B: Gray period; C: Yellow period |
取第3代生长旺盛的黑色素细胞进行L-DOPA染色,在显微镜下观察黑素细胞染色情况,可见斑点状黑色或灰色黑色素细胞,L-DOPA染色呈阳性(图 4B)。黄色素细胞没有多巴染色,还未见黄色素细胞酶活性的方法,只能从显微镜下观察其生长情况。

|
图 4 橘色双冠丽鱼黑色素细胞的L-DOPA染色 Fig.4 L-DOPA staining of melanophores of A. citrinellus A:染色前;B:染色后 A: Before staining; B: After staining |
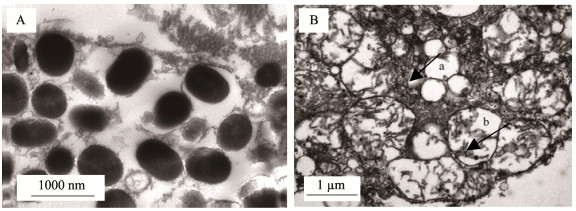
通过透射电镜观察黑色素细胞,可见其内部含大量的黑色素小体(图 5A)。电镜下,观察到黄色素细胞内部的喋呤体(图 5箭头所指a)和类胡萝卜素囊泡(图 5箭头所指b),细胞内部结构完整。
|
图 5 电镜观察黑色素细胞和黄色素细胞的显微结构 Fig.5 The ultrastructure of melanophores and xanthopores observed under electron microscopy electron microscopy A:黑色素细胞;B:黄色素细胞。a:喋呤体;b:类胡萝卜素囊泡 A: Melanophore; B: Xanthopore. a: Sepiapterin; b: Carotenoid vesicle |
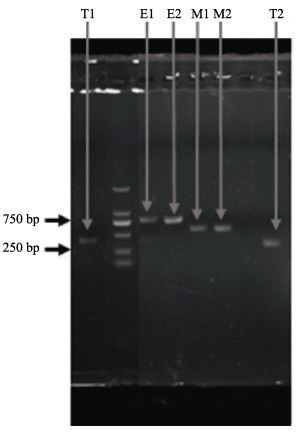
第10代生长旺盛的黑色素细胞和黄色素细胞MC1R、TYR和EDNRB的PCR检测结果显示,扩增条带特异性良好(图 6),说明获得的黑色素细胞和黄色素细胞均保持着较好的生物活性。
|
图 6 色素细胞中TYR、EDNRB和MC1R基因的PCR片段扩增 Fig.6 PCR amplification of TYR, EDNRB and MC1R fragment in pigment cells T1、E1和M1分别为TYR、EDNRB和MC1R在黄色素细胞中的表达; T2、E2和M2分别为TYR、EDNRB和MC1R在黑色素细胞中的表达 T1, E1 and M1 were amplification of TYR, EDNRB and MC1R in xanthophors respectively; T2, E2 and M2 were amplification of TYR, EDNRB and MC1R in melanophores respectively |
在细胞分离培养中,运用不同消化酶对组织进行消化处理是影响细胞提取效果的重要因素,在常用的几种组织消化酶中,DispaseⅡ酶对皮肤组织消化相对较弱,多应用于哺乳动物眼睛黑色素细胞的分离培养(鲍加荣, 2015);中性蛋白酶可选择性作用于纤维蛋白、黏连蛋白和Ⅳ型胶原,破环板桥内的结构,但对于桥粒结构作用却很少,很难将表皮完全分散;胰蛋白酶能水解细胞间质中的蛋白质,破环细胞间的半桥粒和桥粒结构,从而使细胞分散;胶原酶Ⅰ作用于结缔组织中的胶原蛋白,对细胞间质产生消化作用,且对细胞本身影响不大,能使细胞保持高活力(田颖刚等, 2014; 鲍加荣, 2015)。本研究参考Inaba等(2012)的方法并改进,在25℃~28℃下用2.5 mg/mL的胰蛋白酶消化组织6~8 h,去除表皮细胞,再用0.1 mg/mL胶原酶Ⅰ配制的溶液进行二次消化12~15 h,可分离获得活性较高的色素细胞原液。分离的2种色素细胞在Percoll梯度试剂中低速离心后分层明显,细胞层间隔35%的Percoll试剂层,推测黑色素细胞较黄色素细胞质量重,确定2种色素细胞分离时所在Percoll试剂浓度层,可为下一步实验得到培养纯化细胞奠定基础。
色素细胞体外培养一般采用K-SFM角朊细胞培养基、DMEM、M199等,比较K-SFM和DMEM/F12 2种培养基对羊驼毛囊干细胞生长和增殖的影响,发现K-SFM培养基更有利于毛囊干细胞增殖,培养出的细胞数量多、增殖快,克隆生成能力更强(弓慧敏等, 2016)。田颖刚等(2014)以K-SFM培养基为原代培养和细胞纯化,以DMEM培养基为最终传代培养,成功建立乌骨鸡黑色素细胞系。本研究借鉴哺乳动物和鸟类(Deveci et al, 2001)的培养方法加以改进,采用能抑制成纤维细胞和角朊细胞生长的K-SFM培养基进行细胞原代培养和细胞纯化,以DMEM培养基为最终传代培养,获得生理状态良好的色素细胞。
鱼类的鳞片、皮肤和尾鳍有很多胶原纤维细胞和角质细胞,数量远远大于黑色素细胞和黄色素细胞,因此,色素细胞培养中,杂细胞的去除非常关键,培养基中添加促癌因子TPA可对不同细胞产生选择性毒性作用。TPA能促进色素细胞分泌特定的生长因子,促进细胞的生长、粘附和增殖,抑制成纤维细胞及角质形成,达到避免成纤维细胞和胶质污染,从而获得纯化的色素细胞(Yaar et al, 1991)。因此,本研究在原代培养和细胞纯化时,增大TPA用量(10 ng/mL),但传代培养时,应减少TPA用量(1 ng/mL),以减少对2种色素细胞的毒性作用。
本研究在鳞片上直接观察到的黑、黄2种色素细胞个体分明,成群地分布在鳞片上,而提取到的2种色素细胞在低倍镜下观察呈絮状,但也能看到一些单个的色素细胞,为判定所提取的色素细胞有无破裂、有无增殖能力及生物活性状况等,对色素细胞进行培养后显微观察,发现2种色素细胞均能正常生长,其中,黄色素细胞迅速生长,细胞个体变大后,慢慢聚拢成球状。通过多巴染色和透射电镜来观察黑色素小体是鉴定黑色素细胞的经典方法(Deveci, 2001; Fuller et al, 2001; Hu et al, 2007)。多巴染色培养的黑色素细胞呈现阳性反应,高倍透射电镜观察黑色素细胞内部结构,显现大量黑色素小体;黄色素细胞内部可见喋呤体和类胡萝卜素囊泡,2种色素细胞内部结构与在大麻哈鱼(Oncorhynchus keta Walbaum)皮肤表面通过电镜观察到的状态相似(Djurdjevič et al, 2015),佐证本研究所建立的提取、分离和体外培养橘色双冠丽鱼体表黑、黄2种色素细胞方法的可行性。
鱼类体色的分布和形成主要由表现为黑色、棕色表型的真黑色素和表现为黄色、红色表型的褐黑色素2种黑色素的相对数量及分布决定,二者均源于黑色素合成信号通路,都在酪氨酸基因(TYR)的调控下表达(Lin et al, 2007; 王成辉, 2012)。而Agouti基因和MC1R基因在黑色素合成通路中起着类似于"开关"的作用(Adalsteinsson et al, 1987; 蒋燕玲等, 2016)。在色素细胞发育中,EDNRB基因能促进神经嵴细胞的增殖,调节神经嵴细胞分化为色素细胞(Parichy et al, 2000)。因此,本研究从黑、黄2种色素细胞中提取总RNA,检测色素细胞中体色关键基因TYR、EDNRB和MC1R的表达,发现均能扩增出特异性条带,表明获得的黑色素细胞和黄色素细胞具有良好的生物学状态。
本研究利用Percoll梯度试剂分离橘色双冠丽鱼黑色素细胞和黄色素细胞,以K-SFM培养基(添加10 ng/mL TPA)进行原代和纯化培养,最后培养于DMEM培养基,并添加1 ng/mL TPA、20 ng/mL bFGF和1%双抗的完全培养基中,建立了2种色素细胞的培养体系,并利用形态观察、多巴染色、透射电镜观察和体色相关基因表达对培养细胞的特性进行研究,为进一步构建橘色双冠丽鱼黑色素细胞和黄色素细胞系奠定基础,为了解鱼类色素细胞发育、体色形成及相关基因功能等提供参考。
ADALSTEINSSON S, HERSTEINSSON P, GUNNARSSON E. Fox colors in relation to colors in mice and sheep. Journal of Heredity, 1987, 78(4): 235-237 DOI:10.1093/oxfordjournals.jhered.a110373 |
BAI R, YU Z H, FAN R W, et al. Culture, identification of alpaca skin melanocytes in vitro. Chinese Journal of Animal and Veterinary Sciences, 2013, 44(4): 549-556 [白瑞, 于志慧, 范瑞文, 等. 羊驼皮肤黑素细胞体外培养鉴定. 畜牧兽医学报, 2013, 44(4): 549-556] |
BAO J R. Analyzing coat color differences between red and silver fox (Vulpes vulpes), pigment genes cloning and tentative functional investigation of TYRP1. Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2015 [鲍加荣. 赤狐和银黑狐毛色差异分析、色素基因克隆及TYRP1功能初步研究. 中国农业科学院博士研究生学位论文, 2015]
|
COLIHUEQUE N. Genetics of salmonid skin pigmentation: Clues and prospects for improving the external appearance of farmed salmonids. Reviews in Fish Biology and Fisheries, 2010, 20(1): 71-86 DOI:10.1007/s11160-009-9121-6 |
DEVECI M, GILMONT R R, TERASHI H, et al. Melanocyte- conditioned medium stimulates while melanocyte/keratinocyte contact inhibits keratinocyte proliferation. Journal of Burn Care and Rehabilitation, 2001, 22(1): 9-14 DOI:10.1097/00004630-200101000-00004 |
DJURDJEVIČ I, KREFT M E, SUŠNIK B S. Comparison of pigment cell ultrastructure and organisation in the dermis of marble trout and brown trout, and first description of erythrophore ultrastructure in salmonids. Journal of Anatomy, 2015, 227(5): 583-595 DOI:10.1111/joa.12373 |
EISINGER M, MARKO O. Selective proliferation of normal human melanocytes in vitro in the presence of phorbol ester and cholera toxin. Proceedings of the National Academy of Sciences of the United States of America, 1982, 79(6): 2018-2022 DOI:10.1073/pnas.79.6.2018 |
FULLER B B, SPAULDING D T, SMITH D R. Regulation of the catalytic activity of preexisting tyrosinase in black and Caucasian human melanocyte cell cultures. Experimental Cell Research, 2001, 262(2): 197-208 DOI:10.1006/excr.2000.5092 |
GODA M, OHATA M, IKOMA H, et al. Integumental reddish-violet coloration owing to novel dichromatic chromatophores in the teleost fish, Pseudochromis diadema. Pigment Cell and Melanoma Research, 2011, 24(4): 614-617 DOI:10.1111/j.1755-148X.2011.00861.x |
GOLA M, CZAJKOWSKI R, BAJEK A, et al. Melanocyte stem cells: Biology and current aspects. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2012, 18(10): A155-A159 |
GONG H M, BAI R, JIA Z F, et al. Effect of two kinds of culture medium on the alpaca hair follicle stem cell growth and proliferation. Journal of Shanxi Medical University, 2016, 47(5): 424-428 [弓慧敏, 白瑞, 贾宗菲, 等. 两种培养基对羊驼毛囊干细胞生长和增殖的影响. 山西医科大学学报, 2016, 47(5): 424-428] |
HU D N, MCCORMICK S A, SEEDOR J A, et al. Isolation, purification and cultivation of conjunctival melanocytes. Experimental Eye Research, 2007, 84(4): 662 |
INABA M, YAMANAKA H, KONDO S. Pigment pattern formation by contact-dependent depolarization. Science, 2012, 335(6069): 677 DOI:10.1126/science.1212821 |
JIANG Y L, SONG H M, LIU Y, et al. Cloning and expression analysis of the developing sequence and tissue expression of TYR gene in Amphilophus citrinellus. Journal of Agricultural Biotechnology, 2016, 24(5): 697-707 [蒋燕玲, 宋红梅, 刘奕, 等. 橘色双冠丽鱼TYR基因的克隆及其发育时序和组织表达分析. 农业生物技术学报, 2016, 24(5): 697-707] |
LIN J Y, FISHER D E. Melanocyte biology and skin pigmentation. Nature, 2007, 445(7130): 843-850 DOI:10.1038/nature05660 |
PARICHY D M, MELLGREN E M, RAWLS J F, et al. Mutational analysis of endothelin receptor b1 (rose) during neural crest and pigment pattern development in the zebrafish Danio rerio. Developmental Biology, 2000, 227(2): 294-306 DOI:10.1006/dbio.2000.9899 |
SHIGEKI O, YOICHI I, YOHEI O, et al. Generation of human melanocytes from induced pluripotent stem cells. PLoS One, 2011, 6(1): e16182 DOI:10.1371/journal.pone.0016182 |
SINGH A P, NÜSSLEIN-VOLHARD C. Zebrafish stripes as a model for vertebrate colour pattern formation. Developmental Biology, 2015, 25(2): R81-R92 |
SKÖLD H N, ASPENGREN S, WALLIN M. Rapid color change in fish and amphibians: Function, regulation, and emerging applications. Pigment Cell and Melanoma Research, 2013, 26(1): 29-38 DOI:10.1111/pcmr.12040 |
TAMURA A, HALABAN R, MOELLMANN G, et al. Normal murine melanocytes in culture. In Vitro Cellular and Developmental Biology, 1987, 23(7): 519-522 DOI:10.1007/BF02628423 |
TIAN Y G, LIAO C Y, XU D L. Primary culture and identification of skin melanocytes from black-bone silky fowl (Gallus gallus Domesticus Brisson). China Poultry, 2014, 36(12): 6-10 [田颖刚, 廖春艳, 徐德利. 乌骨鸡皮肤黑色素细胞的原代培养及鉴定. 中国家禽, 2014, 36(12): 6-10 DOI:10.3969/j.issn.1004-6364.2014.12.003] |
WANG C H. Brief summary on genetic basis of pigmentation in fish. Journal of Shanghai Ocean University, 2012, 21(5): 103-108 [王成辉. 鱼类体色变异的遗传基础研究进展简述. 上海海洋大学学报, 2012, 21(5): 103-108] |
WANG D, XU X, MA H, et al. Optimization of the method for the culture of melanocyte precursors from hair follicles and their activation by 1, 25-dihydroxyvitamin D3. Experimental and Therapeutic Medicine, 2013, 6(4): 967-972 DOI:10.3892/etm.2013.1252 |
XU W, LI C T, CAO D C, et al. Observation on scale chromatophore and body colors' genesis of carp and cruscian carp. Acta Hydrobiologica Sinica, 2007, 31(1): 67-72 [徐伟, 李池陶, 曹顶臣, 等. 几种鲤鲫鳞片色素细胞和体色发生的观察. 水生生物学报, 2007, 31(1): 67-72 DOI:10.3321/j.issn:1000-3207.2007.01.010] |
YAAR M, GILCHREST B A. Human melanocyte growth and differentiation: A decade of new data. Journal of Investigative Dermatology, 1991, 97(4): 611-617 DOI:10.1111/1523-1747.ep12482985 |



