2. 盐城工学院 水生动物免疫与疾病研究所 江苏 盐城 224051
2. Research Center of Aquatic Animal Immunity and Disease, Yancheng Institute of Technology, Yancheng, Jiangsu 224051, China
海胆与海参、海星等同属棘皮动物门(Echinodermata),是一类营底栖生活的海洋无脊椎动物,也是生物学研究中的一种模式生物。由于棘皮动物处于无脊椎动物向脊椎动物分支进化的特殊阶段,在生物进化上占据独特地位,海胆的免疫学研究可为比较免疫学提供重要资料(Smith et al, 2010)。有关紫球海胆(Strongylocentrotus purpuratus)的基因组测序结果显示,紫球海胆有近70%的基因与人类相似,同果蝇和线虫等其他模式生物相比,海胆在进化关系上与人类更接近,使得其在比较免疫学研究中的地位愈益显著(Materna et al, 2006; Rast et al, 2006)。海胆的石灰质外壳中充满体腔液,其由变形吞噬细胞、色素细胞、纤毛游走细胞、无色球形细胞等多种体腔细胞与细胞外液组成。海胆的体腔细胞类似于一般无脊椎动物中所述的血细胞,不仅具有营养输送、气体交换等生理功能,还在免疫防御中承担重要角色(de Faria et al, 2008)。海胆只存在非特异性免疫,其免疫应答是由体腔中的体腔细胞和多种体液免疫因子共同介导的。体腔细胞通过吞噬、细胞杀伤、趋化修复等发挥细胞免疫功能,还通过合成与分泌凝集素、穿孔素、溶酶体酶等多种免疫因子广泛参与机体的体液免疫(Deveci et al, 2015)。
血细胞的来源与发生机制一直是无脊椎动物免疫基础研究的焦点问题之一,探明血细胞的增殖来源与造血过程可为深入研究机体的免疫系统和免疫机制提供依据(Jia et al, 2016)。目前,对于无脊椎动物造血作用的相关了解多集中于节肢动物,对其他门类的研究比较匮乏(Noonin et al, 2012)。Grigorian等(2013)研究显示,昆虫和其他节肢动物具有明确的造血器官,其中,未成熟的血细胞前体(前血细胞)以及分化成熟的血细胞分别分布于造血器官的不同区域,而不同节肢动物造血器官的位置与内部结构差异较大。与其他动物的血细胞一样,海胆的体腔细胞也具有修复与更新机制,以维持机体稳定。目前,针对海胆体腔细胞的来源仅有一些推测,有观点认为,海胆体腔细胞具有分裂增殖能力,而另一种观点则认为,海胆体腔细胞来源于腹膜上皮和中轴器等造血组织,其中,中轴器是最主要的来源部位(da Silva, 2013)。中轴器(轴腺)位于海胆口咽部与反口面筛板连线的中轴区域,外呈细长状,内具复杂的可收缩结构与腔隙,腺体特征显著,被认为是海胆围脏腔、水管系统及血系统的交汇组织(Millott et al, 1968)。早期研究对海胆中轴器的功能判断不一,包括排泄、生产色素、循环以及免疫、产生体腔细胞等多种功能,然而均未得到证实(Millott, 1966; Millott et al, 1968; Welsch et al, 1987; Ziegler et al, 2009)。
中间球海胆(Strongylocentrotus intermedius),又称虾夷马粪海胆,于1989年自日本引入中国,其味道鲜美,营养价值高,还具有极高的药用价值,为我国黄渤海区域重要的经济物种(Chang, 2008; 张伟杰等, 2010)。作者前期以抗中间球海胆体腔细胞单克隆抗体为工具,定位显示,海胆中轴器中含有大量体腔细胞,确定中轴器至少是中间球海胆体腔细胞的储藏器官(Wang et al, 2018)。为了进一步研究中间球海胆体腔细胞的来源,本研究通过人工抽取体腔液的方法刺激体腔细胞的补充更新,进而观察分析体腔细胞的恢复规律,观察中轴器组织结构及细胞增殖信号的变化,以期为揭示海胆体腔细胞的发生机制提供依据。
1 材料与方法 1.1 海胆中间球海胆[2龄,(50±10) g]购自辽宁省大连旅顺龙王塘海胆养殖场,于农业农村部北方海水增养殖重点实验室活体培养室养殖,实验前驯养14 d。养殖槽水体为3 m3,水深约为1.2 m,水温为20℃,保持充氧,每2 d投喂海带1次、更换1/3海水,并吸底清除排泄物。
1.2 体腔液安全抽取量的确定取3枚海胆于解剖盘中静置沥水,待重量趋于稳定后称重。使用手术剪沿围口膜外缘剪开,使用移液枪吸取全部体腔液,称重、计算体腔液与海胆体重的质量比。取9枚海胆,分为3组,使用无菌注射器自围口膜穿刺,分别抽取海胆体质量5%、10%和15%的体腔液,之后,正常养殖并密切观察14 d。抽取体腔液后,海胆仍能维持正常状态并继续存活的抽取量视为安全抽取量。
1.3 体腔细胞的恢复规律取28枚海胆,按1.2确定的最大安全抽取量,使用预装有CMFSW-EI缓冲液(449 mmol/L NaCl, 33 mmol/L Na2SO4, 9 mmol/L KCl, 2.5 mmol/L NaHCO3, 30 mmol/L EDTA, 50 mmol/L imidazole, pH 7.4) (Brockton et al, 2008)的注射器自围口膜穿刺、抽取海胆体腔液,使体腔液与缓冲液体积比为1∶1,并及时混匀。CMFSW-EI缓冲液具有抗凝集、维持细胞形态的作用。采用血球计数板显微镜下计数,计算每个海胆的初始体腔细胞密度,并进行标记。将抽取过体腔液的海胆放回水槽正常养殖,6、12、18和24 h后分别取7枚海胆,各抽取0.5 mL体腔液,并计算体腔细胞密度。根据每个海胆的初始体腔细胞密度与取样时体腔细胞密度,计算各组体腔细胞密度均值,进行独立样本t检验,以下列公式计算体腔细胞恢复度:
| $ 恢复度=取样时间点体腔细胞密度/初始体腔细胞密度×100\% $ |
统计各组恢复度均值,并通过单因子方差分析(one-way ANOVA)中的Duncan方法进行多重比较。各组海胆在测定体腔细胞密度后,继续用作后续分析的样品。
1.4 中轴器组织学观察取正常海胆3枚,并从1.3各组中分别选取3枚海胆,自围口膜外缘向反口面方向剪开石灰质外壳,至约1 cm处转为环向剪开,将海胆分为2部分,取下中轴器。中轴器使用PBS清洗3次后放入波恩氏液固定,24 h后流水冲洗12 h,随后,70%酒精冲洗。参考赵彦花等(2019)的方法,经70%~100%梯度酒精脱水、二甲苯透明、石蜡包埋及切片后,采用HE染色试剂盒(Solarbio)染色。使用显微镜(Leica DM2500, 德国)观察拍照。
1.5 中轴器内细胞增殖信号检测取正常海胆3枚,并从1.3各组中分别选取3枚海胆,按1.4中描述的方法解剖分离中轴器,经冰冻包埋剂OCT (Sakura)包埋后置于‒20℃冰箱冷冻。使用Leica CM1900冰冻切片机制片,经冰冻丙酮固定后滴加鼠抗人Ki-67单克隆抗体(Sigma),37℃孵育45 min。PBS洗涤3次后滴加FITC标记的羊抗鼠IgG二抗(Sigma),37℃孵育45 min。PBS洗涤3次,滴加actin染色剂Alexa Fluor® 555 phalloidin (Sigma)室温染色20 min,PBS洗涤3次,甘油封片,使用显微镜(Leica DM2500, 德国)观察、拍照。阴性对照使用PBS替代Ki-67单克隆抗体,其他步骤同上。
2 结果 2.1 海胆体腔液的安全抽取量通过统计发现,正常中间球海胆体腔液占海胆总体质量的(26.24±1.29)%。抽取5%体质量的体腔液后14 d内,海胆摄食正常,管足完全伸出、附着于笼壁上,全部存活;抽取10%体质量的体腔液后14 d内,海胆摄食正常,可伸出管足附着于笼壁上,全部存活;抽取15%体质量的体腔液后,海胆基本无摄食,管足伸展状态逐渐变差并失去吸附、运动能力,5 d后全部死亡。因此,海胆体腔液安全抽取量定为体质量的10%以内,约为总体腔液的36%~40%。
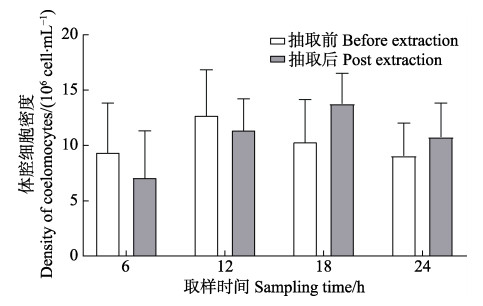
2.2 体腔细胞的恢复规律正常状态下,中间球海胆体腔细胞密度为(10.13± 3.08)×106 cells/mL (N=28),个体差异较大,最大和最小测定密度分别为15.68×106和5.18×106 cells/mL。为保证数据统计的准确性及可靠性,以每个海胆的初始体腔细胞密度与取样时体腔细胞密度为基础,分析体腔细胞的恢复规律(图 1、图 2)。人工抽取体腔液6 h后,海胆体腔细胞密度为(5.70±1.43)×106 cells/mL,低于初始密度[(8.30±3.00)×106 cells/mL],但差异不显著(P > 0.05)。6 h后恢复度为(74.94±29.42)%,但其中有28.6%的个体恢复度略高于100%。
|
图 1 各组海胆体腔细胞密度变化 Fig.1 Variety of coelomocyte density in each group 各组海胆体腔细胞密度(抽取前与抽取后相比)差异均不显著(P > 0.05) The differences of the coelomocytes density in each groups (before extraction vs post extraction) were not significant (P > 0.05) |
|
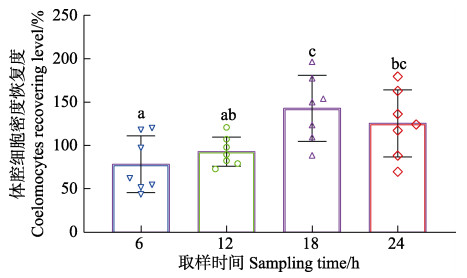
图 2 中间球海胆体腔细胞恢复情况 Fig.2 Recovering of coelomocytes in S. intermedius 不同字母表示具有显著性差异(P < 0.05) Different letters showing significant differences (P < 0.05) |
人工抽取体腔液12 h后,体腔细胞密度为(11.41±2.18)×106 cells/mL,略低于初始密度[(12.75±2.64)× 106 cells/mL],但差异不显著(P > 0.05)。12 h后体腔细胞恢复度为(92.78±29.40)%,其中,42.9%的个体接近甚至超过初始水平,57.1%的个体低于初始水平。
人工抽取体腔液18 h后,体腔细胞密度为(14.00± 2.15)×106 cells/mL,高于初始密度[(11.04±3.59)× 106 cells/mL],但差异不显著(P > 0.05)。18 h后,体腔细胞恢复度为(137.08±32.40)%,恢复度高于150%的海胆有42.9%,与初始水平持平的个体为28.6%。
人工抽取体腔液24 h后,体腔细胞密度为(10.78±2.08)×106 cells/mL,高于初始密度[(8.91±2.44)× 106 cells/mL],但差异不显著(P > 0.05)。24 h后,体腔细胞恢复度为(125.41±29.24)%,其中,恢复度高于150%的海胆有28.6%,其余个体大多超过初始水平。
恢复度随时间的延长逐渐升高,18 h达到高峰,随后降低,其中,18 h组体腔细胞恢复度显著高于6 h和12 h组(P < 0.05);24 h组恢复度显著高于6 h组(P < 0.05),但与12 h和18 h组相比无显著差异(P > 0.05)。
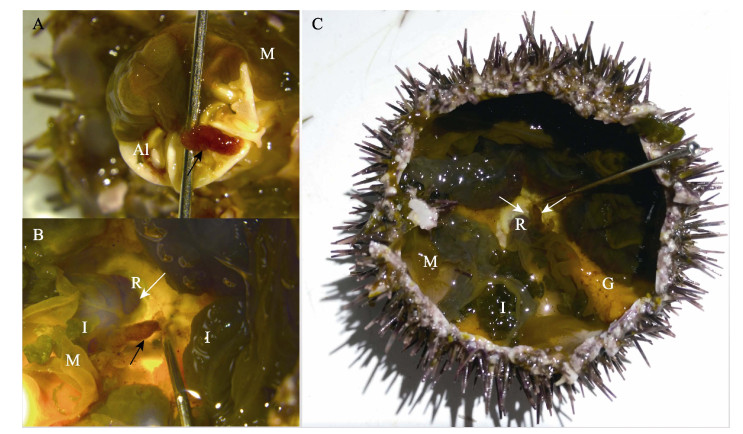
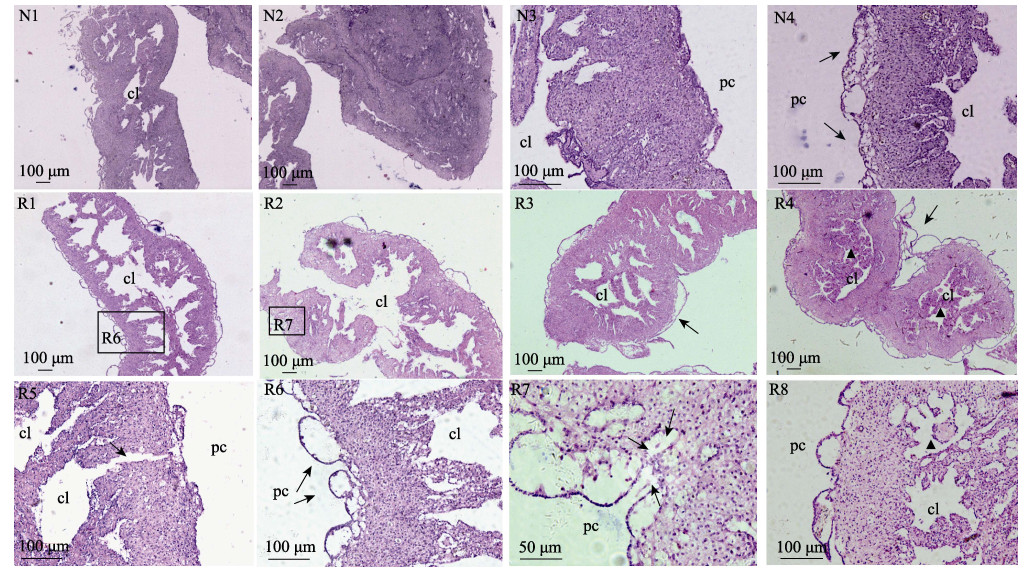
2.3 中轴器组织学观察中间球海胆中轴器为细长的红色囊状组织,长为3~6 mm,解剖后常附于亚氏提灯(口器)(图 3A)或肛门附近(图 3B、图 3C)。石蜡切片观察发现,正常中间球海胆中轴器外层为相对致密的结缔组织,中央为非规则形状的空腔即中央腔,中央腔外缘组织较为疏松,充满复杂的腔隙(图 4N1);尖端部位组织致密、无中央腔(图 4N2);一些部位的外壁上皮细胞层平整严密(图 4N1、图 4N3),有些部位的外壁上皮细胞层向围脏腔弥散或凸起,形成内具稀疏组织的褶皱或泡状结构(图 4N1、图 4N4)。
|
图 3 中间球海胆中轴器 Fig.3 Axial organ of S. intermedius A:中轴器附于亚氏提灯(口器)上;B、C:中轴器附于肛门附近Al:亚氏提灯/口器;M:系膜;R:直肠;I:肠道;G:性腺;黑色箭头示中轴器;白色箭头指示肛门位置 The axial organ attached to Aristotle's lantern (A) or anus (B, C) Al: Aristotle's lantern; M: Mesentery; R: Rectum; I: Intestine; G: Gonad; The black arrows indicating axial organ; the white arrows indicating the position of anus |
|
图 4 体腔细胞修复期海胆中轴器组织结构 Fig.4 Tissue observation of axial organ in coelomocyte recovering stage N1~N4:正常中间球海胆中轴器组织切片,其中,N1为中段部位,N2示尖端部位,N3、N4示中轴器外层组织结构细节,其外壁上皮细胞层呈现不同类型;R1~R4分别为抽取体腔液后6、12、18和24 h的海胆中轴器整体结构,箭头示外壁上皮细胞层空泡化、崩解、脱落,R4中小三角示中央腔内的新生组织;R5~R6:6 h后中轴器组织结构细节,R5中箭头指示中央腔向外延伸的通道,R6中箭头指示外壁上皮细胞凸起空泡化;R7:12 h后中轴器,箭头示中轴器向围脏腔释放细胞;R8:24 h后中轴器,三角示中轴器腔隙中的新生组织。cl:中央腔;pc:围脏腔 N1~N4: Histology of axial organ from normal S. intermedius, in which N1 showing middle area, and N2 showing the top end, N3~N4 showing exterior zone details in axial organ with different types of outer wall epidermal layer; R1~R4 indicating the whole structure of axial organs from uchins at 6, 12, 18 and 24 h post exctraction, arrows here indicating vacuolation, disintegration and detachment of outer wall epidermal layer, the triangle indicating new tissue in central lumen; R5~R6: Structure detail of axial organs at 6 h, the arrow in R5 indicating the channel extended from central lumen to outer space, the arrow in R6 indicating vacuolation in bulge of epidermal layer; R7 from axial organ at 12 h post extraction, the arrow here indicating coelomocytes released from axail organ to perivisceral coelom; R8 from axial organ at 12 h post extraction, the triangle indicating new tissue in cavity of axial organ. cl: Central lumen; pc: Perivisceral coelom |
损失体腔细胞6 h后,海胆的中轴器明显空腔化,其内部疏松组织大量消减甚至缺失,部分区域仅剩外部致密组织与异常扩大的中央腔(图 4R1);外壁上皮细胞出现崩解现象(图 4R1),向体腔伸出的结构也呈现空泡化,内部细胞基本消失(图 4R6)。12 h后,中轴器也表现出明显的空腔化特征,外壁上皮细胞层出现崩解、脱离,凸起结构空泡化(图 4R2)。18 h后,中轴器仍表现为空腔化,且尖端部位也出现大量空腔,外壁上皮细胞层凸起空泡化甚至大片脱离,但其内部疏松组织略有增加(图 4R3)。24 h后,中轴器外壁上皮细胞层大面积脱落,器官略呈现皱缩状态,但内部出现较多新生组织,中央腔空隙明显减少(图 4R4),靠近致密层邻近的腔隙内也出现新生组织(图 4R8)。此外,在6 h后中轴器中观察到由中央腔经外部致密区向外部延伸的通道(图 4R5),而外壁上皮细胞层与下层结缔组织形成的陷窝部位有细胞自中轴器向外迁徙(图 4R7)。
2.4 中轴器内细胞增殖信号观察通过间接免疫荧光检测发现,各海胆的中轴器与鼠抗人Ki-67单克隆抗体均呈阳性反应,但同一时间点不同个体的样品之间存在一定差异。正常海胆中轴器的Ki-67信号较弱(图 5A1);抽取体腔液6 h、12 h后大部分样品的阳性信号与对照无明显差异;抽取体腔液18 h (图 5B1)和24 h后,样品中Ki-67信号明显增强,荧光信号呈点状、均匀分布,但2组之间无明显差异。海胆中轴器与PBS反应均呈阴性(图 5C1)。

|
图 5 中轴器内细胞增殖信号检测 Fig.5 Detection of cell production signal in axial A1:正常海胆中轴器与Ki-67抗体反应结果;B1:抽取体腔液后18 h的海胆中轴器与Ki-67抗体反应结果;C1为阴性对照。A2、B2和C2分别为A1、B1和C1同视野Actin染色对照 A1 showing the reaction between normal urchin axial organ and antibody of Ki-67; B1 showing the reaction between axial organ post 18h and antibody of Ki-67; C1 showing the negtive control. A2, B2 and C2 were the same field of A1, B1 and C1, where actin was stained |
正常状态下,海胆体腔细胞的自我更新比较缓慢,为研究海胆体腔细胞的组织来源及发生机制,本研究通过人工抽取体腔液的方法刺激体腔细胞的补充更新。经测定,2龄海胆体腔液质量占总体质量的(26.24±1.29)%,与同为棘皮动物的刺参[(25.24± 2.91)%~(30.98±1.86)%]相近(王印庚等, 2010)。海胆体腔液的安全抽取量为体质量的10%,约为总体腔液的36%~40%,远高于刺参体腔液的安全抽取量(体质量1.5%以内)(王印庚等, 2010),这可能与物种间的组织构造差异较大有关。
本研究发现,海胆在人工抽取体腔液后6 h,体腔细胞密度明显低于初始值,其原因可能是由于体腔液容积的恢复速度要快于体腔细胞的恢复速度,这与刺参吐脏后体腔液容积快速恢复(吐脏后2 h)结果一致(Li et al, 2018)。在人工抽取体腔液后12 h,海胆体腔细胞密度已恢复至原有水平,18 h时达到高峰,24 h时又恢复至原有水平。由此可见,海胆在损失体腔细胞后,机体会启动快速的补充机制,体腔中迅速聚集大量甚至过量的体腔细胞,随后又通过某种负反馈调节机制将体腔细胞密度降低到正常水平。这一结果与王印庚等(2010)对刺参体腔液穿刺抽取后体腔细胞恢复过程研究不同,刺参在抽取少量(体质量的1.5%)体腔液后总细胞浓度恢复时间为4 d;但与Li等(2018)的研究中刺参吐脏后体腔细胞的恢复规律比较一致,体腔细胞数量在吐脏后6 h时与吐脏前已无显著差异。本研究中,海胆体腔液的抽取量较大,约占体腔液总量的40%,有效刺激了体腔细胞的快速修复。
本研究发现,正常中间球海胆中轴器外层为相对致密的结缔组织,中央为非规则形状的中央腔,中央腔外缘组织较为疏松,充满复杂的腔隙,其与Diadema antillarum及Paracentrotus lividus等海胆的中轴器组织结构相似(Millott et al, 1968; Welsch et al, 1987),这些特殊结构可能与中轴器的造血功能密切相关。与此相似,甲壳动物的造血组织由结缔组织包围,其内也存在大量微管、腔隙网络等结构(Hose et al, 1968; Mats et al, 2000)。本研究发现,中间球海胆损失体腔细胞后,中轴器明显空腔化,其内部疏松组织大量消减甚至缺失,外壁上皮细胞出现崩解现象,向体腔伸出的结构也呈现空泡化。分析可能是由于中轴器内储存的体腔细胞大量释放到体腔中,中轴器的中央内腔扩大、外围组织皱缩,进而使得表皮细胞层崩解、脱落。24 h后,中轴器内部出现明显的新生组织,说明此时中轴器已开始积极修复自身的细胞损失与组织损伤。此外,本研究还发现,中间球海胆损失体腔细胞后,中轴器具有由中央腔向外部延伸的通道,而外壁上皮细胞层与下层结缔组织形成的陷窝部位有细胞自中轴器向外迁徙,推测与中轴器向围脏腔释放体腔细胞有关。Millott等(1968)研究认为,海胆中轴器具有生产和外泌功能,可将分泌物释放进腔隙陷窝、中央腔、微管或直接从器官的外表面进入围脏腔。因此,中轴器内存储的体腔细胞也可能通过一些通道及组织表面的直接扩散释放至体腔内,或通过腔隙释放至中央腔内,再经由未知的通道进入体腔。关于体腔细胞的释放途径和释放机制还有待深入研究。
Ki-67蛋白是细胞周期相关的一种核蛋白,主要表达于细胞增殖分裂的各个时期(G1、S、G2和M期),但在静息的细胞(G0期)中不表达,常用于检测肿瘤细胞的生长指数。此外,Ki-67蛋白也可用于其他细胞的增殖检测,Della Noce等(2019)曾利用Ki-67细胞增殖蛋白抗体对无脊椎动物扁虱(Rhipicephalus microplus)胚性细胞系的细胞增殖情况进行相关研究。本研究通过间接免疫荧光检测发现,鼠抗人Ki-67单克隆抗体可与正常海胆中轴器反应,但信号较弱,提示正常海胆中轴器中存在低水平的细胞增殖,以对体腔细胞的正常消耗进行补充,维持机体平衡。抽取体腔液18 h和24 h后,中轴器中Ki-67信号明显增强,表明在大量损失体腔细胞后,中轴器可能启动了积极的造血程序,细胞增殖活跃。
综上所述,本研究确定了中间球海胆体腔液的最大安全抽取量为体质量的10%,损失体腔细胞后,机体会启动快速恢复机制;中轴器在体腔细胞大量损失后组织结构发生明显变化,组织内细胞增殖活动明显增强。研究结果为海胆体腔细胞的造血组织与发生机制研究提供了科学依据。
BROCKTON V, HENSON J H, RAFTOS D A, et al. Localization and diversity of 185/333 proteins from the purple sea urchin- Unexpected protein-size range and protein expression in a new coelomocyte type. Journal of Cell Science, 2008, 121(3): 339-348 DOI:10.1242/jcs.012096 |
CHANG Y Q. Aquaculture of edible Echinoderms in China. Global Aquaculture Advocate, 2008, 11(3): 38-39 |
DA SILVA J R M C. Immunology in sea urchins. In: LAWRENCE J M (ed). Sea urchins: Biology and ecology. (3rd ed). London: Elsevier, 2013, 187-194
|
DE FARIA M T, DA SILVA J R M C. Innate immune response in the sea urchin Echinometra lucunter (Echinodermata). Journal of Invertebrate Pathology, 2008, 98: 58-62 DOI:10.1016/j.jip.2007.10.004 |
DELLA NOCE B, DE CARVALHO UHL M V, MACHADO J, et al. Carbohydrate metabolic compensation coupled to high tolerance to oxidative stress in ticks. Scientific Reports, 2019, 9(1): 4753 DOI:10.1038/s41598-019-41036-0 |
DEVECI R, ŞENER E, İZZETOĞLU S. Morphological and ultrastructural characterization of sea urchin immune cells. Journal of Morphology, 2015, 276(5): 583-588 DOI:10.1002/jmor.20368 |
GRIGORIAN M, HARTENSTEIN V. Hematopoiesis and hematopoietic organs in Arthropods. Development Genes and Evolution, 2013, 223(1/2): 103-115 |
HOSE J E, MARTIN G G, TIU S, et al. Patterns of hemocyte production and release throughout the molt cycle in the penaeid shrimp Sicyonia ingentis. Biology Bulletin, 1992, 183(2): 185-199 DOI:10.2307/1542206 |
JIA Z H, KAVUNGA S, JIANG S, et al. The characterization of hematopoietic tissue in adult Chinese mitten crab Eriocheir sinensis. Developmental and Comparative Immunologly, 2016, 60: 12-22 DOI:10.1016/j.dci.2016.02.002 |
LI Q, REN Y, LIANG C L, et al. Regeneration of coelomocytes after evisceration in the sea cucumber, Apostichopus japonicus. Fish and Shellfish Immunology, 2018, 76: 266-271 DOI:10.1016/j.fsi.2018.03.013 |
MATERNA S C, BERNEY K, CAMERON R A. The S.purpuratus genome: A comparative perspective. Developmental Biology, 2006, 300(1): 485-495 DOI:10.1016/j.ydbio.2006.09.033 |
MATS W J, PIA K. Crustacean haemocytes and haematopoiesis. Aquaculture, 2000, 191(1/2/3): 45-52 |
MILLOTT N, VEVERS H G. The morphology and histochemistry of the echinoid axial organ. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 1968, 253(784): 201-230 |
MILLOTT P N. A possible function for the axial organ of echinoids. Nature, 1966(209): 594-596 |
NOONIN C, LIN X, JIRAVANICHPAISAL P, et al. Invertebrate hematopoiesis: An anterior proliferation centre as a link between the hematopoietic tissue and the brain. Stem Cells and Development, 2012, 21(17): 3173-3186 DOI:10.1089/scd.2012.0077 |
RAST J P, SMITH L C, LOZA-COLL M, et al. Genomic insights into the immune system of the sea urchin. Science, 2006, 314(5801): 952-956 DOI:10.1126/science.1134301 |
SMITH L C, GHOSH J, BUCKLEY K M, et al. Echinoderm immunity. In: SÖDERHÄLL K (eds). Invertebrate immunity. Advances in Experimental Medicine and Biology, Boston, MA: Springer, 2010, 708
|
WANG Y G, LIAO M J, HAO Z K, et al. Coelomocyte resume of sea cucumber Apostichopus japonicus after puncturable extraction of the coelomic fluid. Progress in Fishery Sciences, 2010, 31(5): 52-58 [王印庚, 廖梅杰, 郝志凯, 等. 刺参体腔液穿刺抽取后细胞恢复过程的初步研究. 渔业科学进展, 2010, 31(5): 52-58 DOI:10.3969/j.issn.1000-7075.2010.05.009] |
WANG Y N, MENG S D, ZHANG J L, et al. Production, characterization and application of monoclonal antibodies to the coelomocytes of sea urchin Strongylocentrotus intermedius. Fish and Shellfish Immunology, 2018, 75: 301-307 DOI:10.1016/j.fsi.2018.01.048 |
WELSCH U, REHKÄMPER G. Podocytes in the axial oragn of echinoderms. Journal of Zoology, 1987, 213(1): 45-50 DOI:10.1111/j.1469-7998.1987.tb03675.x |
ZHANG W J, CHANG Y Q, ZHAO C, et al. Effects of phenotypic traits on gonad traits in sea urchins Strongylocentrotus intermedius. Progress in Fishery Sciences, 2010, 31(3): 49-55 [张伟杰, 常亚青, 赵冲, 等. 虾夷马粪海胆表型性状对性腺性状的影响效果分析. 渔业科学进展, 2010, 31(3): 49-55 DOI:10.3969/j.issn.1000-7075.2010.03.008] |
ZHAO Y H, OU Y J, LI J E, et al. Histology and distribution of mucous cells in digestive system of Bahaba flavolabiata. Progress in Fishery Sciences, 2019, 40(3): 80-86 [赵彦花, 区又君, 李加儿, 等. 黄唇鱼消化系统组织结构及黏液细胞分布特征. 渔业科学进展, 2019, 40(3): 80-86] |
ZIEGLER A, FABER C, BARTOLOMAEUS T. Comparative morphology of the axial complex and interdependence of internal organ systems in sea urchins (Echinodermata: Echinoidea). Frontiers in Zoology, 2009, 6(1): 10 DOI:10.1186/1742-9994-6-10 |



