2. 天津市水产研究所 天津 300221;
3. 天津市动物疫病预防控制中心天津 300221;
4. 天津市凯润淡水养殖有限公司天津 300221
2. Tianjin Fishery Research Institute, Tianjin 300221, China;
3. Prevention and Cure Center for Animal Disease in Tianjin, Tianjin 300221, China;
4. Tianjin Kairun Freshwater Aquaculture Co. Ltd, Tianjin 300221, China
口服疫苗具有使用方便、应激性小、不受鱼体大小限制等优点,但由于其免疫效果不佳而在水产养殖生产中很少被使用(Adelmann et al, 2008; Vandenberg, 2004)。抗原易被消化道中的胃酸和消化酶破坏被认为是影响其免疫保护效果的主要原因之一(Ellis, 1998)。为了解决该问题,通常使用海藻酸盐和乙基纤维素等基质将疫苗包被,帮助抗原抵抗胃和前肠的不良环境,使其顺利到达中肠和后肠,从而被免疫细胞吸收、分解和呈递,激发免疫应答(Vervarcke et al, 2002; Joosten et al, 1997; Romalde et al, 2004)。这种方式虽然能有效减少胃酸和消化酶对抗原的破坏,但同时也会因基质的存在阻碍抗原的吸收,从而影响免疫效果(Lillehaug, 1989)。此外,相对于哺乳动物而言,鱼类中肠和后肠较短,导致食物在肠道中存留时间短,给口服疫苗制备工艺带来挑战。
酵母菌、芽孢杆菌是水产动物常用的益生菌(樊英等, 2021; 杨运楷等, 2020)。近年来,利用这些微生物作为载体表达病原的保护性抗原基因及制备鱼类口服疫苗的方法引起研究人员的关注。Liu等(2020)利用酵母菌表达疱疹病毒(Cyprinid herpesvirus 3) ORF131基因,制备成口服疫苗,能使抗原顺利到达中肠,并给建鲤(Cyprinus carpio var. Jian)提供53.33%~66.67%的免疫保护率。耿小雪等(2016)利用毕赤酵母(Pichia pastoris)成功表达了白斑病毒综合征病毒VP28和VP26蛋白,为疫苗的制备奠定了基础。利用枯草芽孢杆菌(Bacillus subtilis)呈递白斑综合征病毒VP28蛋白时发现,通过拌料投喂能使VP28蛋白顺利到达凡纳滨对虾(Litopenaeus vannamei)的中肠和肝胰腺,并激活对虾的先天性免疫系统,免疫保护率为80.06% (Fu et al, 2011; 沈文英等, 2012),比利用vp28基因制备的核酸疫苗具有更高的免疫保护率(张敬艳等, 2012)。Jiang等(2019)利用枯草芽孢杆菌表达草鱼呼肠孤病毒VP4蛋白制备成口服疫苗,受免草鱼(Ctenopharyngodon idellus)的肠道和血清中特异性抗体都有显著提升,并具有47%的免疫保护效果。Yao等(2019)利用枯草芽孢杆菌表达了无乳链球菌(Streptococcus agalactiae)的Sip蛋白,制备成口服疫苗,发现该疫苗能同时引起罗非鱼(Oreochromis niloticus)的系统免疫应答和黏膜免疫应答,并提供41.7%的免疫保护效果。
柱状黄杆菌(Flavobacterium columnare)是鱼类细菌性烂鳃病的病原,该菌宿主范围广泛,可以感染大部分的淡水鱼(DeClercq et al, 2013)。在前期研究中,我们筛选到柱状黄杆菌的保护性抗原基因lip,其原核表达蛋白能激发草鱼的免疫应答,并提供64%的免疫保护效果(Luo et al, 2016)。本研究利用枯草芽孢杆菌为载体表达lip基因,制备成口服疫苗免疫草鱼,测定其免疫保护效果,旨在为鱼类细菌性烂鳃病的预防奠定基础。
1 材料与方法 1.1 菌株、质粒、抗体和实验鱼柱状黄杆菌G4株由中国科学院水生生物研究所聂品研究员馈赠。pBE2R质粒和枯草芽孢杆菌B. subtilis WB800菌株由本实验室保存。兔抗柱状黄杆菌lip蛋白多克隆抗体委托南京金斯瑞生物科技有限公司制备。利用Optimum AntigenTM软件,预测柱状黄杆菌lip蛋白的抗原位点,选择抗原性较强的肽段CIDLDLNKIKKNLKA进行合成,与偶联载体蛋白(血蓝蛋白KLH)连接后对新西兰兔进行免疫,2周后重复免疫1次。免疫后的第8周采血,ELISA方法检测抗体效价,达到1∶51200。带HRP标记的羊抗兔IgG购自美国Thermo Fisher Scientific公司。实验用草鱼体长为(10.21±1.13) cm,由天津市金锁淡水鱼养殖专业合作社提供,无发病史,实验前参照Darwish等(2004)的方法进行柱状黄杆菌检测,结果为阴性。
1.2 载体的构建根据NCBI数据库中的登录号(gi36590181),查找柱状黄杆菌lip基因的核酸序列,根据芽孢杆菌密码子偏好性进行优化,委托生工生物工程(上海)股份有限公司合成lip基因,并在序列两端分别加上PstⅠ和SphⅠ酶切位点。用T4连接酶将双酶切后的lip基因片段和双酶切后的pBE2R载体进行连接后,以质粒形式转入枯草芽孢杆菌WB800感受态细胞(Xue et al, 1999),用PCR方法进行检测,并获得阳性克隆株B. subtilis WB800 (pBE2R-lip)。将B. subtilis WB800 (pBE2R-lip)接种于含50 µg/mL卡那霉素的LB培养液,28℃、150 r/min培养24 h后,6000×g、10 min离心收集细菌,使用质粒提取试剂盒[天根生化科技(北京)有限公司]提取质粒,用PstⅠ和SphⅠ限制性内切酶对质粒进行双酶切和测序验证。
1.3 SDS-PAGE和West-blotting检测将菌株B. subtilis WB800 (pBE2R-lip)按照1∶100的比例接种于发酵培养基(2.5%酵母粉,1.5%蛋白胨,0.3% K2HPO4,1%葡萄糖),28℃ 150 r/min培养,分别在24 h和48 h取样。6000×g离心30 min后,取上清液,用超滤管浓缩20倍,为分泌蛋白样品。菌体用等体积PBS重悬,冰上超声破碎10 min后,12, 000×g离心30 min,取上清液,用超滤管浓缩20倍,为胞浆蛋白样品。将不含lip基因的菌株B. subtilis WB800 (pBE2R)设为对照,通过SDS-PAGE电泳比较外泌蛋白和胞浆蛋白的组成。
将24 h和48 h的分泌蛋白和菌体蛋白SDS- PAGE电泳后,80 V电压转膜45 min,将蛋白转移至PVDF膜上,依次用PBST溶液漂洗3次,每次5 min。用含5%脱脂奶粉的PBST室温封闭l h后,加入一抗(兔抗lip蛋白多克隆抗体,1∶1000倍稀释)室温孵育l h,PBST洗膜3次,每次5 min。加入二抗(带HRP标记的羊抗兔IgG,1∶5000倍稀释)室温孵育l h,用PBST洗膜3次,每次5 min,最后显色。
1.4 芽孢生成率的测定用发酵培养基对B. subtilis WB800 (pBE2R-lip)进行28℃、150 r/min培养48 h后,用平板计数法计算菌液中细菌活体的数量。此外,取1 mL菌液于80℃水浴加热10 min,杀死营养体细胞后,采用平板计数法计算菌液中芽孢的数量。芽孢生成率计算公式如下:
芽孢生成率=(芽孢的数量/活菌的数量)×100%
1.5 口服疫苗的制备用发酵培养基对B. subtilis WB800 (pBE2R-lip)进行28℃、150 r/min培养48 h后,6000×g离心10 min,收集细菌,用PBS重悬后均匀喷洒在配合饲料表面,以3.0×108 CFU/g饲料的比例制备成口服疫苗,阴干后,4℃保存备用。同时,培养B. subtilis WB800 (pBE2R)菌株,以相同浓度添加到饲料中,作为对照组。
1.6 草鱼肠道内芽孢杆菌数量的测定60尾健康草鱼随机平均分为2组,实验组投喂含口服疫苗的饲料,对照组投喂普通饲料,连续投喂7 d后,2组均投喂普通饲料。按照2%体重进行投喂,每天08:00和16:00各投喂1次。实验鱼在25℃的循环水养殖系统中养殖,有效水体60 L,24 h不间断充气,保持溶解氧 > 5.0 mg/L。结束投喂口服疫苗后,每天每组随机挑选3尾鱼,参照吴正存等(2011)的方法,测定草鱼后肠内容物中芽孢的数量。取肠道内容物1 g,加入1 mL无菌PBS后,在振荡器上充分混匀。80℃水浴处理20 min,10倍梯度稀释后,涂布于含终浓度为30 μg/mL卡那霉素的DSM琼脂培养基上,28℃培养24 h后,记录芽孢数。
1.7 草鱼的免疫270尾健康草鱼随机平均分为3组,每组3个重复,暂养14 d以后进行实验,暂养期间的养殖条件和投喂方法同1.6。实验Ⅰ组为免疫组,用口服疫苗连续投喂草鱼7 d后,间隔7 d,再加强免疫1次。实验Ⅱ组为对照组,投喂含B. subtilis WB800 (pBE2R)的饲料,投喂方法同实验Ⅰ组;实验Ⅲ组为阴性对照组,投喂不含芽孢杆菌的普通饲料。
1.8 血清抗体效价测定分别在免疫后的第7、14、21和28天尾静脉取血,获得血清样品。将纯化的原核重组蛋白rlip用包被液稀释至4 µg/mL,4℃包被过夜后,甩去孔内液体,PBST洗涤3次。每孔加入100 µL的5% BSA,37℃封闭l h。PBST洗涤3次后,加入待检的草鱼血清(首孔加入8倍稀释的草鱼血清,其余各孔2倍梯度稀释,100 µL/孔),37℃孵育l h,PBST洗涤3次。然后,加入鼠抗草鱼IgM单克隆抗体(1∶5000倍稀释),100 µL/孔,37℃孵育l h后,PBST洗涤3次,加入HRP标记的羊抗鼠IgG单克隆抗体(1∶5000倍稀释),37℃孵育1 h,100 µL/孔,PBST洗涤6次。加入TMB (博士德,武汉)溶液,100 µL/孔,25℃孵育10 min或直到显色充分,每孔加入100 µL 2 mol/L H2SO4终止反应,酶标仪OD450 nm读值。
抗体滴度根据P/N值来确定。P/N=(待检血清的OD450 nm‒空白对照的OD450 nm)/(阴性血清的OD450 nm‒空白对照的OD450 nm)。当P/N≥2.1时,抗血清的最高稀释倍数为其最终抗体滴度。数据以平均数±标准差(Mean±SD)表示。
1.9 人工感染实验免疫后第28天进行人工感染,以3.0×107 CFU/mL浓度的柱状黄杆菌G4浸泡感染1 h后,将草鱼转移至水族缸中饲养观察,实验期间进行正常投喂,观察感染后草鱼的活动情况,记录死亡鱼数量,及时捞走死鱼,计算口服免疫对草鱼的保护效果。免疫保护率计算公式如下:
免疫保护率=(1–免疫组死亡率/对照组死亡率)×100%
2 结果与分析 2.1 表达载体的构建将双酶切后的lip基因片段和双酶切后的pBE2R质粒进行连接,构建了pBE2R-lip载体后,以质粒形式转入B. subtilis WB800感受态细胞,经PCR方法筛选出1个阳性克隆,命名为B. subtilis WB800 (pBE2R-lip)。提取B. subtilis WB800 (pBE2R-lip)的质粒,用限制性内切酶SphⅠ和PstⅠ双酶切后进行电泳验证,出现2条不同大小的片段(图 1),片段大小与预期相符,经测序验证,与lip基因的理论序列完全吻合,未发生移码。
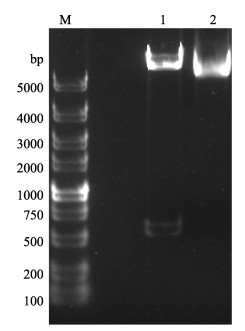
|
图 1 SphⅠ和pstⅠ对质粒pBE2R-lip的双酶切图谱 Fig.1 Recombinant plasmid pBE2R-lip was digested by SphⅠ and PstⅠ 1:双酶切后;2:双酶切前;M:DL5000 DNA marker 1: Before digestion; 2: After digestion; M: DL5000 DNA marker |
通过SDS-PAGE电泳实验,比较了菌株B. subtilis WB800 (pBE2R-lip)和B. subtilis WB800 (pBE2R)不同时间点的蛋白图谱,发现二者的分泌蛋白和胞浆蛋白都存在差异,B. subtilis WB800 (pBE2R-lip)菌株在32 kDa的位置多出1个条带,且48 h样品比24 h样品更明显(图 2),与经氨基酸推导的理论大小一致,可能是lip基因表达的蛋白。

|
图 2 B. subtilis WB800 (pBE2R-lip)和B. subtilis WB800 (pBE2R)的胞浆蛋白和分泌蛋白的SDS-PAGE电泳分析 Fig.2 SDS-PAGE analysis of cytosolic protein and secretory protein extracted from B. subtilis WB800 (pBE2R-lip) and B. subtilis WB800 (pBE2R) M:蛋白marker;1、2:48 h、24 h的B. subtilis WB800 (pBE2R-lip)胞浆蛋白样品;3、4:48 h、24 h的B. subtilis WB800 (pBE2R)胞浆蛋白样品;5、6:48 h、24 h的B. subtilis WB800 (pBE2R-lip)分泌蛋白样品;7、8:48 h、24 h B. subtilis WB800 (pBE2R)分泌蛋白样品。箭头指示分泌的lip蛋白。图 3同 M: Protein marker; 1, 2: B. subtilis WB800 (pBE2R-lip) cytosolic protein at 48 h, 24 h; 3, 4: B. subtilis WB800 (pBE2R) cytosolic protein at 48 h, 24 h; 5, 6: B. subtilis WB800 (pBE2R-lip) secretory protein at 48 h, 24 h; 7, 8: B. subtilis WB800 (pBE2R) secretory protein at 48 h, 24 h; Arrow indicates the secreted lip protein. The same as Fig. 3 |
通过West-blotting实验发现,菌株B. subtilis WB800 (pBE2R-lip)的分泌蛋白和胞浆蛋白在32 kDa位置有1条明显的条带,B. subtilis WB800 (pBE2R)样品在相应位置无条带(图 3),与SDS-PAGE电泳结果一致。因此,确定lip基因能在枯草芽胞杆菌中表达,且能分泌至胞外上清液中。
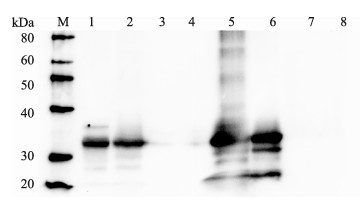
|
图 3 B. subtilis WB800 (pBE2R-lip)和B. subtilis WB800 (pBE2R)胞浆蛋白和分泌蛋白West-blotting检测 Fig.3 West-blotting analysis of cytosolic protein and secretory protein were extracted from B. subtilis WB800 (pBE2R-lip) and B. subtilis WB800 (pBE2R) |
测定结果显示,用发酵培养基培养B. subtilis WB800 (pBE2R-lip) 48 h后,活菌数量为3.8×108 CFU/mL,芽孢数量为2.4×108 CFU/mL,芽孢生成率为63.2%。
2.4 草鱼肠道内芽孢杆菌的数量测定草鱼肠道内容物中的芽孢数量如表 1所示,在停喂芽孢杆菌后的第1~2天,草鱼肠道内容物中检测到大量的活芽孢,数量为105~106 CFU/g。第3天后,存活芽孢数量逐渐减少,至第5天仅有很少量的存活体,说明枯草芽孢杆菌的芽孢在进入草鱼肠道后不能定殖。
|
|
表 1 草鱼肠道内容物中芽孢数量 Tab.1 Amount of B. subtilis WB600 spore in intestine of grass carp |
草鱼血清中特异性抗体效价见图 4。由图 4可知,从免疫结束后的第2周开始,实验Ⅰ组[饲料中含B. subtilis WB800 (pBE2R-lip)]草鱼血清中抗体效价开始升高,在第4周达到最高,其平均值为1∶117.1。在免疫后的第1~4周,实验Ⅱ组[饲料中含B. subtilis WB800 (pBE2R)]和实验Ⅲ组(阴性对照组)草鱼血清中抗体效价基本没有变化,在1∶2~1∶4之间。

|
图 4 草鱼血清中特异性抗体检测 Fig.4 Antibody response of vaccinated fish were detected by ELISA 草鱼被口服免疫后,分别在第1、2、3和4周进行血清抗体效价的测定,每次测定3尾鱼,抗体效价以log2的平均值±标准差表示。实验组Ⅰ用含B. subtilis WB800 (pBE2R-lip)的饲料进行口服免疫,实验组Ⅱ用含B. subtilis WB800 (pBE2R)的饲料进行口服免疫,实验组Ⅲ为阴性对照组。下同 Grass carp were immunized by oral vaccine. Sera were collected from three fishes at one to four weeks post- immunization, and antibody titers were detected. Each value represents the mean of log2 antibody titers with standard deviation (SD) bar. Grass carp in groupⅠwere immunized by B. subtilis WB800 (pBE2R-lip), group Ⅱ were immunized by B. subtilis WB800 (pBE2R), and group Ⅲ was control group. The same as below |
利用柱状黄杆菌G4株浸泡感染以后,草鱼从第2天开始出现死亡,死亡一直持续到第9天。濒死草鱼的症状为身体发黑、独游、往充气头附近聚集及厌食。在人工感染后的第5天,患病草鱼出现鳍条和鳃丝腐烂的现象。从草鱼的鳃丝和鳍条进行细菌分离,经鉴定为大量的柱状黄杆菌,说明草鱼死亡是由柱状黄杆菌感染造成的。经统计,实验Ⅰ组[饲料中含B. subtilis WB800 (pBE2R-lip)]草鱼的累计死亡率为(43.3±2.7)%,实验Ⅱ组[饲料中含B. subtilis WB800 (pBE2R)]草鱼的累计死亡率为(75.6±6.8)%,实验Ⅲ组(阴性对照组)草鱼的累计死亡率为(91.1±1.6)%(图 5)。据此可知,B. subtilis WB800 (pBE2R-lip)对草鱼的免疫保护率为52.4%,B. subtilis WB800 (pBE2R)对草鱼的免疫保护率为17.1%。
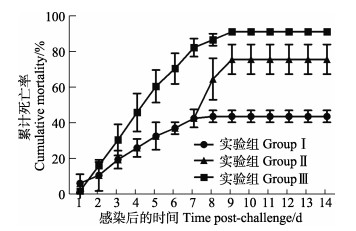
|
图 5 受免草鱼人工感染柱状黄杆菌的累计死亡率 Fig.5 Cumulative mortality curves for grass carp after challenging with F. columnare strain G4 |
从20世纪80年代开始,国内外学者开展了对柱状黄杆菌疫苗的研究工作,最早使用的是福尔马林灭活的全菌疫苗。陈昌福等(1989)分别用福尔马林、苯酚、热灭活的柱状黄杆菌疫苗注射免疫草鱼,都能在短时间内刺激草鱼产生较高的凝集抗体效价,并使草鱼获得较强的保护力。Moore等(1990)连续5年使用福尔马林灭活的柱状黄杆菌疫苗对斑点叉尾鮰(Ictalurus punctaus)鱼苗进行浸泡免疫,其中有3年实验组斑点叉尾鮰的死亡率低于对照组,而另外2年免疫组的死亡率高于对照组,保护效果不稳定。Bader等(1997)比较了高压灭活和福尔马林灭活柱状黄杆菌疫苗对斑点叉尾鮰的免疫保护效果,发现福尔马林灭活会导致柱状黄杆菌1种60 kDa的糖蛋白免疫原性失活,从而影响到免疫保护效果。Shoemaker等(2011)研制出的柱状黄杆菌减毒疫苗,分别给大口黑鲈(Micropterus salmoides)和斑点叉尾鮰提供了57%~ 94%和74%~94%免疫保护率。尽管上述研究结果证明了柱状黄杆菌疫苗的有效性,但这些都是通过注射或者浸泡的免疫方式进行的。目前,柱状黄杆菌口服疫苗的研究仅见于Leal等(2010)的报道,其应用海藻酸钠对灭活的柱状黄杆菌包被后制备成口服疫苗,但通过对罗非鱼(Oreochromis niloticus L.)的免疫,发现该疫苗既不能导致罗非鱼血清中特异性抗体效价的产生,也不能提供免疫保护作用。
本研究利用枯草芽孢杆菌表达柱状黄杆菌的保护性抗原基因lip,提供了一种制备柱状黄杆菌口服疫苗的新思路。通过聚丙酰胺电泳和免疫印迹实验证明,B. subtilis WB800 (pBE2R-lip)能有效表达柱状黄杆菌lip基因,且能将lip蛋白分泌至胞外。由于枯草芽孢杆菌具有较强的抗逆性,能抵抗鱼类消化道中的不良环境,将抗原顺利输送至后肠。相对于常规办法使用海藻酸盐、乙基纤维素等基质将疫苗进行包被而言,枯草芽孢杆菌呈递抗原具有操作简单和成本低廉的特点。此外,枯草芽孢杆菌是我国农业农村部批准使用的水产用益生菌,具有较好的安全性。研究结果显示,在免疫后的第3周和第4周,免疫组草鱼血清中特异性抗体效价显著高于对照组,说明这种免疫方式能引起草鱼的特异性免疫应答。在后续的免疫保护实验中发现,对受免鱼具有一定的免疫保护效果,但该疫苗的免疫保护率较低,仅为52.4%,这可能与草鱼血清中特异性抗体效价较低有关。陈昌福等(1989)研究表明,通过注射免疫,草鱼血清中柱状黄杆菌的特异性抗体效价可达到1∶1024,而本研究中,血清抗体效价最高值仅为1∶117.1。黄钧等(2012)研究发现,通过添加免疫佐剂能增强鱼类口服免疫的免疫应答,而如何筛选合适的免疫佐剂,提高该疫苗口服免疫草鱼后血清的特异性抗体效价和免疫保护率还有待于进一步研究。
ADELMANN M, KÖLLNER B, BERGMANN S M, et al. Development of an oral vaccine for immunisation of rainbow trout (Oncorhynchus mykiss) against viral haemorrhagic septicaemia. Vaccine, 2008, 26(6): 837-844 DOI:10.1016/j.vaccine.2007.11.065 |
BADER J A, KLESIUS P H, VINITNANTHARAT S. Comparison of whole-cell antigens of pressure- and formalin-killed Flexibacter columnaris from channel catfish (Ictalurus punctatus). American Journal of Veterinary Research, 1997, 58(9): 985-988 |
CHEN C F, JI G L. Immunological research for gill-rot disease in grass carp (Ⅰ) Immune response for Myxococcus piscicola in grass carp. Freshwater Fisheries, 1989(2): 8-10 [陈昌福, 纪国良. 草鱼烂鳃病的免疫研究(Ⅰ)草鱼对鱼害粘球菌Myxococcus piscicola的免疫反应. 淡水渔业, 1989(2): 8-10] |
DARWISH A M, ISMAIEL A A, NEWTON J C, et al. Identification of Flavobacterium columnare by a species-specific polymerase chain reaction and renaming of ATCC43622 strain to Flavobacterium johnsoniae. Molecular and Cellular Probes, 2004, 18(6): 421-427 DOI:10.1016/j.mcp.2004.07.002 |
DECLERCQ A M, HAESEBROUCK F, VAN DEN BROECK W, et al. Columnaris disease in fish: A review with emphasis on bacterium-host interactions. Veterinary Research, 2013, 44: 27 DOI:10.1186/1297-9716-44-27 |
ELLIS A E. Meeting the requirements for delayed release of oral vaccines for fish. Journal of Applied Ichthyology, 1998, 14(3/4): 149-152 |
FAN Y, WANG X L, YU X Q, et al. Effect of Bacillus licheniformis on growth, intestinal digestive enzymes, serum non-special immune and resistance against Aeromonas salraonicida in fat greenling, Hexagrammos otakii. Progress in Fishery Sciences, 2021, 42(1): 63-73 [樊英, 王晓璐, 于晓清, 等. 地衣芽孢杆菌对大泷六线鱼生长、肠道消化酶、血清非特异性免疫及抗病力的影响. 渔业科学进展, 2021, 42(1): 63-73] |
FU L L, WANG Y B, WU Z C, et al. In vivo assessment for oral delivery of Bacillus subtilis harboring a viral protein (VP28) against white spot syndrome virus in Litopenaeus vannamei. Aquaculture, 2011, 322/323: 33-83 DOI:10.1016/j.aquaculture.2011.09.036 |
GENG X X, WANG X X, ZHOU Y, et al. Secretive expression of white spot syndrome virus envelope proteins vp28 and vp26 in Pichia pastoris induced by constitutive promoter. Progress in Fishery Sciences, 2016, 37(4): 135-139 [耿小雪, 王小霞, 周怡, 等. 对虾白斑综合征病毒囊膜蛋白VP28和VP26的毕赤酵母组成型分泌表达. 渔业科学进展, 2016, 37(4): 135-139] |
HUANG J, SHI J G, CHEN M, et al. Advance in oral vaccine immune adjuvant for fish. Journal of Southern Agriculture, 2012, 43(6): 869-872 [黄钧, 施金谷, 陈明, 等. 鱼用口服疫苗免疫佐剂研究进展. 南方农业学报, 2012, 43(6): 869-872 DOI:10.3969/j:issn.2095-1191.2012.06.869] |
JIANG H Y, BIAN Q, ZENG W W, et al. Oral delivery of Bacillus subtilis spores expressing grass carp reovirus VP4 protein produces protection against grass carp reovirus infection. Fish and Shellfish Immunology, 2019, 84: 768-780 DOI:10.1016/j.fsi.2018.10.008 |
JOOSTEN P H M, TIEMERSMA E, THREELS A, et al. Oral vaccination of fish against Vibrio anguillarum using alginate microparticles. Fish and Shellfish Immunology, 1997, 7: 471-485 DOI:10.1006/fsim.1997.0100 |
LEAL C A G, CARVALHO-CASTRO G A, SACCHETIN P S C, et al. Oral and parenteral vaccines against Flavobacterium columnare: Evaluation of humoral immune response by ELISA and in vivo efficiency in Nile tilapia (Oreochromis niloticus). Aquaculture International, 2010, 18: 657-666 DOI:10.1007/s10499-009-9287-x |
LILLEHAUG A. Oral immunization of rainbow trout, Salmo gairdneri Richardson, against vibriosis with vaccines protected against digestive degradation. Journal of Fish Diseases, 1989, 12(6): 579-584 DOI:10.1111/j.1365-2761.1989.tb00567.x |
LIU Z X, WU J, MA Y P, et al. Protective immunity against CyHV-3 infection via different prime-boost vaccination regimens using CyHV-3 ORF131-based DNA/protein subunit vaccines in carp Cyprinus carpio var. Jian. Fish and Shellfish Immunology, 2020, 98: 342-353 DOI:10.1016/j.fsi.2020.01.034 |
LUO Z, FU J P, LI N, et al. Immunogenic proteins and their vaccine development potential evaluation in outer membrane proteins (OMPs) of Flavobacterium columnare. Aquaculture and Fisheries, 2016, 1: 1-8 DOI:10.1016/j.aaf.2016.10.002 |
MOORE A A, EIMERS M E, CARDELLA M A. Attempts to control Flexibacter columnaris epizootics in pond-reared channel catfish by vaccination. Journal of Aquatic Animal Health, 1990, 2(2): 109-111 DOI:10.1577/1548-8667(1990)002<0109:ATCCEI>2.3.CO;2 |
ROMALDE J L, LUZARDO-ALVÁREZ A, RAVELO C, et al. Oral immunization using alginate microparticles as a useful strategy for booster vaccination against fish lactoccocosis. Aquaculture, 2004, 236(1/2/3/4): 119-129 |
SHEN W Y, FU L L, LI W F. Effect of Bacillus subtilis expressed the white spot syndrome virus envelope protein VP28 on immune response and disease resistance in Penaeus vannamei. Acta Hydrobiologica Sinica, 2012, 36(2): 375-378 [沈文英, 傅玲琳, 李卫芬. 枯草芽孢杆菌表达的VP28对南美白对虾免疫力和抗病毒感染的影响. 水生生物学报, 2012, 36(2): 375-378] |
SHOEMAKER C A, KLESIUS P H, DRENNAN J D, et al. Efficacy of a modified live Flavobacterium columnare vaccine in fish. Fish and Shellfish Immunology, 2011, 30(1): 304-308 DOI:10.1016/j.fsi.2010.11.001 |
VANDENBERG G W. Oral vaccines for finfish: Academic theory or commercial reality. Animal Health Research Reviews, 2004, 5(2): 301-304 DOI:10.1079/AHR200488 |
VERVARCKE S, OLLEVIER F, KINGET R, et al. Development of a lag time coating for drug-layered fish feed pellets. Pharmaceutical Development and Technology, 2002, 7(4): 471-480 DOI:10.1081/PDT-120015049 |
WU Z C, FU L L, LI W F, et al. The resistance and survival of Bacillus subtilis with in gastrointestinal environment of Pacific white leg shrimp (Litopenaeus vannamei). Fisheries Science, 2011, 30(6): 311-316 [吴正存, 傅玲琳, 李卫芬, 等. 枯草芽孢杆菌WB600芽孢和营养体耐受凡纳滨对虾胃肠道环境及定殖存活的研究. 水产科学, 2011, 30(6): 311-316 DOI:10.3969/j.issn.1003-1111.2011.06.001] |
XUE G P, JOHNSON J S, DALRYMPLE B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis. Journal of Microbiological Methods, 1999, 34(3): 183-191 DOI:10.1016/S0167-7012(98)00087-6 |
YANG Y K, SONG X L, WANG H L, et al. Effect of a compound probiotics on the ability of Litopenaeus vannamei to resist Vibrio parahaemolyticus infection. Progress in Fishery Sciences, 2020, 41(3): 133-141 [杨运楷, 宋晓玲, 王海亮, 等. 一种复合益生菌对凡纳滨对虾抗副溶血弧菌感染能力的影响. 渔业科学进展, 2020, 41(3): 133-141] |
YAO Y Y, CHEN D D, CUI Z W, et al. Oral vaccination of tilapia against Streptococcus agalactiae using Bacillus subtilis spores expressing Sip. Fish and Shellfish Immunology, 2019, 86: 999-1008 DOI:10.1016/j.fsi.2018.12.060 |
ZHANG J Y, LIU Q H, HUANG J. Protection efficacy of vp28 DNA vaccine and immune responses in Litopenaeus vannamei against white spot syndrome virus. Progress in Fishery Sciences, 2012, 33(3): 77-82 [张敬艳, 刘庆慧, 黄倢. vp28重组核酸疫苗对凡纳滨对虾抗WSSV感染的免疫反应和保护效果. 渔业科学进展, 2012, 33(3): 77-82] |



