2. 中国水产科学研究院黄海水产研究所 山东 青岛 266071
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Shandong 266071, China
ATP酶是一类分布广泛的膜结合蛋白酶,由ATP1A3基因(Na+/K+-ATP酶α3亚基基因)编码,属于Na+/K+-ATP酶的亚家族。Na+/K+-ATP酶对Na+、K+不对等运输造成细胞膜内外的电位差,维持着细胞高钾低钠的内环境(Kaplan, 2002)。Na+/K+-ATP酶在虹鳟(Oncorhynchus mykiss) (McCormick et al, 2008)、青鳉(Oryzias latipes) (冯平等, 2006)、金曼龙(Trichogas- ter microlepis) (Huang et al, 2010)、莫桑比克罗非鱼(Oreochromis mossambicus) (Inokuchi et al, 2008)等的渗透压平衡、盐度调节等过程中均发挥关键性作用。
Ca2+-ATP酶是ATP酶家族中的另一重要成员,通过将Ca2+主动转运到细胞外,维持细胞内低钙水平,对神经细胞动作电位的传导、细胞分泌及繁殖均有重要影响(王珂等, 2010)。ATP2B1基因(Ca2+-ATP酶1基因, plasma membrane calcium-transporting ATPase 1)编码Ca2+-ATP酶。目前,关于ATP2B1在脊椎动物中的研究主要集中在血压的调控机制,如Wang等(2017)采用心肌细胞特异性ATP2B1缺失的方法,分别在小鼠(Mus musculus)的器官和细胞水平上研究了ATP2B1在心房Ca2+稳态和电稳定性中的作用。而关于ATP2B1应对外界渗透压变化的分子调控机理的研究主要集中在植物,例如碱茅(Puccinellia chinampoensis)幼苗叶片在盐度胁迫下,其内源激素传导信号导致胞内Ca2+浓度增加,质膜Ca2+-ATP酶活性增加,通过调节胞内Ca2+浓度以维持细胞正常的代谢活动(刘延吉等, 2008)。庚宸帆(2016)研究表明,低盐度胁迫条件下,Ca2+-ATP酶在刺参(Apostichopus japonicus)各组织器官中均呈现高表达,说明ATP2B1基因可能在刺参的盐度适应调控中发挥重要作用。
盐度作为重要的水环境因子之一,对鱼类的存活、摄食生长和渗透压调节等均有直接影响(Shi et al, 2008)。通常情况下,鱼类可凭借高效的渗透压调节机制及应激调节机制应对盐度变化,从而保障鱼体生理生化过程的正常进行。研究显示,ATP酶家族在鱼类的渗透压调控及应对盐度胁迫过程中发挥重要作用,例如,张晓燕等(2018)通过对花鲈(Lateolabrax maculatus) Na+/K+-ATP酶活性及其基因表达的测定,探讨了海水淡化条件下花鲈的生理水平变化与相应的分子调节机制。胡静等(2016)研究发现,急性盐度胁迫对克氏双锯鱼(Amphiprion clarkii)幼鱼的鳃丝和肝脏中Na+/K+-ATP酶活性有显著影响。施兆鸿等(2017)研究了盐度胁迫对云纹石斑鱼(Epinephelus moara)鳃离子调节酶及渗透压的影响,表明Na+/K+-ATP酶和Ca2+-ATP酶在云纹石斑鱼鳃组织的渗透压调节过程中发挥重要作用。此外,盐度骤降条件下,大黄鱼(Pseudosciaena crocea)鳃丝中Na+/K+- ATP酶活力有显著变化(王涛等, 2013)。近年来,关于ATP酶家族的研究主要集中在各种酶的活性水平上,但针对ATP酶家族不同成员在基因水平上应对盐度胁迫的分子调控机制少有报道。
松江鲈(Trachidermus fasciatus)是一种小型近岸浅海、降海洄游鱼类(王金秋, 1999)。松江鲈作为洄游性鱼类,对水环境中的盐度具有极强的适应性。Ma等(2018)在前期开展的松江鲈应对盐度变化的分子调控机制研究中发现,松江鲈肾脏组织中ATP1A3和ATP2B1基因的表达量在低盐胁迫下均存在显著变化。为进一步探究ATP1A3和ATP2B1基因在松江鲈应对盐度胁迫过程中的作用,本研究从前期获得的转录组数据中提取了ATP1A3和ATP2B1基因的序列信息,基于这2个基因的氨基酸序列进行系统进化分析,随后利用实时荧光定量PCR技术检测了松江鲈在2种低盐胁迫处理下,渗透压调控相关组织(鳃、肠和肾脏)及代谢相关组织(肝脏)中2个基因的表达水平变化情况,旨在为揭示ATP1A3和ATP2B1基因在松江鲈应对盐度胁迫的渗透压调节作用,探明洄游性鱼类盐度适应性分子调节机制提供基础资料。
1 材料与方法 1.1 实验材料及处理实验用松江鲈成鱼共计216尾(1龄),体长为(12.22±0.91) cm,体重为(19.54±5.17) g,采集于东营裕海孵化场,随后运至青岛通用水产养殖公司进行实验。实验用鱼平均分布于12个有效容积为100 L的平底纤维增强塑料(FRP)水箱中,暂养2周,水温为10℃~12℃,盐度为30,每天循环水量为600 L,光照周期为12L∶12D。
本研究设置2个低盐胁迫(盐度由30降至3)实验组:盐度骤变低盐胁迫组(sharply-reduced group, SG),盐度变化速率为27/h,盐度降至3后维持不变;盐度渐变低盐胁迫组(gradually-reduced group, GG),盐度变化速率相对缓慢,为1.1/h,盐度降至3后维持不变。2个低盐胁迫实验组各设置6个平行,每个平行各18尾鱼。低盐胁迫处理开始(水体盐度30)记为0 h,分别在盐度胁迫处理开始后0 h、12 h、24 h和48 h的4个时间点取样,每个平行随机选取3尾鱼进行解剖,并分别取其鳃、肠、肾脏和肝脏组织,立即将样品投入液氮中速冻后,在低温状态下转移至–80℃超低温冰箱中保存待用。
1.2 ATP1A3和ATP2B1基因的系统进化分析从前期获得的转录组数据(NCBI SRA数据库登录号:SRP103494)中提取ATP1A3和ATP2B1基因的序列信息,利用EditSeq软件预测松江鲈ATP1A3和ATP2B1基因的开放阅读框,并将其翻译成对应的氨基酸序列;在NCBI搜索其他鱼类及高等脊椎动物的ATP1A3和ATP2B1氨基酸序列,通过DNAMAN软件进行多重序列比对,利用MEGA 5.0软件,以邻接法(Neighbour-Joining, NJ)构建系统进化树,针对进化树各分支结点均进行1000次重复抽样检验(Schmittgen et al, 2008)。
1.3 引物设计基于松江鲈ATP1A3和ATP2B1的cDNA序列,遵循引物设计原则,利用Primer Premier 5.0软件设计基因特异性引物ATP1A3-F/R、ATP2B1-F/R,内参基因引物18S-F/R (表 1),用于实时荧光定量PCR检测。
|
|
表 1 本实验所用引物 Tab.1 Primers used in this study |
将松江鲈各组织样品在液氮中研磨后,采用Trizol法(Invitrogen)提取总RNA。通过核酸测定仪检测浓度和纯度后,以提取的总RNA为模板,根据PrimeScript Rtase试剂盒(TaKaRa)说明书进行反转录,合成第一链cDNA。
1.5 ATP1A3和ATP2B1实时荧光定量PCR根据松江鲈ATP1A3和ATP2B1的cDNA序列,分别设计相应的特异性引物,以核糖体18S rRNA作为内参基因,检测2种低盐胁迫处理下,鳃、肠、肾脏和肝脏组织中ATP1A3和ATP2B1基因在不同时间点的相对表达量。实时荧光定量PCR实验流程按照SYBR® Premix Ex TaqTM试剂盒(TaKaRa)说明书进行操作,在ABI 7500型实时荧光定量PCR仪上进行,实验中每个样品设置3个重复。所有引物均经过扩增效率检测(E > 90%;R2 > 0.990),实时荧光定量PCR产物经测序验证。
1.6 数据分析根据实时荧光定量PCR测得的Ct值,采用2–ΔΔCt法(Schmittgen et al, 2008)计算ATP1A3和ATP2B1基因的相对表达量。所得数据结果均以平均值±标准差(Mean±SD)表示,利用统计学软件SPSS 19.0进行单因素方差分析(one-way ANOVA),并进行Duncan´s多重比较,分析各基因表达量在盐度胁迫处理不同时间点的差异水平,若P < 0.05,为差异显著;若P < 0.01,则差异极显著。
2 结果与分析 2.1 松江鲈基因序列比对及系统进化分析从转录组数据(NCBI SRA数据库登录号:SRP103494)获取松江鲈ATP1A3和ATP2B1的序列信息,其中开放阅读框分别为3030 bp和3177 bp (图 1),利用DNAMAN软件对ATP1A3和ATP2B1氨基酸序列进行比对分析,结果显示,ATP1A3和ATP2B1的一致性为21.42%。种间序列比对结果表明,松江鲈ATP1A3氨基酸序列与圆鳍鱼(Cyclopterus lumpus)物种间一致性最高(98.81%),其次为狼鳗(Anarrhichthys ocellatus) (98.22%)、黄金鲈(Perca flavescens) (96.53%);松江鲈ATP2B1氨基酸序列与牙鲆(Paralichthys olivaceus)物种间一致性最高(88.77%),其次为大黄鱼(83.92%)、圆鳍鱼(80.94%)。

|
图 1 松江鲈ATP1A3和ATP2B1基因编码的氨基酸序列 Fig.1 Deduced amino acid sequences of ATP1A3 and ATP2B1 genes in T. fasciatus |
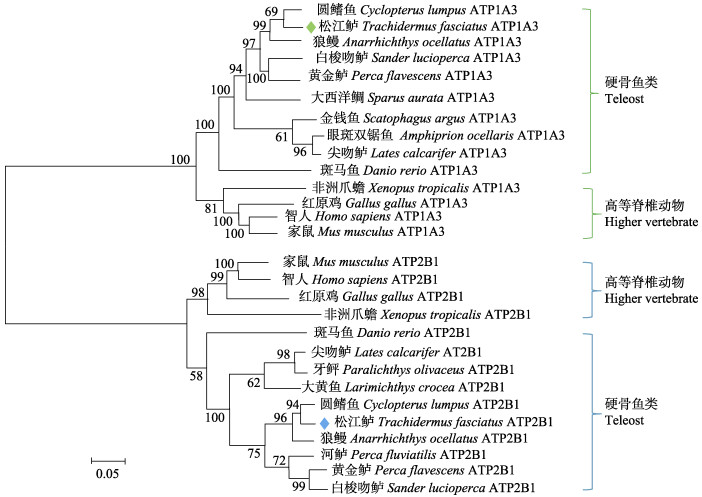
基于已报道的硬骨鱼类及其他高等脊椎动物ATP1A3和ATP2B1氨基酸序列进行的系统进化分析结果显示,ATP1A3和ATP2B1基因分别聚类形成独立的分支(图 2)。在各基因的聚类中,硬骨鱼类均聚为一支,两栖类、鸟类和哺乳类等高等脊椎动物则聚为另一支。在ATP1A3基因中,松江鲈先与鲉形目的圆鳍鱼聚为一支,再与鲈形目的狼鳗(Anarrhichthys ocellatus)聚为一支,之后与其他鲈形目物种所形成的分支聚类,最后与鲤形目的斑马鱼(Danio rerio)聚类;在ATP2B1基因中,松江鲈先与鲉形目的圆鳍鱼聚为一支,再与鲈形目的狼鳗聚为一支,之后与其他鲈形目及鲽形目的物种所形成的分支聚类,最后与鲤形目的斑马鱼聚为硬骨鱼类。
|
图 2 基于ATP1A3和ATP2B1氨基酸序列构建的系统进化树 Fig.2 Phylogenetic tree of ATP1A3 and ATP2B1 amino acid sequences based on Neighbor-Joining method Bootstrap检验的重复次数为1000次,标尺0.05为进化距离 The tree is based on a 1000 bootstrap procedure, the scale bar 0.05 in terms of genetic distance is indicated below the tree |
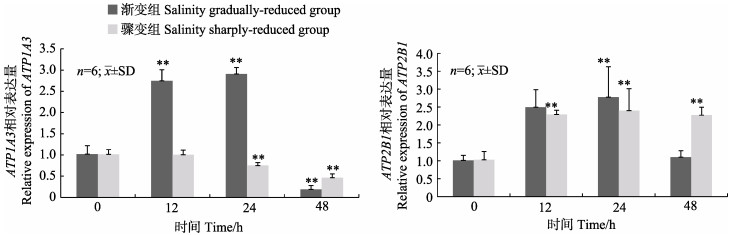
松江鲈鳃组织ATP1A3和ATP2B1表达量的变化趋势在2种低盐胁迫处理下存在一定差异,同一基因表达量间均无显著相关性(R < 0.80)。盐度渐变低盐胁迫组中,ATP1A3表达量在24 h显著升至最高,为0 h的2.9倍,48 h则显著降低;在盐度骤变低盐胁迫组中,ATP1A3表达量在24 h显著降低,在48 h达到最小值。盐度渐变低盐胁迫组中,ATP2B1表达量在24 h显著升高,为0 h的2.7倍;盐度骤变低盐胁迫组中,ATP2B1表达量呈显著上升趋势,且各时间点的表达量相比较0 h均显著升高(图 3)。
|
图 3 盐度渐变低盐胁迫和骤变低盐胁迫下松江鲈鳃中ATP1A3和ATP2B1基因的相对表达量 Fig.3 Relative expression levels of ATP1A3 and ATP2B1 mRNA in gill of T. fasciatus in salinity gradually-reduced group and sharply-reduced group *代表不同时间点处理组与空白对照间差异显著(P < 0.05); **表示差异极显著(P < 0.01)。0 h为空白对照。下同 * denotes significant differences from the control at different time (P < 0.05); ** means highly significant difference (P < 0.01). The untreated (0 h) group was used as the control. The same as below |
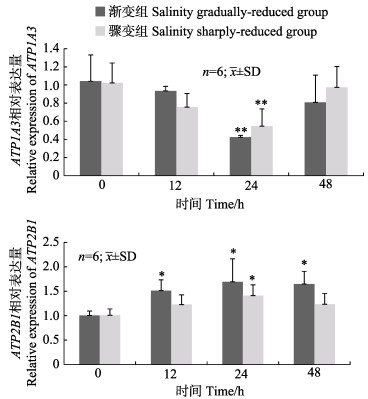
松江鲈肠ATP1A3的表达模式在2种低盐胁迫下基本一致,ATP2B1表达模式存在一定差异,同一基因表达量间呈均显著正相关(R=0.82,0.92)。盐度渐变和骤变2种低盐胁迫下,ATP1A3表达量均在24 h显著降低,分别为0 h的42%和54%。与0 h相比较,盐度渐变低盐胁迫组中ATP2B1表达量呈显著上升趋势,且各时间点的表达量均显著升高;盐度骤变低盐胁迫处理下,ATP2B1表达量在24 h显著升高(图 4)。
|
图 4 盐度渐变低盐胁迫和骤变低盐胁迫下松江鲈肠中ATP1A3和ATP2B1基因的相对表达量 Fig.4 Relative expression levels of ATP1A3 and ATP2B1 mRNA in intestine of T. fasciatus in salinity gradually-reduced group and sharply-reduced group |
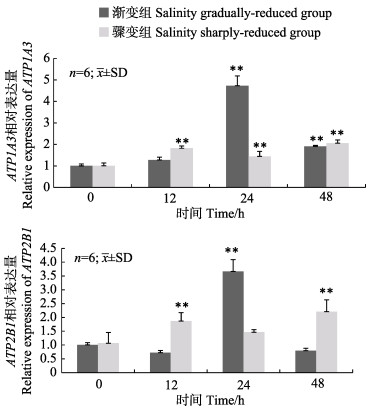
松江鲈肾脏组织ATP1A3和ATP2B1表达量的变化趋势在2种低盐胁迫处理下存在一定差异,同一基因表达量间均无显著相关性(R < 0.80)。盐度渐变低盐胁迫组中,ATP1A3和ATP2B1的表达量均在24 h显著升高并达到最大值,分别为0 h表达量的4.7倍和3.6倍;盐度骤变低盐胁迫组中,ATP1A3表达量在各时间点的表达量相比较0 h均显著升高,ATP2B1表达量在12 h和24 h时显著升高(图 5)。
|
图 5 盐度渐变低盐胁迫和骤变低盐胁迫下松江鲈肾脏中ATP1A3和ATP2B1基因的相对表达量 Fig.5 Relative expression levels of ATP1A3 and ATP2B1 mRNA in kidney of T. fasciatus in salinity gradually-reduced group and sharply-reduced group |
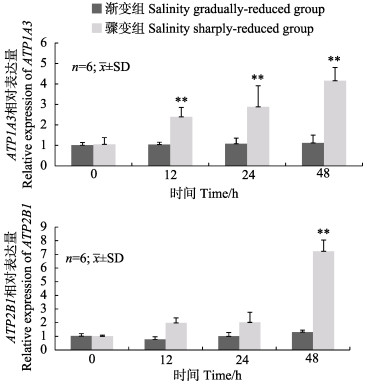
松江鲈肝脏组织中ATP1A3和ATP2B1表达量变化趋势在2种低盐胁迫处理下存在一定差异,ATP1A3表达量之间显著相关(R=0.98)。盐度渐变下,2个基因的表达量均无显著变化。盐度骤变下,ATP1A3表达量呈显著持续增长趋势,ATP2B1表达量在48 h极显著升高,2个基因的表达量均在48 h达到最大值,分别为0 h的4.1倍和7.2倍(图 6)。
|
图 6 盐度渐变低盐胁迫和骤变低盐胁迫下松江鲈肝脏中ATP1A3和ATP2B1基因的相对表达量 Fig.6 Relative expression levels of ATP1A3 and ATP2B1 mRNA in liver of T. fasciaus under salinity gradually-reduced group and sharply-reduced group. |
为了揭示Na+/K+-ATP酶和Ca2+-ATP酶在鱼类应对盐度胁迫过程中的作用,本研究比较分析了2种低盐胁迫处理下,松江鲈不同组织ATP1A3和ATP2B1表达量的变化情况。在2种低盐胁迫处理下,鳃、肠、肾脏和肝脏组织中2个目标基因的表达量呈现不同的变化趋势,推测其原因,可能是组织器官的功能特性导致应对低盐胁迫的渗透压调节机制不同。鳃作为鱼类的呼吸器官,与环境介质的接触面积大,对水环境的变化最为敏感(Suresh et al, 1984)。盐度渐变低盐胁迫处理下,松江鲈鳃组织通过基因的表达调节渗透压来应对低盐胁迫,ATP1A3表达量先上升后下降,导致这一现象的原因可能是盐度渐变低盐胁迫时间的延长对ATP1A3的表达产生抑制。而在盐度骤变处理下,ATP1A3表达量显著下降,ATP2B1表达量显著上升。黄姑鱼(Nibea albiflora)在受到低盐胁迫时,其鳃丝中Na+/K+-ATP酶活力呈先增强后恢复的趋势,且短时间内Ca2+-ATP酶活力也显著上升(施兆鸿等, 2015)。四指马鲅(Eleutheronema tetradactylum)幼鱼鳃丝组织中Na+/K+-ATP酶活力亦先增强后逐渐趋于稳定(罗海忠等, 2015)。这表明盐度骤变对鳃中2个目标基因表达水平的影响更为显著。
肠道作为鱼类渗透压调节的另一重要场所,对水环境变化的响应也较为灵敏,在鱼体应对外界刺激过程中起到关键作用(孙永旭等, 2019)。ATP2B1主要作为ATP酶质膜Ca2+转运基因,通过将胞内高Ca2+浓度调节至静息水平来应对低盐胁迫,进而在维持肠组织细胞的正常代谢过程中发挥一定作用。庚宸帆(2016)在探讨刺参应对低盐胁迫的研究中也有类似的发现。本研究结果显示,盐度渐变低盐胁迫处理下,松江鲈肠中ATP2B1表达量显著上升,但盐度骤变组中ATP2B1表达量仅在24 h显著上升,可能是盐度骤变所引起的应激反应抑制了松江鲈肠组织中ATP2B1的表达。盐度改变后,青鳉鱼肠道内Na+-K+-ATPaseβ基因表达被显著抑制(冯平等, 2006),低盐胁迫处理下,松江鲈肠组织中ATP1A3表达量均在24 h显著降低。出现这种情况的原因可能是肠与鳃组织内Na+/K+ -ATP酶基因表达的调控机制不同,鳃组织主要通过调节与水体中离子交换来应对低盐胁迫,而肠组织主要通过水的吸收以应对低盐胁迫(Shigehisa et al, 2003)。
肾脏也是鱼类响应渗透压调节的重要器官。区又君等(2014)研究表明,在低盐度时(30以下),卵形鲳鲹(Trachinotus ovatus)幼鱼的鳃和肾脏共同完成渗透压调节。在本研究中,松江鲈肾脏组织2个目标基因的表达量在2种低盐胁迫处理下均显著升高,其中,ATP1A3的表达量变化更加显著。结果表明,低盐胁迫更显著促进了松江鲈肾脏组织中ATP1A3的表达。
肝脏作为主要的代谢器官之一,参与鱼类的应激与免疫调节,也是鱼类进行渗透压调节的关键能量来源(Tamura et al, 2011)。大菱鲆的肝脏细胞可通过ATP的合成,促进细胞游离钙的释放,从而与细胞膜嘌呤受体相互作用来适应低渗胁迫(Ollivier et al, 2006)。本研究结果显示,松江鲈肝脏组织2个目标基因的表达量在盐度渐变低盐胁迫处理下无显著变化;盐度骤变低盐胁迫下,ATP1A3的表达量呈显著上升趋势,ATP2B1表达量在48 h极显著升高。这表明盐度骤变低盐胁迫同时诱导肝脏组织中2个目标基因的高表达,且其表达量在一定时间内随着胁迫时间的延长而升高。
本研究发现,2种低盐胁迫处理下,ATP1A3和ATP2B1基因在松江鲈鳃、肠、肾脏和肝脏组织中的表达量呈现不同的变化趋势,且2个基因的表达量在不同时间点的表达水平存在显著差异。由此可见,ATP1A3和ATP2B1基因在松江鲈应对低盐胁迫的渗透压调节过程中发挥着重要作用,为进一步探究鱼类盐度适应性的分子调控机制提供理论基础。
FENG P, WANG F, FAN G L. The effect of salinity on intestine Na+-K+-ATPase genes expression of medaka (Oryzias latipes). Acta Agriculturae Boreali-Occidentalis Sinica., 2006, 15(6): 24-27 [冯平, 王峰, 范光丽. 盐度对青鳉鱼肠内Na+-K+-ATPase基因表达的影响. 西北农业学报, 2006, 15(6): 24-27 DOI:10.3969/j.issn.1004-1389.2006.06.007] |
GENG C F. Analysis on salinity related genes expression and histological structure of Apostichopus japonicus. Masterxs Thesis of Dalian Ocean University, 2016
|
庚宸帆. 刺参盐度调节相关基因的定量表达及组织学分析. 大连海洋大学硕士研究生学位论文, 2016
|
HU J, YE L, WU K C, et al. Effect of acute salinity stress on serum cortisol and activity of Na+-K+-ATPase of juvinile Amphiprion clarkii. South China Fisheries Science, 2016, 12(2): 116-120 [胡静, 叶乐, 吴开畅, 等. 急性盐度胁迫对克氏双锯鱼幼鱼血清皮质醇浓度和Na+-K+-ATP酶活性的影响. 南方水产科学, 2016, 12(2): 116-120 DOI:10.3969/j.issn.2095-0780.2016.02.017] |
HUANG C Y, CHAO P L, LIN H C, et al. Na+-K+-ATPase and vacuolar- type H+-ATPase in the gills of the aquatic air- breathing fish Trichogaster microlepis in response to salinity variation. Comparative Biochemistry and Physiology, Part A Molecular and Integrative Physiology, 2010, 155: 309-318 DOI:10.1016/j.cbpa.2009.11.010 |
INOKUCHI M, HIROI J, WATANABE S, et al. Gene expression and morphological localization of NHE3, NCC and NKCC1a in branchial mitochondria-rich cells of Mozambique tilapia (Oreochromis mossambicus) acclimated to a wide range of salinities. Comparative Biochemistry and Physiology, Part A Molecular and Integrative Physiology, 2008, 151(2): 151-158 DOI:10.1016/j.cbpa.2008.06.012 |
KAPLAN J H. Biochemistry of Na+/K+ ATPase. Annual Review of Biochemistry, 2002, 71: 511-535 DOI:10.1146/annurev.biochem.71.102201.141218 |
LIU Y J, ZHANG L, TIAN X Y, et al. The effects of salt stress on endogenous hormones, NADKase and Ca2+-ATPase in leaves of Puccinellia chinampoensis seedlings. Pratacultural Science, 2008, 25(4): 51-54 [刘延吉, 张蕾, 田晓艳, 等. 盐胁迫对碱茅幼苗叶片内源激素、NAD激酶及Ca2+-ATPase的效应. 草业科学, 2008, 25(4): 51-54] |
LUO H Z, LI W Y, FU R B, et al. The effects of salinity on the growth of juvenile Eleutheronema tetradactylum and Na+/K+-ATP enzyme. Progress in Fishery Science, 2015, 36(2): 94-99 [罗海忠, 李伟业, 傅荣兵, 等. 盐度对四指马鲅(Eleutheronema tetradactylum)幼鱼生长及其鳃丝Na+/K+-ATP酶的影响. 渔业科学进展, 2015, 36(2): 94-99] |
MA Q, LIU X F, FENG W R, et al. Analyses of the molecular mechanisms associated with salinity adaption of Trachidermus fasciatus through combined iTRAQ-based proteomics and RNA sequencing-based transcriptomics. Progress in Biophysics and Molecular Biology, 2018, 136: 40-53 DOI:10.1016/j.pbiomolbio.2018.02.003 |
MCCORMICK S D, REGISH A, SHRIMPTON J M. Are we missing a mineralocorticoid in teleost fish? Effects of cortisol, deoxycorticosterone and aldosterone on osmoregulation, gill Na+-K+-ATPase activity and isoform mRNA levels in Atlantic salmon. General and Comparative Endocrinology, 2008, 157: 35-40 DOI:10.1016/j.ygcen.2008.03.024 |
OLLIVIER H, PICHAVANT-RAFINI K, PUILL-STEPHAN E, et al. Effects of hypo-osmotic stress on ATP release in isolated turbot (Scophthalmus maximus) hepatocytes. Biology of the Cell, 2006, 98(7): 427-437 DOI:10.1042/BC20050077 |
OU Y J, FAN C Y, LI J E, et al. Effects of salinity on the osmoregulation and weight loss from starvation in Trachinotus ovatus juvenile. Acta Ecologica Sinica, 2014, 34(24): 7436-7443 [区又君, 范春燕, 李加儿, 等. 盐度对卵形鲳鲹幼鱼渗透压调节和饥饿失重的影响. 生态学报, 2014, 34(24): 7436-7443] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative C(T) method. Nature Protocols, 2008, 3(6): 1101-1108 DOI:10.1038/nprot.2008.73 |
SHI Z H, HUANG X X, FU R B, et al. Salinity stress on embryos and early larval stages of the pomfret Pampus punctatissimus. Aquaculture, 2008, 275(1/2/3/4): 306-310 |
SHI Z H, LIAO Y L, WANG X S, et al. Impact of the abrupt salinity decrease on ion-regulation enzyme activity in the gill and serum osmolality from Epinehelus moara. Journal of Safety and Environment, 2017, 17(3): 1210-1214 [施兆鸿, 廖雅丽, 王孝杉, 等. 盐度胁迫对云纹石斑鱼鳃离子调节酶及渗透压的影响. 安全与环境学报, 2017, 17(3): 1210-1214] |
SHI Z H, ZHANG C J, PENG S M, et al. Effects of low-salinity stress on the ion regulation, respiratory metabolic enzymes and serum cortisol in the gill of Nibea albiflora juvenile. Progress in Fishery Science, 2015, 36(6): 22-28 [施兆鸿, 张晨捷, 彭士明, 等. 低盐胁迫对黄姑鱼(Nibea albiflora)幼鱼鳃离子调节、呼吸代谢酶和皮质醇的影响. 渔业科学进展, 2015, 36(6): 22-28] |
SHIGEHISA H, TOYOJI K, NOBUKO N, et al. Molecular biology of major components of chloride cells. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2003, 136: 593-620 |
SUN Y X, DONG H B, DUAN Y F, et al. Progresses in stress damage and protection studies on fish intestine. Transactions of Oceanology and Limnology, 2019, 11061106(3): 174-183 [孙永旭, 董宏标, 段亚飞, 等. 鱼类肠道应激及其损伤防护研究进展. 海洋湖沼通报, 2019, 11061106(3): 174-183] |
SURESH N, JAYARAMANI J. The adaptation to salinity: Response of fish gill mitochondria to salinity stress. Journal of Bioenergetics, 1984, 15(6): 363-377 DOI:10.1007/BF00751056 |
TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 2011, 28(10): 2731-2739 |
WANG J Q. Advances in studies on the ecology and reproductive biology of Trachidermus fasciatus Heckel. Acta Hydrobiologica Sinica, 1999, 23(6): 729-734 [王金秋. 松江鲈的生态学和繁殖生物学的研究进展. 水生生物学报, 1999, 23(6): 729-734] |
WANG K, YANG Q, LU K J, et al. Effect of Astragalus complanatus on the activity of Na+, K+-ATPase and Ca2+, Mg2+-ATPase in different tissues of trained rats. Journal of Northwest University (Natural Science), 2010, 40(6): 1031-1035 [王珂, 杨茜, 芦楷钧, 等. 沙苑子提取物对运动训练大鼠不同组织Na+, K+-ATPase和Ca2+, Mg2+-ATPase活性的影响. 西北大学学报(自然科学版), 2010, 40(6): 1031-1035] |
WANG T, MIAO L, LI M Y, et al. Effects of abrupt salinity decrease on serum physiology, biochemistry and gill Na+/K+- ATPase activity of the large yellow croaker Pseudosciaena crocea. Oceanologia et Limnologia Sinica, 2013, 44(2): 421-426 [王涛, 苗亮, 李明云, 等. 突降盐度胁迫对大黄鱼(Pseudosciaena crocea)血清生理生化及鳃丝Na+/K+-ATP酶活性的影响. 海洋与湖沼, 2013, 44(2): 421-426] |
WANG Y W, WILSON C, CARTWRIGHT E J, et al. Plasma membrance Ca2+-ATPase 1 is required for maintaining atrial Ca2+ homeostasis and electorphysiological stability in the mouse. Journal of Physiology, 2017, 595(24): 7383-7389 |
ZHANG X Y, WEN H S, ZHANG K Q, et al. Analysis of the isotonic point and effects of seawater desalination on the Na+/K+/Cl- concentration, Na+-K+-ATPase activity and relative gene expressions in Lateolabrax maculatus. Journal of Fisheries of China, 2018, 42(8): 1199-1208 [张晓燕, 温海深, 张凯强, 等. 花鲈等渗点分析及海水淡化对Na+/K+/Cl-浓度、Na+-K+-ATP酶活性及基因表达的影响. 水产学报, 2018, 42(8): 1199-1208] |



