2. 湖南生物机电职业技术学院 湖南 长沙 410127;
3. 湖南省水产产业技术体系 湖南 长沙 410128
2. Hunan Biological and Electromechanical Polytechnic, Changsha, Hunan 410127, China;
3. Technology System of Aquatic Industry in Hunan Province, Changsha, Hunan 410128, China
主要组织相容性复合体(major histocompatibility complex, MHC)是编码主要组织相容性抗原的基因群的统称,在脊椎动物抵抗疾病和免疫应答过程中发挥重要作用(冯美惠等, 2017)。MHC类分子主要分为MHCⅠ和MHCⅡ,是由MHC基因编码的一类细胞表面转膜蛋白,主要参与抗原呈递(于文博等, 2017; 童正飞等, 2020; 徐田军等, 2008)。Hashimoto等(1990)成功扩增鲤鱼(Cyprinus carpio)的部分MHC基因序列。目前,关于水产动物MHC研究主要集中在鱼类,对中华鳖(Pelodiscus sinensis)MHC的研究还较少。
中华鳖是我国重要的名特优养殖品种之一,具有较高的营养价值及药用价值,近年来创造了巨大的经济效益(彭娜等, 2018; 陈贞年等, 2020)。目前,高度集约化养殖、种质退化及抗生素滥用等导致中华鳖疾病频发,治疗仍主要是通过化学药物,易导致水产品药物残留及产生抗药性(尹梦雅, 2018)。但关于中华鳖免疫基因的遗传分析和抗病性研究却相对较少。本研究利用RACE技术克隆中华鳖MHCⅡα基因cDNA全长,并以嗜水气单胞菌(Aeromonas hydrophila)为刺激物,分析中华鳖MHCⅡα基因在组织中的表达特征,旨在了解中华鳖免疫基因及免疫应答,为中华鳖病害免疫防治和培育抗病新品系等提供理论依据。
1 材料与方法 1.1 实验材料实验中华鳖购自湖南河洲甲鱼养殖基地,选取同批次、体重为100 g左右的健康中华鳖幼鳖60只,随机分为2组,每组设3个平行,每个平行10只,分别饲养于水温为(26±1)℃的容器中。暂养稳定后,实验组腹腔注射0.1 mL浓度为108 CFU/mL的嗜水气单胞菌,对照组注射0.1 mL生理盐水。分别取注射后6 h、12 h、1 d、3 d和5 d中华鳖的肝脏、脾脏、肾脏及肠道4种组织于加有RNA保护液的1.5 mL EP管中,置于–20℃保存备用。同时,选取健康中华鳖幼鳖3只,不做处理,分别取其肝脏、脾脏、肾脏、肠道、心脏、肌肉、脑及胃组织于1.5 mL EP管,液氮冷冻后,–80℃保存。
1.2 主要药品与试剂RNA提取试剂盒和凝胶回收试剂盒购于Omega,SMARTer RACE 5′/3′ Kit、TA克隆相关试剂和TB Green Premix Ex TaqⅡ购自大连宝生物工程(TaKaRa)公司,2×TransTaq-T PCR superMix (+dye) (北京全式金生物)和cDNA合成试剂盒购自Thermo Scientific公司。
1.3 实验方法 1.3.1 引物合成根据本课题组获得的中华鳖转录组数据,利用Primer 6.0软件设计特异性引物(MHCHX-F, MHCHX-R),克隆获得核心序列,并根据核心序列设计特异性引物(MHCⅡ-F, MHCⅡ-R),进行后续基因全长的扩增,荧光定量PCR以GAPDH为内参基因,扩增引物为GAPDH-F和GAPDH-R。引物(表 1)由上海铂尚生物科技有限公司合成。
|
|
表 1 本研究所用引物 Tab.1 Primers used in this study |
采用RNA提取试剂盒(Omega)提取各组织RNA,实验操作按照试剂盒说明书进行,得到各组织RNA后进行琼脂糖凝胶电泳并使用BioSpectrometer Basic核酸蛋白仪(Eppendorf)检测其完整度、浓度及相关比值,选择OD260 nm/280 nm值在1.8~2.0之间且条带完整性良好的RNA用于后续cDNA的合成。
1.3.3 中华鳖MHCⅡα基因cDNA全长克隆根据SMARTer RACE cDNA amplification kit(TaKaRa)说明书合成5′和3′末端cDNA模板,并按照要求进行稀释。按照说明书分别进行MHCⅡα基因的5′或3′端序列的扩增。PCR体系:5′或3′端cDNA模板2 μL,10×UPM引物5 μL,5′或3′端扩增引物1 μL,ddH2O 17 μL,2×TransTaq-T PCR SuperMix (+dye) 25 μL。反应均为25个循环:94℃ 30 s,68℃ 30 s,72℃ 3 min。扩增所得目的PCR条带用凝胶回收试剂盒回收,连接pMD18-T Vector载体后测序。
1.3.4 生物信息学分析及系统进化树构建使用Chromas软件将测序结果中的载体序列去除,利用DNAMAN 6.0软件将克隆片段拼接,得到中华鳖MHCⅡα基因全长序列,通过NCBI数据库进行对比分析。利用ExPASy translate在线工具预测编码的氨基酸序列,利用Protparam在线软件预测蛋白质理化性质,利用SMART及SignalP 5.0等在线软件预测蛋白质结构,使用SWISS-MODEL在线软件预测蛋白质三级结构。运用MEGA-X软件,采用邻位相接法(NJ法)构建氨基酸系统发育树,并设置Bootstrap重复1000次,计算各分支的置信度。
1.3.5 荧光定量PCR1.3.2中合成的cDNA稀释5倍后,取1 μL作为荧光定量PCR模板,设置3个重复。GAPDH为内参基因,内参基因引物采用表 1中的GAPDH-F和GAPDH-R,荧光定量引物使用MHCⅡ-F和MHCⅡ-R。运用CFX96荧光定量PCR仪(Bio-Rad)进行荧光定量PCR:TB Green Premix Ex TaqⅡ(TaKaRa) 5 μL,上、下游引物各0.4 μL,cDNA模板1 μL以及3.2 μL ddH2O。反应程序:95℃ 30 s;40个循环的95℃ 15 s,60℃ 20 s。采用CFX manager 3.1 (Bio-Rad)软件收集和分析基因表达量数据,并采用GraphPad Prism 7软件绘图。
2 结果与分析 2.1 中华鳖MHCⅡα基因cDNA全长序列分析通过RACE技术扩增获得了中华鳖MHCⅡα基因cDNA全长序列(图 1),全长为1296 bp (GenBank登录号: MT834970),其开放阅读框为807 bp,共编码268个氨基酸,利用SMART软件预测蛋白结构域,发现MHCⅡα氨基酸序列包括信号肽(1~37)、Ⅱ类组织相容性抗原α结构域(44~125)、IGc1结构域(143~214)及跨膜结构域(230~252) 4个功能结构域(图 2)。ProtParam tool预测MHCⅡα蛋白分子式为C1345H2081N363O385S8,分子量为29.75 kDa,等电点为5.67,总平均亲水性(GRAVY)为–0.220。
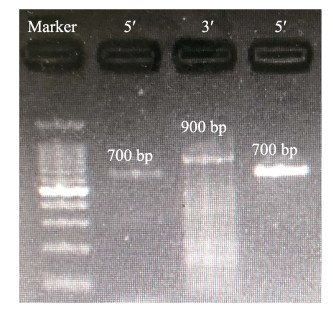
|
图 1 MHCⅡα基因5′/3′RACE电泳 Fig.1 5′/3′RACE product of MHCⅡα |

|
图 2 MHCⅡα基因cDNA全长序列及推导的氨基酸序列 Fig.2 Full-length cDNA and deduced amino acid sequences of MHCⅡα 起始密码子(ATC)和终止密码子(TAG)用方框标示;信号肽用下划线标示;Ⅱ类组织相容性抗原α结构域用虚下划线标示;IGc1结构域用波浪线标示;跨膜结构域用点式下划线标示 The start codon (ATG) and the stop codon (TAG) are indicated in box; the signal peptide is underlined; MHCⅡalpha domain is indicated by dashed underline; IGc1 domain is indicated by wave line; Transmembrane region is indicated by dot underline |
在NCBI网站中选取人(Homo sapiens, CAA25142.1)、黑猩猩(Pan troglodytes, XP_003950844.1)、西部锦龟(Chrysemys picta bellii, XP_005315098.1)、澳洲棕蛇(Pseudonaja textilis, XP_026577346.1)、鸮鹦鹉(Strigops habroptila, XP_030366648.1)、鹌鹑(Coturnix japonica, XP_032297688.1)、白梭吻鲈(Sander lucioperca, XP_ 031149428.1)及红鳍东方鲀(Takifugu rubripes, XP_ 029695924.1)共8种动物的已知或预测MHCⅡα氨基酸序列,利用MEGA-X软件构建NJ系统进化树,发现中华鳖与西部锦龟属于同一分支(图 3),亲缘关系较近。
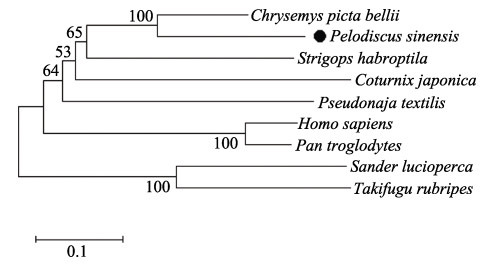
|
图 3 MHCⅡα的系统发育树 Fig.3 Phylogenetic tree of MHCⅡα |
使用SWISS-MODEL在线软件预测MHCⅡα的蛋白质三级结构(图 4)。SWISS-MODEL预测结果显示,匹配的模板与MHCⅡα氨基酸序列一致度为60.67%,GMQE值为0.59,QMEAN值为–2.08,说明MHCⅡα的蛋白质三级结构预测结果可信。
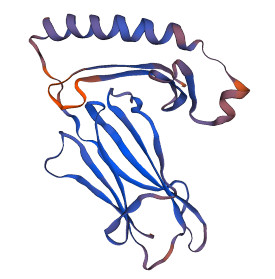
|
图 4 MHCⅡα的3D结构预测 Fig.4 Predicted 3D structure of MHCⅡα |
通过检测MHCⅡα mRNA在健康中华鳖不同组织中的相对表达量,分析其组织表达差异。结果显示,MHCⅡα mRNA在中华鳖的脾、心、肝及肠组织中表达水平较高,显著高于肾、肌肉、脑及胃组织(P < 0.05),在肌肉组织中表达量最低(图 5)。
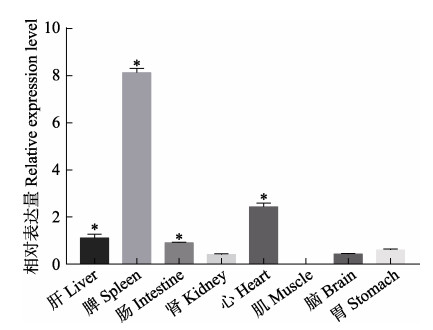
|
图 5 MHCⅡα mRNA在不同组织中的表达分布 Fig.5 Expression of MHCⅡα gene in different tissues *:组织间差异显著(n=3, P < 0.05) *: Significant difference between groups (n=3, P < 0.05) |
腹腔注射嗜水气单胞菌后,分析中华鳖的肝、脾、肠及肾组织在不同时间点(6 h、12 h、1 d、3 d及5 d)的MHCⅡα mRNA相对表达水平(图 6)。MHCⅡα mRNA在肝、脾、肠及肾组织中均出现显著上调表达。各组织MHCⅡα mRNA相对表达量均在1 d时最高。但在脾、肠及肾3个组织的相对表达结果中有下调表达的时期,在脾的表达量在12 h及3 d时呈下调表达,在肠的表达量在3 d时呈下调表达,在肾的表达量在12 h内呈下调趋势以及3 d时呈下调表达。

|
图 6 细菌刺激后中华鳖MHCⅡα mRNA在肝、脾、肠及肾的表达模式 Fig.6 Expression of MHCⅡα mRNA in liver, spleen, intestine and kidney of P. sinensis after bacterial challenge *:显著差异(P < 0.05);**:极显著性差异(P < 0.01) Significant difference between challenge group and control group was indicated with the asterisks ("*"P < 0.05; "**"P < 0.01) |
MHC基因在脊椎动物中广泛存在,且大多数位于同一条染色体上,具有高多态性,在免疫抗病及遗传育种等研究中备受青睐。根据表达产物类型,MHC基因目前分为MHC-Ⅰ、MHC-Ⅱ和MHC-Ⅲ,都由多基因座组成,但在表达组织类型、结构组成、刺激的T细胞类群及多态性演化上均有差异(庞纪彩等, 2012; 林友福等, 2018; Lindqvist et al, 2005)。MHC-Ⅱ类基因被命名为MHC-D,并划分为MHC-DR、MHC-DQ、MHC-DP等亚区(亢孝珍等, 2014)。目前,水产动物MHC-Ⅱ基因研究已较为广泛,大多数研究主要集中在鱼类,现已得到草鱼(Ctenopharyngodon idella)、斑马鱼(Brachydanio rerio var)、军曹鱼(Rachycentron canadum)、牙鲆(Paralichthys olivaceus)、大菱鲆(Scophthalmus maximus)等的MHC-Ⅱ类基因cDNA全长(van Erp et al, 1996; Hideki et al, 1992; 茅莉娜等, 2010; Prapansak et al, 2004; Zhang et al, 2006),而关于龟鳖类水产动物MHC-Ⅱ基因的研究较少,且中华鳖MHC基因家族尚未有相关报道。本研究通过RACE技术成功获得中华鳖MHCⅡα基因cDNA全长1296 bp,编码268个氨基酸,通过预测蛋白结构域,发现MHCⅡα存在明显的信号肽序列、Ⅱ类组织相容性抗原α结构域、IGc1结构域及跨膜结构域。通过建立氨基酸系统进化树分析发现,中华鳖MHCⅡα基因与西部锦龟亲缘关系更近,而与其他爬行类、哺乳类、鸟类及鱼类亲缘关系较远。
MHC与免疫系统有密切关系,其编码产物分布于细胞膜上,参与抗原呈递,与水产动物、家禽及哺乳动物的遗传多样性、抗病性及生产性状等相关(Ruan et al, 2016; Johannes et al, 2013; Zhou et al, 2003; 侯卓成等, 2002; Katarzyna et al, 2012; Łopucki et al, 2016; Lindqvist et al, 2005)。MHC-Ⅱ类基因的组织表达具有差异性(Liu et al, 2002)。本研究荧光定量PCR结果显示,MHCⅡα基因在健康中华鳖所检测的8个组织中均有表达。在中华鳖感染后,实验组肝脏、脾脏、肠道及肾组织MHCⅡα mRNA的相对表达量均出现显著上调,且均在1 d时达到最高。肝脏、脾脏、肠道及肾均与免疫密切相关,据此推测,中华鳖MHCⅡα基因参与了免疫调节。
本研究首次获得了中华鳖MHCⅡα基因的全长,并对该基因序列及结构、所编码的氨基酸序列及结构特点进行分析,构建相关系统发育树,丰富了水产动物中龟鳖类MHC-Ⅱ类基因库,为进一步探索中华鳖MHCⅡα基因免疫调控机制提供了理论依据,也有利于促进中华鳖疾病防控及抗病育种的发展。
CHEN Z N, WANG X Q, LUO L T, et al. High-throughput sequencing analysis of the effects of sanguinarine on Trionyx sinensis intestinal microbiota. Progress in Fishery Sciences, 2021, 42(1): 177-185 [陈贞年, 王晓清, 罗来婷, 等. 高通量测序分析血根碱对中华鳖肠道菌群结构的影响. 渔业科学进展, 2021, 42(1): 177-185] |
FENG M H, CHEN P, LEI W, et al. Full-length cDNA cloning and the effect of dietary vitamin D3 on tissue expression of major histocompatibility complex-Ⅱ in yellow catfish (Pelteobagrus fulvidraco). Acta Hydrobiologica Sinica, 2017, 41(5): 992-999 [冯美惠, 陈沛, 雷文, 等. 黄颡鱼MHC classⅡ基因全长的克隆及饲料维生素D3对其组织表达的影响. 水生生物学报, 2017, 41(5): 992-999] |
HASHIMOTO K, KUROSAWA N Y. Isolation of carp genes encoding major histocompatibility complex antigens. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(17): 6863-6867 DOI:10.1073/pnas.87.17.6863 |
HIDEKI O, DAGMAR K, VLADIMIR V, et al. Major histocompatibility complex classⅡ genes of zebrafish. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(24): 11886-11890 DOI:10.1073/pnas.89.24.11886 |
HOU Z C, YANG N. Advances in major histocompatibility complex research in poultry. Hereditas (Beijing), 2002, 24(1): 72-76 [侯卓成, 杨宁. 家禽主要组织相容性复合体的研究进展. 遗传, 2002, 24(1): 72-76] |
JOHANNES M D, UNNI G, JONG L, et al. Comprehensive analysis of MHC classⅡgenes in teleost fish genomes reveals dispensability of the peptide-loading DM system in a large part of vertebrates. BMC Evolutionary Biology, 2013, 13: 260 DOI:10.1186/1471-2148-13-260 |
KANG X Z, ERDEMTU, JIANG J Q, et al. Research progress on major histocompatibility complex (MHC) gene. China Animal Husbandry and Veterinary Medicine, 2014, 41(5): 28-33 [亢孝珍, 额尔敦木图, 姜建强, 等. 主要组织相容性复合体(MHC)基因研究进展. 中国畜牧兽医, 2014, 41(5): 28-33] |
KATARZYNA K, WIESŁAW B, KATARZYNA B, et al. Evolution of major histocompatibility complex classⅠ and classⅡ genes in the brown bear. BMC Evolutionary Biology, 2012, 12: 197 DOI:10.1186/1471-2148-12-197 |
LIN Y F, YU Y F, LI J J, et al. Progress of major histocompatibility complex (MHC) and relevant gene research in vertebrate. Biology Teaching, 2018, 43(8): 9-10 [林友福, 俞耀飞, 李金江, 等. 脊椎动物的主要组织相容性复合体基因研究进展. 生物学教学, 2018, 43(8): 9-10 DOI:10.3969/j.issn.1004-7549.2018.08.005] |
LINDQVIST A, COUR C D D L, STEGMARK A, et al. Overeating of palatable food is associated with blunted leptin and ghrelin responses. Regulatory Peptides, 2005, 130(3): 123-132 DOI:10.1016/j.regpep.2005.05.002 |
LIU Y, KASSHARA M, RUMFELT L L, et al. Xenopous classⅡ A genes: Studies of genetic, polymorphism, and expression. Developmental and Comparative Immunology, 2002, 26(8): 735-750 DOI:10.1016/S0145-305X(02)00034-4 |
ŁOPUCKI R, MRÓZ I. An assessment of non-volant terrestrial vertebrates response to wind farms-a study of small mammals. Environmental Monitoring and Assessment, 2016, 188(2): 122 DOI:10.1007/s10661-016-5095-8 |
MAO L N, FENG J, LI Y G, et al. Full length cDNA cloning and tissue expression of major histocompatibility complex (MHC)-Ⅱα from Cobia (Rachycentron canadum). China Animal Husbandry and Veterinary Medicine, 2010, 37(10): 48-56 [茅莉娜, 冯娟, 李玉谷, 等. 军曹鱼MHC-Ⅱα基因全长cDNA的克隆及其组织表达分析. 中国畜牧兽医, 2010, 37(10): 48-56] |
PENG N, ZENG D, WANG X Q, et al. SNP markers on IGF2 gene in Pelodiscus sinensis and its correlation analysis to growth traits. Journal of Hunan Agricultural University (Natural Sciences), 2018, 44(1): 88-94 [彭娜, 曾丹, 王晓清, 等. 中华鳖IGF2基因SNP标记与生长性状的关联分析. 湖南农业大学学报(自然科学版), 2018, 44(1): 88-94] |
PANG J C, GAO F Y, LU M X, et al. Progress of major histocompatibility complex (MHC) Ⅱ gene and relevant gene research in fish. Guangdong Agricultural Sciences, 2012, 39(3): 141-145 [庞纪彩, 高风英, 卢迈新, 等. 鱼类MHCⅡ类基因及其研究进展. 广东农业科学, 2012, 39(3): 141-145 DOI:10.3969/j.issn.1004-874X.2012.03.048] |
PRAPANSAK S, TSUYOSHI O, IKUO H, et al. Cloning, characterization and expression of cDNA containing major histocompatibility complex classⅠ, Ⅱa and Ⅱb genes of Japanese flounder Paralichthys olivaceus. Fisheries Science, 2004, 70(2): 264-276 DOI:10.1111/j.1444-2906.2003.00800.x |
RUAN R, RUAN J, WAN X L, et al. Organization and characteristics of the major histocompatibility complex classⅡ region in the Yangtze finless porpoise (Neophocaena asiaeorientalis asiaeorientalis). Scientific Reports, 2016, 6: 22471 DOI:10.1038/srep22471 |
TONG Z F, HU Y Z, TAN J, et al. Transcriptome comparison and immune related gene analysis of spleen of Chinese soft-shelled turtle Pelodiscus sinensis. Genomics and Applied Biology, 2020, 39(12): 5449-5456 [童正飞, 胡亚洲, 谭进, 等. 中华鳖脾脏转录组比较及免疫相关基因分析. 基因组学与应用生物学, 2020, 39(12): 5449-5456] |
VAN ERP S H M, EGBERTS E, STET R. Characterization of major histocompatibility complex class Ⅱ A and B genes in gynogenetic carp clone. Immunogenetics, 1996, 44(3): 192-202 DOI:10.1007/BF02602585 |
XU T J, CHEN S L. Progress of major histocompatibility complex (MHC) and relevant gene research in fish. Marine Fisheries Research, 2008, 29(4): 116-126 [徐田军, 陈松林. 鱼类MHC及其基因研究进展. 海洋水产研究, 2008, 29(4): 116-126] |
YIN M Y. The Study on the epidemiology investigation and pathogenicity, drug-resistance characteristics about fulminent death of Pelodiscus sinensis. Masterxs Thesis of Huazhong Agricultural University, 2018 [尹梦雅. 中华鳖暴发性死亡症流行性调查及病原菌的致病性、耐药性研究. 华中农业大学硕士研究生学位论文, 2018]
|
YU W B, ZHU K C, GUO H Y, et al. Cloning and expression analysis of MHCⅡβ gene in Trachinotus ovatus. South China Fisheries Science, 2017, 13(4): 69-79 [于文博, 朱克诚, 郭华阳, 等. 卵形鲳鲹MHCⅡβ基因的克隆与表达分析. 南方水产科学, 2017, 13(4): 69-79] |
ZHANG Y X, CHEN S L. Molecular identification, polymorphism, and expression analysis of major histocompatibility complex class Ⅱ A and B genes of turbot (Scophthalmus maximus). Marine Biotechology, 2006, 8(6): 611-623 DOI:10.1007/s10126-005-6174-y |
ZHOU H J, LAMONT J. Chicken MHC class Ⅰ and Ⅱ gene effects on antibody response kinetics in adult chickens. Immunogenetics, 2003, 55(3): 133-140 DOI:10.1007/s00251-003-0566-9 |



