鲤疱疹病毒2型(Cyprinid herpesvirus 2, CyHV-2)又称金鱼造血器官坏死病毒(goldfish haematopoietic necrosis virus, GFHNV),主要引起鲫(金)鱼(Carassius auratus)的造血器官坏死病。自1992年首次于日本报道后,该病毒迅速在全球范围内蔓延,1995年首次在我国台湾的东北地区被报道(Jung et al, 1995; Chang et al, 1999),2012年江苏省养殖的异育银鲫(Carassius auratus gibelio)大规模感染该病毒并大量死亡,之后其在全国其他鲫(金)鱼主养区蔓延并广泛存在,对鲫(金)鱼养殖业造成了严重的经济损失(袁锐等, 2019)。鲤疱疹病毒3型(CyHV-3)又称锦鲤疱疹病毒(koi herpesvirus, KHV),其主要感染鲤鱼(Cyprinus carpio)和锦鲤(Cyprinus carpio haematopterus),引发高传染性和致死性的锦鲤疱疹病毒病(koi herpesvirus disease),该病是世界动物卫生组织(OIE)必须申报的疾病,我国将其列为二类动物疫病。2002年以来,CyHV-3先后引起我国东北地区和海南、广东、天津、江苏等省市养殖的鲤鱼和锦鲤发病死亡,对各地的鲤鱼和锦鲤养殖业构成严重威胁(曲木等, 2020)。
目前,已有多种关于CyHV-2和CyHV-3的PCR检测方法被研究报道。Waltzek等(2009)建立CyHV-2普通PCR检测方法,以其目的基因构建的质粒为模板,最低能检测到78 copies/μg DNA,且对鲤疱疹病毒1型(Cyprinid herpesvirus 1, CyHV-1)和CyHV-3等病毒基因无扩增,具有较高的灵敏度和特异性。张旻等(2017)根据CyHV-2的衣壳蛋白基因设计引物和TaqMan探针,建立了CyHV-2的实时荧光定量PCR检测方法,该方法最低能检测到10 copies的目的基因,且对CyHV-3、流行性造血器官坏死病毒(epizootic haematopoietic necrosis, EHNV)等水生动物病原无交叉反应。赵欣等(2017)建立了CyHV-2的微滴式数字PCR检测方法,可准确定量CyHV-2,表现出高度的灵敏性和稳定性。谢亚君等(2019)针对CyHV-2的普通PCR、双重PCR和荧光定量PCR等不同检测方法之间的优劣进行了比较。对于CyHV-3的研究报道则涵盖了普通PCR、巢式PCR、双重PCR和荧光定量PCR等各种PCR检测方法(Gilad et al, 2002; 刘荭等, 2002; 郑树城等, 2016)。但是,同时对这2种类型鲤疱疹病毒进行检测的PCR方法尚未有报道。
本研究建立的鲤疱疹病毒2型和3型三重PCR检测方法,能在1次反应中同时检测2种类型的鲤疱疹病毒,具有精准、快捷和高效的特点,该方法不仅能丰富和完善鲤疱疹病毒2型和3型的检测方法,还可为其预警监测工作提供新的参考。
1 材料与方法 1.1 实验毒株及样品CyHV-2、CyHV-3、草鱼呼肠孤病毒(grass carp reovirus, GCRV)、鲤春病毒血症病毒(spring viraemia of carp virus, SVCV)、传染性皮下及造血组织坏死病毒(infectious hypodermal and haematopoietic necrosis virus, IHHNV)、白斑综合征病毒(white spot syndrome virus, WSSV)和虾虹彩病毒(shrimp hemocyte iridescent virus, SHIV)等水生动物病毒病料及检测所用鲫鱼和鲤鱼样品均由实验室鉴定并保存(其中,CyHV-3阳性样本由中国水产科学研究院珠江水产研究所馈赠)。CyHV-2的鉴定方法参照国家标准(GB/T 36194-2018)《金鱼造血器官坏死病毒检测方法》,CyHV-3的鉴定方法参照水产行业标准(SC/T 7212.1-2011)《鲤疱疹病毒检测方法第1部分:锦鲤疱疹病毒》。
1.2 引物的设计与合成根据GenBank中鲤疱疹病毒的基因序列,选取DNA聚合酶基因(CyHV-2、CyHV-3型, Pol)、解旋酶基因(CyHV-2型, Hel)和胸苷激酶基因(CyHV-3型, TK)的保守序列设计3对特异性引物(表 1),并由生工生物工程(上海)股份有限公司合成。
|
|
表 1 引物序列和扩增基因 Tab.1 Primer sequences and amplified genes |
研究所用CyHV-2、CyHV-3和其他水生动物病毒DNA及检测样品DNA均按照DNA提取试剂盒(TaKaRa, 大连)说明书进行提取,并于–20℃保存备用。
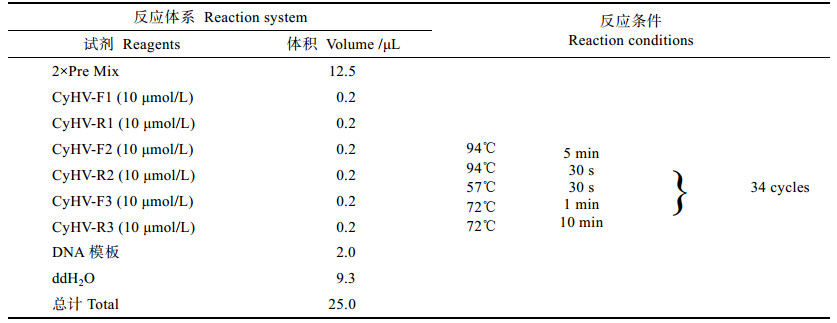
1.3.2 标准品的制备分别以CyHV-2和CyHV-3的DNA为模板,按照DNA扩增试剂盒(TaKaRa, 大连)的方法进行单重PCR扩增,其反应体系和条件见表 2,然后,将反应所得PCR产物进行1%琼脂糖凝胶电泳,并按照DNA凝胶回收试剂盒(Axy Prep)的方法对目的条带进行胶回收,之后将其分别连接到pMD19-T载体上,从而构建Pol、Hel和TK的标准质粒,并根据以下公式计算其拷贝数:
|
|
表 2 单重PCR反应体系和条件 Tab.2 Reaction system and conditions of single PCR |
拷贝数(copies/μL)=6.02×1023(copies/mol)×质粒浓度(ng/μL)×10‒9/质粒分子量(g/mol)。
1.4 三重PCR检测方法的建立与优化将Pol、Hel和TK的质粒拷贝数换算到同一数量级后按比例混合,以混合后的质粒为DNA模板,在单重PCR的基础上进行三重PCR扩增。3对引物(10 μmol/L)的添加量均设为0.2~0.6 μL 5个梯度,退火温度为55℃~60℃ 6个梯度,其他反应条件不变,根据扩增结果选择最佳引物量和退火温度,并将扩增产物送生工生物工程(上海)股份有限公司测序。
1.5 敏感性实验将Pol、Hel和TK的混合质粒进行10倍梯度稀释,浓度范围为2.85×108~2.85×10 copies/μL,以各梯度浓度的混合质粒为DNA模板,采用优化后的三重PCR检测方法进行PCR扩增,测试该方法的灵敏性。
1.6 特异性实验分别以CyHV-2、CyHV-3、GCRV、SVCV、IHHNV、WSSV和SHIV等水生动物病毒的DNA或cDNA为模板,采用优化后的三重PCR检测方法进行扩增,同时还以CyHV-2和CyHV-3的混合DNA为模板,分别进行只添加单对引物的单重PCR反应,以检测该方法的特异性。
1.7 养殖生产中样品检测的应用根据1.1的方法分别对实验室自2018—2020年鉴定保存的122份鲫鱼和60份鲤鱼样品进行鲤疱疹病毒检测。其中,鲫鱼样品进行CyHV-2检测,鲤鱼样品进行CyHV-3检测,并从鲫鱼样品中选取15份CyHV-2阳性样品和15份阴性样品进行CyHV-3检测;另外,再选取15份CyHV-2和CyHV-3的DNA混合样(其中,阳性DNA混合样为8份)进行CyHV-2和CyHV-3检测。同时,采用本研究建立的三重PCR方法对以上样品进行检测,以评估该方法的稳定性和可靠性。
1.8 三重PCR检测方法评价根据OIE《水生动物疫病诊断手册》(2019)所规定的原则,在95%以上的置信区间、允许误差5%的范围内对122份鲫鱼和60份鲤鱼样品进行鲤疱疹病毒检测,以1.1推荐的检测方法为标准,计算该三重PCR检测方法的诊断敏感性(Dse)和诊断特异性(Dsp),计算公式如下:
诊断敏感性Dse=TP/(TP+FN)×100%
诊断特异性Dsp=TN/(TN+FP)×100%
2 结果 2.1 三重PCR检测方法的建立与优化构建的三重PCR检测方法的最佳退火温度为57℃,在此温度下,添加不同引物量的各PCR反应均扩增出3条目的条带,其中,当各引物(10 μmol/L)添加量为0.2 μL时,3条目的条带最清晰且均一(图 1),将送检测序的结果与GenBank中的CyHV-2和CyHV-3基因序列进行比对,匹配度均达到99%以上。优化后的三重PCR最佳反应体系和条件见表 3。

|
图 1 最佳退火温度下的三重PCR扩增结果 Fig.1 The amplification results of triple PCR at the optimum annealing temperature M:DL2000 bp marker;N:阴性对照;1~5分别表示3对引物的添加量分别为0.2、0.3、0.4、0.5和0.6 μL M: DL2000 bp marker; N: Negative control; 1~5: Addition amount of 3 pairs of primers was 0.2, 0.3, 0.4, 0.5, and 0.6 μL, respectively |
|
|
表 3 三重PCR反应体系和条件 Tab.3 Reaction system and conditions of triplex PCR |
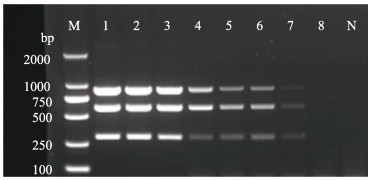
分别以2.85×108~2.85×10 copies/μL的混合质粒为模板进行三重PCR扩增,结果显示,随着模板浓度的降低,3条目的条带的亮度也逐渐降低,该方法能检测到的质粒最低极限为2.85×102 copies/μL (图 2)。
|
图 2 三重PCR敏感性实验结果
Fig.2 The results of sensitivity experiments of triplex PCR
M:DL2000 bp marker;N:阴性对照;1~8分别表示 质粒模板浓度为2.85×108、2.85×107、2.85×106、2.85×105、2.85×104、2.85×103、2.85×102和2.85×10 copies/μL M: DL2000 bp marker; N: Negative control; 1~8: Concentration of plasmid was 2.85×108, 2.85×107, 2.85×106, 2.85×105, 2.85×104, 2.85×103, 2.85×102, and 2.85×10 copies/μL, respectively |
以CyHV-2和CyHV-3为模板的三重PCR反应和分别添加单对引物进行的单重PCR反应均只扩增出相应的目的条带,无交叉反应;以GCRV、SVCV、IHHNV、WSSV和SHIV为模板的三重PCR反应均未扩增出任何条带,结果见图 3。

|
图 3 三重PCR特异性实验结果 Fig.3 The results of specificity experiments of triplex PCR M:DL2000 bp marker;N:阴性对照Negative control;P:阳性对照Positive control;1:CyHV-2;2:CyHV-3;3:GCRV;4:SVCV;5:IHHNV;6:WSSV;7:SHIV;8~10:CyHV-2和CyHV-3混合DNA(单对引物)Mixed DNA of CyHV-2 and CyHV-3 (single primer pair) |
采用1.1推荐的方法检测的结果显示,122份鲫鱼样品中有15份为CyHV-2阳性,107份为CyHV-2阴性,从中抽取的30份鲫鱼样品进行CyHV-3检测,结果全部为阴性;60份鲤鱼样品中有8份为CyHV-3阳性,52份为CyHV-3阴性,采用三重PCR方法检测的结果与以上结果一致。另外,以DNA混合样为模板进行的三重PCR反应的结果显示,8份为阳性,7份为阴性,具体结果见表 4。
|
|
表 4 样品检测结果 Tab.4 The detecting results of samples |
分别以国家标准(GB/T 36194-2018)和水产行业标准(SC/T 7212.1-2011)推荐的检测方法为标准,根据计算公式求得本研究建立的三重PCR检测方法的诊断敏感性(Dse)和诊断特异性(Dsp)均为100%,结果见表 5。
|
|
表 5 不同方法对样品的检测 Tab.5 Detection of samples by different methods |
2018年全国鲤鱼和鲫鱼的养殖总产量超过了573万t,占淡水鱼类养殖品种的比重达到19.37% (农业农村部渔业渔政管理局等, 2019)。针对此类养殖占比较高的水产品种,采用精准而高效的检测技术对其易感病原进行合理监测,可有效提升对疫病发生的预警能力,这对于水产养殖业的绿色健康发展具有重要意义。CyHV-2主要引起鲫(金)鱼的造血器官坏死病,该病的发病率和死亡率均较高,属于新发疫病,近几年本实验室对送样鲫鱼进行检测时,也偶有检出CyHV-2阳性,提示其对本地鲫鱼养殖业的健康发展可能存在潜在的威胁。此外,本研究对鲫鱼进行CyHV-3的检测结果显示,30份鲫鱼样品(包括15份CyHV-2阳性样品)均为CyHV-3阴性。值得一提的是,CyHV-3主要感染鲤鱼及其杂交种,但最新研究表明,鲫鱼也会感染CyHV-3 (全国水产技术推广总站等, 2020),这说明对鲫鱼进行CyHV-3检测具有一定的必要性。
PCR检测方法作为生物实验研究中的常规技术手段,在水产养殖动物实验研究中应用广泛(宋增磊等, 2019; 周朝伟等, 2019)。与传统PCR相比,多重PCR可在1次反应中检测多个目的基因,也可用于多种病原的同时检测,显得更加便捷和高效(张迪等, 2013; 刘婵等, 2018; 张文等, 2019)。本研究建立的三重PCR检测方法扩增的Pol基因属于CyHV-2和CyHV-3的同源序列,Hel基因和TK基因分别为CyHV-2和CyHV-3的特有序列,在引物设计时,合理地控制3条目的条带的长度,确保各扩增条带易于辨认,从而有效区分相应的病原。3对引物之间无交叉反应,且对GCRV、SVCV、IHHNV、WSSV和SHIV 5种水生动物病毒的基因无扩增,具有良好的特异性。通过对反应条件的优化,该方法所能检测的混合质粒的最低极限为2.85×102 copies/μL,比谢亚君等(2019)建立的CyHV-2双重PCR检测方法灵敏度高约50倍,与张文等(2019)建立的鲤浮肿病毒(carp edema virus, CEV)和CyHV-2三重PCR检测方法的灵敏度接近。样品检测结果显示,采用该方法与采用1.1推荐方法的检测结果较一致,表明该方法的精确性和稳定性都较高,并且该方法极大地缩短了样品检测的时间,有效提高检测效率,可在大量样品的实际检测中广泛应用。
另外,由于CyHV-2和CyHV-3的主要宿主存在一定差异,在实际生产中很少会发生混合感染的情况,截至目前,作者并未见有这2种病毒混合感染的研究报道,但鲫鱼也会感染CyHV-3的最新研究提示,在未来的养殖生产中,可能会发生鲫鱼混合感染CyHV-2和CyHV-3的情况,而本研究建立的三重PCR检测方法亦可对此种特殊样品进行有效的检测与鉴定。
Bureau of Fisheries and Fishery Administration under Ministry of Agriculture and Rural Affairs, Nation Fishery Technology Extension Center, China Society of Fisheries. China Fishery Statistical Yearbook. Beijing: China Agriculture Press, 2019 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴. 北京: 中国农业出版社, 2019]
|
CHANG P H, LEE S H, CHIANG H C, et al. Epizootic of herpes-like virus infection in goldfish, Carassius auratus in Taiwan. Fish Pathology, 1999, 34(4): 209-210 DOI:10.3147/jsfp.34.209 |
GILAD O, YUN S, ANDREE K B, et al. Initial characteristics of koi herpesvirus and development of a polymerase chain reaction assay to detect the virus in koi, Cyprinus carpio koi. Diseases of Aquatic Organisms, 2002, 48(2): 101-108 |
JUNG S J, MIYAZAKI T. Herpesviral haematopoietic necrosis of goldfish, Carassius auratus (L.). Journal of Fish Diseases, 1995, 18(3): 211-220 DOI:10.1111/j.1365-2761.1995.tb00296.x |
LIU C, FENG J, XIE Y D, et al. The application and detection of Streptococcus agalactiae isolated from tilapia with a triple PCR based on virulence genes. Progress in Fishery Sciences, 2018, 39(5): 130-136 [刘婵, 冯娟, 谢云丹, 等. 基于毒力基因的罗非鱼无乳链球菌三重PCR检测方法的建立及应用. 渔业科学进展, 2018, 39(5): 130-136] |
LIU H, SHI X J, GAO L Y, et al. Study on the aetiology of koi epizootic disease using the method of nested-polymerase chain reaction assay (nested-PCR). Journal of Huazhong Agricultural University, 2002, 21(5): 414-418 [刘荭, 史秀杰, 高隆英, 等. 进口锦鲤暴发病病原的nested-PCR鉴定. 华中农业大学学报, 2002, 21(5): 414-418 DOI:10.3321/j.issn:1000-2421.2002.05.004] |
Nation Fishery Technology Extension Center, China Society of Fisheries. Standard compilation of aquatic animal disease prevention. Beijing: China Agriculture Press, 2020 [全国水产技术推广总站, 中国水产学会. 水生动物防疫标准汇编. 北京: 中国农业出版社, 2020]
|
QU M, ZHANG B L, ZHAO G Y, et al. Epidemic characteristics and control measures of koi herpesvirus disease. Livestock and Poultry Industry, 2020(6): 76-79 [曲木, 张宝龙, 赵国营, 等. 锦鲤疱疹病毒病的流行特征及防治措施. 畜禽业, 2020(6): 76-79] |
SONG Z L, DONG X, ZHAO R H, et al. Evaluation on the detection of Enterocytozoon hepatopenaei in pooled DNA samples of Litopenaeus vannamei based on TaqMan qPCR. Progress in Fishery Sciences, 2019, 40(3): 122-132 [宋增磊, 董宣, 赵若恒, 等. 基于TaqMan qPCR检测凡纳滨对虾样品中虾肝肠胞虫并样检测方法的评价. 渔业科学进展, 2019, 40(3): 122-132] |
WALTZEK T B, KUROBE T, GOODWIN A E, et al. Development of a polymerase chain reaction assay to detect Cyprinid herpesvirus 2 in goldfish. Journal of Aquatic Animal Health, 2009, 21(1): 60-67 DOI:10.1577/H08-045.1 |
XIE Y J, SHUI D Z, WU P, et al. Study on Cyprinid herpesvirus Ⅱ (CyHV-2) detection techniques based on the different PCR methods. Genomics and Applied Biology, 2019, 38(3): 1018-1025 [谢亚君, 税典章, 吴萍, 等. 基于不同PCR方法的Ⅱ鲤疱疹病毒检测技术研究. 基因组学与应用生物学, 2019, 38(3): 1018-1025] |
YUAN R, CHEN J, LIU X M, et al. A review: Research progress of Cyprinid herpesvirus 2. Chinese Journal of Fisheries, 2019, 32(1): 39-45 [袁锐, 陈静, 刘训猛, 等. 鲤疱疹病毒2型研究进展. 水产学杂志, 2019, 32(1): 39-45] |
ZHANG D, YANG K, SU Y L, et al. A duplex nested-PCR assay for detection of mud crab reovirus and mud crab dicistrovirus-1. Journal of Fishery Sciences of China, 2013, 20(4): 808-815 [张迪, 杨铿, 苏友禄, 等. 青蟹呼肠孤病毒和青蟹双顺反子病毒-1双重巢式PCR检测方法的建立. 中国水产科学, 2013, 20(4): 808-815] |
ZHANG M, WANG S, WANG N, et al. Development of real-time PCR assay for the detection of goldfish haematopoietic necrosis virus (GFHNV). China Animal Health Inspection, 2017, 34(11): 99-103 [张旻, 王姝, 王娜, 等. 金鱼造血器官坏死病毒实时荧光定量PCR检测方法的建立. 中国动物检疫, 2017, 34(11): 99-103] |
ZHANG W, XU L P, LÜ X N, et al. Establishment and preliminary application of triplex PCR detection method for carp edema virus and koi herpesvirus. Journal of Inspection and Quarantine, 2019, 29(1): 1-5 [张文, 徐立蒲, 吕晓楠, 等. 鲤浮肿病毒和锦鲤疱疹病毒三重PCR检测方法的建立及初步应用. 检验检疫学刊, 2019, 29(1): 1-5] |
ZHAO X, JIA P, LIU Y, et al. Development and evaluation of droplet digital PCR assay for the detection of CyHV-2 and comparative analysis. Progress in Fishery Sciences, 2017, 38(4): 126-133 [赵欣, 贾鹏, 刘莹, 等. 鲤疱疹病毒2型微滴式数字PCR检测方法的建立及比较分析. 渔业科学进展, 2017, 38(4): 126-133] |
ZHENG S C, WANG Q, LI Y Y, et al. Research advances of Cyprinid herpesvirus 3. Chinese Journal of Virology, 2016, 32(1): 108-120 [郑树城, 王庆, 李莹莹, 等. 鲤疱疹病毒3型研究进展. 病毒学报, 2016, 32(1): 108-120] |
ZHOU C W, LEI L, DENG X X, et al. Cloning, tissue expression profiling, functional characterization of corticotropin- releasing hormone (crh) on feeding in gibel carp (Carassius auratus gibelio). Progress in Fishery Sciences, 2019, 40(3): 69-79 [周朝伟, 雷骆, 邓星星, 等. 银鲫crh基因的克隆、组织表达谱及其对摄食的影响. 渔业科学进展, 2019, 40(3): 69-79] |