 麻醉效果研究
麻醉效果研究
2. 中国水产科学研究院黄海水产研究所 青岛海洋科学与技术试点国家实验室深蓝渔业工程联合实验室 山东 青岛 266071;
3. 东北林业大学生命科学学院 黑龙江 哈尔滨 150040
 (Seriola aureovittata)是一种全球水域广泛分布的具有长距离洄游特性的大型大洋性鱼类,其生性凶猛、游泳速度快,人工养殖条件下对环境刺激的应激反应强烈。为开发适宜黄条
(Seriola aureovittata)是一种全球水域广泛分布的具有长距离洄游特性的大型大洋性鱼类,其生性凶猛、游泳速度快,人工养殖条件下对环境刺激的应激反应强烈。为开发适宜黄条 实验和生产操作的低应激处理技术,采用实验生态学、生理学手段,首次研究了2种温度条件下(20℃和24℃)、2种麻醉剂(MS-222和丁香油)对1龄黄条
实验和生产操作的低应激处理技术,采用实验生态学、生理学手段,首次研究了2种温度条件下(20℃和24℃)、2种麻醉剂(MS-222和丁香油)对1龄黄条 的麻醉效果,通过行为判别与生理指标分析(皮质醇、肾上腺素和葡萄糖的水平),确定了2种麻醉剂对黄条
的麻醉效果,通过行为判别与生理指标分析(皮质醇、肾上腺素和葡萄糖的水平),确定了2种麻醉剂对黄条 的最适麻醉时间、复苏时间和麻醉剂量。根据黄条
的最适麻醉时间、复苏时间和麻醉剂量。根据黄条 麻醉和复苏时的行为特征,将麻醉过程分为7个时期,复苏过程分为6个时期。在水温为20℃和24℃时,MS-222麻醉黄条
麻醉和复苏时的行为特征,将麻醉过程分为7个时期,复苏过程分为6个时期。在水温为20℃和24℃时,MS-222麻醉黄条 的最佳浓度分别为100~120和100 mg/L,而丁香油的最佳浓度均为40 mg/L。在此条件下,实验鱼均可在3 min之内入麻,5 min之内复苏。随着麻醉剂浓度的增加,黄条
的最佳浓度分别为100~120和100 mg/L,而丁香油的最佳浓度均为40 mg/L。在此条件下,实验鱼均可在3 min之内入麻,5 min之内复苏。随着麻醉剂浓度的增加,黄条 入麻时间呈缩短趋势,复苏时间呈延长趋势。水温的升高降低了入麻时间,而对复苏时间无明显影响。在水温20℃和24℃条件下,40 mg/L的丁香油麻醉黄条
入麻时间呈缩短趋势,复苏时间呈延长趋势。水温的升高降低了入麻时间,而对复苏时间无明显影响。在水温20℃和24℃条件下,40 mg/L的丁香油麻醉黄条 后,血清皮质醇水平分别于6 h和12 h达峰值;在水温24℃条件下,100 mg/L的MS-222麻醉黄条
后,血清皮质醇水平分别于6 h和12 h达峰值;在水温24℃条件下,100 mg/L的MS-222麻醉黄条 后,血清肾上腺素水平于12 h达峰值,其他各实验组血清肾上腺素、葡萄糖和皮质醇水平均在24 h达峰值。2种温度条件下,实验鱼血清中3种应激相关生理指标在复苏72 h后均显著降低至初始水平以下。本研究结果可为制定规范化的黄条
后,血清肾上腺素水平于12 h达峰值,其他各实验组血清肾上腺素、葡萄糖和皮质醇水平均在24 h达峰值。2种温度条件下,实验鱼血清中3种应激相关生理指标在复苏72 h后均显著降低至初始水平以下。本研究结果可为制定规范化的黄条 实验与养殖生产操作技术提供参考依据。
实验与养殖生产操作技术提供参考依据。 MS-222 丁香油 麻醉效果 生理应答
MS-222 丁香油 麻醉效果 生理应答 2. Joint Laboratory for Deep Blue Fishery Engineering of Pilot National Laboratory for Marine Science and Technology (Qingdao), Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao, Shandong 266071, China;
3. College of Life Science, Northeast Forestry University, Harbin, Heilongjiang 150040, China
黄条



黄条




本实验于2019年8—10月在辽宁省大连富谷食品有限公司完成。实验用鱼为规格均一、体质健康的1龄黄条
实验所需MS-222标准品(纯度98%)和丁香油均购于国药集团化学试剂有限公司。为提高丁香油的溶解率,使用时按照丁香油∶95%酒精=1∶10的比例溶解于酒精,再溶于水。
1.2 麻醉和复苏过程分期及有效质量浓度确定参考Woolsey等(2004)的研究,同时结合麻醉处理后黄条
|
|
表 1 黄条 |
根据Marking等(1985)的研究结果,本研究中麻醉剂有效质量浓度标准定义为实验鱼在3 min内进入麻醉状态(达到A6期)、5 min内完全复苏(恢复至B6期)。实验鱼进入A7期麻醉状态后再持续3 min,然后转入清洁海水复苏,成活率为100%。
1.3 不同水温下MS-222和丁香油对黄条
在实验开始前,实验鱼饥饿24 h。实验容器为容积300 L的白色圆形塑料桶。设置温度为20℃和24℃,使用加热器控制水温(精确度为±1℃),MS-222浓度梯度为40、60、80、100和120 mg/L,丁香油浓度梯度为20、40、60、80、100和120 mg/L。麻醉实验开始前,先将暂养的鱼放到预先控制好温度(20℃和24℃)的水桶中适应2 h。每组随机选取5尾鱼,用于麻醉实验,观察每尾鱼的麻醉情况,分别记录每尾鱼达到不同麻醉状态(A1~A7期)所需要的时间。麻醉时间从实验鱼放入不同麻醉剂实验组(A1期)开始计时,至A6期结束,精确到秒。麻醉后的实验鱼,转移至清洁海水中复苏,分别记录每尾鱼达到不同复苏状态(B1~B6期)所需要的时间,复苏时间从实验鱼放入清洁海水中开始计时,至实验鱼行为达B6期状态时结束,精确到秒。
1.4 血液样品采集与血清激素指标测定根据1.3的实验结果,选择容积300 L的白色圆形塑料桶为实验容器,配制100 mg/L的MS-222实验组和40 mg/L的丁香油实验组。实验开始前,将实验鱼饥饿24 h。实验开始后,在20℃和24℃下对黄条
实验数据均使用Excel 2016和SPSS 24.0软件进行处理。利用单因素方差分析法(one-way ANOVA)和Duncan多重分析法对麻醉时间、复苏时间和血清激素和葡萄糖水平进行显著性分析,同一时间点2种不同温度(20℃和24℃)条件下血清激素和葡萄糖水平采用成对样本t检验,所有结果以平均值±标准差(Mean±SD)表示,显著性水平P设定为0.05,当P < 0.05时认为差异显著。
2 结果 2.1 不同水温下麻醉剂有效浓度的确定2种温度条件下丁香油和MS-222对黄条

|
|
表 2 不同丁香油浓度和水温对黄条 |
|
|
表 3 不同MS-222浓度和水温对黄条 |
在同一麻醉浓度条件下,水温的升高使实验鱼进入A6期麻醉状态的时间缩短,而对复苏时间没有明显影响(表 2和表 3)。在2种不同水温下,丁香油浓度为20 mg/L时,实验鱼进入A6期的时间与其他各浓度均存在显著性差异(P < 0.05),其他各浓度组之间无显著性差异(P > 0.05),而MS-222浓度为100 mg/L和120 mg/L时,实验鱼进入A6期的时间无显著性差异(P > 0.05),而与其他各浓度组之间均有显著性差异(P < 0.05)。MS-222浓度为40 mg/L时,实验鱼在2种水温下都不能进入A6期麻醉状态;MS-222浓度为60 mg/L时,20℃水温下实验鱼仅能达到A5期状态,而24℃水温条件下实验鱼可达A6期麻醉状态。
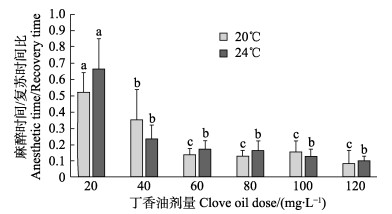
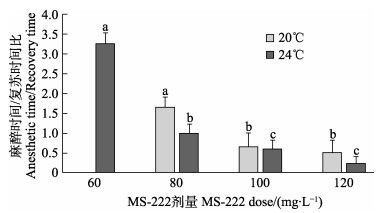
不同的水温下,麻醉时间与复苏时间之比随丁香油浓度的升高整体呈下降趋势,至120 mg/L降到最低。水温为20℃时,丁香油浓度为20 mg/L和40 mg/L时与其他各浓度组均有显著性差异;24℃时,仅有20 mg/L与其他各浓度组存在显著性差异(P < 0.05),其他浓度组之间无显著性差异(P > 0.05)(图 1)。不同的水温下,随着MS-222浓度的增加,麻醉时间与复苏时间之比显著降低(P < 0.05),MS-222浓度为100 mg/L和120 mg/L时,二者之间无显著性差异(P > 0.05),而与其他各浓度组均有显著性差异(P < 0.05)(图 2)。
|
图 1 不同水温与丁香油浓度下黄条 |
|
图 2 不同水温与MS-222浓度下黄条 |
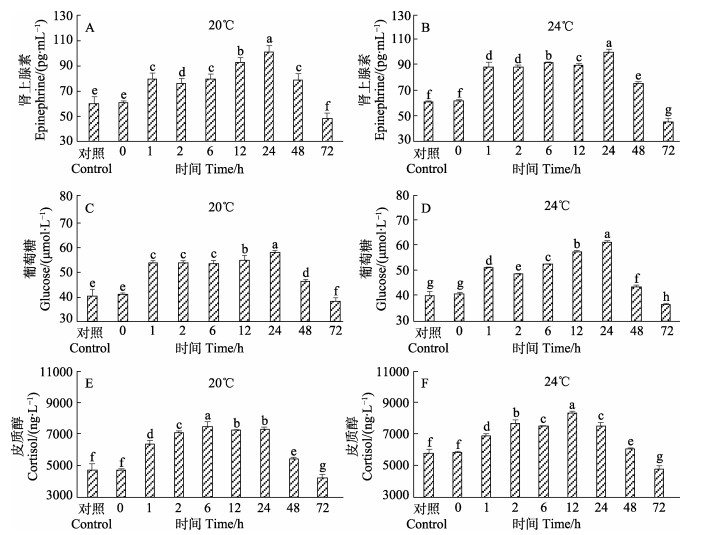
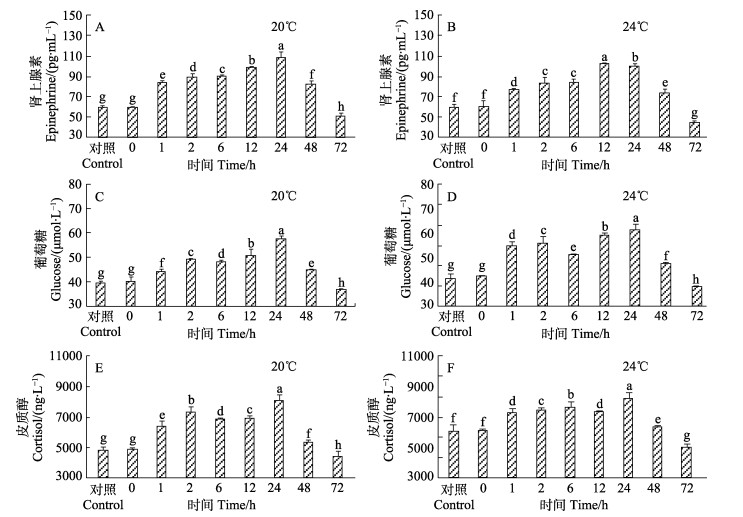
实验开始前,20℃下对照组实验鱼血清肾上腺素水平为(59.17±0.5006) pg/mL,24℃下对照组血清肾上腺素水平为(60.36±0.2212) pg/mL。在2种温度条件下,2种麻醉剂处理的实验鱼复苏1 h后,血清肾上腺素水平均显著升高(P < 0.05)(图 3A、B;图 4A、B)。在2种温度条件下,丁香油麻醉处理的实验鱼复苏后,实验鱼血清肾上腺素水平均在24 h达峰值,与其他各组均差异显著(P < 0.05)(图 3A、B)。MS-222麻醉处理的实验鱼复苏后,20℃下血清肾上腺素水平在24 h达峰值,与其他各组差异显著(P < 0.05)(图 4A),24℃下血清肾上腺素水平在12 h达峰值,且与其他各组差异显著(P < 0.05)(图 4B)。在2种温度条件下,丁香油和MS-222麻醉和复苏处理的实验鱼,血清肾上腺素水平呈先上升后下降的趋势,且高温度组比低温度组的肾上腺素水平上升快且恢复也快,复苏72 h后均恢复到对照组水平以下(图 3A、B;图 4A、B)。
|
图 3 不同温度下丁香油麻醉后黄条 |
|
图 4 不同温度下MS-222麻醉后黄条 |
实验开始前,20℃下对照组黄条
实验开始前,20℃下对照组黄条
麻醉剂的主要作用是抑制大脑皮质的中枢神经系统,从而对鱼体产生一定的麻痹作用,在面对外界环境胁迫的刺激时,降低鱼体应激反应,达到生理保护作用(Devi et al, 2019)。因此,麻醉剂的浓度直接影响鱼类的麻醉效果,浓度过低起不到抗应激作用,浓度过高则容易导致鱼体受到生理胁迫伤害,甚至休克死亡。因此,在对鱼类进行不同的生产操作时需要明确不同的给药剂量,合适的麻醉浓度有利于生产操作,还能起到保活运输作用(Chanseau et al, 2002)。
本研究结果显示,MS-222和丁香油对黄条




水温是影响麻醉剂对鱼类麻醉效果的关键因子之一,随着水温的升高,鱼体新陈代谢加快,呼吸频率上升,麻醉剂经过鳃丝渗透进入鱼体的速率随之加快。Marking等(1985)认为,在相同的麻醉浓度下,随着水体温度的升高,入麻时间相应缩短,鱼体到达最终麻醉状态的时间也随之缩短,这一观点被广泛接受。本研究中,随着温度升高,2种麻醉剂作用下黄条
与温度对麻醉时间的影响不同的是,温度对鱼类麻醉后的复苏时间的研究结果却存在着分歧。部分学者研究认为,随着水温的增加,同一麻醉浓度下处理的实验鱼复苏时间明显延长,如对斑点叉尾


皮质醇是衡量鱼体应激程度的常见指标,鱼体受到外界刺激后,下丘脑–垂体–肾上腺皮质轴应答刺激,下丘脑分泌促肾上腺皮质激素增多,进而引起垂体分泌的促肾上腺皮质激素水平大幅升高,该激素会促进皮质醇的分泌增加(高仁法等, 2020)。鱼类肾上腺激素均来自于前肾间组织,是鱼体初级应激反应中的重要产物。其在血清中的含量不仅能够判断应激是否发生和应激的程度,还可以用于判断鱼体的敏感性,因此,常用作量化鱼体应激反应的指标(丁晨雨, 2018)。本研究结果显示,黄条


葡萄糖是反映鱼体应激水平的一个重要生理指标,易受环境因子的影响而变化,通常运动能力强的鱼类比运动能力弱的鱼类体内的葡萄糖值高。Barton等(1991)指出,鱼体受到应激反应后,首先体内皮质醇水平会先升高,而后机体为了维持内环境稳态,血糖代谢加快,葡萄糖水平后升高。Chang等(1999)对鲻鱼(Mugil cephalus)的研究也证实了这一点。而本研究结果显示,麻醉处理再复苏后,黄条
综上所述,2种温度条件下,MS-222和丁香油麻醉处理的实验鱼血清中皮质醇、肾上腺素和葡萄糖均能在72 h后恢复到初始水平,相较于其他鱼类,黄条
BAO J, FENG F, YU Y H, et al. Study on the anesthetic effect of clove oil on Poecilia reticulata. Heilongjiang Animal Husbandry and Veterinary, 2016(6): 162-163 [包杰, 冯帆, 于业辉, 等. 丁香油对孔雀鱼麻醉效果的研究. 黑龙江畜牧兽医, 2016(6): 162-163] |
BAO J, JIANG H B, LU H Y, et al. Study on the anesthetic effect of clove oil on Misgurnus anguillicaudatus. Journal of Shenyang Agricultural University, 2014, 45(5): 621-624 [包杰, 姜宏波, 卢焕云, 等. 丁香油对泥鳅麻醉效果的研究. 沈阳农业大学报, 2014, 45(5): 621-624] |
BARTON B A, IWAMA G K. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids. Annual Review of Fish Diseases, 1991, 1: 3-26 DOI:10.1016/0959-8030(91)90019-G |
BOWMAN J, HJELMSTEDT P, GRÄNS A. Non-invasive recording of brain function in rainbow trout: Evaluations of the effects of MS-222 anaesthesia induction. Aquaculture Research, 2019, 50(11): 3420-3428 DOI:10.1111/are.14300 |
CAO X C, HUANG X L, SUN X Y, et al. Study on the anesthetic effect of eugenol on juvenile Siganus canaliculatus. Southern Fisheries Science, 2019, 15(3): 50-56 [曹晓聪, 黄小林, 孙莘溢, 等. 丁香酚对黄斑篮子鱼幼鱼麻醉效果的研究. 南方水产科学, 2019, 15(3): 50-56] |
CHAI X, LI X, LU R, et al. Karyotype analysis of the yellowtail kingfish Seriola lalandi (Perciformes: Carangidae) from South Australia. Aquaculture Research, 2009, 40(15): 1735-1741 DOI:10.1111/j.1365-2109.2009.02278.x |
CHANG Y J, HUR J W. Physiological responses of grey mullet (Mugil cephalus) and Nile tilapia (Oreochromis niloticus) by rapid changes in salinity of rearing water. Korean Journal of Fisheries and Aquatic Sciences, 1999, 32(3): 310-316 |
CHANSEAU M, BOSC S, GALIAY E, et al. The use of clove oil as anesthetic for Atlantic salmon (Salmo salar L.) and comparison of its effects with those of 2-phenoxyethanol. Bulletin Français de la Pêche et de la Pisciculture (France), 2002, 75(3): 579-589 |
DEVI A A, KAMILYA D. Efficacy and effects of clove oil and MS-222 on the immune-biochemical responses of juvenile rohu Labeo rohita. Aquaculture Research, 2019, 50(3): 957-963 DOI:10.1111/are.13980 |
DING CY. Physiological response of Hypophthalmichthys molitrix to carbon dioxide anesthetic and its mechanism. Masterxs Thesis of Southwest University, 2018 [丁晨雨. 鲢对二氧化碳麻醉的生理响应及其机理研究. 西南大学硕士研究生学位论文, 2018]
|
FENG G P, XU B, ZHUANG P, et al. Effects of chemical anesthetic and electric anesthesia on blood parameters of Acipenser schrencki. Anhui Agricultural Sciences, 2010, 38(20): 10731-10733, 1075 [冯广朋, 徐滨, 庄平, 等. 化学麻醉与电麻醉对史氏鲟幼鱼血液指标的影响. 安徽农业科学, 2010, 38(20): 10731-10733, 1075 DOI:10.3969/j.issn.0517-6611.2010.20.096] |
GAO R F, LIU Y, CHEN S C, et al. The anesthetic effect of MS-222 on Amphilophus. Modern Agricultural Science and Technology, 2020(16): 172-174 [高仁法, 刘毅, 陈书畅, 等. MS-222对鹦鹉鱼的麻醉效果研究. 现代农业科技, 2020(16): 172-174 DOI:10.3969/j.issn.1007-5739.2020.16.102] |
GUAN J, GUAN S G, ZHENG Y Y, et al. Experimental study on the anesthetic effect of 2-phenoxyethanol and eugenol on juvenile Sebastes schlegelii. Progress in Fishery Sciences, 2010, 31(6): 22-28 [关健, 官曙光, 郑永允, 等. 2-苯氧乙醇和丁香酚对许氏平鲉幼鱼麻醉效果的实验研究. 渔业科学进展, 2010, 31(6): 22-28] |
GUAN M, ZHANG D Z, RAO J, et al. The effect of temperature on the anesthetic effect of juvenile Acipenser sinensis. Journal of Ecology, 2020(2): 576-585 [管敏, 张德志, 饶军, 等. 温度对中华鲟(Acipenser sinensis)幼鱼麻醉效果的影响. 生态学杂志, 2020(2): 576-585] |
HAO C J, ZHUANG P, ZHAO F, et al. Comparative study on the anesthetic effects of MS-222 and eugenol on juvenile Takifugu obscurus. Marine Fisheries, 2019, 41(5): 546-554 [郝长杰, 庄平, 赵峰, 等. MS-222和丁香酚对暗纹东方鲀幼鱼麻醉效果的比较研究. 海洋渔业, 2019, 41(5): 546-554] |
HU F W, LI L, LIU Y W, et al. The anesthetic effect of clove oil and MS-222 on juvenile Hexagrammos otakii. Journal of Dalian Ocean University, 2017, 32(6): 671-675 [胡发文, 李莉, 刘元文, 等. 丁香油和MS-222对大泷六线鱼幼鱼的麻醉效果. 大连海洋大学学报, 2017, 32(6): 671-675] |
KANG E J, KIM E M, KIM Y J, et al. Effect of lidocaine hydrochloride and clove oil as an anaesthetic on Korean rose bitterling, Rhodeus uyekii and oily bifterling, Acheilognathus koreensis. Journal of Aquaculture, 2005, 18(4): 272-279 |
LI L, FAN Y, WANG X L, et al. The anesthetic effect of MS-222 on juvenile steelhead, salmon gairdneri at different temperatures. Journal of Ocean University of China (Natural Science), 2019, 49(3): 155-160 [李乐, 樊英, 王晓璐, 等. 不同温度下MS-222对硬头鳟幼鱼的麻醉效果. 中国海洋大学学报(自然科学版), 2019, 49(3): 155-160] |
LI W Y, XU Z J, LIU M H, et al. Study on the anesthesia effect of MS-222 on juvenile Trichiurus lepturus in the East China Sea. Journal of Dalian Ocean University, 2018, 33(5): 589-594 [李伟业, 徐志进, 柳敏海, 等. MS-222对东海带鱼幼鱼的麻醉效果研究. 大连海洋大学学报, 2018, 33(5): 589-594] |
LIU H H, ZOU R J, LIU X J, et al. The effect of eugenol on reducing the stress of Oreochroms mossambcus. Chinese Agricultural Science Bulletin, 2019, 35(8): 141-145 [刘慧慧, 邹荣婕, 刘小静, 等. 丁香酚对降低罗非鱼捕捉应激的作用. 中国农学通报, 2019, 35(8): 141-145] |
LIU X Z, XU Y J, LI R, et al. Analysis and evaluation of the nutritional composition of Seriola aureovittata. Progress in Fishery Sciences, 2017, 38(1): 128-35 [柳学周, 徐永江, 李荣, 等. 黄条  (Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 2017, 38(1): 128-135] (Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 2017, 38(1): 128-135] |
LIU X, GAO Q, CHEN M K, et al. Effects of MS-222 on blood biochemical indicators of juvenile Acipenser gueldenstaedti. Hebei Fisheries, 2018(11): 6-10 [刘霞, 高乔, 陈明康, 等. MS-222对俄罗斯鲟幼鱼血液生化指标的影响. 河北渔业, 2018(11): 6-10] |
MACIEJ R, MAREK H, KONRAD S, et al. Impact of fish size, water temperature, and MS-222 concentration on inducing general anesthesia in pikeperch (Sander lucioperca). Aquaculture Research, 2018, 49(8): 2774-2781 |
MARKING L L, MEYER F P. Are better anesthetics needed in fisheries?. Fisheries, 1985, 10(6): 2-5 |
MATTSON N S, RIPLE T H. Metomidate, a better anesthetic for cod (Gadus morhua) in comparison with benzocaine, MS-222, chlorobutanol, and phenoxyethanol. Aquaculture, 1989, 83(1/2): 89-94 |
PARK I S. The anesthetic effects of clove oil and MS-222 on far eastern catfish, Silurus asotus. Development and Reproduction, 2019, 23(2): 183-191 |
PARK M O, IM S Y, SEOL D W, et al. Efficacy and physiological responses of rock bream, Oplegnathus fasciatus to anesthetization with clove oil. Aquaculture, 2009, 287(3/4): 427-430 |
ROZYNSKI M, ZIOMEK E, DEMSKAZAKEŚ K, et al. Impact of inducing general anaesthesia with MS-222 on haematological and biochemical parameters of pikeperch (Sander lucioperca). Aquaculture Research, 2019, 50(8): 2125-2132 |
WANG H L, XU H, AN M, et al. The anesthetic effect of MS-222 on juvenile hybrid sturgeon and simulated transportation experiment. Journal of Mountain Agriculture and Biology, 2016, 35(1): 40-44 [王昊龙, 徐弘, 安苗, 等. MS-222对杂交鲟幼鱼的麻醉效果及模拟运输试验. 山地农业生物学报, 2016, 35(1): 40-44] |
WANG W H, DONG H B, SUN Y X, et al. The anesthetic effect of MS-222 and eugenol in simulated transportation of juvenile Micropterus salmoides. Southern Fisheries Science, 2018, 14(6): 52-58 [王文豪, 董宏标, 孙永旭, 等. MS-222和丁香酚在大口黑鲈幼鱼模拟运输中的麻醉效果. 南方水产科学, 2018, 14(6): 52-58] |
WOOLSEY J, HOLCOMB M, INGERMANN R L. Effect of temperature on clove oil anesthesia in Steelhead fry. North American Journal of Aquaculture, 2004, 66(1): 35-41 |
YAN Y L, SHI Y H, ZHANG H M, et al. The anesthetic effects of MS-222 and eugenol on juvenile Coilia nasus. Journal of Shanghai Ocean University, 2016, 25(2): 177-182 [严银龙, 施永海, 张海明, 等. MS-222、丁香酚对刀鲚幼鱼的麻醉效果. 上海海洋大学学报, 2016, 25(2): 177-182] |
YANG M, WANG J T, HAN T, et al. The effect of MS-222 on cold stress response of Oplegnathus fasciatus and the choice of optimal anesthesia concentration at room temperature. Aquatic Science and Technology Information, 2013, 40(5): 258-262 [杨敏, 王骥腾, 韩涛, 等. MS-222对条石鲷冷应激反应的影响及室温下最佳麻醉浓度的选择. 水产科技情报, 2013, 40(5): 258-262] |
ZHAI S W, SHEPHERD B S, YANG S, et al. Efficacy of tricaine methanesulfonate (MS-222) as an anesthetic agent for short-term anesthesia in juvenile yellow perch (Perca flavescens). Israeli Journal of Aquaculture, 2018, 70: 1515-1525 |
ZHANG M Q, WANG K Y, WANG J, et al. The effect of MS-222 on Ictalurus punctatus anesthesia. Fisheries Science and Technology Information, 2014, 41(1): 21-25 [张民强, 汪开毓, 王均, 等. MS-222对斑点叉尾  麻醉效果的研究. 水产科技情报, 2014, 41(1): 21-25] 麻醉效果的研究. 水产科技情报, 2014, 41(1): 21-25] |
ZHANG T, YANG Y, HOU J L, et al. Anesthetic effect of MS-222 and eugenol on Eleutheronema tetradactylum fingerlings. Fishery Information and Strategy, 2014, 29(2): 136-142 [张涛, 杨阳, 侯俊利, 等. MS-222、丁香酚对多鳞四指马(鲅)幼鱼麻醉效果的研究. 渔业信息与战略, 2014, 29(2): 136-142] |
ZHAO M, LIU X Z, XU Y J, et al. Study on the effect of MS-222 anesthetizing adult Verasper variegatus. Advances in Marine Science, 2010, 28(4): 531-537 [赵明, 柳学周, 徐永江, 等. MS-222麻醉圆斑星鲽成鱼效果研究. 海洋科学进展, 2010, 28(4): 531-537] |



