 早期生长发育特征及胚胎发育的温度适应特性
早期生长发育特征及胚胎发育的温度适应特性
2. 上海海洋大学水产与生命学院 上海 201306;
3. 莱州明波水产有限公司 山东 烟台 261400
 (Seriola quinqueradiata)胚胎和仔稚幼鱼阶段生长发育的形态与数量特征。结果显示,五条
(Seriola quinqueradiata)胚胎和仔稚幼鱼阶段生长发育的形态与数量特征。结果显示,五条 成熟卵子为透明的圆球形浮性卵,卵径长为1.26~1.36 mm,单油球。在水温(22.0±0.5)℃、盐度30、pH 7.6~8.0的条件下,历时35 h 15 min孵化出膜。胚胎发育过程可分为卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、器官发生期、肌肉效应期和脱膜孵化期8个时期。初孵仔鱼全长为(4.03±0.27) mm,卵黄囊呈长椭圆形,长度约为全长的3/8。3 DAH(day after hetching,DAH)仔鱼全长为(16.23±1.61) mm,开口,转入混合营养期,开口饵料为轮虫(Brachionus plicatilis)。6 DAH仔鱼全长为(4.93±0.17) mm,卵黄囊消耗殆尽,鳔开始充气。10 DAH仔鱼全长为(5.21±0.23) mm,油球消耗完毕,完全进入外源性营养阶段。15 DAH仔鱼全长为(6.24±0.66) mm,脊椎末端开始弯曲,至25 DAH时,稚鱼全长为(10.25±1.35) mm,弯曲过程完成,开始摄食卤虫无节幼体(Artemia salina)。30 DAH稚鱼全长为(16.23±1.61) mm,开始进行配合饲料转化;40 DAH稚鱼全长为(28.07±2.32) mm,苗种摄食配合饲料良好。65 DAH幼鱼全长为(81.49±5.11) mm,体态与成体相似。研究表明,五条
成熟卵子为透明的圆球形浮性卵,卵径长为1.26~1.36 mm,单油球。在水温(22.0±0.5)℃、盐度30、pH 7.6~8.0的条件下,历时35 h 15 min孵化出膜。胚胎发育过程可分为卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、器官发生期、肌肉效应期和脱膜孵化期8个时期。初孵仔鱼全长为(4.03±0.27) mm,卵黄囊呈长椭圆形,长度约为全长的3/8。3 DAH(day after hetching,DAH)仔鱼全长为(16.23±1.61) mm,开口,转入混合营养期,开口饵料为轮虫(Brachionus plicatilis)。6 DAH仔鱼全长为(4.93±0.17) mm,卵黄囊消耗殆尽,鳔开始充气。10 DAH仔鱼全长为(5.21±0.23) mm,油球消耗完毕,完全进入外源性营养阶段。15 DAH仔鱼全长为(6.24±0.66) mm,脊椎末端开始弯曲,至25 DAH时,稚鱼全长为(10.25±1.35) mm,弯曲过程完成,开始摄食卤虫无节幼体(Artemia salina)。30 DAH稚鱼全长为(16.23±1.61) mm,开始进行配合饲料转化;40 DAH稚鱼全长为(28.07±2.32) mm,苗种摄食配合饲料良好。65 DAH幼鱼全长为(81.49±5.11) mm,体态与成体相似。研究表明,五条 胚胎孵化的适宜温度范围为22℃~24℃。研究结果可为构建稳定的五条
胚胎孵化的适宜温度范围为22℃~24℃。研究结果可为构建稳定的五条 苗种培育技术提供依据,保障深远海养殖优质种苗生产与供给。
苗种培育技术提供依据,保障深远海养殖优质种苗生产与供给。 胚胎发育 胚后发育 形态特征 生长特征 温度适应
胚胎发育 胚后发育 形态特征 生长特征 温度适应 2. College of Fishers and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Laizhou Mingbo Aquatic Co., Ltd, Yantai, Shandong 261400, China
五条




近年来,我国深远海养殖发展迅猛,各种大型养殖平台建设加速。然而,适宜的养殖品种缺乏成为深远海养殖发展的瓶颈之一。大洋性经济鱼类是适宜深远海养殖的优良品种,目前,国际上开发的三文鱼(Oncorhynchus)、金枪鱼(Thunnini)、




近年来,许多企业在福建和辽宁大连地区开展了五条




实验于2020年5—7月在山东莱州明波水产有限公司进行。五条
每天检测亲鱼产卵情况,当发现亲鱼在培育池内产卵时,立即取样观察。收集受精卵置于方形白色PVC材质的塑料箱(容积为60 L)内,连续充气,流水孵化,控制水温为22℃~23℃。孵化期间,胚胎发育至原肠期前每15~20 min取样1次,胚体形成后每20~ 40 min取样1次。利用NIKON(MSZ800,日本)解剖镜进行胚胎发育观察,记录胚胎发育时序及其形态特征,并使用NIKON (Coolpix 4500,日本)数码相机进行显微拍照。
1.3 仔稚幼鱼生长发育观察仔鱼孵化出膜后,利用室内圆形水泥池(容积为7 m3)开展苗种培育,初孵仔鱼布池密度为10, 000尾/m2。培育条件:水温为22℃~24℃,盐度为27~30,pH为7.6~8.0,光照周期为12L : 12D。饵料系列:褶皱臂尾轮虫(Brachionus plicatilis)→卤虫无节幼体(Artemia salina)→配合饲料。苗种胚后发育时间以日龄(day after hetching, DAH)计算,初孵仔鱼为0日龄,以此类推。3~21 DAH仔鱼投喂褶皱臂尾轮虫,日投喂2次,投喂密度为8~10 ind./mL;投喂轮虫时添加小球藻(Chlorella vulgaris),密度为5×105 cell/mL。20 DAH开始增加投喂卤虫无节幼体,密度为1~2 ind./mL,日投喂2次;30 DAH开始投喂配合饲料,进行配合转化;40 DAH后转换投喂配合饲料。自4 DAH开始换水,换水率逐渐达100%~200%,定期清理培育池底部,保持水质清洁。
自仔鱼布池日起15 DAH前,每天从育苗池中随机取样40~60尾;15 DAH后每3 d随机取样30~40尾;30 DAH后,每5 d随机取样20~30尾。实验之前,先使用MS-222对仔鱼进行麻醉处理,然后在NIKON (MSZ800,日本)解剖镜下对仔鱼不同时期的形态特征、色素变化、器官发育、摄食情况进行观察并拍照记录,测量仔鱼的体长、眼径、油球径等。另外,使用固定液固定各日龄标本10~20尾,以备实验室补充观察使用。
1.4 温度对胚胎孵化的影响温度梯度设置:20℃、22℃、24℃、26℃、28℃共5组,每组重复2次。实验容器为8个白色塑料桶(容积为100 L),使用300 W电热棒带控温仪控制温度(精确度为±0.5℃)作为恒温水浴。将实验烧杯(2 000 mL)加水放入,将水温调控到各自的温度组,每个温度组放置3个烧杯。发现产卵时,从采卵网箱中取受精卵,挑选发育至多细胞的卵,计数120粒分别放入每个烧杯中,微充气,定时观察并记录胚胎发育进程。每天将每个烧杯中的死卵计数后去除,并换水30%~50%左右。受精卵孵出后,统计孵化率、畸形率,确定适宜孵化水温。
1.5 数据统计分析仔稚幼鱼生长数据、受精卵孵化率和畸形率数据采用平均值±标准差(Mean±SD)表示,使用SPSS 24.0软件进行单因素方差(one-way, ANOVA)分析方法,对受精卵孵化率、畸形率进行显著性分析,差异显著性水平P设定为0.05,当P < 0.05时为差异显著。
2 结果 2.1 胚胎发育特征五条
|
|
表 1 五条 |
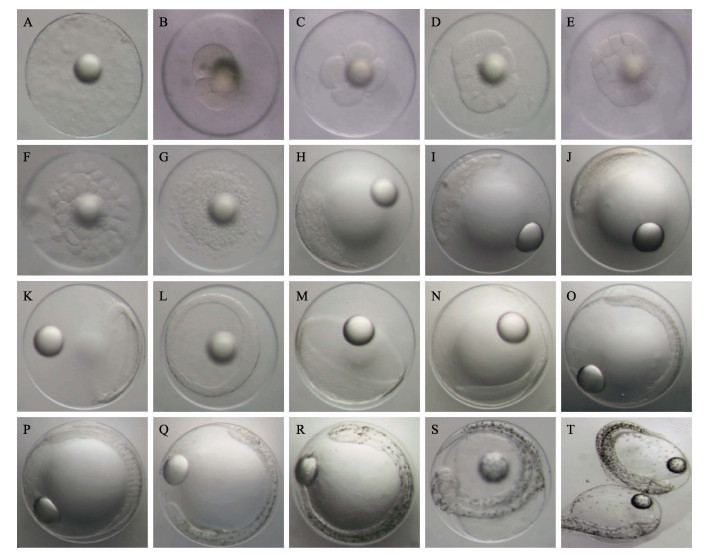
|
图 1 五条 |
未受精成熟卵子原生质表层分布着复杂的网纹结构。受精后,胚盘形成,卵周隙扩大(图 1A)。
2.1.2 卵裂期受精后2 h 10 min,受精卵胚盘发生经裂。胎盘发生3次经裂,将胚盘分成8个大小均等的细胞,进入8细胞时期。每1次经裂的卵裂沟均与前1次卵裂沟垂直,分裂球等大;受精后3 h发生第5次经裂,进入32细胞时期,卵裂大小不一;受精后3 h 30 min,第1次纬裂发生,胚盘分化成排列不均的2层细胞,进入64细胞期;之后细胞不断分裂,在动物极处排成多层;至受精后5 h 15 min,胚盘动物极一侧形成表面粗糙的高帽状细胞群,进入桑葚期(图 1B~图 1H)。
2.1.3 囊胚期受精后6 h 5 min,高帽状细胞群表面由粗糙变得光滑,细胞继续分裂增多,高帽状细胞群高度增加,形成高囊胚;受精后10 h 20 min,高囊胚边缘开始变薄并向扁平发展,进入低囊胚期(图 1I和图 1J)。
2.1.4 原肠期受精后11 h 30 min,进入原肠早期。原肠胚边缘下包,形成原肠腔,胚盾逐渐明显;之后经历原肠中期、原肠晚期,至受精后17 h 30 min,原肠腔壁加厚,原口即将关闭,出现胚体雏形(图 1K~图 1N)。
2.1.5 神经胚期受精后18 h 50 min,原口完全关闭,进入神经胚期。此时,神经胚两侧加厚隆起向内卷曲后在中间结合,形成神经脊。胚体头部呈椭圆形,胚体体节为5~6对,有棕黄色点状色素分布,出现克氏泡(图 1O)。
2.1.6 器官发生期受精后27 h 40 min,胚体包卵黄囊1/2,胚体头部和尾部明显,体节为9~12对,心脏原基形成;受精后28 h 40 min,胚体包卵黄囊2/3,形成尾芽,出现心跳活动(频率为58~79次/min),胚体两侧均匀分布零散点状黑色素,脑分化为3部分,形成晶体,体节为20~24对,胚体偶尔出现间歇性收缩(频率为1~3次/min)(图 1P和图 1Q)。
2.1.7 肌肉效应期受精后30 h 25 min,胚体包卵黄囊4/5,胚体两侧分布的黑色素明显增多,形成黑色素条带,尾部较头部密集;受精后32 h,胚体完全包被卵黄囊,头部和卵黄囊色素明显增多,头部分化为5部分,尾部扭转明显,胚体间歇性收缩(肌肉效应)明显,收缩频率为12~18次/min(图 1R和图 1S)。
2.1.8 孵化期受精后35 h 15 min,胚体肌肉效应幅度和频率增大(15~23次/min),卵黄囊缩小,胚体按先尾部后头部的顺序,将卵膜顶破,脱膜而出(图 1T)。
2.2 仔稚幼鱼生长发育特征 2.2.1 卵黄囊仔鱼期初孵仔鱼(0 DAH):全长为(4.03±0.27) mm,卵黄囊较大,呈椭圆形,长径为(1.53±0.13) mm,短径为(0.81±0.07) mm,油球径为(0.48±0.04) mm。头长占全长的10.9%,肛前距占全长的57.2%,眼径为头长的52.2%。初孵仔鱼刚脱膜时,身体弯曲,躯体前半部分伏在卵黄囊上,腹部朝上或横卧在水中,呈静止状态。背鳍膜和尾鳍膜之间存在明显的分界线,背鳍膜和臀鳍膜边缘分布棕黄色点状色素带,躯干、头部、油球上散布着枝状黑色素。肠道为细线状,紧贴躯干腹部(图 2A)。

|
图 2 五条 G: Larvae of 15 DAH; H: Larvae of 20 DAH; I: Larvae of 25 DAH; J: Larvae of 30 DAH; K: Post-larvae of 35 DAH; L: Juvenile of 40 DAH; M: Juvenile of 50 DAH; N: Juvenile of 65 DAH |
1 DAH仔鱼:全长为(4.21±0.17) mm,卵黄囊体积减少约55%,油球径为(0.44±0.06) mm。头长占全长的11.5%,肛前距占全长的57.4%,眼径为头长的54.5%。仔鱼身体完全展开,在水体中静止倒立悬浮,活动能力较弱。心脏呈L型,心跳为150~180次/min。背鳍膜和臀鳍膜边缘分布的色素细胞密度增加,呈较为明显的色素带;躯干两侧色素分布密集,尾部近乎透明。肠道尚未充气(图 2B)。
2 DAH仔鱼:全长为(4.43±0.13) mm,卵黄囊体积减少约75%,油球径为(0.40±0.04) mm。头长占全长的11.6%,肛前距占全长的57.5%,眼径为头长的55.4%。仔鱼开始平游,靠尾部摆动可变换水层,且瞬时游泳速度快。在水体中分布较为均匀,分布密度水体上层较下层大。背鳍膜和臀鳍膜增高,色素带密度增加;眼囊开始分布淡黄色色素;尾鳍膜仍为透明,呈扇形。肠道加粗,中间腔扩大(图 2C)。
3 DAH仔鱼:全长为(4.51±0.33) mm,卵黄囊体积减少约90%,油球径为(0.21±0.05) mm。头长占全长的15.1%,肛前距占全长的58.5%,眼径为头长的48.5%。仔鱼多静止在水体中。鳔原基形成,未充气。躯干上、下两侧枝状黑色素增多,尾部有少量点状色素,背鳍膜升高,棕黄色色素减少,胸鳍呈小叶状,活动能力不强。眼囊因黑色素分布密集而呈黑色。心脏有血液流动。仔鱼开口,下颌骨明显,膀胱腔扩大,肠道出现褶皱(图 2D)。
6 DAH仔鱼:全长为(4.93±0.17) mm,卵黄囊消耗殆尽,油球仍有残余。头长占全长的23.2%,肛前距占全长的57.8%,眼径为头长的38.9%。仔鱼游泳能力提高,能躲避障碍物,主要分布在水体中、上层,有趋光性。鳔开始充气。躯干上、下两侧和眼囊黑色素分布密集,躯干中部为棕黄色,通体呈黄褐色(图 2E)。
2.2.2 脊索弯曲前仔鱼期10 DAH仔鱼:全长为(5.21±0.23) mm,油球消耗完毕。头长占全长的25.7%,肛前距占全长的59.3%,眼径为头长的32.5%。躯干黑色素分布密度加大,形成黑色色斑;两侧胸鳍分成明显的两部分,上半部为黑,下半部为棕黄。肩带骨凸显。胸鳍明显增长。鳔充气呈椭圆形。消化系统进一步发育,肠道褶皱增多(图 2F)。
2.2.3 脊索弯曲仔鱼期15 DAH仔鱼:全长为(6.24±0.66) mm。头长占全长的27.6%,肛前距占全长的66.3%,眼径为头长的35.1%。躯干左右两侧明显加宽。除头部下半部分和尾部,全身分布黑色和棕黄色色斑,通体为深褐色。仔鱼摄食轮虫良好,摄食率(feeding rate, FT, %)(摄食率=摄食仔鱼数/仔鱼总数×100%)达90%以上,肠道前端和胃部后方形成第1个生理弯曲。仔鱼脊索末端开始向上弯曲,下方尾扇形成,鳍条为12根,上有少量棕黄色点状色素,背鳍膜明显后移(图 2G)。
20 DAH仔鱼:全长为(7.55±1.12) mm。头长占全长的28.7%,肛前距占全长的60.5%,眼径为头长的41.6%。除尾部和眼囊,全身密集分布黑色色素,通体呈淡黑色,眼囊变成深蓝色。脊索末端弯曲完成。背鳍鳍条16根,臀鳍鳍条8根,覆盖着棕黄色色素。尾鳍扇形面积增大,鳍条17根,仍为透明。仔鱼开始摄食卤虫无节幼体,肠道形成2个生理弯曲(图 2H)。
2.2.4 脊索弯曲后稚鱼期25 DAH稚鱼:全长为(10.25±1.35) mm。头长占全长的28.8%,肛前距占全长的59.5%,眼径为头长的33.1%。脊索末端演化成尾鳍条,尾鳍条17根,背鳍条23根,臀鳍条13根。通体除尾鳍外呈黄绿色。鱼体能顺流游动,有集群现象,分布在水体中、上层。个体生长差异加剧。苗种摄食卤虫无节幼体良好(图 2I)。
30 DAH稚鱼:全长为(16.23±1.61) mm。头长占全长的24.7%,肛前距占全长的55.6%,眼径为头长的34.9%。尾鳍分叉明显,鳍条19根,尾鳍始端有黑色色素斑点。背鳍鳍条30根,臀鳍条21根,腹鳍条5根,胸鳍条12根。通体呈黑金色,眼囊为金黄色,体表开始形成色素带。可逆流游动。全部摄食卤虫无节幼体,开始进行配合饲料诱导。出现攻击与残食行为(图 2J)。
35 DAH稚鱼:全长为(22.45±1.42) mm。头长占全长的26.6%,肛前距占全长的53.6%,眼径为头长的33.8%。鳍条数量与成鱼一样。鱼苗呈梭形,通体呈金黄色。生长速度加快,个体差异加大,残食现象严重,个体大的鱼苗撕咬吞食个体小的鱼苗,造成鱼苗死亡率增高(图 2K)。
40 DAH稚鱼:全长为(28.07±2.32) mm。头长占全长的27.8%,肛前距占全长的54.3%,眼径为头长的32.3%。鱼体体色发生巨大变化,开始生成鳞片,通体呈黑金色,光照下躯干部为银白色,尾鳍上、下端出现褐色色斑。体表形成3~4条纵向的色素带。鱼苗在水中集群快速游动,遇有外部刺激快速散开逃逸(图 2L)。
2.2.5 幼鱼期50 DAH幼鱼:全长为(45.75±4.03) mm。头长占全长的28.9%,肛前距占全长的53.64%,眼径为头长的30.1%。色素带颜色加深,背部为黑褐色,腹部为棕黄色,背鳍、尾鳍边缘、臀鳍边缘为棕黄色,眼囊为棕黄色。纵向色素带增加至5~6条(图 2M)。
65 DAH幼鱼:全长为(81.49±5.11) mm。头长占全长的25.9%,肛前距占全长的49.2%,眼径为头长的37.7%。体色再次发生变化,背部为青色,腹部为银白色,背鳍、尾鳍、臀鳍为棕黄色,体表鳞片形态同成体。眼囊为黄色,纵向色素带褪去,苗体态与成体相似(图 2N)。
2.3 仔稚幼鱼摄食与生长特性仔鱼开口前,生长主要靠内源性营养;3 DAH时,仔鱼开口后转入混合营养期(图 3);在4 DAH时,卵黄囊消耗96%;在6 DAH时,卵黄囊吸收完毕,仔鱼开始发育并完全依赖外源营养,生长速度加快。油球吸收速度较卵黄囊慢,至10 DAH吸收完毕。3 DAH时,仔鱼初次摄食轮虫;6 DAH仔鱼摄食率为60%~70%;20 DAH仔鱼摄食卤虫无节幼体;30 DAH仔鱼进行配合饲料转化;40 DAH仔鱼全部摄食配合饲料。
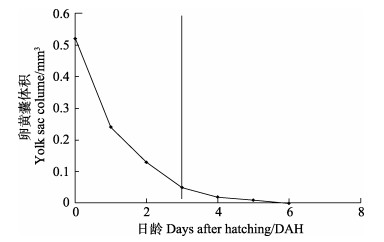
|
图 3 五条 |
本研究条件下,五条
TL=0.024 3D2–0.390 7D+5.855 7 (R=0.997 2)

|
图 4 五条 |
式中,TL为仔鱼全长,D为日龄。
仔鱼在20 DAH之前生长缓慢,日生长速率为0.17 mm/d;20 DAH之后生长速率明显提升,日生长速率为1.02 mm/d;随着鱼苗开始摄食配合饲料后,日生长速率达到2.13 mm/d。从初孵仔鱼开始至65 DAH幼鱼,五条
五条

|
图 5 温度对五条 |
从孵化速率看,在20℃条件下,胚胎发育最慢,孵化时间为39 h,孵化率相对较低;而28℃条件下,胚胎发育最快,但大多数胚胎发育到一定时期就会停止,孵化出的仔鱼几乎全为畸形;26℃条件下胚胎发育也很快,用时28 h,但仔鱼畸形率较高,温度对胚胎发育速率的影响很明显(表 2)。综合温度对胚胎发育的影响,五条
|
|
表 2 温度对五条 |

本研究观察和记录了五条

五条











五条













本研究发现,五条

本研究还发现,五条

温度是影响鱼类受精卵孵化的重要因素,不同的鱼种胚胎发育需要的温度条件不同,对温度的适应范围有很大差异。在一定温度范围内,五条



CHEN C S, HUANG J M, HE H W, et al. Morphological studies of the embryos, larvae juvenile and young fish of Seriola dumerili. Journal of Fishery Sciences of China, 1998, 5(1): 25-29 [陈昌生, 黄佳鸣, 何华武, 等. 高体  胚胎及仔稚幼鱼的形态观察. 中国水产科学, 1998, 5(1): 25-29 DOI:10.3321/j.issn:1005-8737.1998.01.005] 胚胎及仔稚幼鱼的形态观察. 中国水产科学, 1998, 5(1): 25-29 DOI:10.3321/j.issn:1005-8737.1998.01.005] |
ERIKO O, TAKUYA N, YOSHITOMO N, et al. Genetic linkage maps of two yellowtails (Seriola quinqueradiata and Seriola lalandi). Aquaculture, 2004, 244(1/2/3/4): 41-48 |
EMMANUEL M M, KARINA G Á, JUAN P L, et al. Morphological development and allometric growth of yellowtail kingfish Seriola lalandi V. Larvae under culture conditions. Aquaculture Research, 2016, 47(4): 1277-1287 |
FAN Y J, SHI Z P. Research progress and application prospects of fish hatching enzymes. Marine Limnology Bulletin, 2002(1): 48-56 [樊廷俊, 史振平. 鱼类孵化酶的研究进展及其应用前景. 海洋湖沼通报, 2002(1): 48-56 DOI:10.3969/j.issn.1003-6482.2002.01.007] |
FUKUHARA O, NAKAGAWA T, FUKUNAGA T. Larval and juvenile development of yellowtail reared in the laboratory. Nippon Suisan Gakkaishi, 1986, 52(12): 2091-2098 DOI:10.2331/suisan.52.2091 |
HIGUCHI K, YOSHIDA K, GEN K, et al. Effect of timing of restricted feeding on sexual maturation in female yellowtail, Seriola quinqueradiata. Aquaculture, 2017, 479: 609-615 DOI:10.1016/j.aquaculture.2017.06.039 |
HUANG X K, SHAN L Z, YAN M C, et al. Embryonic development of yellow aquarium and its relationship with temperature and salinity. Marine science, 2017, 41(7): 44-50 [黄贤克, 单乐州, 闫茂仓, 等. 黄姑鱼胚胎发育及其与温度和盐度的关系. 海洋科学, 2017, 41(7): 44-50] |
KEIICHI M, KAZUTOSHI K, TAKASHI K, et al. Advanced spawning in yellowtail, Serriola quinqueradiata, by manipulations of the photoperiod and water temperature. Fisheries Science, 1998, 64(5): 727-731 DOI:10.2331/fishsci.64.727 |
LIU X W, WEI W Q. Research progress on the nutritional physiology of yellow amberjack protein. Feed and Animal Husbandry, 2009(5): 49-51 [刘兴旺, 魏万权. 五条  蛋白营养生理研究进展. 饲料与畜牧, 2009(5): 49-51] 蛋白营养生理研究进展. 饲料与畜牧, 2009(5): 49-51] |
LIU X Z, XU Y J, LIU X F, et al. Early growth and development characteristics of barfin flounder (Verasper moseri). Oceanologia et Limnologia Sinica, 2009, 40(6): 699-706 [柳学周, 徐永江, 刘新富, 等. 条斑星鲽(Verasper moseri)的早期生长发育特征. 海洋与湖沼, 2009, 40(6): 699-706 DOI:10.3321/j.issn:0029-814X.2009.06.005] |
LIU X Z, XU Y J, MA A J, et al. The effect of temperature, salinity, and light on embryonic development of semi-smooth tongue sole and incubation condition regulation technology. Marine Fisheries Research, 2004, 25(6): 1-6 [柳学周, 徐永江, 马爱军, 等. 温度、盐度、光照对半滑舌鳎胚胎发育的影响及孵化条件调控技术研究. 海洋水产研究, 2004, 25(6): 1-6] |
LOU Y D. Hatching enzymes of fish. Zoological Journal, 1965(3): 97-101, 123 [楼允东. 鱼类的孵化酶. 动物学杂志, 1965(3): 97-101, 123] |
MEN Q W, SU J X, MIU X Z. Taxonomy of fishes. Beijing: China Agriculture Press, 1995: 672 [孟庆闻, 苏锦祥, 缪学祖. 鱼类分类学. 北京: 中国农业出版社, 1995: 672]
|
NGUYEN N H, WHATMORE P, MILLER A, et al. Quantitative genetic properties of four measures of deformity in yellowtail kingfish Seriola lalandi Valenciennes, 1833. Journal of Fish Diseases, 2016, 39: 217-228 DOI:10.1111/jfd.12348 |
OSAMU F, TOHRU N, TATSUHIRO F. Larval and juvenile development of yellowtail reared in the laboratory. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52(12): 2091-2098 DOI:10.2331/suisan.52.2091 |
RØNNESTAD I, KOVEN W, TANDLER A, et al. Utilisation of yolk fuels in developing eggs and larvae of European sea bass (Dicentrarchus labrax). Aquaculture, 1998, 162(1/2): 157-170 |
SANG G Y, SANG W H, JI S C, et al. Morphological development of embryo, larvae and juvenile in yellowtail kingfish, Seriola lalandi. Development and Reproduction, 2016, 20(2): 131-140 DOI:10.12717/DR.2016.20.2.131 |
SHIOGAKI M, DOUTSU Y. The spawning of sea culpin, Pseudoblennius cottoides. Bulletin of Fishery of Nagasaki University, 1974, 38: 71-76 |
SHUKEI M, MASAEI K, KAZUHISA T. Embryonic and morphological development of larvae and juveniles of the amberjack, Seriola dumerili. Japanese Journal of Ichthyology, 1990, 37(2): 164-169 DOI:10.1007/BF02905385 |
WANG H T, ZHANG P J. Effects of environmental factors on the development of marine fish fertilized eggs and early larvae. Marine Science, 1998, 22(4): 50-52 [王宏田, 张培军. 环境因子对海产鱼类受精卵及早期仔鱼发育的影响. 海洋科学, 1998, 22(4): 50-52] |
XU Y J, ZHANG Z R, LIU X Z, et al. Early growth and development characteristics of yellowtail. Journal of Fishery Sciences of China, 2019, 26(1): 172-182 [徐永江, 张正荣, 柳学周, 等. 黄条  早期生长发育特征. 中国水产科学, 2019, 26(1): 172-182] 早期生长发育特征. 中国水产科学, 2019, 26(1): 172-182] |
XU Y J, LIU X Z, SHI B, et al. Domestication and early development characteristics of Pacific cod (Gadus macrocephalus) broodstock. Fishery Science Progress, 2017, 38(1): 159-167 [徐永江, 柳学周, 史宝, 等. 太平洋鳕(Gadus macrocephalus)亲鱼驯化培育与早期发育特征. 渔业科学进展, 2017, 38(1): 159-167] |
ZHANG T T, CHEN C, SHI Z H, et al. Effects of temperature on embryonic development and larval vigor of Moray grouper (Epinephelus moara). Fishery Science Progress, 2016, 37(3): 28-33 [张廷廷, 陈超, 施兆鸿, 等. 温度对云纹石斑鱼(Epinephelus moara)胚胎发育和仔鱼活力的影响. 渔业科学进展, 2016, 37(3): 28-33] |




