2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 山东 烟台 264006
2. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Shandong Marine Resource and Environment Research Institute, Yantai, Shandong 264006, China
益生菌是一类有益活性微生物的统称,是海水养殖病害生物防控的重要手段,在改善养殖生物肠道菌群结构、促进生物对饲料的消化吸收、提高宿主免疫力、增强机体抗病力等方面表现出较好的效果(Lakshmi et al, 2013; Madani et al, 2018),可作为养殖生产中抗生素类药物的理想替代品(薛俊敬, 2018; Pandiyan et al, 2013)。芽孢杆菌是研究较多的益生菌种之一,主要包括枯草芽孢杆菌(Bacillus Subtilis)、地衣芽孢杆菌(B. licheniformis)、凝结芽孢杆菌(B. coagulans)等,其被广泛应用于大菱鲆(胡凡光等, 2014)、大泷六线鱼(Hexagrammos otakii) (樊英等, 2021)、菲律宾鳗鲡(Anguill marmorata) (姚清华等, 2016)和尖吻鲈(Lates calcarifer)(袁丰华等, 2010)等鱼类养殖中。但关于蜡样芽胞杆菌在水产养殖中的应用研究相对较少,Catesoupe(1999)研究表明,蜡样芽孢杆菌进入宿主体内能够迅速定殖,并可通过产生蛋白酶和淀粉酶等大分子物质提高宿主的消化机能,促进营养物质的消化吸收。
大菱鲆(Scophthalmus maximus)于1992年引入我国,因其具有生长迅速、肉质鲜美、易于饲养等特点(雷霁霖, 2000),现已成为我国北方工厂化养殖的重要经济海水鱼类(路晶晶等, 2018; 樊瑞锋等, 2011)。近年来,随着养殖规模不断扩大、集约化程度不断提高,大菱鲆养殖环境恶化、病害频发等问题突出。抗生素类药物的使用有效解决了养殖过程中的病害问题,但长期使用会导致病原菌耐药性、药物残留以及水环境污染等问题,严重制约了大菱鲆养殖产业的健康发展。研制绿色、安全的抗生素替代品成为大菱鲆养殖产业高质量发展的必然趋势。本课题组研究发现,蜡样芽胞杆菌YB1在一定浓度内对大菱鲆具有动物安全性,可作为益生菌的候选菌株(孙娜等, 2019)。目前,关于蜡样芽胞杆菌应用于大菱鲆养殖中的研究尚未见报道。本研究将本课题组筛选的蜡样芽胞杆菌YB1添加到饲料中,探讨其在大菱鲆养殖过程中对鱼体生长性能、肠道消化酶及肝脏抗氧化酶活力、肠道组织结构的影响,以期为大菱鲆健康养殖和疾病的生态防控提供新的益生菌种。
1 材料与方法 1.1 蜡样芽孢杆菌制剂的制备及饲料配制实验所用蜡样芽胞杆菌YB1 (由本实验室筛选、保存)活化后接种于LB液体培养基,37℃、200 r/min振荡培养24 h后,6000 r/min离心收集菌体,使用PBS缓冲液[生工生物工程(上海)股份有限公司]重悬获得原菌液,其活菌含量为1×1010 CFU/mL。使用PBS稀释原菌液以喷雾形式均匀添加至基础饲料(购于山东升索饲料科技有限公司)表面,阴凉处风干,涂布含YB1的饲料于LB固体培养基,检测饲料中YB1的含量分别为0、105、106和107 CFU/g。
1.2 实验设计及饲养管理实验所用大菱鲆幼鱼共计720尾(购于烟台泰华海洋科技有限公司),其种质来源相同、大小均匀、体质健壮、平均体质量为(3.6±0.7) g。实验开始前,将幼鱼置于0.6 m3水体的实验桶中暂养1周。暂养结束后,将实验用鱼随机分为4组,分别命名为D-C组(含菌量0 CFU/g)、D-E-L组(含菌量105 CFU/g)、D-E-M组(含菌量106 CFU/g)和D-E-H组(含菌量107 CFU/g)。每组设置3个平行,每个平行60尾,各平行之间幼鱼体质量基本保持一致。每日早、中、晚共投喂3次,日投喂量约占大菱鲆幼鱼体质量的2%~4%,以饱食为准,及时清理粪便和残饵。实验期间控制水温为(21±2)℃,盐度为28~32,pH为7.9~8.2,溶氧 > 5 mg/L,氨氮 < 0.01 mg/L,养殖周期为50 d。
1.3 样品采集及处理 1.3.1 大菱鲆幼鱼生长指标的测定在0、25和50d分别对各组实验用鱼的体质量进行测量,测量前停食24 h,测量后计算平均体质量、增重率(WGR)、特定生长率(SGR)和饲料系数(FCR)。
| $ \text {WGR (%)}=(W_{t} – W_{0})/W_{0}×100% $ |
| $ \text{SGR (%/d)}=(\ln W_{t} – \ln W_{0})/{\rm t}×100% $ |
| $ \text {FCR}=I_{t}/W_{t} – W_{0} $ |
式中,t为饲养时间,W0为平均每尾大菱鲆幼鱼初始体质量,Wt为平均每尾大菱鲆幼鱼终末体质量,It为平均每尾大菱鲆幼鱼摄食饲料总质量。
1.3.2 肠道消化酶活力的测定在第25和50天时,随机从各实验组的每个平行中取3尾大菱鲆幼鱼测定肠道酶活力,取样前停食24h。取样时于冰盘上解剖大菱鲆,取出肠道后用灭菌水冲洗干净,装入冻存管迅速置于液氮中冷冻保存、待测。肠道蛋白酶(protease)、脂肪酶(lipase)、淀粉酶(amylase)均采用南京建成试剂盒测定,其中,组织蛋白含量采用考马斯亮蓝法,蛋白酶和脂肪酶采用比色法,淀粉酶采用碘—淀粉比色法。
1.3.3 肝脏抗氧化酶活力的测定在第25和50天时,随机从各实验组的每个平行中取3尾大菱鲆幼鱼测定肝脏酶活力,取样前停食24h。取样时,于冰盘上解剖大菱鲆,取出肝脏后用灭菌水冲洗干净,装入冻存管,迅速置于液氮中冷冻保存、待测。肝脏超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和过氧化氢酶(catalase, CAT)均采用南京建成试剂盒测定。其中,肝脏SOD酶活力测定采用WST-1法,MDA含量测定采用TBA法,CAT酶活力测定采用紫外法。
1.3.4 肠道组织结构的观察在0、25和50 d时,随机从各实验组的每个平行中取3尾大菱鲆幼鱼,分析肠道组织结构。取样前停食24 h,解剖大菱鲆,剪取前肠段用灭菌水冲洗干净,用滤纸吸干表面水分后置于波恩氏液中固定24 h,用70%乙醇多次清洗至样品无黄色。固定好的肠道组织经脱水、浸蜡,包埋于石蜡中,用切片机切片;切片烘干后置于二甲苯中脱蜡,梯度乙醇溶液洗脱;苏木精染色,伊红复染,洗去浮色后封片、烘干,显微镜下观察肠道组织结构。
1.4 数据处理使用Excel软件进行数据统计,采用SPSS 19.0软件进行单因素方差分析(one-way ANOVA),通过Duncan多重比较检验各组数据差异显著性,差异显著水平设置为P < 0.05,结果以平均值±标准差(Mean± SD)表示。
2 结果与分析 2.1 YB1对大菱鲆幼鱼生长性能的影响在饲料中添加蜡样芽胞杆菌YB1对大菱鲆幼鱼WGR、SGR和FCR的影响见表 1。由表 1可知,实验前期(0~25 d),仅D-E-M组WGR和SGR高于D-C组,D-E-L组、D-E-M组和D-E-H组的FCR均高于D-C组,但无显著差异(P > 0.05)。实验末期(25~50 d),各实验组的WGR和SGR均高于对照组,其中D-E-H组最高,与对照组相比WGR和SGR分别提高了27.78%和21.39% (P < 0.05)。整个实验周期(0~50 d),D-E-L组、D-E-M组和D-E-H组的WGR和SGR均高于D-C组,其中D-E-H组最高,较D-C组分别提高了13.91%和7.98%,且与D-C组具有显著差异(P < 0.05),D-E-L组、D-E-M组和D-E-H组的FCR均稍高于D-C组,但与D-C组无显著差异(P > 0.05)。
|
|
表 1 饲料中添加蜡样芽胞杆菌YB1对大菱鲆幼鱼生长性能的影响(平均值±标准差, n=3) Tab.1 Effects of dietary B. cereus YB1 on growth performance of juvenile S. maximus (Mean±SD, n=3) |
饲料中添加YB1对于大菱鲆幼鱼肠道蛋白酶、淀粉酶、脂肪酶活力和肝脏丙二醛含量、超氧化物歧化酶、过氧化氢酶活力的影响见表 2。由表 2可知,实验前期(0~25 d),D-E-L组、D-E-M组和D-E-H组的肠道蛋白酶活力和淀粉酶活力均高于D-C组,但各组间无显著性差异(P > 0.05);D-E-M组的脂肪酶活力最高,且显著高于D-C组(P < 0.05);D-E-L组、D-E-M组和D-E-H组的肝脏SOD活力均高于D-C组,D-E-L组和D-E-H组的CAT活力均高于D-C组,各实验组的MDA含量均显著低于对照组(P < 0.05)。
|
|
表 2 饲料中添加蜡样芽胞杆菌YB1对大菱鲆幼鱼肠道消化酶和肝脏抗氧化酶活力的影响 Tab.2 Effects of dietary B. cereus YB1 on intestinal and liver enzyme activity in juvenile S. maximus |
实验末期(25~50 d),D-E-M组肠道蛋白酶和淀粉酶活力最高,且显著高于D-C组(P < 0.05),D-E-L组的脂肪酶活力最高,且显著高于D-C组(P < 0.05);各实验组的肝脏MDA含量均低于对照组,其中D-E-M组的MDA含量最低,且与D-C组存在显著性差异(P < 0.05),D-E-H组的SOD和CAT活力最高,但各组间无显著性差异(P > 0.05)。
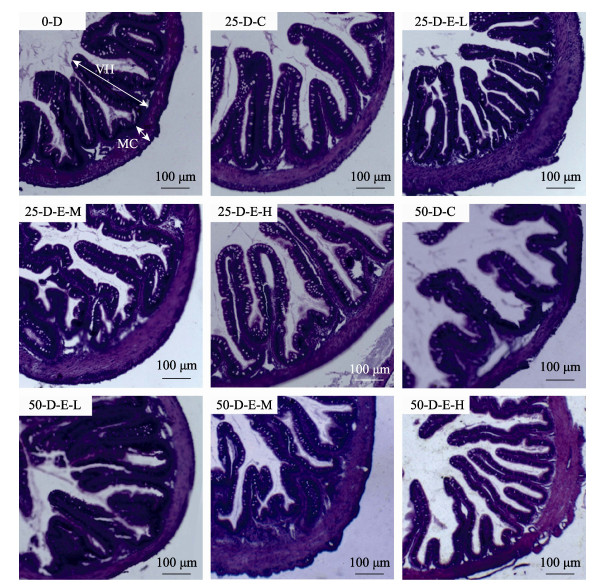
2.3 YB1对大菱鲆幼鱼肠道组织结构的影响饲料中添加YB1可以增加大菱鲆幼鱼肠粘膜皱襞高度、肌层厚度以及肠道褶皱数量,显著改善幼鱼肠道组织结构。实验结果显示,各组大菱鲆幼鱼肠道黏膜组织清晰,结构完整,排列有序,无混乱、脱落的现象(图 1)。由表 3可知,整个实验周期,25 d和50 d实验组大菱鲆幼鱼肠道黏膜皱襞高度、肌层厚度和肠道褶皱量与第0天相比显著增加;25 d时,D-E-L组和D-E-M组的肠黏膜皱襞高度、肌层厚度较D-C组显著增加(P < 0.05),D-E-L组、D-E-M组和D-E-H组的肠道褶皱量均较D-C组显著增加(P < 0.05);50 d时,各实验组的肠黏膜皱襞高度、肌层厚度和肠褶皱量显著高于对照组(P < 0.05)。
|
图 1 蜡样芽孢杆菌YB1对大菱鲆幼鱼肠道组织结构的影响 Fig.1 Effects of B. cereus YB1 on the intestinal structure of juvenile S. maximus VH:肠黏膜皱襞高度;MC:肌层厚度 VH: Villus height; MC: Muscularis thickness |
|
|
表 3 蜡样芽孢杆菌YB1对大菱鲆幼鱼肠道组织结构的影响 Tab.3 Effects of B. cereus YB1 on the intestinal structure of juvenile S. maximus |
目前,益生菌已被广泛应用于水产养殖行业(Pandiyan et al, 2013),如芽孢杆菌能够促进珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀× E. lanceolatus♂)生长,提高其免疫力和抗氧化能力(王成强等, 2019);乳酸菌可提高许氏平鲉(Sebastes schlegelii)的免疫力,促进其生长(王腾腾, 2017);解淀粉芽孢杆菌(Bacillus amyloliquefaciens)能提高黑鲷(Sparus macrocephalus)的WGR和SGR (覃初斌等, 2017)。本研究中,饲料中蜡样芽胞杆菌YB1的添加量为107 CFU/g时,可显著提高大菱鲆幼鱼WGR和SGR,YB1应用于大菱鲆幼鱼养殖可起到促进生长的良好效果。此外,益生菌的使用要求适宜的添加量,添加量太低达不到相应的益生效果,添加量太高则会破坏养殖生物的肠道菌群结构(Panigrahi et al, 2004)。益生菌的具体添加量尚未形成统一的标准,多由研究者根据实际情况针对不同的研究对象探索最适添加量,例如,凡纳滨对虾(Litopenaeus vannamei)最适宜的芽孢杆菌添加量为109 CFU/kg (王苓等, 2017);枯草芽孢杆菌的添加量为1.2×104 CFU/g时,仿刺参(Apostichopus japonicus)的SGR提高最显著,但当添加量为1×104 CFU/g时,蛋白酶活力提高了53.93%,而脂肪酶活力无显著性提高(董春光等, 2015)。本研究中,蜡样芽胞杆菌YB1的添加量为107 CFU/g时,可显著提高大菱鲆幼鱼的WGR和SGR。因此,益生菌添加量的确定应综合考虑养殖对象、益生菌种类以及应用目标等因素。
3.2 YB1对大菱鲆幼鱼肠道消化酶和肝脏抗氧化酶活力的影响肠道中消化酶活力的高低是鱼类饲料吸收转化率和养殖效率的主要影响因素,芽孢杆菌进入鱼类肠道后能迅速定植,提高相应的消化酶活力,促进机体对营养物质的消化吸收(程远等, 2014)。姚清华等(2016)发现,在饲料中添加2.5% (5×108 CFU/g)枯草芽孢杆菌可显著提高黑仔期菲律宾鳗鲡(Anguill marmmorata)肠道淀粉酶、蛋白酶以及脂肪酶的活力。付保荣等(2018)研究认为,短短芽孢杆菌(Brevibacillus brevis)可显著提高鲤鱼(Cyprinus carpio)肠道蛋白酶和淀粉酶的活力。Sun等(2010)研究表明,饲料中添加嗜冷芽孢杆菌(Psychrobactersp)可提高点带石斑鱼(Epinephelus coioides)肠道内蛋白酶、淀粉酶以及脂肪酶的活力,但与对照组无显著差异。本研究中,投喂含有YB1饲料的大菱鲆幼鱼肠道消化酶活力与对照组相比在实验前期有升高的趋势;实验末期,YB1添加量为105 CFU/g组的幼鱼肠道内脂肪酶活力显著高于对照组,添加量为106 CFU/g时,淀粉酶和蛋白酶活力显著高于对照组。本课题组前期研究发现,YB1具有产淀粉酶和蛋白酶的特性(孙娜等, 2019),实验组大菱鲆幼鱼肠道内消化酶活力的提高可能与YB1定植于幼鱼肠道后分泌的胞外酶有关,淀粉酶、蛋白酶等胞外酶能够协助机体消化营养物质,促进饲料中营养素的降解,提高饲料利用率。
鱼类的抗氧化防御系统能够清除体内过量的氧自由基,减少活性氧对机体的损伤(Sakai, 1999),SOD是机体内一种重要的抗氧化酶,可通过清除机体内氧自由基参与机体的抗氧化防御过程;CAT则可参与活性氧的代谢过程,保护细胞免受损伤;MDA含量可反映机体内氧化反应对细胞的损伤程度(李雅琴等, 2015; 张坤生等, 2007; 孔祥会等, 2007)。本研究中,YB1添加量为107 CFU/g组的大菱鲆幼鱼肝脏SOD活力较对照组增加了23%,且幼鱼肝脏内CAT活力相较于对照组有显著提高;在同一添加量下,幼鱼的WGR和SGR也处于较高的水平。这说明,在饲料中添加适量的YB1能提高大菱鲆体内抗氧化酶活力,维持其抗氧化系统的平衡,在一定程度上提高幼鱼的抗氧化能力和生长性能。黄坤鹏等(2012)研究也发现,芽孢杆菌可显著提高斜带石斑鱼(Epinephelus coioides)仔鱼体内的SOD活力。袁卫(2016)研究表明,饲料中添加芽孢杆菌在提高凡纳滨对虾体内抗氧化活性指标的同时,对其生长也有一定的促进作用。MDA是脂类物质参与生物体内氧化反应的最终产物,其含量的高低可作为衡量生物体内抗氧化系统能否正常发挥作用的指标(李盈锋等, 2014)。本研究发现,实验组大菱鲆幼鱼肝脏MDA含量显著低于对照组,YB1添加量为107 CFU/g时,MDA含量下降了42%。这表明芽孢杆菌对大菱鲆幼鱼体内的抗氧化能力产生了积极的影响,但其对抗氧化系统的具体益生机制仍待进一步研究。
3.3 YB1对大菱鲆幼鱼肠道组织结构的影响鱼类肠道由黏膜层、黏膜下层、肌层和浆膜层4部分构成(赖红娥, 2013),黏膜层是肠道进行营养物质消化吸收和肠道菌群黏附的主要场所,肠道肌层可为肠道蠕动提供充足的动力,促进营养物质吸收,因此,通过观察黏膜层和肌层的结构变化可直观的了解益生菌在肠道中发挥的作用。黄灵等(2018)研究表明,饲料中添加益生菌微生态制剂可提高虎龙斑(Epinephelus fuscoguttatus ♀×E. lanceolatus ♂)肠道绒毛密度和高度。徐晨等(2018)研究发现,生物絮团养殖模式下添加益生菌可显著提高异育银鲫(Carassius auratus gibelio)肠道肌层厚度和黏膜下层厚度。本研究发现,与对照组相比,饲料中YB1添加量为106 CFU/g时,大菱鲆幼鱼肠道黏膜皱襞高度、肌层厚度和肠道褶皱数量分别提高了48.85%、48.47%和68.91%。宿主肠道组织结构的改善可能与微生物分泌的一些次生代谢产物或生物活性物质有关,如枯草芽孢杆菌代谢产生的表面活性素可影响肠道细胞膜结构;丁酸梭菌(Clostridium butyricum)分泌的丁酸可促进肠道细胞的增殖,凝结芽孢杆菌代谢产生的乳酸对生物肠道的蠕动和肠黏膜细胞的增殖具有促进作用(樊英等, 2019)。本研究中,YB1对大菱鲆幼鱼肠道组织结构的改善作用,可能与其分泌的一些活性物质对肠道黏膜细胞的促进作用有关,但具体的作用机制仍需进一步研究。
CHENG Y, HUANG K, HUANG X Y, et al. Effects of dietary Bacillus subtilis on growth performance, immunity and anti-oxidation function of juvenile genetic improvement of farmed tilapia (GIFT, Oreochromis niloticus). Chinese Journal of Animal Nutrition, 2014, 26(6): 1503-1512 [饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响. 动物营养学报, 2014, 26(6): 1503-1512 DOI:10.3969/j.issn.1006-267x.2014.06.010] |
DONG C G, YANG A G, SUN X J, et al. The health-promoting effects of Bacillus subtilis in the culture of sea cucumber. Progress in Fishery Sciences, 2015, 36(3): 109-115 [枯草芽孢杆菌(Bacillus subtilis)在刺参养殖中的益生作用. 渔业科学进展, 2015, 36(3): 109-115] |
FAN R F, WANG Y G, LIANG Y, et al. Screening and identification of a eurythermal probiotic bacterium in the intestine of cultured Scophthalmus maximus. Progress in Fishery Sciences, 2011, 32(1): 40-46 [一株广温性大菱鲆肠道益生菌的筛选与鉴定. 渔业科学进展, 2011, 32(1): 40-46 DOI:10.3969/j.issn.1000-7075.2011.01.006] |
FAN Y, WANG X L, YU X Q, et al. Effect of Bacillus Licheniformis on growth, intestinal digestive enzymes, serum non-special immune and resistance against Aeromonas salraonicida in fat greenling, Hexagrammos otakii. Progress in Fishery Sciences, 2021, 42(1): 63-73 [地衣芽孢杆菌对大泷六线鱼生长、肠道消化酶、血清非特异性免疫及抗病力的影响. 渔业科学进展, 2021, 42(1): 63-73] |
FAN Y, YE H B, WANG X L, et al. Effects of Clostridium butyricum and Bacillus coagulans on growth performance, hepatic function and intestinal microbiota in rainbow trout Oncorhynchus mykiss. Journal of Dalian Ocean University, 2019, 34(2): 198-203 [丁酸梭菌和凝结芽孢杆菌对虹鳟生长性能、肝功能及肠道菌群的影响. 大连海洋大学学报, 2019, 34(2): 198-203] |
FU B R, LIU M Q, ZHANG R J, et al. Effects of Brevibacillus brevis on aquiculture water quality and carps growth characteristics. Ecological Science, 2018, 37(5): 146-151 [短短芽孢杆菌(Brevibacillus brevis)对鲤鱼养殖水质及其生长特性的影响. 生态科学, 2018, 37(5): 146-151] |
GATESOUPE F J. The use of probiotics in aquaculture. Aquaculture, 1999, 180(1/2): 147-165 |
HU F G, GUO P P, MA D P, et al. Study on the impact of Bacillus subtilis on growth and water quality of Scophthalmus maximus (Linnaeus). Fishery Modernization, 2014, 41(2): 7-11 [饲料中添加枯草芽孢杆菌对促进大菱鲆生长及养殖水环境的影响. 渔业现代化, 2014, 41(2): 7-11 DOI:10.3969/j.issn.1007-9580.2014.02.002] |
HUANG K P, YANG H L, SUN Y Z, et al. Application of autochthonous probiotic Bacillus in grouper Epinephelus coioides juvenile nursery. Fisheries Science, 2012, 31(2): 63-67 [鱼源芽孢杆菌在石斑鱼稚鱼育苗中的应用研究. 水产科学, 2012, 31(2): 63-67 DOI:10.3969/j.issn.1003-1111.2012.02.001] |
HUANG L, LI X M, SHU H, et al. The effects of two kinds of microecologics on body composition, intestinal digestive enzyme and histological structure of hybrid grouper (Epinephelus fuscoguttatus ♀×E. lanceolatus ♂). Feed Industry, 2018, 39(12): 24-31 [两种微生态制剂对虎龙斑体成分、肠道消化酶及组织学结构的影响. 饲料工业, 2018, 39(12): 24-31] |
KONG X H, WANG G L, LI S J. Changes of antioxidant defenses, ATPase activity and cell membrane fatty acid composition in gill of Scylla serrata under low temperature acclimation. Acta Hydrobiologica Sinica, 2007, 31(1): 59-66 [低温驯化锯缘青蟹鳃抗氧化防护、ATPase及膜脂肪酸组成变化. 水生生物学报, 2007, 31(1): 59-66 DOI:10.3321/j.issn:1000-3207.2007.01.009] |
LAI H E. Effects of glycinin on growth, digestive enzyme activities and intestinal tissue of larval and juvenile common carp, Cyprinus carpio. Master´s Thesis of Jilin Agricultural University, 2013 [赖红娥. Glycinin对鲤稚鱼和幼鱼生长、消化酶活力及肠道组织的影响. 吉林农业大学硕士研究生学位论文, 2013]
|
LAKSHMI B, VISWANATH B, SAI GOPAL D V R. Probiotics as antiviral agents in shrimp aquaculture. Journal of Pathogens, 2013, 2013: 424123 |
LEI J L. A new marine culture species Scophthalmus maximus. China Fisheries, 2000(4): 38-39 [海水养殖新品种介绍—大菱鲆. 中国水产, 2000(4): 38-39 DOI:10.3969/j.issn.1002-6681.2000.04.027] |
LI Y F, QI X, HUA Y, et al. Effect of Bacillus subtilis on growth, digestive enzyme activity and antioxidant function in juvenile of black sea bream (Acanthopagrus schlegelii). Journal of Yangzhou University (Agricultural and Life Science Edition), 2014, 35(1): 37-42 [枯草芽孢杆菌对黑鲷幼鱼生长、消化酶活性以及抗氧化功能的影响. 扬州大学学报(农业与生命科学版), 2014, 35(1): 37-42] |
LI Y Q, MA X G, FAN S F, et al. Effects of dietary melamine on enzyme activity in liver of Nile tilapia. Fisheries Science, 2015, 34(2): 77-82 [饲料中添加三聚氰胺对吉富罗非鱼肝脏酶活性的影响. 水产科学, 2015, 34(2): 77-82] |
LU J J, GUO R, QI G S, et al. Effects of Chinese herbal medicine compounds on growth and non-specific immunity of turbot Scophthalmus maximus. Journal of Dalian Ocean University, 2018, 33(6): 722-728 [复方中草药对大菱鲆幼鱼生长性能及非特异性免疫指标的影响. 大连海洋大学学报, 2018, 33(6): 722-728] |
MADANI N S H, ADORIAN T J, FARSANI H G, et al. The effects of dietary probiotic bacilli (Bacillus subtilis and Bacillus licheniformis) on growth performance, feed efficiency, body composition and immune parameters of whiteleg shrimp (Litopenaeus vannamei) postlarvae. Aquaculture Research, 2018, 49(5): 1926-1933 DOI:10.1111/are.13648 |
PANDIYAN P, BALARAMAN D, THIRUNAVUKKARASU R, et al. Probiotics in aquaculture. Drug Invention Today, 2013, 5(1): 55-59 DOI:10.1016/j.dit.2013.03.003 |
PANIGRAHI A, KIRON V, KOBAYASHI T, et al. Immune responses in rainbow trout Oncorhynchus mykiss induced by a potential probiotic bacteria Lactobacillus rhamnosus JCM 1136. Veterinary Immunology and Immunopathology, 2004, 102(4): 379-388 DOI:10.1016/j.vetimm.2004.08.006 |
QIN C B, ZHU H Y, MEI X Q, et al. Effects of dietary Bacillus amyloliquefaciens on growth performance and hepatic function in juvenile black seabream (Sparus macrocephalus). Journal of Agricultural Science and Technology, 2017, 19(12): 110-118 [解淀粉芽孢杆菌对黑鲷幼鱼生长和肝脏功能的影响. 中国农业科技导报, 2017, 19(12): 110-118] |
SAKAI M. Current research status of fish immunostimulants. Aquaculture, 1999, 172(1/2): 63-92 |
SUN N, WANG T T, HAN H Z, et al. Isolation, identification and characteristics of two Bacillus associated from intestine of marine fishes. Marine Fisheries, 2019, 41(5): 606-615 [两株海水鱼肠道芽孢杆菌的分离鉴定及特性分析. 海洋渔业, 2019, 41(5): 606-615] |
SUN Y Z, YANG H L, MA R L, et al. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune responses of grouper Epinephelus coioides. Fish and Shellfish Immunology, 2010, 29(5): 803-809 DOI:10.1016/j.fsi.2010.07.018 |
WANG C Q, WANG J Y, HUANG B S, et al. Study on Bacillus subtilis from hybrid grouper (Epinephelus fuscoguttatus♀× Epinephelus lanceolatus♂) intestine and its zymogenicities. Jouranl of Fisheries Research, 2019, 41(5): 366-373 [珍珠龙胆石斑鱼肠道枯草芽孢杆菌的分离鉴定及产酶能力分析. 渔业研究, 2019, 41(5): 366-373] |
WANG L, TIAN X L, DONG S L, et al. Effects of two Bacillus on growth performance and serum non-specific immunity of Litopenaeus vannamei. Periodical of Ocean University of China, 2017, 47(4): 14-21 [两株芽孢杆菌对凡纳滨对虾生长和血清非特异性免疫指标的影响研究. 中国海洋大学学报(自然科学版), 2017, 47(4): 14-21] |
WANG T T. Identification, characterization and application of a lactic acid bacteria isolated from intestine of Sebastes schlegelii. Master´s Thesis of Shanghai Ocean University, 2017 [王腾腾. 一株许氏平鲉肠道乳酸菌的分离鉴定、特性分析及其应用研究. 上海海洋大学硕士研究生学位论文, 2017]
|
XU C, LI Y, SUN Q R, et al. Effects of probiotic addition on the growth performance, digestive enzyme activity, and intestinal morphology of gibel carp (Carassius auratus gibelio) cultured using biofloc technology. Journal of Fishery Sciences of China, 2018, 25(5): 1004-1011 [生物絮团养殖模式下益生菌添加对异育银鲫生长、消化酶活性及肠道组织结构的影响. 中国水产科学, 2018, 25(5): 1004-1011] |
XUE J J. The effects of dietary probiotics on growth, nutritional metabolism and body immunity of the grass carp (Ctenopharyngodon idellus). Master's Thesis of Nanchang University, 2018 [薛俊敬. 益生菌对草鱼生长、营养代谢和机体免疫的影响. 南昌大学硕士研究生学位论文, 2018]
|
YAO Q H, WANG B Z, GUO Q X, et al. Effects of Bacillus subtilis on growth performance, body composition and digestive enzymes activity of Philippine eel black fry, Anguill marmorata. Journal of Chinese Institute of Food Science and Technology, 2016, 16(12): 177-184 [枯草芽孢杆菌对黑仔期菲律宾鳗鲡生长、体成分和消化酶活性的影响. 中国食品学报, 2016, 16(12): 177-184] |
YUAN F H, Lin H Z, LI Z J, et al. Effects of Bacillus coagulans on growth performance, digestive enzymes and nonspecific immune enzymes of sea bass (Lates calcarifer). Journal of Shanghai Ocean University, 2010, 19(6): 792-797 [凝结芽孢杆菌对尖吻鲈的生长、消化酶及非特异性免疫酶的影响. 上海海洋大学学报, 2010, 19(6): 792-797] |
YUAN W. Bacillus screening and the effects on the growth, immunity and stress resistance of white shrimp, Litopenaeus vannamei. Master´s Thesis of Hainan University, 2016 [袁卫. 芽孢杆菌筛选及其对凡纳滨对虾生长、免疫力和抗逆性的影响研究. 海南大学硕士研究生学位论文, 2016]
|
ZHANG K S, TIAN H L. Research and function of catalase in organism. Food Science and Technology, 2007, 32(1): 8-11 [过氧化氢酶的功能及研究. 食品科技, 2007, 32(1): 8-11] |



