2. 山东省水生生物资源养护管理中心 山东 烟台 264005
2. Shandong Aquatic Biological Resources Conservation, Yantai, Shandong 264005, China
口虾蛄(Oratosquilla oratoria),俗称皮皮虾,螳螂虾等,常居于海底泥沙砾的U形洞穴中(王春琳等, 1996),在我国沿海各地均有分布(徐海龙等, 2010),为我国沿海重要的经济虾蟹类(刘海映等, 2013)。近年来,口虾蛄已成为山东海阳近岸流刺网渔业的主要渔获物(李春芝等, 2019),经济价值的提高导致对其捕捞强度不断增强(刘修泽等, 2014),其种群面临前所未有的生存压力。为保护海阳近岸口虾蛄资源,迫切需要了解其群体现状及生活史特征。
20世纪80年代,日本的口虾蛄渔业因过度捕捞造成产量急剧下降(Ohtomi et al, 2005),资源的剧烈波动引起政府和学者的关注。生物学家通过生态控制实验和野外调查,对分布于日本周边几个海湾内的口虾蛄的生长、繁殖和种群动态等进行研究发现,虽然生活于不同海域的口虾蛄具有相似的生活史过程,但在生长规律(Hamano et al, 1987; Kodama et al, 2010)、繁殖策略(Kodama et al, 2006、2003; Ohtomi et al, 1988)、生命周期和摄食组成(Hamano et al, 1992)等方面存在差异。国内学者对口虾蛄的研究主要集中在渔业生物学(邓景耀等, 1992; 盛福利, 2009)、繁殖与摄食(刘海映等, 2013; 王春琳等, 2002; 徐善良等, 1996; 薛梅等, 2016)、形态性状(张新明等, 2020)及资源分布(刘修泽等, 2014; 李春芝等, 2019)等方面。李明坤等(2019)分析了山东南部近海口虾蛄的空间分布特征及季节变化,孙东昱等(2021)研究了海阳与烟台近岸口虾蛄的形态比较,但还未见关于海阳近岸口虾蛄群体状况的研究报道。本研究通过对海阳近岸口虾蛄的月度跟踪调查,分析海阳近岸口虾蛄的群体结构组成、生长与繁殖等渔业生物学特征,掌握其群体动态变化规律,旨在为山东南部海域口虾蛄资源的科学管理和合理的开发利用提供依据。
20世纪80年代,日本的口虾蛄渔业因过度捕捞造成产量急剧下降(Ohtomi et al, 2005),资源的剧烈波动引起政府和学者的关注。生物学家通过生态控制实验和野外调查,对分布于日本周边几个海湾内的口虾蛄的生长、繁殖和种群动态等进行研究发现,虽然生活于不同海域的口虾蛄具有相似的生活史过程,但在生长规律(Hamano et al, 1987; Kodama et al, 2010)、繁殖策略(Kodama et al, 2006、2003; Ohtomi et al, 1988)、生命周期和摄食组成(Hamano et al, 1992)等方面存在差异。国内学者对口虾蛄的研究主要集中在渔业生物学(邓景耀等, 1992; 盛福利, 2009)、繁殖与摄食(刘海映等, 2013; 王春琳等, 2002; 徐善良等, 1996; 薛梅等, 2016)、形态性状(张新明等, 2020)及资源分布(刘修泽等, 2014; 李春芝等, 2019)等方面。李明坤等(2019)分析了山东南部近海口虾蛄的空间分布特征及季节变化,孙东昱等(2021)研究了海阳与烟台近岸口虾蛄的形态比较,但还未见关于海阳近岸口虾蛄群体状况的研究报道。本研究通过对海阳近岸口虾蛄的月度跟踪调查,分析海阳近岸口虾蛄的群体结构组成、生长与繁殖等渔业生物学特征,掌握其群体动态变化规律,旨在为山东南部海域口虾蛄资源的科学管理和合理的开发利用提供依据。
1 材料与方法 1.1 调查方法和样品采集本研究所用口虾蛄样品为2018年3月—2019年9月在山东半岛南部海阳近海的流刺网渔获(2018年6—8月及2019年2月、5—8月除外),每月随机取5 kg样品,共计1538尾。生物学测量1514尾,其中,雌性744尾,雄性770尾(表 1)。流刺网网具为口虾蛄漂流三重刺网,上纲长度为27.00 m,侧纲为3.50 m,网目为60.00 mm。
|
|
表 1 海阳近岸流刺网口虾蛄各月样品采集数量 Tab.1 Sample quantity of O. oratoria collected from Haiyang offshore gillnet in each month |
口虾蛄样品根据有无交接肢区分雌、雄(徐善良等, 1996),利用游标卡尺测量其体长(L),精度为0.01 mm;利用分析天平测量其体质量(W),精度为0.01 g。
1.2.2 性比及性腺发育对口虾蛄进行性别鉴定,解剖雌性个体,口虾蛄卵巢发育阶段划分参考王春琳等(1996)的方法,大致可分为5期:
Ⅰ期(未发育期):卵巢呈细线状分布,无色素分布,紧贴在消化道上,宽度为1~2 mm。
Ⅱ期(发育期):卵巢开始发育,向两侧扩大,呈薄带状,半透明,浅黄色,开始有少量色素分布。
Ⅱ'期(恢复期)为排卵后不久的个体拥有:卵巢灰黄色,有较多色素沉积,大小与Ⅱ期卵巢一致。
Ⅲ期(成熟前期):卵巢迅速生长,纵向已发展到尾节。轻压卵巢有弹性,解剖镜下能见到清晰的卵粒,不能分离。
Ⅳ期(成熟期):卵巢已进入成熟期,几乎充满整个腹腔背部。卵巢呈橙黄色,卵粒已能分离,为不规则圆形。为即将产卵的个体拥有。
Ⅴ期(产卵期):卵极度膨大,通过甲壳隐约能见到橙黄色卵巢,解剖卵巢,卵子能自动散开。
卵子产出后,抱卵于胸部附肢上,同时,排空的卵巢开始萎缩吸收,逐渐进入Ⅱ'期(恢复期),待下次繁殖季节再次发育。
1.2.3 摄食强度参考徐善良等(1996)划分的口虾蛄摄食强度等级观察胃囊的充实程度,分为4级:0级为空胃,1级为胃中食物含量较少,2级为胃含物较多但不饱满,3级为胃含物很多、饱满且胃壁膨胀。
1.2.4 体长–体质量关系对体长–体质量关系运用幂函数回归方法进行分析。体长和体质量呈幂函数增长关系,其关系式为:
| $ W = {\rm{a}}{L^{\rm{b}}} $ | (1) |
式中,W为体质量(g),L为体长(mm),a、b为系数。
1.2.5 体长相对生长速率本研究参考甲壳动物群体中区分不同世代的体长频率分布法(Peterson, 1892),以每月流刺网渔获样本中优势体长组的中值为参考点,选取体长组中值±5 mm的口虾蛄样本,作为体长相对增长率样本的计算对象,计算月间体长相对增长速率,计算公式(Chang et al, 2012)如下:
| $ {C_e} = \frac{{\lg {L_2} - \lg {L_1}}}{{0.434\;3({t_2} - {t_1})}} $ | (2) |
式中,0.434 3为自然对数转换为以10为底数一般对数的系数;L1和L2为计算生长速率的前一月和当月的口虾蛄体长;t1和t2为以生长开始起,即需要计算生长比速的前一月和当月。
1.2.6 统计检验使用t检验分析比较雌、雄月度平均体长及体质量间的差异,使用K-S检验分析比较雌、雄月度优势体长组及优势体质量组的分布差异。对口虾蛄雌、雄比例,以1∶1为期望值进行卡方检验(x2=0.50,df=2)。
2 结果 2.1 体长组成2018年3月—2019年9月,流刺网口虾蛄样品体长范围为62.00~180.40 mm。雌性平均体长为(122.01±13.90) mm,2018年3月平均体长最大,为(131.49±8.68) mm;9月平均体长最小,为(106.49± 8.62) mm。雄性平均体长为(129.27±13.99) mm,2019年1月平均体长最大,为(139.38±8.02) mm。2018年9月平均体长最小,为(117.04±9.93) mm。除2019年4月外,其余月份雄性平均体长均大于雌性(图 2)。t检验结果显示,2018年4、12月雌、雄样品平均体长差异不显著(P > 0.05),其余月份均存在显著差异(P < 0.05)。
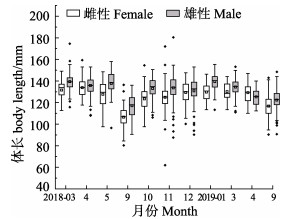
|
图 2 海阳近岸口虾蛄雌性与雄性体长月间分布箱线图 Fig.2 Boxplot of body length of female and male O. oratoria in the inshore waters of Haiyang |
雌性口虾蛄全年优势体长为100~140 mm,占总尾数的84.96%。优势体长组月间变化明显,其中,2018年3、12月及2019年1、4月优势体长组为120~140 mm;2018年4、5月及2019年3月优势体长组为120~150 mm;2018年9月、2019年9月优势体长组分别为100~120 mm及100~130 mm;2018年10月与11月优势体长组为110~140 mm(图 1)。
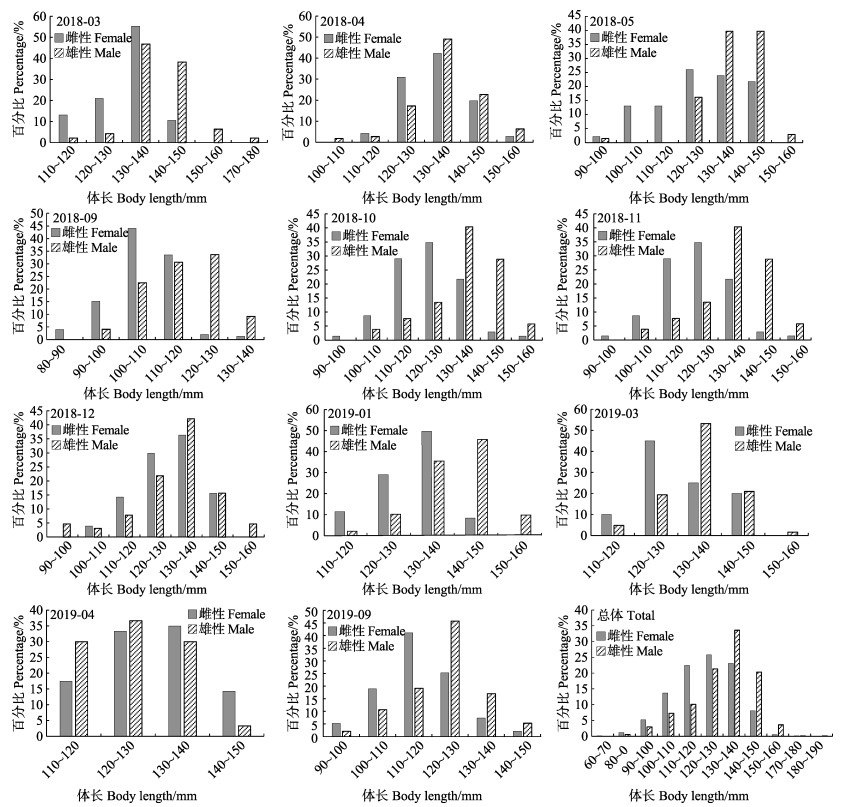
|
图 1 海阳近岸口虾蛄体长分布的月间变化 Fig.1 Monthly variation in body length distribution of O. oratoria in the inshore waters of Haiyang |
雄性口虾蛄的全年优势体长为110~150 mm,占总尾数的88.99%。优势体长组的月间变化较明显,其中,2018年4、5、10、11月及2019年3月的优势体长组为120~150 mm;2018年3月及2019年1月的优势体长组为130~150 mm;2018年9月的优势体长组为100~130 mm,12月的优势体长为120~140 mm;2019年9月及4月的优势体长组均为110~140 mm (图 1)。K-S检验表明,除2018年12月外,其余月份雌、雄样品体长分布均存在显著性差异(P < 0.05)。
2.2 体质量组成2018年3月—2019年9月口虾蛄流刺网全年体质量范围为8.30~64.20 g,雌性全年平均体质量为(25.79± 8.87) g,2018年3月平均体质量最大,为(35.96±6.76) g;2018年9月平均体质量最小,为(16.44±3.65) g。雄性全年平均体质量为(32.49±10.46) g;2018年1月平均体质量最大,为(41.13±7.14) g,2018年9月平均体质量最小,为(22.99±5.79) g。各月雌性平均体质量均小于雄性(图 3)。t检验结果表明,除2019年4月雌、雄样品平均体质量差异不显著(P > 0.05)外,其余月份均存在显著性差异(P < 0.05)。
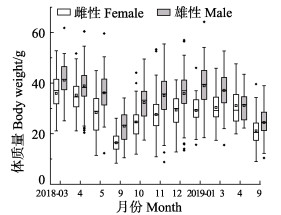
|
图 3 海阳近岸雌性与雄性口虾蛄体质量月间分布箱线图 Fig.3 Boxplot of body weight of female and male O. oratoria in the inshore waters of Haiyang |
雌性口虾蛄全年优势体质量为10~40 g,占总尾数的91.38%。优势体质量组月间变化明显,其中,2018年3月优势体质量组为20~50 g;2018年4、5月优势体质量组分别为30~40 g、20~40 g;2018年9月及次年9月优势体质量均为10~20 g;10月的优势体质量组为10~40 g;2018年11月—次年4月的优势体质量组均为20~40 g。雄性口虾蛄全年优势体质量为20~50 g,占总尾数的82.97%。优势体质量组月间变化较明显,其中,2018年3月及4月的优势体质量组为30~50 g;2018年5月及11月的优势体质量组为20~50 g;2018年9月的优势体质量组分别为10~30 g,10月及次年4月优势体质量均为20~40 g;12月—次年3月优势体质量组均为30~50 g;2019年9月优势体质量组为20~30 g。K-S检验表明,除2019年4月外,其余月份雌、雄样品体质量分布均存在显著性差异(P < 0.05)。
2.3 性比及性腺发育本研究共测量1514尾流刺网口虾蛄样品,其中,雌性个体744尾,雄性个体770尾,雌、雄比为1∶1.03。卡方检验表明,雌、雄个体比例符合1∶1 (P=0.094 > 0.05)。口虾蛄各月份性比变化幅度明显,2018年9、10、12月及2019年4、9月性比均 > 1,其余月份均 < 1;其中,2019年4月的性比最大,为2.1∶1;3月性比最小,为0.32∶1(图 4)。口虾蛄性比月间变化显著(P < 0.05),2018年9月及次年1、3、4月性比不符合1∶1,其他月份均符合1∶1(P > 0.05)。
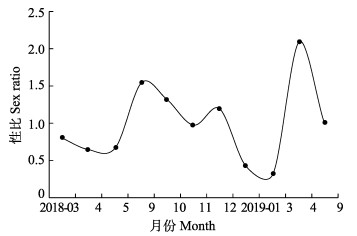
|
图 4 海阳近岸口虾蛄性比月变化 Fig.4 Monthly variation of sex ratio of O. oratoria in the inshore waters of Haiyang |
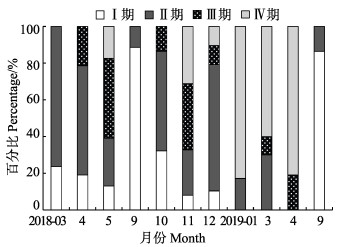
雌性口虾蛄全年样品生殖腺成熟度在Ⅰ~Ⅳ期,因为Ⅴ期个体处于排卵期,居于穴中进行产卵活动,流刺网很难捕捉,故未发现Ⅴ期个体。全年中,Ⅲ期和Ⅳ期个体主要出现在2个时间段,分别为4—5月和10月—次年1月(图 5)。
|
图 5 海阳近岸雌性口虾蛄性腺发育程度月变化 Fig.5 Monthly variation of gonadal development of O. oratoria in the inshore waters of Haiyang |
第1个时间段从4月开始,雌性口虾蛄开始出现Ⅲ期的个体,占雌性总体的比例为21.43%,5月Ⅲ期占雌性总体的比例增加到43.48%,且出现17.39%的Ⅳ期个体,9月初未发现Ⅲ期和Ⅳ期个体,Ⅰ期个体占比高达86.67%。
第2个时间段从10月开始,同时出现Ⅲ期和Ⅳ期个体,分别占雌性总比例的47.89%和16.90%,11月Ⅲ期个体减少到36.00%,Ⅳ期个体增加至31.20%,12月Ⅲ期与Ⅳ期个体均减小至10.39%,到次年1月Ⅲ期的个体全部消失,Ⅳ期个体达到最高值82.86%。次年3月与4月均出现Ⅲ期与Ⅳ期个体,其中,3月Ⅳ期个体占60.00%,4月Ⅳ期个体占比高达80.95%。
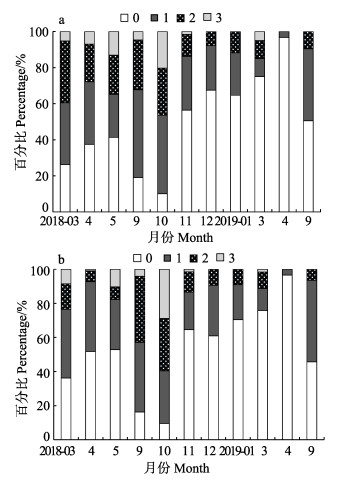
2.4 摄食强度口虾蛄的摄食强度在全年的波动较明显。雌性口虾蛄3—5月摄食强度逐渐减小,其中,摄食强度达1级的个体所占比例由34.21%降低至23.91%,2级所占比例由34.21%降低至21.74%,3级由5.26%增至13.04%,整体摄食强度减至58.70%。9—10月摄食强度达3级个体数量由4.61%增加至20.29%,10月空胃率全年最低,为10.14%;11月—次年4月摄食强度呈先上升后下降的趋势,空胃率均大于50%,且未发现摄食强度达3级的个体,4月空胃率达到全年最高(96.83%),且仅存在摄食强度为1级的个体。9月空胃率明显下降,为50.53%(图 6)。
|
图 6 海阳近岸雌性(a)与雄性(b)口虾蛄摄食强度的月变化 Fig.6 Monthly variation of feeding intensity of female (a) and male (b) O. oratoria in the inshore waters of Haiyang 0:空胃;1:胃含物较少;2:胃含物较多但不饱满;3:胃含物饱满 0: Empty stomach; 1: Less stomach contents; 2: More stomach contents but not full; 3: Full stomach contents |
雄性口虾蛄与雌性个体摄食强度变化较为一致。雄性个体在3—5月摄食强度减小,摄食强度达1级和2级的个体数量分别减小至29.41%和7.35%,摄食强度达3级的个体数量由8.51%增加至10.29%,空胃率增加。9—10月空胃率逐渐下降,摄食强度达3级个体数量在10月占比最高,为28.85%,空胃率最低为9.62%;11月—次年4月,摄食强度呈逐渐下降的趋势,4月最低,仅为3.33%,空胃率高达到96.83%;9月摄食强度明显增加,但未发现达到3级的个体。
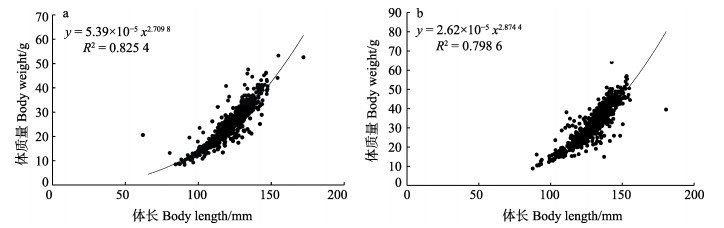
2.5 体长与体质量的关系雌、雄口虾蛄的体长与体质量均符合异速生长特征,其中,雌性口虾蛄回归方程为W=5.39×10–5L2.709 8 (R2=0.825 4, P < 0.05),雄性口虾蛄为W=2.62×10–5L2.874 4 (R2=0.798 6, P < 0.05)(图 7)。
|
图 7 海阳近岸雌性(a)与雄性(b)口虾蛄体长–体质量关系 Fig.7 Relationship between body length and weight of male (a) and female (b) O. oratoria in the coastal waters of Haiyang |
雌性口虾蛄月度体长相对增长速率整体呈先上升后下降的趋势,4—5月由1.29增加至6.24,10月最高,为36.71,后呈下降趋势,次年1月最低,为0.92。雄性口虾蛄月度体长相对增长速率与雌性总体趋势一致,均在10月达到最高值,次年1月相对增长速率较12月有所增加,由3.49增加至10.01(表 2)。
|
|
表 2 海阳近岸雌性与雄性口虾蛄体长相对增长速率 Tab.2 Relative growth rate of body length of male and female of O. oratoria in the coastal waters of Haiyang |
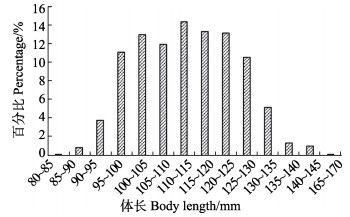
甲壳动物的生长需要通过规律性的蜕皮来实现,在蜕皮时,包含年龄信息的钙化部分会丢失,因此,体长频率法是渔业上广为应用的一种可行的世代区分方法(Chang et al, 2012)。对于甲壳动物来说,在渔具不具备选择性的条件下,长度组分布曲线的高峰一般依次降低(李壮, 2006),每个高峰代表 1个世代,每个高峰的长度则代表着该年龄组的体长范围。黄海的口虾蛄群体每年产卵1次(刘海映等, 2013),因此,体长频率分布图中的每个高峰,即代表 1个年龄组。与一般使用的拖网调查方法不同,本研究采用的是流刺网调查。流刺网虽然具有一定的选择性,但这种选择性只针对于一定体长范围以上的个体。李显森等(2016)在渤海进行的口虾蛄三重刺网、单层刺网和底拖网渔获组成的研究中发现,网目尺寸在50~60 mm的三重刺网和单层刺网捕获的口虾蛄体长范围为78~166 mm,而底拖网捕获的口虾蛄体长范围为64~130 mm。流刺网对于体长较大的口虾蛄个体选择性较强,小个体不易被捕获,尤其是1龄以下的,因为口虾蛄的生物学最小型即初次性成熟体长为80 mm (徐善良等, 1996)。根据前期对口虾蛄拖网面上调查发现,9月拖网捕获的口虾蛄优势体长组为95~110 mm和110~130 mm (图 8),其第2个体长分布高峰与流刺网捕获的口虾蛄体长分布高峰重合。根据口虾蛄的生长曲线(王波等, 1998),可判断优势体长组95~110 mm为当年生的世代,第2个优势体长组110~130 mm为生长1年后的世代。
|
图 8 基于拖网调查的2019年9月海阳近岸海域口虾蛄体长组成 Fig.8 Composition of body length of O. oratoria in Haiyang coastal waters based on trawl survey in September 2019 |
甲壳类应用体长频率法分析时,常因较大年龄组中发育相对较慢的个体与前一年龄组发育较快的个体体长分布出现重叠,带来分析误差(Fournier et al, 1991)。为了尽可能避免由此导致对不同年龄组的错误判断,本研究选取优势体长组中的组中值±5 mm作为体长相对增长率计算样本的选择范围。计算月间体长相对增长速率时,所用的也是该范围内的样本的平均长度数值。
3.2 流刺网渔获中口虾蛄优势体长组的生活史流刺网对口虾蛄群体的捕获具有选择性,其捕获个体的93.1%以上为1龄以上个体(李显森等, 2016),因此,本研究对海阳近岸流刺网所捕获的口虾蛄进行跟踪采样,并根据体长频率分布划分各月优势体长组,分析其生长和摄食情况。
9—10月间,口虾蛄摄食强度逐渐增强,空胃率逐渐下降(图 6),说明这一阶段的口虾蛄处于大量索饵育肥、加速生长阶段。其中,10月雌、雄口虾蛄体长增长最快(表 1)。口虾蛄是甲壳动物,其生长需要通过周期性的蜕皮来实现,在蜕去旧的外骨骼前后,摄入水分,使柔软的新皮膨胀,准确地说,这个过程只是一种膨胀(Lockwood, 1968)。因此,9—10月间体长的快速增长表明口虾蛄很可能正处于阶段性蜕皮的过程中,10月中旬绝大多数口虾蛄样品外骨骼较软、残体较多也证实了这一推测。10月开始,虽然雌性平均摄食强度低于前期,但卵巢逐渐开始发育,Ⅳ期比例由16.90%逐渐增加到次年1月初的82.86%,考虑到流刺网捕获的雌性口虾蛄均为1龄以上个体,表明其在秋季有第2个卵巢发育高峰。薛梅等(2016)对皮口海域口虾蛄的研究也发现,不同年龄口虾蛄群体在性成熟的时期会有所差异,认为口虾蛄的性成熟高峰期在5月和11月。口虾蛄一般寿命为2—3年,经计算,海阳5月和12月2个性成熟高峰期的雌性的优势组平均体长相近,分别为134.93 mm和130.47 mm,因此,判断1龄以上性成熟口虾蛄在春、夏季产卵,未满1龄口虾蛄在11月—次年1月期间达到性成熟,但未出现真正意义上的繁殖群体,卵巢发育积累的能量用于育肥越冬,次年5—7月进入真正产卵期。Kim等(2017)对韩国口虾蛄进行研究时也发现,统营海域口虾蛄主要产卵季节为夏季,但生殖腺指数在冬季开始升高,12月达到最高,并未发现冬季产卵现象。Ohtomi等(1988)同样认为,日本东京湾口虾蛄存在2个性成熟高峰期,但仅有1个繁殖期。
本调查中,1月中旬—3月初,自然海域很难捕获口虾蛄,说明其正处于越冬期。根据郭文场等(2011)的研究,越冬期口虾蛄会在其U型洞穴中段向地底延伸一段洞穴以抵御低温,形成近Y字型的洞穴。徐海龙等(2010)认为,黄海北部海域口虾蛄1月进入越冬期,而青岛近岸口虾蛄12月—次年1月处于越冬期(盛福利等, 2009),浙江北部海域口虾蛄12月进入越冬期(徐善良等, 1996),表明口虾蛄进入越冬期的早晚跟海域平均水温有关。越冬期结束后,口虾蛄分批次进入渔场,开始大量索饵,为繁殖期做准备。生长发育较好的个体率先进入渔场,这也是3—5月捕获的口虾蛄平均体长逐渐降低的原因。海阳近岸雌性口虾蛄3月生殖腺发育以Ⅱ期为主,4月开始出现Ⅲ期个体,5月Ⅲ和Ⅳ期的个体占到总数的43.48%和17.39%,9月Ⅲ期及Ⅳ期个体消失(图 5)。说明3月开始,海阳近岸口虾蛄生殖腺开始发育,5月进入繁殖旺盛期,8月繁殖进入尾声。与此同时,3—5月雌、雄性比逐渐减小,一方面,可能因为繁殖期雌性个体在洞穴中的产卵和护卵;另一方面,产卵后高龄雌性个体大量死亡(王春琳等, 2002)导致雌性个体减少,被网具捕获的几率较低。本研究中,2019年4月口虾蛄性比高达2.1,推测是由于产卵前期雌性口虾蛄大量聚集索饵,导致雌性数量明显多于雄性。渤海海域口虾蛄繁殖前期同样出现雌性个体较多的现象,产卵后性比明显减小(邓景耀等, 1988)。盛福利等(2009)对青岛近岸口虾蛄调查发现,5月下旬是口虾蛄繁殖盛期,与本研究结果较为一致。辽东湾海域口虾蛄产卵期为6—7月(刘修泽等, 2014),稍晚于本研究结果。推测是由于不同海域水温及其他环境因素的差异导致口虾蛄生殖腺发育起始时间和繁殖期持续时间不同,从而影响到生命周期(Ohtomi et al, 1988)。
因此,本研究推断8—12月是海阳近岸口虾蛄的生长期,其间10月经历一次蜕皮,前一年出生的雌性生殖腺开始发育;1—2月为越冬期,3—5月生殖腺再度开始生长发育,5—7月间繁殖。这与王春琳等(1996)对浙江沿岸海域口虾蛄生活周期的研究基本一致,但产卵阶段早于6月中旬。
3.3 流刺网捕捞对海阳近岸口虾蛄资源利用的分析邓景耀等(1992)对渤海海域口虾蛄进行年龄组划分,认为30~70 mm为当年生个体,70~110 mm为1龄组,90~150 mm为2龄组,150~175 mm为3龄组。根据本研究优势体长分布(图 1),流刺网所捕获的口虾蛄大多为1龄以上及2龄个体。口虾蛄1年可达性成熟(王波等, 1998),第1次性成熟的生物学最小型为80 mm (徐善良等, 1996),以此为节点划分,本研究中流刺网口虾蛄99.88%已达性成熟,且完成了1次产卵。因此,本研究认为,流刺网捕捞对海阳近岸口虾蛄初生世代资源具有较强的保护作用,对于整个自然群体的补充及延续是有利的。郭瑞等(2016)认为,60 mm三重刺网对辽东湾口虾蛄具有较强的选择性,所捕获的口虾蛄均大于最小可捕体长110 mm。而李显森等(2016)在对渤海口虾蛄三重刺网渔获组成的研究中,对比了流刺网和拖网渔获口虾蛄的群体组成,其中,流刺网捕捞体长组为78~166 mm,拖网体长组成为64~130 mm;优势体长组分别为120~130 mm和80~90 mm。由此推测,流刺网比拖网对口虾蛄自然群体的延续更有利。
海阳的近岸口虾蛄渔业有2个捕捞汛期——春汛和秋汛,春季捕捞以流刺网为主,秋季则以流刺网和拖网为主,这种捕捞方式对海阳当地的口虾蛄渔业起到了较好的保护作用。根据2014—2016年的调查,海阳各类流刺网渔船的渔获物中,口虾蛄占比20.86%,为优势种(李春芝等, 2019)。以《渤海生物资源养护规定》的可捕标准为划分幼体的标准,2019年4月及9月对海阳近岸口虾蛄资源的拖网调查中,4月幼体比例为26.32%,9月幼体比例为50.00%。渤海海域拖网口虾蛄渔获群体中幼体比例高达83.3%,而流刺网口虾蛄渔获中幼体比例仅为5.9%~9.0%(李显森等, 2016)。与渤海海域相比,海阳近岸拖网口虾蛄渔获的群体结构中,幼体比例明显偏低,推测其群体结构更有利于自然群体的延续。
由此可见,流刺网较拖网能更好地保护海阳近岸口虾蛄幼体,有利于其群体延续及渔业资源的持续发展。因此,本研究认为,应提倡流刺网捕捞代替拖网捕捞,尽量降低拖网捕捞对口虾蛄资源造成的不利影响,减轻口虾蛄自然群体的生存压力,实现海阳近岸口虾蛄渔业资源的可持续利用。
CHANG Y J, SUN C L, CHEN Y, et al. Modelling the growth of crustacean species. Reviews in Fish Biology and Fisheries, 2012, 22: 157-187 DOI:10.1007/s11160-011-9228-4 |
DENG J Y, CHENG J S. Biological study on mantis shrimps fishery in Bohai Bay. Qingdao: Qingdao Ocean University Press, 1992: 36-44 [邓景耀, 程济生. 渤海口虾蛄渔业生物学研究. 青岛: 青岛海洋大学出版社, 1992: 36-44]
|
DENG J Y, ZHU J S, CHENG J S, et al. The main invertebrates and their fishery biology in Bohai Sea. Marine Fisheries Research, 1988, 9: 91-120 [邓景耀, 朱金声, 程济生, 等. 渤海主要无脊椎动物及其渔业生物学. 海洋水产研究, 1988, 9: 91-120] |
FOURNIER D A, SIBERT J R, TERCEIRO M. Analysis of length frequency samples with relative abundance data for the Gulf of Maine northern shrimp (Pandalus borealis) by the MULTIFAN method. Canadian Journal of Fisheries and Aquatic Sciences, 1991, 48: 591-598 DOI:10.1139/f91-075 |
GUO R, LI X S, ZHAO X Y, et al. The selectivity of driftgill-net for mantis shrimp Oratosquilla oratoria in Liaodong Bay. Fisheries Science, 2016, 35(4): 352-358 [郭瑞, 李显森, 赵宪勇, 等. 辽东湾口虾蛄流刺网的渔获选择性研究. 水产科学, 2016, 35(4): 352-358] |
GUO W C, LIU J H. Cultivation and comprehensive utilization of Oratosquilla oratoria in coastal China. Special Economic Animal and Plant, 2011, 14(11): 13-16 [郭文场, 刘佳贺. 中国沿海虾蛄的养殖与综合利用. 特种经济动植物, 2011, 14(11): 13-16 DOI:10.3969/j.issn.1001-4713.2011.11.005] |
HAMANO T, MATSUURA S. Egg size, duration of incubation, and larval development of the Japanese mantis shrimp in the laboratory. Nippon Suisan Gakkaishi, 1987, 53: 23-29 DOI:10.2331/suisan.53.23 |
HAMANO T, MORRISSY N M. Growth of Oratosquilla oratoria (De Haan, 1844) (Stomatopoda) in the Sea of Suo-Nada, Japan. Crustaceana, 1992, 63(3): 263-276 DOI:10.1163/156854092X00415 |
KIM S E, KIM H J, BAE H J, et al. Growth and reproduction of the Japanese mantis shrimp, Oratosquilla oratoria (De Haan 1844) in the coastal area of Tongyeong, Korea. Ocean Science Journal, 2017, 52(2): 257-265 DOI:10.1007/s12601-017-0027-2 |
KODAMA K, KUME G, SHIRAISHI H, et al. Relationship between body length, processed-meat length and seasonal change in net processed-meat yield of Japanese mantis shrimp Oratosquilla oratoria in Tokyo Bay. Fisheries Science, 2010, 72(4): 804-810 |
KODAMA K, SHIMIZU T, YAMAKAWA T, et al. Changes in reproductive patterns in relation to decline in stock abundance of the Japanese mantis shrimp Oratosquilla oratoria in Tokyo Bay. Fisheries Science, 2006, 72(3): 568-577 DOI:10.1111/j.1444-2906.2006.01185.x |
KODAMA K, YAMAKAWA T, AOKI I, et al. Multi-spawning under rearing condition, and reduction in size at maturity of the Japanese mantis shrimp Oratosquilla oratoria in Tokyo Bay. Bulletin of the Kanagawa Prefectural Fisheries Research Institute, 2003, 8: 77-79 |
LI C Z, WANG L, QIU S Y, et al. Analysis of catch status of gill net vessels in Haiyang based on fishing log. Marine fisheries, 2019, 41(3): 304-311 [李春芝, 王蕾, 邱盛尧, 等. 基于渔捞日志的海阳市流刺网船渔获状况分析. 海洋渔业, 2019, 41(3): 304-311 DOI:10.3969/j.issn.1004-2490.2019.03.005] |
LI M K, XU B D, XUE Y, et al. Spatial distribution characteristics and seasonal variation of Oratosquilla oratoria in the southern coastal waters of Shandong Province. Journal of Fisheries of China, 2019, 43(8): 1749-1758 [李明坤, 徐宾铎, 薛莹, 等. 山东南部近海口虾蛄空间分布特征及其季节变化. 水产学报, 2019, 43(8): 1749-1758] |
LI X S, WU Y F, YOU Z B, et al. Analysis on the catch composition by trammel net and its fishing performance for Oratosquilla oratoria in the Bohai Sea. Marine Fisheries, 2016, 38(5): 516-524 [李显森, 吴亚飞, 尤宗博, 等. 渤海口虾蛄三重刺网渔获组成及其捕捞性能分析. 海洋渔业, 2016, 38(5): 516-524 DOI:10.3969/j.issn.1004-2490.2016.05.008] |
LI Z. The study on the performances of length-frequency analysis methods on the simulated and real fishery data sets. Masterxs Thesis of Ocean University of China, 2006 [李壮. 渔业体长频数分析法在模拟和实际渔业中的应用. 中国海洋大学硕士研究生学位论文, 2006]
|
LIU H Y, GU D X, JIANG Y S, et al. Annual reproductive cycle and germ cell development in mantis shrimp Oratosquilla oratoria. Journal of Dalian Ocean University, 2013, 28(3): 269-272 [刘海映, 谷德贤, 姜玉声, 等. 口虾蛄繁殖周期及生殖细胞发育的研究. 大连海洋大学学报, 2013, 28(3): 269-272 DOI:10.3969/j.issn.2095-1388.2013.03.010] |
LIU X Z, GUO D, WANG A Y, et al. The resource characteristics and their variation of Oratosquilla oratoria in Liaodong Bay. Acta Hydrobiologica Sinica, 2014, 38(3): 602-608 [刘修泽, 郭栋, 王爱勇, 等. 辽东湾海域口虾蛄的资源特征及变化. 水生生物学报, 2014, 38(3): 602-608] |
LOCKWOOD A P M. Aspects of the physiology of crustacea, Chapter Three, 1968
|
OHTOMI J, KAWAZOE H, FUROTA T. Temporal distribution of the Japanese mantis shrimp Oratosquilla oratoria larvae during transition from good catch period to poor catch period in Tokyo Bay, Japan. Memoirs of the Faculty of Fisheries Kagoshima University, 2005, 54: 1-6 |
OHTOMI J, SHIMIZU M, MARTINEZ V J A. Spawning season of the Japanese mantis shrimp Oratosquilla oratoria in Tokyo Bay. Bulletin of the Japanese Society of Scientific Fisheries, 1988, 54(11): 1929-1933 DOI:10.2331/suisan.54.1929 |
SHENG F L, ZENG X Q, XUE Y. Breeding and feeding habits of Oratosquilla oratoria in the off-shore area of Qingdao. Journal of Ocean University of China (Natural Science), 2009, 39(S1): 326-332 [盛福利, 曾晓起, 薛莹. 青岛近海口虾蛄的繁殖及摄食习性研究. 中国海洋大学学报(自然科学版), 2009, 39(S1): 326-332] |
SHENG F L. Study on the fishery biology of Oratosquilla oratoria in the coastal waters of Qingdao. Masterxs Thesis of Ocean University of China, 2009 [盛福利. 青岛近海口虾蛄(Oratosquilla oratoria)渔业生物学的初步研究. 中国海洋大学硕士研究生学位论文, 2009]
|
SUN D Y, WANG L, QIU S Y, et al. Morphological comparison of Oratosquilla oratoria stocks along the coast of Haiyang and Yantai. Progress in Fishery Sciences, 2021, 42(1): 154-164 [孙东昱, 王蕾, 邱盛尧, 等. 海阳和烟台近岸口虾蛄群体的形态比较. 渔业科学进展, 2021, 42(1): 154-164] |
WANG B, ZHANG X L, SUN P X. On biological characters and artificial seedling-rearing techniques of Mantis shrimp (Oratosquilla oratoria). Journal of Oceanography of Huanghai and Bohai Seas, 1998(2): 3-5 [王波, 张锡烈, 孙丕喜. 口虾蛄的生物学特征及其人工苗种生产技术. 黄渤海海洋学报, 1998(2): 3-5] |
WANG C L, XU S L, MEI W X, et al. A biological basic character of Oratosquilla oratoria. Journal of Zhejiang Ocean University, 1996, 15(1): 60-62 [王春琳, 徐善良, 梅文骧, 等. 口虾蛄的生物学基本特征. 浙江水产学院学报, 1996, 15(1): 60-62] |
WANG C L, YE X Y, DING A X, et al. Cultivation and comprehensive utilization of Oratosquilla oratoria in coastal China. Transactions of Oceanology and Limnology, 2002(3): 58-64 [王春琳, 叶选怡, 丁爱侠, 等. 虾蛄繁殖生物学与繁育技术研究. 海洋湖沼通报, 2002(3): 58-64] |
XU H L, ZHANG G F, QIAO X T, et al. Relationship between body length and body weight in mantis shrimp Oratosquilla oratoria in Northern Yellow Sea. Fisheries Science, 2010, 29(8): 451-454 [徐海龙, 张桂芬, 乔秀亭, 等. 黄海北部口虾蛄体长及体质量关系研究. 水产科学, 2010, 29(8): 451-454 DOI:10.3969/j.issn.1003-1111.2010.08.003] |
XU S L, WANG C L, MEI W X, et al. Preliminary studies on propagation and feeding habits of Oratosquilla oratoria in Northern Zhejiang Sea areas. Journal of Zhejiang Fisheries University, 1996(1): 30-36 [徐善良, 王春琳, 梅文骧, 等. 浙江北部海区口虾蛄繁殖和摄食习性的初步研究. 浙江水产学院学报, 1996(1): 30-36] |
XUE M, YAN H W, LIU H Y, et al. Reproductive biology of mantis shrimp Oratosquilla oratoria in Pikou Bay in coastal Dalian. Journal of Dalian Ocean University, 2016, 31(3): 237-245 [薛梅, 闫红伟, 刘海映, 等. 大连市皮口海域口虾蛄群体繁殖生物学特征初步研究. 大连海洋大学学报, 2016, 31(3): 237-245] |
ZHANG X M, CHENG S F. Effect and curve fitting of morphological traits to body weight between male and female mantis shrimp (Oratosquilla oratoria). Progress in Fishery Sciences, 2020, 41(6): 82-91 [张新明, 程顺峰. 不同性别口虾蛄形态性状对体重的影响分析及曲线拟合. 渔业科学进展, 2020, 41(6): 82-91] |



