2. 烟台市三维饲料有限公司 山东 烟台 264006;
3. 上海海洋大学 水产科学国家级实验教学示范中心 农业农村部鱼类营养与环境生态研究中心 水产动物遗传育种中心上海市协同创新中心 上海 201306
2. Yantai Three Dimensional Feed Co. LTD, Yantai, Shandong 264006, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Centre for Research on Environmental Ecology and Fish Nutrion (CREEFN) of the Ministry of Agriculture and Rural Affairs, National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
随着水产养殖业的快速发展,我国北方重要的海水鱼养殖经济品种鲆鲽类产量不断上升,2019年产量达12.8万t (农业农村部渔业渔政管理局, 2020)。大菱鲆(Scophthalmus maximus)是鲆鲽类养殖的主要品种之一,在欧洲及东亚具有较高的消费需求市场,其配合饲料所需蛋白质较高,而鱼粉作为其配合饲料中的主要优质蛋白源,约占饲料成本的60%~80% (梅琳等, 2015; 贾高旺等, 2019),这是制约大菱鲆产业发展的重要瓶颈。为降低养殖成本,提高大菱鲆产业的健康发展,有必要寻找替代鱼粉的蛋白源。动物性蛋白源由于蛋白质含量较高、氨基酸含量较丰富,且富含多种动物所需的维生素和矿物质(陈水春等, 2008),成为近年来鱼粉替代蛋白源的研究重点。
核糖蛋白是一种新型生物分子的免疫蛋白,经特殊工艺加工包装而成的一种粉末状动物蛋白。核糖蛋白除了含有人们所熟知的肽、氨基酸等成分,还含有一些未知的生长因子,如促生长因子和免疫因子等。研究表明,核糖体在生物体内的主要功能为合成各种蛋白质以调节生物的生命活动,而大部分核糖蛋白在核糖体中的作用是辅助多肽链的合成,甚至可以执行核糖体外的功能(田媛等, 2011)。而多肽在生物机体中具有促生长、刺激消化酶分泌和增强机体免疫能力的作用(Kotzamanis et al, 2007),且因其安全无毒副作用被广泛应用于畜牧及水产饲料中。然而,核糖蛋白作为富含多肽及免疫活性物质的营养性添加剂,还未见其在水产饲料中的应用报道。鉴于此,实验以大菱鲆为研究对象,在其饲料中添加核糖蛋白替代部分鱼粉,研究其对大菱鲆生长性能、消化酶活性、非特异性免疫指标和生理生化指标的影响,以期为核糖蛋白在大菱鲆配合饲料中的应用提供参考。
1 材料与方法 1.1 实验饲料本研究所用核糖蛋白由山东省烟台市三维饲料有限公司提供,其加工工艺为新鲜猪脾脏经过低温匀浆,细胞破碎处理,提取其有效成分,经过特殊工艺包被,220℃高温喷雾干燥(有效成分:核糖≥1.0 g/kg;多肽≥14 g/kg)。以核糖蛋白分别替代基础饲料中0 (D1组,作为对照组)、0.5% (D2组)、1% (D3组)、2% (D4组)、3% (D5组)和4% (D6组)的鱼粉,配制6组实验饲料(粗蛋白为49%、粗脂肪为10.50%),鱼粉和核糖蛋白营养成分见表 1。制作饲料时,将所有饲料原料过80目筛,按比例称重,逐级扩大均匀,经螺旋挤压机加工成直径为3.0 mm的硬颗粒饲料,自然风干储存于–20℃冰箱备用。实验饲料组分及营养水平见表 2。
|
|
表 1 鱼粉和核糖蛋白的主要营养成分含量(%, 干物质基础) Tab.1 Main nutritional component contents of fish meal and ribose protein (%, dry weight basis) |
|
|
表 2 饲料配方和主要营养成分组成(%, 干重) Tab.2 Formulation and proximate chemical composition of the tested diets (%, dry weight basis) |
实验用大菱鲆购自山东蓬莱宗哲养殖有限公司,养殖实验在山东省海洋资源与环境研究院全封闭水循环系统进行。实验鱼用基础饲料(D1)暂养14 d,循环水养殖,连续充气。暂养结束后,禁食24 h,挑选健康无病,规格均一的大菱鲆幼鱼[初始体重为(24.00± 0.30) g]随机分为6组,每组3个重复(30尾/重复),共540尾,放养于18个绿色圆柱形塑料养殖桶中。每天投喂2次(08:00、17:00),日投喂量为鱼体重的1.2%~1.5%,据摄食情况调整投喂量,投喂结束后,统计残饵量。整个实验期间,微水流循环水养殖,控制水温为(16±1)℃,pH为7.8~8.0,盐度为27~28,溶解氧(DO) > 6 mg/L,氨氮 < 0.01 mg/L,亚硝酸盐 < 0.01 mg/L。养殖周期为56 d。
攻毒实验:实验结束后,每桶取10尾鱼进行攻毒实验。将纯化的鳗弧菌(Vibrio anguillarum)于28℃,200 r/min震荡培养箱中培养10 h,至OD600 nm约0.5,4℃,8000 r/min离心10 min,收集菌体沉淀,用无菌PBS稀释,至OD600 nm为1左右,每尾注射100 μL的鳗弧菌(1×107 CFU)进行攻毒,分别放入室内塑料桶内,保证充足供氧,每2 h观察1次,捞出死鱼,于48 h统计累积死亡率。
1.3 样品采集养殖实验结束时,禁食24 h,以桶为单位称重,记录每桶实验鱼的尾数和质量,计算成活率、增重率和饲料系数。每桶随机选择15尾幼鱼,丁香酚麻醉,尾静脉采血,之后取内脏团称重,然后分离肝脏称重,计算脏体比和肝体比。血样4℃静置4 h,4000 r/min离心10 min,取血清。将所有样品保存于–20℃,待测。
1.4 测定指标与方法 1.4.1 生长指标成活率(survival rate, SR, %)= 100×存活尾数/30
增重率(weight gain rate, WGR, %)=100×(均末体质量–均初体质量)/均初体质量
特定生长率(specific growth rate, SGR, %/d)= 100×(ln均末体质量–ln均初体质量)/56
蛋白质效率(protein efficiency ratio, PER, %)=100× (终末体质量–初始体质量)/(摄食量×饲料粗蛋白含量)
饲料系数(feed conversion ratio,FCR)=摄食量/ (终末体质量–初始体质量)
肥满度(condition factor, CF)=100×体质量/体长3
脏体比(viscerosomatic index, VSI, %)=100×内脏团重量/体质量
肠体比(intestinesomatic index, ISI, %)=100×肠道重量/体质量
血清类胰岛素生长因子(IGF-1)、生长激素(GH)采用上海酶联ELISA试剂盒测定。
1.4.2 实验饲料常规成分的测定饲料中水分采用105℃恒重法测定(GB/T6435-2006),粗蛋白采用凯氏定氮法测定(GB/T6432-2018),粗脂肪采用索氏抽提法测定(GB/T6433-2006),粗灰分采用灰化法测定(GB/T6438-2007),能量采用氧弹仪燃烧法测定(IKA, C6000, 德国),饲料及原料氨基酸含量参照《GB/T 18246-2019》中方法处理,上机液采用全自动氨基酸测定仪(Hitachi L-8900, 日本)测定分析。
1.4.3 血清酶活性测定总蛋白(TP)、白蛋白(ALB)、溶菌酶(LZM)、碱性磷酸酶(ALP)和超氧化物歧化酶(SOD)均采用南京建成试剂盒进行测定;血清总胆固醇(TCHO)、甘油三酯(TG)、低密脂蛋白胆固醇(HDL-C)、高密度脂蛋白胆固醇(LDL-C)和血糖(GLU)均采用南京建成试剂盒微板法测定;血清白介素β1 (IL-1β)、干扰素γ (IFN-γ),肿瘤坏死因子(TNF-α)均采用上海酶联ELISA试剂盒测定。
1.4.4 肠道消化酶活力肠道胰蛋白酶(trypsin)、α-淀粉酶(α-Amylase)和脂肪酶(lipase)均采用南京建成试剂盒进行测定。
1.4.5 攻毒实验测定累积死亡率,计算公式如下:累积死亡率(cumulative mortality rate, %)=100×(病死鱼尾数/初感染鱼尾数)
1.5 数据分析采用SPSS 17.0软件对所得数据进行单因素方差分析(one-way ANOVA),差异显著,则采用Duncan进行多重检验,显著水平为0.05,统计数据以平均值±标准差(Mean±SD)表示。
2 结果 2.1 核糖蛋白替代鱼粉对大菱鲆幼鱼生长性能的影响由表 3可知,随着饲料中核糖蛋白替代鱼粉比例的升高,增重率、特定生长率和蛋白质效率均呈现先上升后下降的趋势,而饲料系数则呈相反趋势。幼鱼增重率、特定生长率和蛋白质效率最高值均出现在D3组,显著高于对照组(P < 0.05);饲料系数在D3组达到最低值,显著低于D1组(P < 0.05),但与其他组之间差异不显著(P > 0.05)。随着饲料中核糖蛋白替代鱼粉水平的增加,幼鱼肥满度呈先上升后下降趋势,D2和D3组与对照组无显著差异(P > 0.05),D4~D6组显著低于对照组(P < 0.05)。各组间幼鱼成活率、脏体比和肠体比无显著差异(P > 0.05)。
|
|
表 3 核糖蛋白替代鱼粉对大菱鲆幼鱼生长性能的影响 Tab.3 Effects of partial replacement of fish meal by ribose protein on growth performance of juvenile turbot |
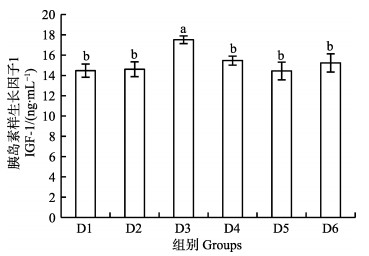
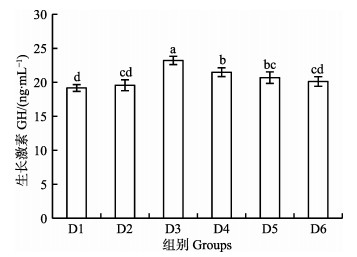
由图 1和图 2可知,幼鱼血清IGF-1和GH含量均在D3组达到最高值,显著高于其他组(P < 0.05)。
|
图 1 核糖蛋白替代鱼粉对大菱鲆幼鱼血清IGF-1的影响 Fig.1 Effects of partial replacement of fish meal by ribose protein on serum IGF-1 content juvenile of turbot 不同字母表示组间存在显著差异(P < 0.05). 下同 Values in each column with different letter superscripts are significantly different (P < 0.05). The same as below |
|
图 2 核糖蛋白替代鱼粉对大菱鲆幼鱼血清GH的影响 Fig.2 Effects of partial replacement of fish meal by ribose protein on serum GH content of juvenile turbot |
由表 4可知,肠道胰蛋白酶和α-淀粉酶活力均在D4组达到最高值,与对照组差异显著(P < 0.05)。与对照组相比,核糖蛋白替代鱼粉后降低了幼鱼脂肪酶活性(P < 0.05),在D6组达到最低值,显著低于对照组(P < 0.05)。
|
|
表 4 核糖蛋白替代鱼粉对大菱鲆幼鱼肠道消化酶活力影响 Tab.4 Effects of partial replacement of fish meal by ribose protein on digestive enzyme activities in intestinal of juvenile turbot |
由表 5可知,幼鱼血清TP含量在D3组出现最高值,与对照组差异显著(P < 0.05);血清GLB含量在D2组显著高于对照组(P < 0.05);各组间ALB含量和总超氧化物歧化酶(T-SOD)活性无显著差异(P > 0.05);LZM活性在D1~D5组显著高于D6组(P < 0.05);D2~D6组血清ALP活性显著高于对照组(P < 0.05)。幼鱼血清IL-β1含量在D2组达到最高值,显著高于对照组(P < 0.05);IFN-γ含量在D3和D5组与对照组无显著差异(P > 0.05),但其他组均显著低于对照组(P < 0.05);饲料中添加核糖蛋白显著增加了幼鱼血清TNF-α浓度(P < 0.05),其中在D2组达到最高值。
|
|
表 5 饲料中添加不同水平核糖蛋白对大菱鲆幼鱼血清免疫能力的影响 Tab.5 Effects of partial replacement of fish meal by ribose protein on serum immune indices of juvenile turbot |
由表 6可知,幼鱼血清总胆固醇含量在D3组达到最高值,与对照组无显著差异(P > 0.05),但显著高于D4~D6组(P < 0.05);随着饲料中核糖蛋白含量的增加,幼鱼血清甘油三酯呈下降趋势,在D6组达到最低值,显著低于对照组(P < 0.05);血清低密度脂蛋白胆固醇含量在D5组达到最低值,显著低于对照组(P < 0.05);高密度脂蛋白胆固醇含量在D4组达到最高值,显著高于对照组(P < 0.05);血糖含量呈先上升后下降趋势,在D3组达到最高值,显著高于其他各组(P < 0.05)。
|
|
表 6 饲料中添加不同水平核糖蛋白对大菱鲆幼鱼血清生化指标的影响 Tab.6 Effects of partial replacement of fish meal by ribose protein on serum biochemical indices of juvenile turbot |
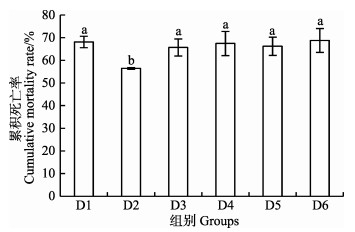
在大菱鲆幼鱼饲料中添加核糖蛋白替代不同比例鱼粉喂养大菱鲆幼鱼56 d后,进行鳗弧菌注射感染实验,感染48 h各实验组累积死亡率统计结果见图 3。各组感染之后,在12 h即出现死亡情况,在24 h内死亡率急剧增加,36 h减缓,48 h即达到平稳。与对照组相比,D2组累积死亡率达56.45%,达到最低值,显著低于对照组和其他实验组(P < 0.05)。
|
图 3 核糖蛋白替代鱼粉对大菱鲆幼鱼累积死亡率的影响 Fig.3 Effect of fishmeal replacement by ribose protein on cumulative mortality rate of juvenile turbot |
本研究发现,核糖蛋白替代大菱鲆幼鱼饲料中1%鱼粉可提高幼鱼增重率、特定生长率和蛋白质效率,降低饲料系数,说明添加适量核糖蛋白替代鱼粉可以增加鱼体内蛋白质的合成与沉积,促进营养物质的利用率和鱼体的生长,这可能与核糖蛋白中的多肽能增加蛋白质吸收速率,提高蛋白质消化率有关(冯健等, 2004)。这与家禽副产品多肽(Yigit et al, 2006)、家禽副产物酶解肽(贾高旺等, 2019)等在大菱鲆中的应用有相似的结果。另有研究表明,在果蝇(Drosophila melanogaster)核糖体重要基因表达因子不足或缺失会降低核糖体的数量和蛋白质的合成,从而导致果蝇生长发育缓慢(Jorgensen et al, 2002),说明核糖体对动物机体蛋白质的合成、生长发育具有重要的作用(Marygold et al, 2007)。在本研究中,大菱鲆饲料中添加1%核糖蛋白提高了幼鱼的生长性能,这可能与增加了鱼体核糖体重要基因的表达量有关,具体机理还需进一步验证。但当核糖蛋白添加水平高于1%时,其增重率、特定生长率、蛋白质效率均受到显著抑制,可能是低分子量的多肽产生过多氨基酸,使肠道中的氨基酸转运系统饱和造成的,也可能是核糖蛋白中的肽类与其他原料中的氨基酸吸收不同步造成的(路晶晶等, 2018),这与在海鲈鱼(Dicentrarchus labrax) (Cahu et al, 1999)的研究结果一致。
肥满度、脏体比和肠体比是衡量鱼体能量状态的重要指标,增加摄食营养物质和能量均会引起肥满度、脏体比和肠体比的升高(Daudpota et al, 2016)。本研究中,随着饲料中核糖蛋白替代鱼粉比例的增加,肥满度呈先上升后下降趋势,这表明饲料中添加适量的核糖蛋白替代鱼粉可以改善鱼体的营养状况,这与本研究中生长指标相一致;大菱鲆幼鱼肠体比和脏体比在添加组均稍高于对照组,但无显著差异,可能与核糖蛋白中的有效成分影响了鱼体的肝脏和肠道代谢有关(Boza et al, 2000)。
类胰岛素生长因子是一种生长内分泌激素,能增加机体或细胞对氨基酸的摄取和利用,促进蛋白质和RNA的合成,促进肌肉生长(孙伟等, 2011)。本研究中,随着核糖蛋白替代鱼粉比例的增加,鱼体类胰岛素生长因子在1%组与对照组无显著差异,其他替代组均显著低于对照组。研究表明,在花鲈(Lateolabrax japonicus) (Men et al, 2014)、军曹鱼(Rachycentron canadum) (Luo et al, 2013)、金头鲷(Sparus aurata) (Gómez-Requenia et al, 2004)饲料中添加动、植物蛋白替代鱼粉会导致鱼体类胰岛素生长因子基因表达量下降,这是由饲料营养组分不同造成的(Hevrøy et al, 2011),这也有可能是本研究中,核糖蛋白替代鱼粉降低了大菱鲆幼鱼血清IGF-1浓度的原因之一。生长激素在动物的生长发育过程中起决定性的作用,生长激素通过由垂体分泌的生长因子刺激合成并释放出IGF-I作用于靶细胞进而促进机体的生长(王连生等, 2016)。本研究表明,饲料中添加核糖蛋白替代鱼粉降低了血清中生长激素含量,与血清中IGF-I浓度变化趋势一致,表明饲料中添加核糖蛋白替代鱼粉降低了血清GH和IGF-I浓度,从而降低了鱼体的生长,但添加适量核糖蛋白替代鱼粉(1%组)可提高幼鱼血清GH和IGF-I浓度,这对鱼体生长及降低鱼粉添加量都具有一定的意义。
3.2 核糖蛋白替代鱼粉对大菱鲆幼鱼肠道消化酶活力的影响本研究发现,核糖蛋白适量替代鱼粉对大菱鲆肠道胰蛋白酶、淀粉酶和脂肪酶活性均有显著影响,但能提高幼鱼胰蛋白酶和淀粉酶活性,降低脂肪酶活性。这与一些肽类物质在草鱼(Ctenopharyngodon idella) (冯健等, 2004)、美洲黑石斑鱼(Centropristis striata) (邱金海等, 2009)等研究结果类似。推测其作用机理与多肽蛋白可刺激鱼体肠道中开放型细胞分泌激素调节消化酶的分泌有关(李加儿等, 2015)。但在核糖蛋白替代量为4%时显著降低了肠道胰蛋白酶活性,说明随着核糖蛋白替代鱼粉比例的增加,核糖蛋白能使肠道胰蛋白酶活性呈先上升后下降的趋势。此外,饲料中添加核糖蛋白替代鱼粉降低了幼鱼脂肪酶的活性,其机理可能是核糖蛋白中某些有效成分下调了鱼体脂肪代谢相关基因表达,影响了脂肪的消化吸收及转运代谢过程(田许等, 2019)。综上,适量的核糖蛋白替代鱼粉可提高大菱鲆幼鱼的消化能力,但高剂量的核糖蛋白替代鱼粉将影响大菱鲆的消化能力,表现为胰蛋白酶和脂肪酶活力降低,其深层机制还需要进一步的研究。
3.3 核糖蛋白替代鱼粉对大菱鲆幼鱼免疫能力的影响本研究中,饲料中添加核糖蛋白适量替代鱼粉显著提高了幼鱼血清总蛋白、球蛋白、溶菌酶含量和碱性磷酸酶的活性,说明饲料中添加一定量的核糖蛋白替代鱼粉可以增加鱼体的非特异免疫能力,与凡纳滨对虾(Litopenaeus vannamei) (刘丽波等, 2010)、中华鳖(Trionyx Sinensis) (张海琪等, 2013)研究一致。推测其机理是:一、核糖蛋白里面有效成分多糖可通过激活NF-κB途径来激活鱼体的免疫功能(钱隆等, 2019);二、核糖蛋白中的有效成分多肽具有抗菌、抗病毒和增强鱼体免疫力的作用。
白介素-1β是白细胞介素1的一种亚型,是一种重要的炎症和免疫原性细胞因子,在诱发炎症、造血及免疫调节代谢等过程中发挥重要作用(高珊等, 2014; Bird et al, 2002)。肿瘤坏死因子作为重要的炎症因子,在抵抗细菌和病毒感染以及清除被感染的细胞等方面发挥着重要的作用(田佳音等, 2020)。本研究表明,饲料中添加核糖蛋白替代鱼粉显著提高了幼鱼血清白介素-1β和TNF-α含量,均在0.5%替代组达到最高值,表明饲料中添加核糖蛋白可以提高幼鱼的免疫能力,与小鼠(樊乃境等, 2020)研究结果一致。
3.4 核糖蛋白替代鱼粉对大菱鲆幼鱼血清生化指标的影响本研究表明,饲料中添加核糖蛋白替代大菱鲆幼鱼饲料中2%~4%的鱼粉可降低血清中总胆固醇和低密度脂蛋白含量,说明核糖蛋白替代鱼粉对大菱鲆幼鱼脂代谢有一定的影响。若脂类在体内运输发生障碍,则会造成血清中总胆固醇等指标的上升(路晶晶等, 2018),替代组血清中总胆固醇和低密度脂蛋白含量较对照组下降,表明核糖蛋白可以促进血清中脂质的代谢,加速脂代谢产物的清除,也有可能是核糖蛋白中的一些活性物质可以调控鱼体脂肪代谢相关基因表达,从而影响血清脂肪代谢酶活变化,但具体调控受核糖蛋白成分剂量影响(张秀媛等, 2019)。血糖含量是反应生物碳水化合物代谢水平的重要指标,一般鱼体摄食积极,血糖浓度较高,则表明鱼体健康状况良好(Almeida et al, 2005)。本研究表明,幼鱼血清血糖浓度随核糖蛋白替代水平变化呈先上升后下降趋势,与本研究中生长趋势相一致。在1%替代组显著高于对照组,表明饲料中核糖蛋白替代1%鱼粉具有一定的摄食诱食性。但当核糖蛋白替代量在2%~ 4%时,幼鱼血清血糖含量显著低于对照组,与其他动物蛋白源替代鱼粉可降低鱼体血糖浓度结果一致(曹晓莉等, 2020)。
3.5 核糖蛋白替代鱼粉对大菱鲆幼鱼累积死亡率的影响鳗弧菌是海水鱼常见的代表性致病菌之一,通常可引起大菱鲆发生弧菌病。因此,可采用攻毒感染后的累积死亡率来判断大菱鲆幼鱼的抗病力强弱(郝甜甜等, 2014)。在本研究中,攻毒后大菱鲆幼鱼死亡高峰期出现在12~24 h,36~48 h出现减缓并趋于稳定。研究表明,饲料中添加0.5%核糖蛋白替代鱼粉显著降低了幼鱼的累积死亡率,提高了免疫保护率,与本研究中的血清免疫指标白介素-1β和TNF-α的变化趋势一致。Wu等(2013)研究表明,多肽类可以通过下调肠道炎症因子含量或者抑制NF-κB信号通路来减轻炎症反应。本研究中,添加适量核糖蛋白替代鱼粉可能是通过改善肠道健康来发挥抗炎作用从而达到提高免疫保护率的作用,具体机理还需进一步验证。另有研究表明,水生动物在受到细菌感染时,可通过提高机体的白细胞数目和溶菌酶含量来增强机体免疫能力(Liu et al, 2020; Zhang et al, 2020;敖秋栀等,2020)。在本研究中,0.5%替代组幼鱼累积死亡率达到最低值,溶菌酶活性达到最高,表明核糖蛋白替代适宜比例的鱼粉可通过提高鱼体溶菌酶活性来增加鱼体免疫能力(Zhou et al, 2010)。
4 结论在本研究条件下,以生长性能为基础,综合考虑消化和免疫等指标,核糖蛋白替代大菱鲆幼鱼饲料中鱼粉的适宜比例为1%。
ALMEIDA J S, MELETTI P C, MARTINEZ C B. Acute effects of sediments taken from an urban stream on physiological and biochemical parameters of the neotropical fish Prochilodus lineatus. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 2005, 140(3): 356-363 |
AO Q Z, LUO Y J, LÜ M, et al. Effects of Streptococcus agalactiae infection on blood and hepatopancreatic tissue biochemical indices in different species of tilapia. Progress in Fishery Sciences, 2020, 41(4): 167-173 [不同罗非鱼品系感染无乳链球菌后对血液和肝胰腺生化指标的影响. 渔业科学进展, 2020, 41(4): 167-173] |
BIRD S, ZOU J, WANG T H, et al. Evolution of interleukin-1 beta. Cytokine and Growth Factor Reviews, 2002, 13(6): 483-502 DOI:10.1016/S1359-6101(02)00028-X |
BOZA J J, MOËNNOZ D, VUICHOUD J, et al. Protein hydrolysate vs free amino acid-based diets on the nutritional recovery of the starved rat. European Journal of Nutrition, 2000, 39(6): 237-243 DOI:10.1007/s003940070001 |
Bureau of Fisheries Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook. Beijing: China Agriculture Press, 2020, 44 [农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴. 北京: 中国农业出版社, 2020, 44]
|
CAHU C L, INFANTE J L Z, QUAZUGUEL P, et al. Protein hydrolysate vs fish meal in compound diets for 10-day old sea bass Dicentrarchus labrax larvae. Aquaculture, 1999, 171(1/2): 109-119 |
CAO X L, ZHONG L, DAI Z Y, et al. Effects of fish meal replacement by pet grate poultry by-product meal on growth performance, intestinal digestive enzyme activities and serum biochemical indexes of rice filed eel (Monopterus albus). Chinese Journal of Animal Nutrition, 2020, 32(5): 2352-2360 [宠物级鸡肉粉替代鱼粉对黄鳝鱼生长性能、肠道消化酶活性及血清生化指标的影响. 动物营养学报, 2020, 32(5): 2352-2360 DOI:10.3969/j.issn.1006-267x.2020.05.044] |
CHEN S C, HU J R, LI J Y, et al. Progress in research on replacer as fish meal applied to aquatic animals. Fishery Information and Strategy, 2008, 23(11): 20-23 [鱼粉替代物在水生动物上的研究进展. 渔业信息与战略, 2008, 23(11): 20-23 DOI:10.3969/j.issn.1004-8340.2008.11.006] |
DAUDPOTA A M, ABBAS G, KALHORO I B, et al. Effect of feeding frequency on growth performance, feed utilization and body composition of juvenile Nile tilapia, Oreochromis niloticus (L. ) reared in low salinity water. Pakistan Journal of Zoology, 2016, 48(1): 171-177 |
FAN N J, WANG D M, GAO Y, et al. Immunomodulatory effects of the iron yam peptides on mice with immunocompromised. Food and Fermentation Industries, 2020, 46(6): 101-107 [山药蛋白肽对免疫能力低下小鼠的免疫调节作用. 食品与发酵工业, 2020, 46(6): 101-107] |
FENG J, GAO L, LIU Y J, et al. The effect of small peptides from shrimp waste in diet on growth performance of grass carps Ctenopharyngodon idella. ACTA Scientiarum Naturalium Universitatis Sunyatseni, 2004, 43(2): 100-103 [草鱼日粮中虾蛋白肽对幼龄草鱼生长性能的影响. 中山大学学报(自然科学版), 2004, 43(2): 100-103 DOI:10.3321/j.issn:0529-6579.2004.02.026] |
GAO S, YU T, ZHOU J X, et al. A review of interleukin and receptors in fish. Chinese Journal of Fisheries, 2014, 27(3): 62-64 [鱼类白介素及其受体的研究. 水产学杂志, 2014, 27(3): 62-64 DOI:10.3969/j.issn.1005-3832.2014.03.014] |
GÓMEZ-REQUENIA P, MINGARROA M, CALDUCH-GINERA J A, et al. Protein growth performance, amino acid utilization and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream (Sparus aurata). Aquaculture, 2004, 232(1/2/3/4): 493-510 |
HAO T T, WANG J Y, LI B S, et al. Effect of dietary supplementation of saccharicterpenin on growth, immunity and heat shock protein 70 content of juvenile turbot (Scophthalmus maximus). Journal of Zhejiang University (Agriculture and Life Sciences), 2014, 40(3): 338-347 [饲料中添加糖萜素对大菱鲆幼鱼生长、免疫及热休克蛋白70含量的影响. 浙江大学学报(农业与生命科学版), 2014, 40(3): 338-347 DOI:10.3785/j.issn.1008-9209.2014.03.014] |
HEVRØY E M, AZPELETA C, SHIMIZU M, et al. Effects of short-term starvation on ghrelin, GH-IGF system, and IGF binging proteins in Atlantic salmon. Fish Physiology and Biochemistry, 2011, 37(1): 217-232 DOI:10.1007/s10695-010-9434-3 |
JIA G W, GUO R, ZHANG Y, et al. Effects of partial replacement of fish meal by peptides hydrolyzed from poultry by-products on growth performance, digestive indices and specific immune indices of turbot. Chinese Journal of Animal Nutrition, 2019, 31(5): 2201-2211 [家禽副产物酶解肽部分替代鱼粉对大菱鲆生长性能、消化指标和特异性免疫指标的影响. 动物营养学报, 2019, 31(5): 2201-2211 DOI:10.3969/j.issn.1006-267x.2019.05.027] |
JORGENSEN P, NISHIKAWA J L, BREITKREUTZ B J, et al. Systematic identification of pathways that couple cell growth and division in yeast. Science, 2002, 297(5580): 395-400 DOI:10.1126/science.1070850 |
KOTZAMANIS Y P, GISBERT E, GATESOUPE F J, et al. Effects of different dietary levels of fish protein hydrolysates on growth, digestive enzymes, gut microbiota, and resistance to Vibrio anguillarum in European sea bass (Dicentrarchus labrax) larvae. Comparative Biochemistry and Physiology, Part A: Molecular and Integrative Physiology, 2007, 147(1): 205-214 DOI:10.1016/j.cbpa.2006.12.037 |
LI J E, WU S Q, QU Y J, et al. Study on mucous and gastrin cells of digestive tract in Qinglong grouper (Epinephelus coioides♀×E.lanceolatus♂) juveniles. South China Fisheries Science, 2015, 11(3): 67-73 [斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代幼鱼消化道粘液细胞和胃泌素细胞的研究. 南方水产科学, 2015, 11(3): 67-73 DOI:10.3969/j.issn.2095-0780.2015.03.011] |
LIU F, GENG C H, QU Y K, et al. The feeding of dietary codonopsis pilosula polysaccharide enhances the immune responses, the expression of immune-related genes and the growth performance of red swamp crayfish (Procambarus clarkii). Fish and Shellfish Immunology, 2020, 103: 321-331 DOI:10.1016/j.fsi.2020.05.034 |
LIU L B, LI S D, CHEN J H, et al. Effect of fresh housefly larva on growth and immunity in pacific white leg shrimp Litopenaeus vannamei. Fisheries Science, 2010, 29(12): 721-724 [鲜活蝇蛆对凡纳滨对虾生长和免疫的影响. 水产科学, 2010, 29(12): 721-724 DOI:10.3969/j.issn.1003-1111.2010.12.007] |
LU J J, GUO R, XIA H, et al. Effects of peptides hydrolyzed from poultry by-products on growth performance, digestive indices and non-specific immune indices of Litopenaeus vannamei. Chinese Journal of Animal Nutrition, 2018, 30(2): 797-806 [家禽副产物酶解肽对凡纳滨对虾生长性能、消化指标和非特异性免疫指标的影响. 动物营养学报, 2018, 30(2): 797-806 DOI:10.3969/j.issn.1006-267x.2018.02.046] |
LUO Y W, AI Q H, MAI K S, et al. Effects of dietary corn gluten meal on growth performance and protein metabolism in relation to IGF-Ⅰ and TOR gene expression of juvenile cobia (Rachycentron canadum). Journal of Ocean University of China, 2013, 12(3): 418-426 DOI:10.1007/s11802-013-2021-3 |
MARYGOLD S J, ROOTE J, REUTER G, et al. The ribosomal protein genes and minute loci of Drosophila melanogater. Genome Biology, 2007, 8(10): 1-26 |
MEI L, ZHOU H H, MAI K S, et al. Effects of dietary substitution of fishmeal by fermented silkworm pupae on the growth, feed intake, digestion and immunity of juvenile turbot (Scophthalmus maximus L.). Progress in Fishery Sciences, 2015, 36(3): 85-92 [蛹肽蛋白替代鱼粉对大菱鲆(Scophthalmus maximus L.)幼鱼生长、饲料利用、消化代谢酶及免疫性能的影响. 渔业科学进展, 2015, 36(3): 85-92] |
Effects of dietary corn gluten meal on growth, digestion and protein metabolism in relation to IGF-Ⅰ gene expression of Japanese seabass, Lateolabrax japonicas. Aquaculture, 2014, 428–429: 303-309 |
QIAN L, LIU Y, LI B X, et al. Atractylodes macrocephala koidz may alleviates liver injury induced by cyclophosphamide via toll-like receptor 4 signaling pathway in goslings. Chinese Journal of Animal Nutrition, 2019, 31(2): 764-774 [白术多糖可能通过Toll样受体4信号通路缓解环磷酰胺诱导的雏鹅肝脏损伤. 动物营养学报, 2019, 31(2): 764-774 DOI:10.3969/j.issn.1006-267x.2019.02.033] |
QIU J H, LIN X, WU D F. Study on the effects of phytase, small peptide and Chinese herbal medicine for growth of juvenile Centropristis striata. Acta Ecologiae Animalis Domastici, 2009, 30(5): 74-80 [饲料中添加植酸酶、小肽和中草药制剂对美洲黑石斑幼鱼生长影响的研究. 家禽生态学报, 2009, 30(5): 74-80] |
SUN W, MA W J, SONG E L, et al. Effect of feeding different levels of heat-treated soybeans on levels of different hormones in longissimus dorsi muscle, back fat, liver and serum of beef cattle. Grass Feeding Livestock, 2011(2): 35-39 [饲喂不同水平热处理大豆对肉牛体组织和血清中类胰岛素生长因子-I、生长激素、胰岛素和瘦素水平的影响. 草食家畜, 2011(2): 35-39 DOI:10.3969/j.issn.1003-6377.2011.02.013] |
TIAN J Y, CHEN K Y, ZHANG C, et al. Expression analysis of zebrafish tumor necrosis factor (tnfα) and its receptor (tnfrsflα) in response to bacterial and viral infections. Journal of Shanghai Ocean University, 2020, 29(2): 171-179 [斑马鱼肿瘤坏死因子(tnfα)及其受体(tnfrsflɑ)应答细菌和病毒感染的表达. 上海海洋大学学报, 2020, 29(2): 171-179] |
TIAN X, YANG Y H, WANG Y N, et al. Effects of fish collagen peptides on hepatic lipid metabolism and redox status in mice fed with high-fat diet. Food Science, 2019, 40(3): 149-157 [鱼胶蛋白肽对高脂膳食小鼠肝脏脂肪代谢和氧化还原状态的影响. 食品科学, 2019, 40(3): 149-157] |
TIAN Y, ZHANG J P. The extra ribosomal functions of ribosomal proteins and the related diseases. Chemistry of Life, 2011, 31(4): 488-491 [核糖体蛋白质的新功能及其与相关疾病的关系. 生命化学, 2011, 31(4): 488-491] |
WANG L S, XU Q Y, CHEN D, et al. Effects of dietary α-ketoglutarate supplementation on liver glutamine content, antioxidant capacity and the expressions of growth hormone and insulin-like growth factor genes of juvenile hybrid sturgeon fed different protein source diets. Chinese Journal of Animal Nutrition, 2016, 28(12): 3917-3924 [不同蛋白质源饲料中添加α-酮戊二酸对杂交鲟幼鱼肝脏谷氨酰胺含量、抗氧化能力及生长激素、胰岛素样生长因子-Ⅰ基因表达的影响. 动物营养学报, 2016, 28(12): 3917-3924] |
WU Z, PAN D D, GUO Y X, et al. Structure and anti-inflammatory capacity of peptidoglycan from Lactobacillus acidophilus in RAW-264. 7 cell. Carbohydrate Polymers, 2013, 96(2): 466-473 DOI:10.1016/j.carbpol.2013.04.028 |
YIGIT M, ERDEM M, KOSHIO S, et al. Substituting fish meal with poultry by-product meal in diets for black sea turbot Psetta maeotica. Aquaculture Nutrition, 2006, 12(5): 340-347 DOI:10.1111/j.1365-2095.2006.00409.x |
ZHANG H Q, ZHOU F, WANG W P, et al. Effects of housefly maggot meal instead of fish meal on growth performance, textural mechanical properties, serum parameters in Pelodiscus sinensis Japanese strain. Acta Agriculturae Zhejianggensis, 2013, 25(2): 225-229 [蝇蛆蛋白粉替代鱼粉对中华鳖日本品系生长、肌肉品质、免疫及抗氧化指标的影响. 浙江农业学报, 2013, 25(2): 225-229 DOI:10.3969/j.issn.1004-1524.2013.02.04] |
ZHANG W N, ZHANG M X, CHENG A Y, et al. Immunomodulatory and antioxidant effects of astragalus polysaccharide liposome in large yellow croaker (Larimichthys crocea). Fish and Shellfish Immunology, 2020, 100: 126-136 DOI:10.1016/j.fsi.2020.03.004 |
ZHANG X Y, LI S Y, WANG C F, et al. Effects of Allium mongolicum regel and its extract on growth performance and lipid metabolism related indices of small tail Han sheep. Chinese Journal of Animal Nutrition, 2019, 31(1): 334-341 [沙葱及其提取物对小尾寒羊生长性能和脂肪代谢相关指标的影响. 动物营养学报, 2019, 31(1): 334-341 DOI:10.3969/j.issn.1006-267x.2019.01.040] |
ZHOU F, XIONG W, XIAO J X, et al. Optimum arginine requirement of juvenile black sea bream, Sparus macrocephalus. Aquaculture Research, 2010, 41(10): 418-430 |



